(2: 同济大学建筑设计研究院(集团)有限公司,上海 200092)
(2: Tongji Architectural Design (Group) Co., Ltd., Shanghai 200092, P.R.China)
流速是水动力条件中最基本、最直观的参数,对浮游植物的生长和繁殖具有十分重要的影响,不仅影响水体中能量和营养盐的分配、溶解氧水平、沉积物特性等,而且能够对水生生物的生理活动产生直接的影响.天然河流、湖泊和水库中,有关流速与浮游藻类生物量统计关系的研究也常见报道,流速、流量等水动力条件已经成为浮游植物生长繁殖、群落更替和诱发水华现象的重要驱动因子[1-2].对浮游植物个体而言,每种生命体对其生存的流场环境都有特定的要求,当条件改变时,生命体都会表现出自由、逃离和失控3种状态[3].因此,通过研究浮游植物个体在不同水动力条件下的生命规律,局部改变有害藻类生存的流场,达到抑制水华暴发的目的,具有十分重要的意义.
由于自然水体中藻类生长的影响因素较为复杂,流速效应经常被其他各种因素所掩盖而导致研究结论不明确.室内模拟实验能够在排除其它因素影响的情况下较为精细地反映流速与浮游植物之间的关系[4-6],许多研究者通过研究流速对单一藻种或者混合藻种的影响,认为存在一定的临界流速,当流速大于或者小于临界流速时,浮游植物的生长速率都会减缓[7].但受空间和时间尺度限制,其研究结论缺乏普遍性,结果差异性较大,仍需大量更大尺度的研究[8-10].朱宜平等[11]、Li等[12]通过野外围隔实验,发现0.03~0.30m/s的流速均对叶绿素a浓度产生抑制作用,并且显著降低藻类丰度;但受底泥扰动和降雨等因素影响,再加上水动力产生的剪切力极大地促进了水绵的营养生殖,流速效应同样受到一定程度的掩盖.因此,本研究在野外模拟实验的基础上,采用较大尺度的有机玻璃水槽来模拟夏季富营养水体中流速对浮游藻类生长和种群变化的影响,以期准确反映流速对浮游植物生长的抑制效果和种群变化规律.
1 材料与方法中心湖位于上海市崇明县竖新镇前卫村,该水体毗邻同济大学长江水环境教育部重点实验室崇明水环境研究中心,是由5条相互贯通的河段组成的封闭水域,面积约52000m2,水深1.0~1.3m,全湖总氮(TN)浓度为0.53~4.14mg/L,总磷(TP)浓度为0.056~0.750mg/L.该水体封闭性较好且具有相对简单的生态系统,十分便于野外密集观测和现场实验研究.具体信息可参考文献[13].
实验装置采用3个环形有机玻璃水槽,如图 1所示,四周为透明有机玻璃板,底部为加厚PVC板,高1.3m,置于崇明水环境研究中心大厅内,避开了底泥扰动起浮和降雨带来的影响.从早上至上午10:30左右装置能接受阳光照射,白天时段通过日光灯提供光照条件,日光灯于早上6:00开启,晚上18:00关闭.实验用水为中心湖原水,于2010年8月13日取水约480L置于装置内,用2种不同型号潜水泵(堵住增氧口)推流,其中一个装置保持静止,作为对比参照.3个装置分别标记为S0、S1和S2,对应的平均驱动流速分别为0、0.06和0.10m/s,实验周期约为13d.同时实验中还采集中心湖西部的1个监测点(W2)作为对照.实验期间向3个装置中分别加入200ml(15g/L的NaNO3和3g/L的KH2PO4)营养盐溶液,隔天测1次营养盐浓度,保证装置中氮、磷营养盐浓度维持在高富营养水平(TN浓度大于2mg/L和TP浓度大于0.2mg/L),自8月15日开始,每天早上(8:00)和晚上(17:00)分别监测1次,记录水温、溶解氧(DO)、pH、电导率等,并采样测定叶绿素a(Chl.a)浓度和蓝藻、绿藻、硅藻的生物量比例.
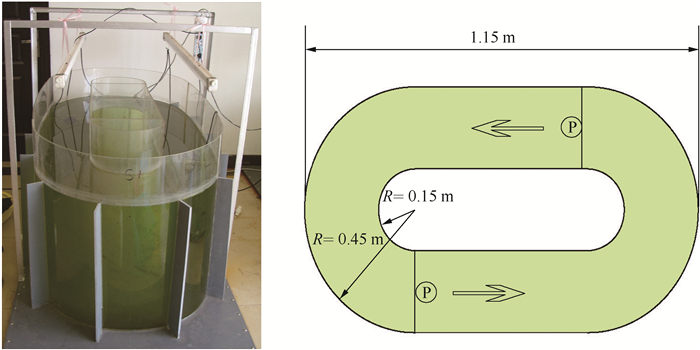
|
图 1 围隔实验装置及示意图 Fig.1 Enclosure experimental apparatus and its diagram |
流速采用便携式智能流速仪(LGY-Ⅱ型,南京水利科学研究院)测定.现场通过便携式水质分析仪(Hq40d,HACH,美国)测定并记录DO、pH值、电导率、水温等指标,采用散射光浊度仪(WGZ-1A系列,上海昕瑞仪器仪表有限公司)测定样品浊度.参照国家环保部推荐的标准方法测定铵态氮(NH4+-N)、硝态氮(NO3--N)、溶解性总氮(DTN)、TN、磷酸盐(PO43--P)、溶解性总磷(DTP)、TP等营养盐指标的浓度.
2 结果与讨论 2.1 物化因素分析实验期间不同流速下水温波动较小,在28.1~31.4℃之间,平均水温为29.6℃,在显著性水平P=0.05下各装置水温无显著性差异.在没有底泥干扰情况下,各装置浊度亦无显著性差异,除第1d(D1)浊度较高(约为15.0NTU)外,之后均保持较低的水平,大致在2.2~4.5NTU范围内(表 1).由于添加了营养盐,保证了各装置中营养盐保持在较高水平,平均浓度分别为NH4+-N:0.483mg/L、DTN:5.247mg/L、TN:5.821mg/L、DTP:0.279mg/L、TP:0.361mg/L,TN和TP浓度约为同期中心湖浓度的两倍,各装置营养盐浓度变化无显著性差异.这就表明,在S0、S1和S2运行下,由于水温、营养盐差异引起的相关参数差别不明显.3个装置运行过程中,pH和电导率变化范围较小,水体pH值基本维持在弱碱性,在7.93~8.78范围内变化,电导率基本在1066~1151μS/cm范围内波动,流动装置中水体电导率略高于静止装置.
| 表 1 实验期间不同流速下水温、pH、电导率和浊度的日变化趋势 Tab.1 Daily variations of water temperature, pH, conductivity and turbidity under different flow conditions |
水体流动对装置内DO影响较大,DO的日变化如图 2a所示.S1和S2水体中DO浓度在前2d发生骤降,自第3d开始受水体流动影响逐步变大,第5d开始基本保持稳定. S2中DO浓度略高于S1,两者稳定后的平均DO浓度分别为7.3和7.7mg/L,显著高于静止水槽(DO平均浓度为4.5mg/L).静止装置中DO变化波动明显,可能受浮游植物生长影响较大.

|
图 2 无底泥围隔中不同流速下DO(a)和Chl.a(b)的变化趋势 Fig.2 Daily variations of DO values (a) and Chl.a concentrations (b) under different flow conditions in enclosures |
Chl.a浓度变化趋势如图 2b所示,初始Chl.a浓度为44.22μg/L.浮游藻类从自然水体移到小尺度的水槽,必然要经历一个适应的过程.实验最初阶段,在0.06和0.10m/s流速下,Chl.a浓度在第2d均增加了约1.2倍,静止水槽中藻类的增长并不明显,这是由于水流加速了营养盐向藻细胞的扩散,显著刺激了浮游藻类生长,此时水流引起的营养盐向藻细胞的扩散作用为控制因素.流速对浮游植物的抑制效果在第3~8d表现明显,静止围隔中Chl.a浓度在实验开始前3d有所降低,之后出现大幅升高,于第6d下午达到最高值55.24μg/L,随后逐渐降低至10μg/L左右;两种流速下浮游藻类的生长规律相对一致,Chl.a浓度差异不明显,自第3d开始出现明显下降,至第6d和第7d降低至10μg/L,随后小幅升高,稳定在20~30μg/L左右.实验第8d以后,静止装置中Chl.a浓度出现明显下降,这与装置中出现大量的浮游动物关系密切.镜检结果发现,此时装置中水体清澈透明,藻细胞数量很少,枝角类浮游动物增多,平均密度超过80ind./L,远大于S1和S2中的平均密度20ind./L.朱宜平等[11]在流速为0.002m/s的野外围隔实验条件下,发现水体中有大量的枝角类动物生长,主要种类为秀体溞属(Diaphanosoma)和溞属(Daphnia), 能够将浮游藻类捕食殆尽.陈伟民等[10]认为相对于大水流状态,在静止状态和微小流动状态下,枝角类种类和数量会明显增多,且以大体型种类为主,常以浮游单细胞藻类、有机碎屑等为食,受到这些浮游甲壳动物的滤食,浮游藻类的数量和生物量将大幅降低.在0.06和0.10m/s流速下,Chl.a浓度除在后期出现了小幅度升高外,基本保持稳定,这可能是由于在流动条件下,流速抑制了浮游动物的生长,减小了浮游藻类的被捕食压力,促进了流动系统中生态系统的相对稳定.从生物量的角度计算,在这种尺度的实验条件下,流速对浮游藻类生长的相对抑制率约可达到50%.根据潜水泵自身带来的剪切效应对藻类细胞的影响,估算由此带来的抑制率在10%左右[12].
流速对水体DO浓度的影响是本研究的重要影响因素.实验过程中堵住潜水泵的增氧口,使得潜水泵的主要功能为制造水流.前2d流动水槽中DO浓度有一定的骤降,这与第2d浮游植物的骤增进而会消耗大量DO有关.在水流效应下,水层之间的搅动形成较强的扩散梯度,将造成大气中DO的快速补充,因此自第3d开始DO浓度迅速上升且基本保持稳定,这说明水体流动引起的DO浓度增加起主导作用,同时也说明水体中浮游藻类的光合作用能力可能受到了水流的影响;静止水槽中,DO浓度呈W形波动,与该水槽中浮游藻类的Chl.a浓度变化趋势基本一致,DO的上升与降低略微迟滞于Chl.a浓度的变化,这是由于静止条件下DO的扩散较慢.由于静止水体中DO浓度主要受浮游藻类光合作用产氧的影响,同时由于有机物、浮游动物等耗氧,DO浓度经常处于较低水平,但静止水体中Chl.a浓度在第3~8d显著高于流动水体,说明流动水槽中流速对浮游藻类的生长产生的抑制作用占据主导,DO对浮游藻类生长的作用弱于流速的作用.
2.3 流速对浮游藻类种群变化的影响静止装置(S0)和流动装置(S1和S2)中浮游植物种群变化差异明显,优势种属变化如表 2所示.运行前,各装置优势藻种相同,主要为蓝藻门的微囊藻属、绿藻门中的纤维藻属和硅藻中的小环藻属.S1和S2形成持续流动后,第5天即观察到微囊藻消失,且浮游藻种类越来越少,最后以绿藻为主,而静止围隔中,微囊藻直到第10d一直存在,这与每日进行的Phyto-PAM检测的种属变化结果比较一致(图 3).
| 表 2 流动和静止围隔装置内浮游植物的优势种属变化* Tab.2 Dominant phytoplankton species variations in still enclosure and flow enclosures |
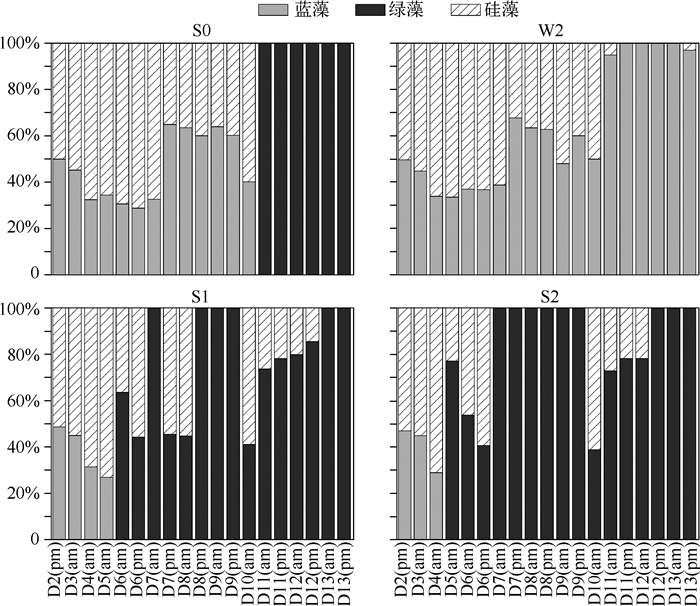
|
图 3 实验期间无底泥围隔装置和中心湖中蓝藻、绿藻和硅藻生物量比例变化 Fig.3 Daily biomass variations of Cyanophyta, Chlorophyta and diatoms composition in enclosures and Zhongxinhu Lake during observation periods |
在中心湖(W2)监测点,前10d主要是蓝藻和硅藻为优势种,平均生物量所占的比例分别为47.7%和52.3%,后3d硅藻少量出现,优势种99%以上为蓝藻,这与微囊藻的生理特性是相符的;S0中的藻种变化在前10d与W2相仿,后3d仅存绿藻中纤维藻属,S1和S2中的蓝藻分别在第5d和第4d全部消失,之后两个装置中均以绿藻为主、硅藻为辅,此时S1中绿藻和硅藻的平均生物量比例为77.1%和22.9%,S2中的平均生物量比例为83.7%和16.3%,S2中的环境条件相对更有利于绿藻生长(图 3).但静止水槽中,第11d开始微囊藻很快消失.S0、S1和S2后期均以绿藻门中的纤维藻属为主,这可能与浮游动物的选择性捕食有关.从静止状态向持续流动状态,浮游植物种属优势种基本从蓝藻向绿藻转化,这与国外在淡水河流[14]、湖泊[15]中的研究结论是一致的.从生物学的意义来看,多数蓝藻具有气囊,能够在水体中垂直移动,获取有利于自身增殖的营养盐和光照条件,较适宜在静止或弱紊动水体中生长,而多数绿藻和硅藻自身不能够运动,在流动或紊动的环境下反而能获得较大的增殖优势,这也是S0中蓝藻能够在第10d以后才消失而流动水体中蓝藻在第4d或第5d即消失的主要原因.S0中枝角类浮游动物多以单细胞藻类为食,使得围隔装置内以其难以觅食的纤维藻属占据优势地位.
水动力对浮游藻类群落演替的影响显著.Leira等[16]指出水动力强度变化是影响浮游藻类群落演替和数量变化的重要原因.Elliott等[17]认为水动力对藻类群落演替的影响极其显著,水动力条件会对一些浮游藻类生长造成抑制,同时促进其他藻类的生长.本研究中两组实验在流动的围隔装置内均发现了浮游植物优势藻种的显著变化,蓝藻的迅速消失、绿藻和硅藻形成生长优势是其主要特征.Huisman等[18]通过研究认为,随着水动力作用的增强,水体Chl.a浓度增加受抑制,且易下沉的绿藻和硅藻替代能垂直自由运动的蓝藻而成为优势种,认为藻类对光的竞争是造成群落演替的主要原因.本研究中采用透明的有机玻璃水槽,底部水体也能得到较好的光照条件.与自然水体相比,可能排除了浮游藻类对光的竞争,具有伪空胞的蓝藻无需浮到水面也能获取足够光照,因此对光的竞争可能不是引起本研究中藻类种群变化的原因.与所在的自然水体W2相比,W2中蓝藻一直是优势种,流动水槽S1和S2分别在第5d和4d以后蓝藻消失,一方面说明流速对蓝藻的抑制作用显著,另一方面说明空间尺度的改变显著影响了浮游藻类的生存环境,由于藻类生理习性的差异,不同物种对环境变化的适应速度是不同的,因此造成了适应相对较快的藻类生长速度加快,而适应相对较慢的藻类生长受到抑制,甚至在这样的环境中被淘汰.郭蔚华等[19]通过对优势藻种的分析认为,在三峡水库不同类型的水体中,优势硅藻、绿藻、蓝藻对流速表现出多种结构的适应性,流速是影响优势硅藻、蓝藻、绿藻组成变化的直接原因.
3 结论1) 实验中0.06和0.10m/s的流速均对浮游藻类的生长具有明显的抑制作用,总体抑制率可达50%左右.流速引起的DO浓度快速补充对浮游藻类的作用弱于实验中0.06和0.10m/s流速的作用,但实验初期流速加速营养盐向藻细胞扩散和实验后期流速对浮游动物生长的抑制作用仍会对流速效应造成较大影响.
2) 流速对浮游植物优势藻种变化影响显著.与静止水槽相比,流速对蓝藻的生长造成明显的抑制作用,同时促进了绿藻的生长,这与国外众多研究者在淡水河流和湖泊中的研究结果相一致.流速对浮游藻类种群变化的影响不仅表现为对光的竞争,而且与藻类对流速多种结构的适应性有关.
致谢: 本研究的野外工作得到同济大学长江水环境教育部重点实验室崇明水环境研究中心黄德发工程师和张增胜博士的大力支持, 在此表示感谢.| [1] |
孔繁翔, 马荣华, 高俊峰等. 太湖蓝藻水华的预防、预测和预警的理论与实践. 湖泊科学, 2009, 21(3): 314-328. DOI:10.18307/2009.0302 |
| [2] |
梁培瑜, 王烜, 马芳冰. 水动力条件对水体富营养化的影响. 湖泊科学, 2013, 25(4): 455-462. DOI:10.18307/2013.0401 |
| [3] |
李大美等. 生态水力学. 北京: 科学出版社, 2006.
|
| [4] |
颜润润, 逄勇, 赵伟等. 环流型水域水动力对藻类生长的影响. 中国环境科学, 2008, 28(9): 813-817. |
| [5] |
黄钰玲, 刘德富, 陈明曦. 不同流速下水华生消的模拟. 应用生态学报, 2008, 19(10): 2293-2298. |
| [6] |
王婷婷, 朱伟, 李林. 不同温度下水流对铜绿微囊藻生长的影响模拟. 湖泊科学, 2010, 22(4): 563-568. |
| [7] |
Mitrovic SM, Oliver RL, Rees C et al. Critical flow velocities for the growth and dominance of Anabaena circinalis in some turbid freshwater rivers. Freshwater Biology, 2003, 48(1): 164-174. DOI:10.1046/j.1365-2427.2003.00957.x |
| [8] |
古滨河, 刘正文, 李宽意等. 湖沼学——内陆水生态系统. 北京: 高等教育出版社, 2011, 26-32.
|
| [9] |
Long TY, Wu L, Meng GH et al. Numerical simulation for impacts of hydrodynamic conditions on algae growth in Chongqing Section of Jialing River, China. Ecological Modelling, 2011, 222(1): 112-119. DOI:10.1016/j.ecolmodel.2010.09.028 |
| [10] |
陈伟民, 陈宇炜, 秦伯强等. 模拟水动力对湖泊生物群落演替的实验. 湖泊科学, 2000, 12(4): 343-352. DOI:10.18307/2000.0408 |
| [11] |
朱宜平, 张海平, 李飞鹏等. 水动力对浮游生物影响的围隔研究. 环境科学, 2010, 31(1): 69-75. |
| [12] |
Li FP, Zhang HP, Zhu YP et al. Effect of flow velocity on phytoplankton biomass and composition in a freshwater lake. Science of the Total Environment, 2013, 447: 64-71. DOI:10.1016/j.scitotenv.2012.12.066 |
| [13] |
李飞鹏, 张海平, 陈玲. 小型封闭水体环境因子与叶绿素a的时空分布及相关性研究. 环境科学, 2013, 34(10): 3854-3861. |
| [14] |
Mitrovic SM, Chessman BC, Davie A et al. Development of blooms of Cyclotella meneghiniana and Nitzschia spp. (Bacillariophyceae) in a shallow river and estimation of effective suppression flows. Hydrobiologia, 2008, 596(1): 173-185. |
| [15] |
Hondzo M, Warnaars TA. Coupled effects of small-scale turbulence and phytoplankton biomass in a small stratified lake. Journal of Environmental Engineering-Asce, 2008, 134(12): 954-960. DOI:10.1061/(ASCE)0733-9372(2008)134:12(954) |
| [16] |
Leira M, Cantonati M. Effects of water-level fluctuations on lakes: an annotated bibliography. Hydrobiologia, 2008, 613(1): 171-184. DOI:10.1007/s10750-008-9465-2 |
| [17] |
Elliott JA, Defew L. Modelling the response of phytoplankton in a shallow lake (Loch Leven, UK) to changes in lake retention time and water temperature. Hydrobiologia, 2012, 681(1): 105-116. DOI:10.1007/s10750-011-0930-y |
| [18] |
Huisman J, Sharples J, Stroom JM et al. Changes in turbulent mixing shift competition for light between phytoplankton species. Ecology, 2004, 85(11): 2960-2970. DOI:10.1890/03-0763 |
| [19] |
郭蔚华, 李楠, 张智等. 嘉陵江出口段三类水体蓝绿硅藻优势种变化机理. 生态环境学报, 2009, 18(1): 51-56. |
 2015, Vol. 27
2015, Vol. 27 

