(2: 河海大学环境学院,南京 210098)
(3: 河海大学水利工程科学与水文水资源国家重点实验室,南京 210098)
(4: 河海大学港口海岸与近海工程学院,南京 210098)
(5: 南京大学盐城环保技术与工程研究院, 盐城 224000)
(2: College of Environment, Hohai University, Nanjing 210098, P.R.China)
(3: State Key Laboratory of Hydrology-water Resources and Hydraulic Engineering, Hohai University, Nanjing 210098, P.R.China)
(4: College of Harbour, Coastal and Offshore Engineering, Hohai University, Nanjing 210098, P.R.China)
(5: Yancheng Institute of Environmental Technology and Engineering, Nanjing University, Yancheng 224000, P.R.China)
自然水体生物膜主要指水体中大量微生物以附着形式存在于表层沉积物、岩石表面以及岸带,并以水体中的营养物质为养分不断地生长繁殖,通过微生物胞外聚合物对细胞的粘附、凝聚形成的,具有一定结构的微生物膜[1-2].自然水体中,生物膜微生物对水体物质循环及能量流动起着极其重要的作用,同时生物膜特征的变化也受水体环境因子、营养元素的影响[3-4].目前,有关水流条件对生物膜中微生物群落结构的研究主要集中在特定微生境下,如Beyenal等[5]通过考察流速对生物膜的影响,指出在低流速环境条件下生长的生物膜密度低,扩散性好,但不能抵抗高的水力剪切力;在高流速环境条件下生长的生物膜密度高,能抵抗高的水力剪切力,但扩散性差.生物反应器中生物膜结构研究发现[6],反应器的结构、水力剪切力、HRT、扰动程度、相界面湍动均会对生物膜结构产生影响.楼菊青[7]在研究移动床生物膜反应器水力特性的实验发现过快的水流循环速度会造成挂膜困难甚至会导致生物膜大量脱落,从而降低反应器效率.Celmer等[8]发现增大搅拌强度能够提高反硝化细菌的活性,使反硝化速率增大,随着生物膜反应器运行时间变化,反应器内微生物的丰度和种群变化也发生改变.田鑫等[9]讨论了不同水力及营养条件对沼泽红假单胞菌生物膜表面覆盖率、膜厚、干重和密度的影响,结果表明不同水力及营养条件对生物膜生长速率及结构具有重要影响.而对河流水体自然生物膜中微生物群落结构影响方面的研究甚少,因此,研究改善和提高水体生物膜适宜的水流条件不仅是当前河流治理和保护的迫切需要,而且也是值得深入研究和探讨的重要科学问题.
近年来磷脂脂肪酸(phospholipid fatty acid,PLFA)谱图分析法[10-14]、Biolog法[15]、PCR变性梯度凝胶电泳(DGGE)以及荧光原位杂交技术(FISH)等生物化学和分子生物学方法[16-17]对微生物群落结构分析起了积极的推动作用.其中, PLFA技术在对技术和仪器条件要求相对较低的情况下可以确定生态环境中微生物的生物量分布, 更重要的是, 从磷脂类化合物的组成成分中还可以得到较完整的“存活”微生物群落在数量和结构方面的重要信息, 如真菌、革兰氏阳性菌(G+)及革兰氏阴性菌(G-)等微生物群落.自White等[18]最先将PLFA技术应用于研究河口沉积物中微生物生物量的变化以来, PLFA技术已广泛应用于堆肥样品、海洋沉积物和土壤微生物群落研究[10-14], 但目前应用于水体生物膜微生物群落结构分析还鲜见报道.本文以南京市的静态、流动水体(包括乌龙潭、石头城护城河、玄武湖、秦淮河)为研究对象,采用PLFA法检测、分析不同时段两组水体生物膜微生物群落特征,探讨不同水体水质、温度与微生物群落结构特征之间的响应关系,以及水流状态对不同水体生物膜群落特征引起的差异,为水体生态修复提供依据.
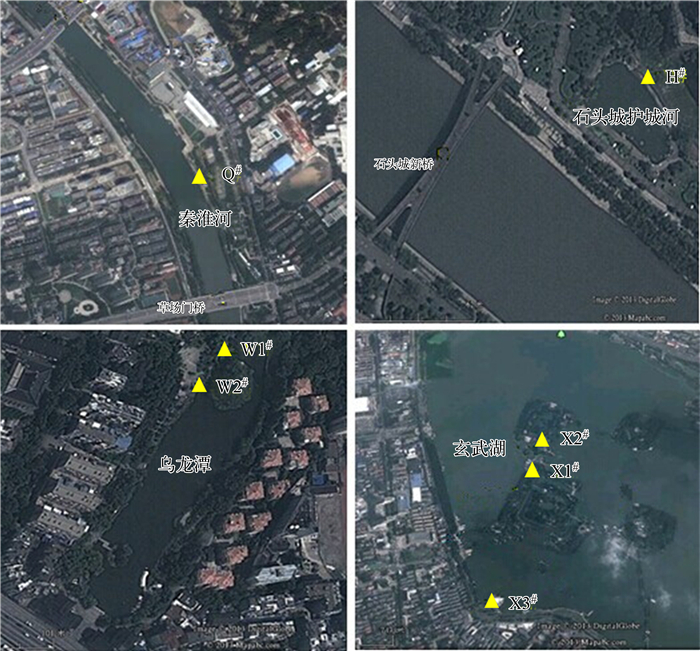
1 材料与方法 1.1 采样点设置本实验以南京市秦淮河、石头城护城河、乌龙潭、玄武湖为研究对象(图 1).采样点Q#设于草场门桥与定淮门桥之间,调查期间断面流速均大于0.1m/s.石头城护城河位于清凉山与石头城之间,采样点H#设于护城河岸坡,断面在调查期间流速几乎为零.乌龙潭位于南京市乌龙潭公园内,在乌龙潭内设置2个采样点,分别为W1#、W2#,在调查时段内采样点流速几乎为零.玄武湖位于南京市玄武湖风景区内,属于浅水湖泊,该实验在玄武湖设置3个采样点,分别为X1#、X2#、X3#,其中X1#、X2#设置于湖内桥的两侧,调查期间其流速大于0.1m/s,X3#位于玄武湖西南角,调查期间流速几乎为零.分别于2012年9、10、11、12月对7个采样点进行采样调查,采样频率为每月1次,所采集的生物膜均附着生长于水下10~20cm的岩石壁上.
|
图 1 采样点位图 Fig.1 Satellite map of sampling sites |
水样采集遵循《水和废水监测分析方法》(第四版)中地表水的采集要求,采用有机玻璃水质采样器采集各断面水样,并现场加酸固定使pH<2,装入塑料瓶内运回并贮存于冰箱内4℃备用.水体生物膜采用原位采集的方法[19],用不锈钢利器将附着在河道岩壁上的生物膜刮入盛有微量矿物盐溶液的塑料瓶内,低温保存并转移至实验室.并在现场对水体温度(T)及溶解氧含量(DO)进行测定,溶解氧测定采用便携式溶解氧测定仪,仪器型号为LDOTMHQ10.
1.2 实验方法化学需氧量(COD)、总磷(TP)、总氮(TN)、铵态氮(NH4+-N)和亚硝态氮(NO2--N)等水质指标根据《水和废水监测分析方法》(第四版)中的有关规定进行测定,硝态氮(NO3--N)根据文献[21]中改进的麝香草酚分光光度法进行测定.生物膜群落结构采用磷脂脂肪酸法进行测定[20-22].
PLFA提取:将生物膜和沉积物样品置于锥形瓶中,依次加入磷酸盐缓冲溶液7.2ml、氯仿8ml、甲醇16ml,振荡器振摇60min, 静置12h;再加入磷酸盐缓冲溶液7.2ml、氯仿8ml,振摇30min,静置过夜;离心3min(2500转/min)分离水相、氯仿相及固体相,移出氯仿相,并用氮气将其吹干;氯仿相过硅胶(6ml, 500mg)层析柱,依次用氯仿、丙酮、甲醇洗涤层析柱,收集甲醇洗涤液,用氮气吹干;用1ml体积比为1:1的甲醇和甲苯混合溶液与1ml 0.2mol/L的KOH甲醇溶液溶解样品,并在30~35℃的水浴中保温15min,冷却至室温,再加2ml体积比为4:1的正己烷、氯仿混合溶液,用乙酸将溶液定容调至中性,加2ml纯水,振摇1min,去水相,取底部正己烷相进行气相色谱(GC)测试.
GC条件:处理后的样品采用MIDI方法测定PLFA,用PLFA菌种鉴定系统测定提取的FAME.色谱条件:进样口250℃,检测器300℃,载气(氢气)流速30ml/min.升温程序:初始温度170℃,以5℃/min速度升温至260℃,维持18min,再以40℃/min的速度升温至310℃,保持1.5min,以C19作为内标[23].
2 结果与讨论 2.1 上覆水温度及营养盐分布2012年9、10、11、12月分别对7个断面进行监测,得到上覆水水温、溶解氧及营养盐分布情况,详见表 1和表 2.根据水体流速的差异,将研究断面分为静态水体和流动水体,其中W1#、W2#、H#、X3#为静态水体断面,X1#、X2#、Q#为流动水体断面.
| 表 1 静态水体不同月份上覆水环境因子变化 Tab.1 Variation of environmental factors in overlying water in static water |
| 表 2 流动水体不同月份上覆水环境因子变化 Tab.2 Variation of environmental factors in overlying water in running water |
采用Sherlock MIS系统得出PLFA的响应量,通过系统对内标十九烷酸甲酯的响应量及摩尔浓度计算出各点PLFA的摩尔浓度.PLFA与生物量之间的转换系数一般为2×104~6×104cells/pmol PLFA[18],本文取4×104cells/pmol,计算得到各监测点生物膜微生物总量及其变化趋势见表 3.
| 表 3 不同水体生物膜中微生物量的变化(cells/g) Tab.3 Variation of microbial biomass in different biofilms |
静态水体生物膜样品中微生物量的变化范围为9.16×106~2.74×108cells/g,流动水体生物膜样品中为1.69×107~7.77×107cells/g.静态水体生物膜微生物量各月份间变化较大,且各监测点微生物量随着时间的变化基本呈逐渐降低的趋势;流动水体生物膜微生物量随月份的变化规律不明显,X1#与X2#点的微生物量差异不大,Q#点的微生物量在10、12月有所突变;分析其与静态水体差异的原因,可能是流动水体中水流剪切力的增加,加强了生物膜传质能力,使得生物膜微生物量保持在107的数量级.
通过对生物膜中微生物的脂肪酸检测得到:4个水体中测得的PLFA共有91种,其中静态水体中检测到16种特异性的PLFA, 分别是:11:00、11:0 anteiso、11:0 iso 3OH、11:0 2OH、12:0 iso、13:0 anteiso、14:0 anteiso、15:0 3OH、14:0 3OH/16:1 iso I、15:1 anteiso A、16:1 iso G、17:1 w7c、17:0 iso 3OH、17:0 2OH、18:1 w5c、20:00,表征的主要微生物有G-和脱硫叶菌等;流动水体中检测到9种特异性的脂肪酸,分别是:10:0 iso、9:0 3OH、14:1 w5c、15:0 2OH、16:0 3OH、18:1 iso H、19:0 cyclo w10c/19w6、20:0 iso、20:2 w6, 9c,表征的主要微生物有黄杆菌,G-和原生动物等.
2.2.2 生物膜功能菌群含量分布PLFA分子的首官能团和侧链中通常隐含着样品中微生物的类型信息.因此,PLFA技术在微生物群落组成的确定方面有很大的实用价值.不同菌种的PLFA特征谱图不同[25],在高度专一性基础上具有多样性,可以作为微生物群落的标记物[24, 26-27].
微生物群落的研究中,PLFA一般能定性地粗略区分G+、G-、原生动物、放线菌及真菌等,见表 4.
| 表 4 示各种微生物类型的PLFA标记物[28-32] Tab.4 Types of PLFA markers indicating different kinds of microorganisms |
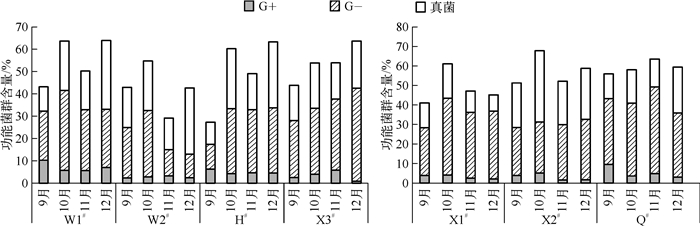
本文分别统计了3类可以指示功能菌群的PLFA丰度分布:G-、G+和真菌,G-包含的PLFA种类有16:1 w9c、16:1 w7c、16:1 w5c、18:1 w5c、18:1 w7c、17:0 cyclo、19:0 cyclo w8c、19:0 cyclo w10c/19w6;G+包含的PLFA种类有15:0 iso、15:0 anteiso、16:0 iso、16:0 10-methyl、15:0 iso 3OH、17:0 iso、17:0 anteiso;真菌包含的PLFA种类有18:3 w6c(6, 9, 12)、18:2 w6, 9c、18:1 w9c.功能菌群丰度统计见图 2,各采样点的G-含量相对比较多,真菌次之,G+最少.静态水体与流动水体中各菌群含量呈现不一样的规律.
|
图 2 静态水体和流动水体功能菌群相对含量 Fig.2 Content of functional bacteria in static water and running water |
静态水体中G-的含量为11.11%~46.14%,其中16:1w7c、16:1w5c、18:1w7c所指示的微生物是G-的主要成分并存在于每个样品中.在9、10、11月3个调查时段内,真菌的含量均少于G-,真菌含量变化范围在10.12%~26.80%之间;12月份的调查样品中真菌的含量高于G-,真菌的变化范围为20.92%~30.66%;3种脂肪酸中18:2w6, 9c、18:1w9c是其含量的主要贡献者.G+在3组成分中含量最少,含量为0.88%~10.38%;在统计的几种脂肪酸中15:0iso和16:0iso是其主要成分.4个调查时段中W1#、W2#生物膜中主要功能菌群的含量呈现锯齿形的变化规律,呈现这种变化主要是由于G-和真菌含量发生大的变化,而H#、X3#呈现逐渐增加的变化规律,H#的变化主要是由G-和真菌引起的,X3#的变化则主要由G-的含量大幅度增加造成的.4组水体中主要功能菌群含量的变化范围为27.41%~66.20%.
流动水体中G-的含量变化不明显,且各监测点之间的含量差异也不大,含量变化范围为24.63%~44.54%,其中16:1w9c、16:1w7c、16:1w5c、18:1w7c为G-含量的主要贡献者,存在于每一个检测样品中,且16:1w7c的含量居多,达到10.14%~26.19%.各调查时段内,真菌含量基本均小于G-,含量范围为8.44%~36.71%,随着时间的变化,真菌的含量变化规律不明显.G+含量在3类主要菌群中最少,含量变化为1.63%~9.70%,贡献率较大的脂肪酸为15:0iso,随着季节的变化,G+的含量有所降低.4个调查时段内,流动水体的主要功能菌群量变化波动不大,变化范围为43.09%~68.25%.
2.3 生物膜群落结构与环境因子的响应关系 2.3.1 生物膜微生物量与环境因子的响应关系采用SPSS 17.0对不同水体生物膜微生物量及上覆水水质指标进行相关性分析,旨在找出生物膜微生物量与上覆水各水质指标的定量响应关系.分析采用9、10、11、12月份各采样点的微生物量及其上覆水水质数据.静态水体生物膜中微生物量与温度、COD、TP、TN有较显著的正相关性,其相关系数r≥0.567(P<0.05),与其他因子没有显著的相关性;在流动水体中,分析结果显示微生物量与NO2--N呈显著负相关(r=-0.644,P<0.05),与其他水质指标未表现出较显著的相关性(表 5).这说明水体上覆水中氮、磷对微生物的生长、繁殖有一定的影响,但氮元素的影响可能更集中在有机氮的影响,无机氮对微生物生长的影响不大.分析其原因可能是由于静态水体中氮、磷含量充足可促进微生物的生物、化学反应,加快微生物的代谢功能.流动水体中微生物量与NO2--N呈显著负相关,可能是因为流动水体加速了上覆水中氮元素向生物膜及沉积物的迁移转化,微生物生长、繁殖加快,硝化、反硝化作用完全,致使上覆水NO2--N含量下降,但是水流剪切力的变化也可能加速了沉积物中磷元素向上覆水中的释放,所以微生物量与TP未表现出很好的相关性.通过两类水体分析结果的对比,可以认为水体流速及剪切力的变化对微生物降解有机污染物有一定的促进作用.
| 表 5 各水体生物膜微生物量与上覆水环境因子的相关性 Tab.5 Correlation coefficients of microbial biomass and environmental factors |
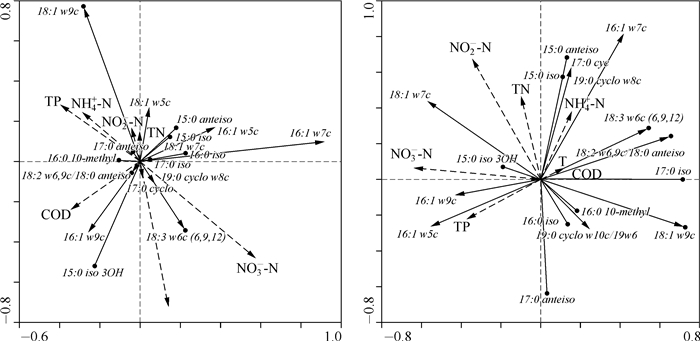
将水环境营养要素作为环境变量、PLFA种类数据代表微生物群落主要功能菌群组成信息,利用CANOCO for windows 4.5对静态水体、流动水体采样断面环境营养要素与微生物主要功能菌群进行冗余分析,分析结果见图 3.图中,箭头分别表示各指标沿程增加的方向,PLFA指标标线与环境因子标线之间夹角的余弦值为两者间的相关性大小,投影方向与环境因子标线方向一致表示呈正相关,方向相反则为负相关,物种箭头长度表示的是在排序空间内的物种变化量的比例,环境因子箭头标线的长短表示其对于PLFA群落结构影响程度的大小.
|
图 3 静态水体和流动水体生物膜功能菌群与环境因子的冗余分析 Fig.3 RDA analysis between functional bacteria and environmental factors in static water and running water |
对照表 5及图 3可以看出,第一、二轴围成的4个平面内均有脂肪酸分布.环境因子中影响程度较大的主要是温度和NO3--N.指示真菌的18:3 w6c(6, 9, 12)与温度、NO3--N表现出了显著的正相关性,18:2 w6, 9c/18:0 ante与温度、COD正相关性较显著,18:1 w9c与温度、NO3--N表现出了负相关性、与TP、NH4+-N、NO2--N有显著的正相关性;从脂肪酸箭头长度可以看出18:1 w9c、18:3 w6c较长,说明4个月份中,其含量变化相对较大.指示G+的各脂肪酸种类含量相对变化较小,15:0 iso、15:0 anteiso、16:0 iso、17:0 iso主要分布在第一、二轴的正半轴组成的平面内,该平面内脂肪酸箭头与NO3--N、TP、NH4+-N、NO2--N基本垂直,即表示与这几个指标相关性不显著,与COD增加方向相反,说明与COD呈一定的负相关性.指示G-的脂肪酸主要分布于第二轴与第一轴负半轴及第一、二轴的负半轴组成的三个平面内,环丙烷脂肪酸17:0 cyclo、19:0 cyclo w8c与温度、NO3--N表现出了显著的正相关性,单不饱和脂肪酸16:1 w7c、16:1 w5c、18:1 w7c与COD表现出了负相关性,16:1 w9c与COD有显著的正相关性.随着时间的变化,G-中C16对应的单不饱和脂肪酸含量变化相对较大,环丙烷脂肪酸及C18对应的单不饱和脂肪酸含量变化较小.通过分析可知,温度、NO3--N、COD是功能菌群的主要影响因子,各指标对真菌、G-中C16对应的单不饱和脂肪酸的相对含量变化影响较大,对G+及G-中的环丙烷、C18对应的单不饱和脂肪酸相对含量变化影响较小.
从图 3可以看出,流动水体中环境因子氮、磷元素是功能菌群显著影响因子,温度、COD的影响较小.指示G-的单不饱和脂肪酸16:1 w9c、16:1 w5c、18:1 w7c主要分布于第二轴与第一轴的负半轴围成的平面,与环境因子TP、NO3--N、NO2--N所在平面基本一致,说明两者之间有较显著的正相关性,与COD、温度表现出负相关性;16:1 w7c/16:1 w6c、17:0 cyclo、19:0 cyclo w8c与TN、NH4+-N表现出较显著的正相关性;19:0 cyclo w10c/19 w6与TN、NO2--N的负相关性较显著.从各脂肪酸的相对含量变化来看,G-对应的脂肪酸相对含量变化较大.指示G+的C15饱和脂肪酸15:0 iso、15:0 anteiso、15:0 iso 3OH所在平面与氮元素指标所在平面,说明氮元素与C15饱和脂肪酸呈显著正相关,而16:0 iso、16:0 10-methyl、17:0 iso、17:0 anteiso则与氮元素表现出显著的负相关性,且C16对应的饱和脂肪酸相对含量变化较小.真菌包含的3种C18脂肪酸主要分布于第二轴与第一轴正半轴组成的平面,与TP、NO3--N表现出显著的负相关性,与COD、温度表现出正相关性,且各相对含量变化均较大.由此可以看出,TP主要影响功能菌群中指示G-的单不饱和脂肪酸和真菌,可促进G-的生长,对真菌的繁殖有抑制作用.氮元素含量的增加可促进G+中的C15饱和脂肪酸及G-的单不饱和脂肪酸生长,而C16、C17、C19对应的饱和脂肪酸会受到一定的抑制.随着时间的变化,除个别指示G+的脂肪酸如15:0 iso 3OH、16:0 iso、16:0 10-methyl外,其他指示功能菌群的脂肪酸相对含量变化均较大.
3 结论1) 在调查月份中,水体温度逐月降低,使得水体微生物新陈代谢缓慢,生长、繁殖能力下降,由于上覆水营养盐浓度降低,微生物可吸收利用的物质减少,大量微生物死亡,致使静态水体中生物膜微生物量不断减少,微生物数量级从108降低到106.流动水体微生物量与水体温度、上覆水营养盐没有显著的响应关系,而水流剪切力的增加,加强了生物膜传质能力,使得流动水体生物膜微生物量保持在107的数量级.
2) 在调查水体中,功能菌群(G-、G+、真菌)含量可达到微生物总量的27.41%以上,其中G-比重相对较大,真菌次之,革兰氏阳性菌(G+)最小.随着温度的降低,静态水体中功能菌群的总含量波动较大,其波动范围为27.41%~66.20%,而流动水体中功能菌群的总含量波动较小,在43.09%~68.25%之间,差异的主要贡献者为G-和真菌.G-中脂肪酸16:1 w7c/161 w6c、16:1 w5c的含量较多,G+中脂肪酸15:0iso是其主要成分,而18:2 w6, 9c/18:0 ante、18:1 w9c是真菌含量的主要贡献者.
3) 静态水体中环境因子温度、NO3--N、COD是功能菌群的主要影响因子,氮元素是流动水体中功能菌群显著影响因子.真菌受NO3--N、温度、COD的影响较大,COD及温度的提高对真菌的生长有促进作用,NO3--N抑制18:1 w9c的生长,但在静态水体中可促进18:3 w6c(6, 9, 12)对应的真菌的生长.G+在静态水体中主要受COD的影响,COD浓度增加对指示G+的饱和脂肪酸有抑制作用;而在流动水体中主要受氮元素影响,C15饱和脂肪酸对应的G+生长受到促进,C16、C17饱和脂肪酸对应的G+受到抑制.G-中单不饱和脂肪酸与COD呈负相关性,COD浓度的增加抑制其生长;环丙烷脂肪酸主要受水体氮元素含量的影响,氮含量的增加可促进17:0 cyclo、19:0 cyclo w8c的生长.
| [1] |
付长营, 方涛, 邓南圣. 天然水体中生物膜对水环境中磷的生物地球化学过程影响. 地球科学与环境学报, 2006, 28(3): 97-101. |
| [2] |
黄敏婷, 陆春. 生物膜胞外聚合物的检测技术与功能的研究进展. 微生物学杂志, 2010, 30(6): 82-85. |
| [3] |
Hoellein TJ, Arango CP, Yana Z. Spatial variability in nutrient concentration and biofilm nutrient limitation in an urban watershed. Biogeochemistry, 2011, 106(2): 265-280. DOI:10.1007/s10533-011-9631-x |
| [4] |
李鱼, 董德明, 刘亮等. 自然水体生物膜及其在水环境中的作用. 环境科学动态, 2004(4): 16-19. |
| [5] |
Beyenal H, Lewandowski Z. Internal and external mass transfer in biofilms grown at various flow velocities. Biotechnology Progress, 2008, 18(1): 55-61. |
| [6] |
Mudliar S, Banerjee S, Vaidya A. Steady state model for evaluation of external and internal mass transfer effects in an immobilized biofilm. Bioresource Technology, 2008, 99(9): 3468-3474. DOI:10.1016/j.biortech.2007.08.001 |
| [7] |
楼菊青. 新型移动床生物膜反应器水力特性的研究. 环境科学与技术, 2007, 30(9): 31-35. |
| [8] |
Celmer D, Oleszkiewicz JA, Cicek N. Impact of shear force on the biofilm structure and performance of a membrane biofilm reactor for tertiary hydrogen-driven denitrification of municipal wastewater. Water Research, 2008, 42: 3057-3065. DOI:10.1016/j.watres.2008.02.031 |
| [9] |
田鑫, 廖强, 党楠等. 营养及水力条件影响光合细菌生物膜生长特性实验. 中国生物工程杂志, 2009, 29(4): 67-72. |
| [10] |
Medeiros PM. Fernandes MF, Dick RP et al. Seasonal variations in sugar contents and microbial community in a ryegrass soil. Chemosphere, 2006, 65(5): 832-839. DOI:10.1016/j.chemosphere.2006.03.025 |
| [11] |
Hackl E, Pfeffer M, Donat C et al. Cpmposition of the microbial communities in the mineral soil under different types of nature forest. Soil Biology and Biochemistry, 2005, 37(4): 661-671. DOI:10.1016/j.soilbio.2004.08.023 |
| [12] |
PuglisI E, Nicelli M, Capri E et al. A soil slteration index based on phospholipid fatty acid. Chemosphere, 2005, 6(11): 1548-1557. |
| [13] |
Crdovakrelyos AL, Cao Y, Green PG et al. Diversity, composition, and geographical distribution of microbial communities in California salt marsh sediments. Applied and Environmental Microbiology, 2006, 72(5): 3357-3366. DOI:10.1128/AEM.72.5.3357-3366.2006 |
| [14] |
Syakti AD, Mazzella N, Nerini D et al. Phospholipid fatty acid of a marine sedimentary microbial community in a laboratory microcosm:response to petroleum hydrocarbon contamination. Organic Geochemistry, 2006, 37(11): 1617-1628. DOI:10.1016/j.orggeochem.2006.01.009 |
| [15] |
Mondini C, Insam H. Community level physiological profiling as a tool to evaluate compost maturnity: a kinetic approach. European Journal of Soil Biology, 2003, 39(3): 141-148. DOI:10.1016/S1164-5563(03)00029-3 |
| [16] |
Green SJ, Michejr FC, Hadar Y et al. Similarity of bacterial communities in sawdust-and straw-amend cow manure composts. FEMS Microbiology Letters, 2004, 233(1): 115-123. DOI:10.1016/j.femsle.2004.01.049 |
| [17] |
Cahyani VR, Matsuya K, Asakawa S et al. Succession and phylogenetic profile of eukaryotic communities in the composting process of rice straw estimated by PCR-DGGE analysis. Biology and Fertility of Soils, 2004, 40(5): 334-344. DOI:10.1007/s00374-004-0783-x |
| [18] |
White DC, Davis WM, Nickels JS et al. Determination of the sedimentary microbial biomass by extractible lipid phosphate. Oecologia, 1979, 40: 51-62. DOI:10.1007/BF00388810 |
| [19] |
Behra R, Landwehrjohann R, Vogal L et al. Copper and zinc content of periphyton from two rivers as a function of dissolved metal concentration. Aquatic Sciences, 2002, 64(3): 300-306. DOI:10.1007/s00027-002-8074-9 |
| [20] |
朱亮, 孙凌宇, 储如花等. 城市纳污河流沉积物微生物群落结构特征. 水科学进展, 2013, 24(1): 132-137. |
| [21] |
陈开林, 陈开梅. 麝香草酚比色法检测硝酸盐的改进. 海峡预防医学杂志, 2004, 10(3): 49-50. |
| [22] |
Buyer JS, Sasser M. High throughput phospholipid fatty acid analysis of soils. Applied Soil Ecology, 2012, 61: 127-130. DOI:10.1016/j.apsoil.2012.06.005 |
| [23] |
Liu Y, Yao H, Huang C. Assessing the effect of air-drying and storage on microbial biomass and community structure in paddy soils. Plant and Soil, 2009, 317: 213-221. DOI:10.1007/s11104-008-9803-1 |
| [24] |
Tunlid A, Baird BH, Trexler MB et al. Determination of phospholipids ester-linked fatty acid and poly β-hydroxybutyrate for the stimulation of bacterial biomass and activity in the rhizosphere of the rape plant Brassica napus (L. Microbiol, 1985, 31(12): 1113-1119. |
| [25] |
Marschner P. Soil microbial community structure and function assessed by FAME, PLFA and DGGE-Advantages and limitations. Soil Biology, 2007, 11: 181-200. DOI:10.1007/978-3-540-70865-0 |
| [26] |
Guezennec J, Ortega-Morales O, Raguenes G et al. Bacterial colonization of artificial substrate in the vicinity of deep-sea hydrothermal vents. FEMS Microbiology Ecology, 1998, 26: 89-99. DOI:10.1111/fem.1998.26.issue-2 |
| [27] |
Tunlid A, White DC. Biochemical analysis of biomass, community structure, nutritional status, and metabolic activity of microbial communities in soil. Soil Biochemistry, 1992, 7: 229-262. |
| [28] |
Leckie SE. Methods of microbial community profiling and their application to forest soils. Forest Ecology and Management, 2005, 220: 88-106. DOI:10.1016/j.foreco.2005.08.007 |
| [29] |
Kucera JM, Dick RP. PLFA profiling of microbial community structure and seasonal shifts in soils of a douglas-fir chronosequence. Microbial Ecology, 2008, 55: 500-511. DOI:10.1007/s00248-007-9295-1 |
| [30] |
Heike Rutter. Phospholipid analysis as a tool to study complex microbial communities in marine sediments. Journal of Microbiological Methods, 2002, 48: 149-160. DOI:10.1016/S0167-7012(01)00319-0 |
| [31] |
Liu Y, Yao H, Huang C. Assessing the effect of air-drying and storage on microbial biomass and community structure in paddy soils. Plant and Soil, 2009, 317: 213-221. DOI:10.1007/s11104-008-9803-1 |
| [32] |
Mentzer JL, Goodman RM, Balser TC. Microbial response over time to hydrologic and fertilization treatments in a simulated wet prairie. Plant and Soil, 2006, 284: 85-100. DOI:10.1007/s11104-006-0032-1 |
| [33] |
朱亮, 赵林多, 刘钢等. 大运河沉积微生物群落结构特征分析. 中国矿业大学学报, 2010, 39(2): 295-301. |
| [34] |
吴愉萍. 基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[学位论文]. 杭州: 浙江大学, 2009.
|
| [35] |
王亚芬. 应用磷脂脂肪酸技术解析人工湿地微生物群落结构的研究[学位论文]. 北京: 中国科学院研究生院, 2007.
|
 2015, Vol. 27
2015, Vol. 27 

