(2: 中国科技大学地球与空间学院极地环境研究室,合肥 230026)
(3: 中国科学院地质与地球物理研究所,北京 100029)
(2: Institute of Polar Environment, University of Science and Technology of China, Hefei 230026, P.R.China)
(3: Institute of Geology and Geophysics, Chinese Academy of Sciences, Beijing 100029, P.R.China)
随着人类活动的加剧和社会经济的持续发展,云南典型湖泊的生态系统结构与功能在过去几十年里发生了较大变化.例如滇池蓝藻水华频繁暴发[1],抚仙湖土著鱼类大量减少[2],阳宗海水体砷污染等[3].各种环境压力已经对云南湖泊的生态系统产生了重要的影响,尤其是湖泊中的水生生物,而这些环境压力的长期生态效应可以被湖泊沉积物记录下来[4].浮游动物处于湖泊食物链的中间环节,既直接摄食浮游植物,其本身又是很多鱼类的重要食物来源.同时浮游动物对湖泊环境的变化十分敏感,已成为评价湖泊生态环境变化的重要指标之一.目前对云南湖泊生态系统中部分重要的水生生物指标(如浮游动物)缺乏长期、连续的监测数据和较为系统的研究,尤其是对多重环境压力驱动湖泊生态系统的叠加和独立效应缺乏系统评价,因此急需开展对浮游动物长期变化的历史重建与影响因子识别.
枝角类是甲壳纲浮游动物的重要组成部分,是反映湖泊营养水平与捕食压力变化的敏感生物指标之一.象鼻溞(Bosmina)是云南湖泊中一种常见的浮游枝角类,其生物量与物种组成通常受湖泊初级生产力的控制,如B.longispina主要出现在较低的营养水平时期,而富营养时期则被B.longirostris所代替[5];同时由于枝角类作为一种重要的鱼类食物对鱼类捕食压力的变化十分敏感,其个体大小已成为捕食压力变化的良好指示器[6].大量研究表明大型食浮游动物鱼类趋向于选择性捕食个体更大、更可见的属种(例如溞属)和种群内相对更大的个体,而一些个体相对较小的种类(例如象鼻溞属)更容易受到小型食浮游动物鱼类和大型无脊椎动物捕食者的攻击和选择性捕食[7].
由于对云南湖泊水生生物的监测存在时间尺度较短且缺乏连续、系统的调查等问题,使得在应用现代监测数据了解湖泊生态系统变化方面受到较大的限制.目前云南湖泊的污染修复与生态治理对获取长期生态环境数据的需要变得急为迫切,古湖沼学的研究方法与技术手段可以为研究湖泊生态系统的长期变化提供重要信息[8].例如,湖泊食物网的一些重要组成部分(如硅质藻类、几丁质无脊椎动物)可以较好地在湖泊沉积物中保存,使得它们成为古湖沼学研究中的重要生物指标,它们在沉积物中的生物量、群落组成等信息可以用来重建湖泊生物群落变化的历史,并为评价不同环境压力的长期生态效应提供基础数据.在湖泊沉积物中象鼻溞的数量较大、保存良好,其响应捕食压力所表现的形态变化特征(壳长、刺长与第一触角长度)在湖泊沉积物中可以较为完整地保存,同时根据其头孔位置等特征可以鉴定到物种的水平,使得象鼻溞在古湖沼学的应用中成为指示湖泊环境压力变化的良好指示器[9].
在云南湖泊的研究中,一些学者已经利用湖泊沉积物中的枝角类提取出了湖泊环境变化的信息.例如,Liu等利用湖泊沉积物中枝角类群落结构的变化探讨了滇池中浮游动物对湖泊富营养化、外来鱼类引入的响应特征[10],也利用湖泊沉积物中的枝角类群落结构变化以及象鼻溞的形态变化探讨了抚仙湖富营养化和鱼类引入对浮游动物的长期影响[11].然而,由于象鼻溞生物量的变化既受到湖泊富营养化又受到鱼类捕食的影响,目前我们对上行效应与下行效应对不同湖泊的象鼻溞生物量变化是否存在差异性影响,以及这两种效应的相互作用强度如何还知之甚少.大量湖泊生态实验与野外数据表明鱼类对浮游动物的捕食压力会随着湖泊营养水平的变化而改变.如Jeppesen等发现在湖泊营养水平较低或较高时鱼类的捕食压力较大,而在中等的营养水平下鱼类捕食压力相对较弱.因此,在不同营养水平下湖泊浮游动物面临的鱼类捕食压力随着湖泊生产力的变化可能出现不同的变化模式,如在重富营养化的水体中鱼类捕食压力与营养水平的相互作用可能要强于营养水平总体较低且变化幅度较小的湖泊[12].
本研究以目前处于重富营养水平的滇池和中-贫营养水平的抚仙湖为研究对象,通过分析沉积物色素、象鼻溞等生物记录,识别象鼻溞生物量随着湖泊营养水平变化的响应模式,并对比2个湖泊上行与下行效应对象鼻溞生物量的相对驱动强度及其相互作用强度.因此,通过对比不同营养水平及经历不同富营养化过程的湖泊沉积物记录,可以帮助我们探讨湖泊营养水平与捕食压力对浮游动物变化的长期驱动过程与机制,为认识多重环境压力下湖泊生态系统的响应模式并对污染湖泊开展生态修复提供重要的科学依据.
1 材料与方法 1.1 样品采集位于滇中地区的滇池为大型浅水湖泊,目前处于重富营养水平;而抚仙湖则是大型深水湖泊,目前处于中-贫营养水平(表 1).利用重力采样器于2012年6月采集滇池(24°46′7″N,102°39′51″E)样品,水深5.4m,柱长33cm,以0.5cm间隔进行分样;于2012年3月采集抚仙湖(24°28′10″N,102°52′12″E)样品,水深58m,柱长21cm,按5cm以前间隔0.25cm,5cm以后间隔0.5cm进行分样.样品密封并避光保存,竖立带回实验室.
| 表 1 滇池与抚仙湖的湖泊学基本特征* Tab.1 Summary of key limnological features of Lake Dianchi and Lake Fuxian |
通过对样品放射性核素210Pb和137Cs进行测试分析,利用美国Canberra公司生产的高纯锗探测器、数字化谱仪及多通道分析系统,建立了两个钻孔的年代学序列.具体步骤包括:将冻干的样品研磨,称取3~5g左右干重样品放入与标准源同一规格的塑料容器内并蜡封2周左右,使226Ra与210Pb处于衰变平衡体系,然后测定不同深度样品的210Pb和137Cs放射性强度,并应用恒定放射性通量模式建立年代学系列[14].
沉积物枝角类样品的处理参照Korhola等的方法[15].首先将冻干的样品充分混合均匀,称取约0.1g(干重)样品,倒入100ml烧杯中;再加入50ml的10%KOH,并在电热板上加热到70℃左右约30min,期间利用玻璃棒轻轻地搅拌样品,以使样品充分地分解絮凝;然后用78μm的筛网过滤,再用蒸馏水将筛网上的样品清洗到带有刻度的15ml离心管中,加入3滴95%的乙醇用于样品的室温保存,并定容.再将样品充分摇匀,利用0.05ml的移液枪吸取样品溶液,置于载玻片上,在电热板上以50℃加热,在样品蒸发待干前,加入两滴甘油-藏红染料,用针轻轻搅拌使其混合并均匀分布,将盖玻片置于其上,待其冷却后用指甲油密封盖玻片的边缘以便长期保存.象鼻溞的鉴定与计数在莱卡显微镜(Leica DM2500)下进行,依据Goulden和Frey的鉴定标准[16],象鼻溞有Bosmina longispina与B.longirostris 2个种.同时统计头壳、触角、后腹部的个数并使总个体数量不少于60个,最后换算成绝对丰度(每克干重沉积物中象鼻溞个体数量)作为生物量的指标.并测量玻片中所见象鼻溞的第一触角长度(LA)、壳长(LC)与刺长(LM)(图 1)[17-18],每个样品中象鼻溞不同部位的测量样本个数不低于10.
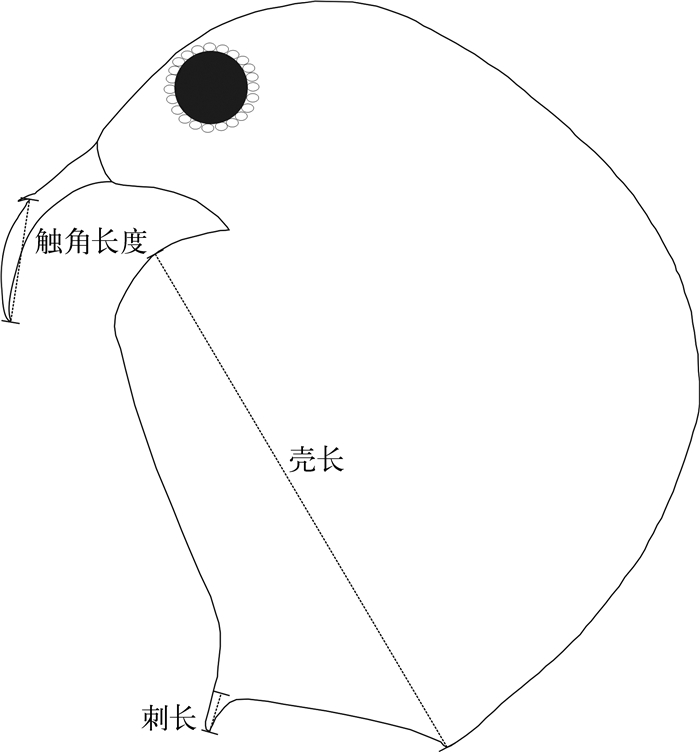
|
图 1 象鼻溞的长度测量 Fig.1 Diagram showing the length measurement of Bosmina |
藻类植物死亡后产生的某些色素长期保存在湖泊沉积物中,由于不同植物具有不同的色素组合类型,因此根据湖泊沉积物中色素的含量和种类可恢复湖泊的初级生产力.沉积物色素分析方法主要参考文献[19].具体步骤包括:将沉积物样品搅拌均匀并冻干;称重50~150mg,不同色素指标按照标准方法用0.2mm孔隙先过滤,然后在最小光辐照下用氮气干燥;类胡萝卜素、叶绿素和衍生化合物含量用高效液相色谱仪(HPLC)测量,并用苏丹染料做参照标准.
为探讨上行效应与下行效应对象鼻溞生物量的影响强度,本文应用沉积物Chl.a色素含量这一指标指示湖泊初级生产力,用象鼻溞的壳长(LC)代表鱼类的捕食压力,对象鼻溞生物量的变化进行多元回归分析,探讨在滇池与抚仙湖中两个自变量(Chl.a和LC)对因变量(象鼻溞生物量)变化的独立解释程度和相互作用强度,并应用方差分解方法对结果进行图形表达.在统计分析中相关数据首先进行正态化分布的检验并进行相应的数据转换,本文所采用的统计分析在Rv 2.3.0软件中完成,沉积物地层图应用C2 v1.4.3软件进行处理分析.
2 结果 2.1 滇池和抚仙湖沉积物色素与象鼻溞变化的历史重建近百年来沉积物色素记录表明湖泊初级生产量在滇池和抚仙湖中均出现不同程度的增加,但其变化时间序列和幅度呈现明显不同的特征.在20世纪中期之前2个湖泊沉积物色素记录持续处于较低的含量且变化幅度较小;1960s初期开始,滇池的Chl.a含量开始显著增加并呈现持续快速增加的特征(图 2a),而抚仙湖从1950s开始出现小幅度的叶绿素含量上升,但总体增加幅度相对较小(图 2b).

|
图 2 滇池(a)和抚仙湖(b)沉积物指标变化的地层图 Fig.2 Stratigraphic plots showing sedimentary pigment and bosminid changes |
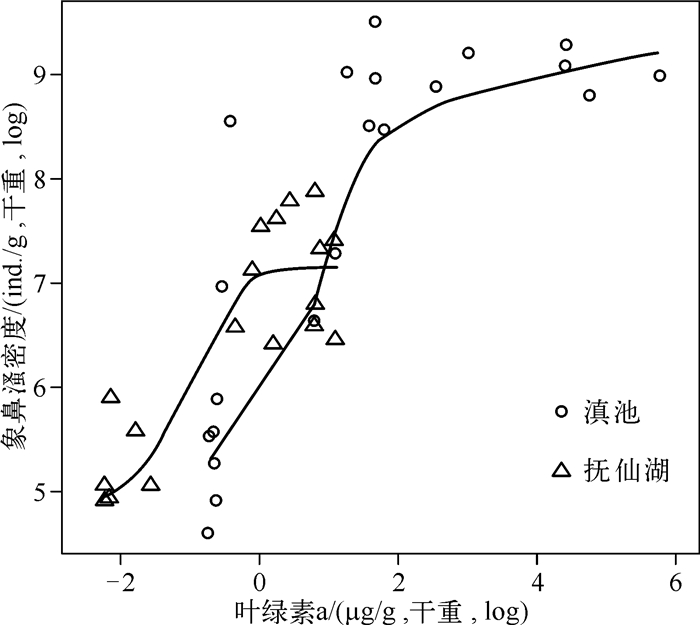
沉积物象鼻溞密度在2个湖泊中也出现较为显著的变化.在湖泊生产力持续较低的时期,2个湖泊的象鼻溞密度总体维持在较低的水平,且以喜好贫营养生境的Bosmina longispina为主(如占全部象鼻溞密度的百分比大于60%~70%).随着湖泊营养水平的升高,B.longispina在象鼻溞密度中所占的比例逐渐减少,而喜好富营养的B.longirostris占比则逐渐升高(图 2).同时2个湖泊中象鼻溞的密度总体上也随湖泊生产力的增加而上升(图 3),但在抚仙湖其密度在过去40年里出现总体下降的趋势(图 2b).
|
图 3 滇池和抚仙湖沉积物象鼻溞与Chl.a生产量的关系 Fig.3 The relationship between the sedimentary bosminid and Chl.a productions at Lake Dianchi and Lake Fuxian |
与沉积物色素和象鼻溞密度的变化相比,沉积物象鼻溞的个体大小呈现较大的波动.滇池和抚仙湖中,象鼻溞总体大小的壳长呈现与较大个体物种B.longispina第一触角长度相似的变化趋势(滇池:r=0.578,P=0.01,n=18).与外来银鱼总捕捞量的历史数据对比发现,象鼻溞总体大小的壳长在银鱼引入时期出现明显的减小.如在1980s初期开始2个湖泊中皆引入银鱼并很快成为建群种(图 2),同期象鼻溞的壳长和B.longispina第一触角长度均出现明显减小,指示了银鱼的引入导致对包括象鼻溞在内的浮游动物捕食压力的增加,从而对象鼻溞群落和个体大小产生抑制效应.
2.2 上行与下行效应对象鼻溞生物量长期变化的驱动分析为了评价上行与下行效应对湖泊生态系统的驱动作用,应用沉积物色素指标指示湖泊初级生产力水平(即上行效应),同时以沉积物象鼻溞壳长代表鱼类捕食压力的变化(即下行效应),通过应用多元线性回归方法来定量探讨两种效应对象鼻溞生物量变化的相对驱动强度及相互作用强度.方差分析结果表明,Chl.a、象鼻溞的LC共同解释了滇池象鼻溞生物量变化的77.25%(P<0.001,n=18),Chl.a独立解释了象鼻溞生物量变化的19.67%,LC独立解释了象鼻溞生物量变化的15.46%,Chl.a与LC的相互作用可以解释浮游动物生物量变化的42.12%.而在抚仙湖两个自变量共同解释了象鼻溞生物量变化的83.59%(P<0.001,n=15),Chl.a独立解释了象鼻溞生物量变化的69.74%,LC单一解释了象鼻溞生物量变化的10.39%,Chl.a与LC的相互作用仅为3.46%.
3 讨论多指标沉积物记录揭示了滇池和抚仙湖近百年来富营养化的历史与浮游动物长期响应的过程.20世纪中后期出现的富营养化导致了2个湖泊沉积物记录的湖泊初级生产力水平上升(图 2),象鼻溞在湖泊沉积物中记录的生物量也相应上升(图 3),且都呈现喜贫营养水平的物种B.longispina被B.longirostris逐渐取代的趋势,这些变化与富营养化之前持续较低的浮游植物与浮游动物生物量明显不同.与现代记录相一致的是沉积物记录表明滇池经历了持续、快速富营养化过程,并与抚仙湖总体较弱的富营养化过程形成明显差别.在对象鼻溞生物量变化的长期驱动强度上,上行效应对滇池浮游动物的影响比抚仙湖弱,而下行效应则比抚仙湖强.上行效应与下行效应的相互作用在富营养的滇池中较为显著,表明在营养水平较高、水体较浅的滇池上行效应影响了鱼类(如引入的银鱼)对浮游动物的捕食压力变化,而在中-贫营养的抚仙湖则表现为上行效应较强的控制作用.
3.1 滇池与抚仙湖近百年来浮游动物长期变化的历史与特征20世纪中期以来滇池和抚仙湖沉积物记录的Chl.a水平出现不同程度的增加,与现代监测数据记录的2个湖泊近30年的富营养化趋势基本一致[20-21].随着2个湖泊初级生产力水平的升高,B.longispina在2个湖泊中都呈现被B.longirostris逐渐取代的趋势.我们对滇池沉积物中象鼻溞生物量分析的结果与Liu等的结果一致[10],主要是从1960s开始显著增加的.我们的沉积物色素数据表明,抚仙湖湖泊初级生产力的提高,使得浮游动物的资源可获得性增强,从而象鼻溞的生物量也开始明显增加.例如Liu等在对抚仙湖的研究中发现营养盐增加后,B.longirostris的绝对丰度明显增加[11].
在1960s与1980s期间,滇池与抚仙湖象鼻溞的生物量与壳长以及第一触角长度出现显著的波动,分别对应了“四大家鱼”、太湖新银鱼等外来鱼类的引入.在抚仙湖与滇池,外来鱼类的引入促进了湖泊中渔业捕捞量的增加,但同时对生态系统的影响之一是可能增加湖泊中的鱼类捕食压力.关于象鼻溞的形态变化与鱼类捕食关系的研究在国外已取得大量成果,主要结果表明鱼类的选择性捕食会造成象鼻溞个体大小的减小[22-23],而象鼻溞刺长的变化比较复杂,可能更多的是响应无脊椎动物捕食者的捕食压力[24-27].例如在挪威北部湖泊中,一种高效率的食浮游动物鱼类欧白鲑的引入,导致B.longispina和B.longirostris产卵母体的大小下降.由于B.longispina的个体大,使得它比B.longirostris更易受到攻击,所以其个体大小呈现显著的减小.虽然B.longirostris被认为是不易受到选择性捕食的鱼类的攻击,但是它平均个体大小的减小也被观察到,表明它也受到欧白鲑的选择性捕食[28].本研究发现象鼻溞生物量、壳长以及第一触角长度的下降,时间上对应于外来鱼类的引入,尤其是象鼻溞的壳长的变化主要是由鱼类捕食压力的增加导致的,所以本文用其指示湖泊中鱼类捕食压力变化是合理的.Liu等在对滇池沉积物枝角类的研究中也发现,在1980s中期到1990s末这一阶段,几乎所有枝角类属种的绝对丰度都呈现下降的趋势,而且也发现Daphinia休眠卵的长度变短[10].Liu等的这些研究结果反映了这一时期鱼类捕食压力的变化对浮游动物的明显影响,但由于该研究没有提取象鼻溞个体大小等直接反映鱼类捕食压力的信息,我们的结果是对该研究结论的一个重要补充.同时从Liu等的数据中可以看出,Bosmina spp.与B.longirostris的绝对丰度数据在1960s也出现显著的下降,可能也间接反映了“四大家鱼”引入这一事件.我们的分析结果与Liu等在对抚仙湖沉积物枝角类的研究中得到的1987年以后象鼻溞长度变化的信息一致[11].这些研究总体都表明象鼻溞在云南部分湖泊中是捕食压力变化的良好指示者,特别是其个体大小对湖泊中鱼类捕食压力的变化十分敏感.
滇池等部分高原湖泊的现代调查数据也表明,湖泊浮游动物密度与鱼类数量的变化呈现很好的一致性.1980s初期太湖新银鱼引入滇池后增殖较为成功,其产量迅速在湖泊中形成规模后对湖泊中的浮游动物密度有较大影响.尤其是在1984年太湖新银鱼的产量达到3600t,与此同时,水体中的桡足类、枝角类仅有45.5、68ind./L,比1980年分别下降了92%与88.7%(表 2)[29].因此在太湖新银鱼捕食压力增强的背景下,枝角类与桡足类生物量受到了捕食压力的抑制作用而呈现协同下降的特征.关于太湖新银鱼食性的研究已有许多成果,主要研究在对浮游动物的选择性捕食上都表明象鼻溞是太湖新银鱼的主要食物来源之一.高礼存等报道长刺溞(Daphnia longispina)在滇池银鱼(如平均体长为43~76mm)食物中数量最多,其次依次为象鼻溞、剑水蚤(Cyclops)、镖水蚤(Diaptomus)、盘肠溞(Chydorus)和米虾幼体[29].刘恩生等对太湖新银鱼的食物组成分析中发现,太湖新银鱼的主要食物是桡足类,其次是枝角类,而轮虫几乎不被摄食[30].本文基于沉积物记录的结果表明,象鼻溞在长时间尺度上表现为对太湖新银鱼引入十分敏感,与对该外来鱼类的食性分析相一致.
| 表 2 滇池枝角类与桡足类密度的现代调查数据[29, 31-32] Tab.2 Modern survey data of cladoceran and copepod densities at Lake Dianchi |
太湖新银鱼在抚仙湖中的增殖和种群数量与滇池表现出截然不同的模式,可能反映2个湖泊营养水平的差异导致鱼类捕食压力对浮游动物群落的差异性影响.滇池中的太湖新银鱼经过1980s的增殖繁盛期后种群数量明显下降,而在抚仙湖中却逐渐成为优势种群(图 2).太湖新银鱼自1980s中期引入抚仙湖以来,成功增殖并形成稳定产量,已成为抚仙湖渔业捕捞中的主要经济鱼类.与此同时,抚仙湖中的太湖新银鱼在湖泊中增殖的成功对水体中的象鼻溞存在长期强烈的捕食压力,使得象鼻溞的生物量、壳长与B.longispina的LA稳定在低值水平(图 2b).而滇池中,可能由于营养水平的快速增加,使得湖泊中的鱼类捕食压力随营养水平出现明显的变化,同时滇池较强的渔业捕捞、鱼类养殖等人类活动也可能影响浮游动物对鱼类捕食的响应模式.
3.2 上行与下行效应对浮游动物长期变化的驱动强度分析长期以来大量研究表明典型湖泊的食物网主要是由上行效应控制,即资源可获得性的驱动作用.例如浮游植物被营养盐和光所控制,浮游动物被浮游植物控制,食浮游动物鱼类被浮游动物所控制等[33].随后的研究表明,食物网结构可能同时受到下行效应的控制,例如食浮游动物鱼类控制浮游动物、浮游动物控制浮游植物等[34].然而,对食物网中上行效应与下行效应的相对影响程度研究还主要基于现代湖泊调查和中小型实验的数据.例如McQueen等的研究认为,上行效应在食物网底部是最强的,而且越往上影响越小;下行效应在食物网的顶部是最强的,越往下影响越小[33, 35].Jeppesen等在对从温带到北极地区的466个湖泊的下行效应研究中发现,在营养水平高的湖泊中,食浮游动物的鱼类通过作用于浮游动物,进而对浮游植物产生显著影响,而这一影响在营养水平低的湖泊中却不明显[12].本文方差分析的结果也发现,在富营养的滇池中,代表鱼类捕食压力的壳长与代表湖泊初级生产力的Chl.a相互作用强度十分显著,而这一相互作用在抚仙湖中较弱.所以,本研究结果拓展了Jeppesen等的研究区域,表明上行效应与下行效应的相互作用模式不仅在温带到北极地区的湖泊中存在,在低纬高原区的湖泊中也十分明显.
Jeppesen等还发现在空间尺度上对大个体浮游动物的捕食控制在浅水湖泊中比在深水湖泊中更高[12].我们的结果表明在大型重富营养的浅水湖泊滇池,下行效应对象鼻溞生物量变化的影响比在大型贫营养的深水抚仙湖中大;上行效应对象鼻溞生物量变化的影响在贫营养的深水抚仙湖中更大.Jeppesen等探讨了浅水湖泊中下行效应更强的原因,认为可能是浅水湖泊中单位体积水柱中的食浮游动物鱼类密度更大,或者底栖的无脊椎动物维持了食浮游动物鱼类的生物量,进而对浮游动物造成高的捕食压力,或者浅水湖泊对于浮游动物来讲缺少避难所[36].
Liu等在对抚仙湖的研究中提出,在贫营养湖泊中资源的可利用性可能对枝角类种群的发展更为重要[11].尽管太湖新银鱼的引入能通过粪便排放、尸体分解等过程,通过食物链的传递作用增加水体中营养盐的释放,增加藻类的初级生产力,然而对湖滨区面积狭小的深水抚仙湖中鱼类的这种影响可能是非常微弱的.而在滇池这种湖滨区面积较大的大型浅水湖泊中,鱼类通过此类作用促进湖滨区与底泥中营养盐的释放,进而促进藻类的生长,可能是比较显著的.因此,在湖滨区面积不同与深度不同的湖泊中,鱼类对湖泊中营养盐循环所起的作用是不同的.
4 结论通过对滇池与抚仙湖沉积物多指标记录的对比研究,本文在重建近百年来两个湖泊初级生产力和象鼻溞长期变化历史的基础上,定量评价了上行与下行效应对两个大型湖泊浮游动物长期变化的驱动强度,并识别了营养水平等湖泊类型的差异可能对湖泊生态系统过程产生的差异性影响.具体来说,滇池与抚仙湖象鼻溞的生物量随着湖泊营养水平和初级生产力的升高出现增加的趋势,同时象鼻溞生物量以及个体大小变化特征与两个湖泊外来鱼类的引入时间基本一致.进一步的分析表明,下行效应对象鼻溞生物量的影响在滇池中更大,而上行效应则在抚仙湖中更强,上行效应与下行效应的相互作用在富营养的滇池中更显著.总之,本结果表明沉积物象鼻溞记录的生物量与个体大小变化能够记录湖泊富营养化与鱼类捕食压力的变化信息,是湖泊生态环境变化的良好指示者.因此,对不同类型的湖泊开展以浮游动物为代表的生态系统重要组分长期变化特征研究并进行对比分析,可以为我们认识湖泊生态系统结构与功能的长期变化模式与驱动机制提供重要的科学依据,可为对污染湖泊开展生态修复并进行有效的湖泊管理提供科学依据.
致谢: 感谢评审人对本文提出宝贵的意见,同时对在本研究中给予野外采样、室内分析等帮助的云南师范大学高原湖泊生态与全球变化重点实验室的各位老师和同学表示感谢.| [1] |
郭怀成, 王心宇, 伊璇. 基于滇池水生态系统演替的富营养化控制策略. 地理研究, 2013, 32(6): 998-1006. |
| [2] |
熊飞, 李文朝, 潘继征等. 云南抚仙湖鱼类资源现状与变化. 湖泊科学, 2006, 18(3): 305-311. DOI:10.18307/2006.0318 |
| [3] |
王振华, 何滨, 潘学军等. 云南阳宗海砷污染水平、变化趋势及风险评估. 中国科学:化学, 2011, 41(3): 556-564. |
| [4] |
Smol JP. Pollution of lakes and rivers: a paleoenvironmental perspective. New York: John Wiley & Sons, 2008.
|
| [5] |
Boucherle MM, Züllig H. Cladoceran remains as evidence of change in trophic state in three Swiss lakes. Hydrobiology, 1983, 103: 141-146. DOI:10.1007/BF00028442 |
| [6] |
Dodson SI. Adaptive change in plankton morphology in response to size-selective predation: a new hypothesis of cyclomorphosis. Limnology and Oceanography, 1974, 19(5): 721-729. DOI:10.4319/lo.1974.19.5.0721 |
| [7] |
Brooks JL, Dodson SI. Predation, body size, and composition of plankton. Science, 1965, 150(3692): 28-35. DOI:10.1126/science.150.3692.28 |
| [8] |
Smol JP. The power of the past: using sediments to track the effects of multiple stressors on lake ecosystems. Freshwater Biology, 2010, 55(s1): 43-59. |
| [9] |
Korosi JB, Kurek J, Smol JP. A review on utilizing Bosmina size structure archived in lake sediments to infer historic shifts in predation regimes. Journal of Plankton Research, 2013, 35(2): 444-460. DOI:10.1093/plankt/fbt007 |
| [10] |
Liu G, Liu Z, Chen F et al. Response of the cladoceran community to eutrophication, fish introductions and degradation of the macrophyte vegetation in Lake Dianchi, a large, shallow plateau lake in southwestern China. Limnology, 2013, 14(2): 159-166. DOI:10.1007/s10201-012-0391-7 |
| [11] |
Liu G, Liu Z, Li Y et al. Effects of fish introduction and eutrophication on the cladoceran community in Lake Fuxian, a deep oligotrophic lake in southwest China. Journal of Paleolimnology, 2009, 42(3): 427-435. DOI:10.1007/s10933-008-9286-3 |
| [12] |
Jeppesen E, Jensen JP, Jensen C et al. The impact of nutrient state and lake depth on top-down control in the pelagic zone of lakes: a study of 466 lakes from the temperate zone to the Arctic. Ecosystems, 2003, 6(4): 313-325. DOI:10.1007/PL00021503 |
| [13] |
王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998, 368-377.
|
| [14] |
王小雷, 杨浩, 丁兆运等. 云南抚仙湖近现代沉积速率变化研究. 地理学报, 2011, 66(11): 1551-1561. DOI:10.11821/xb201111011 |
| [15] |
Korhola A, Rautio M. Cladocera and other branchiopod crustaceans, tracking environmental change using lake sediments. Dordrecht: Springer Netherlands, 2001, 5-41.
|
| [16] |
Goulden CE, Frey DG. The occurrence and significance of lateral head pores in the genus Bosmina(Cladocera). Hydrobiology, 1963, 48(3): 513-522. |
| [17] |
Sweetman JN, Finney BP. Differential responses of zooplankton populations (Bosmina longirostris) to fish predation and nutrient-loading in an introduced and a natural sockeye salmon nursery lake on Kodiak Island, Alaska, USA. Journal of Paleolimnology, 2003, 30(2): 183-193. DOI:10.1023/A:1025543421436 |
| [18] |
Ahlen E, Bystrom P, Korsman T et al. Relationships between planktivore community capacity (PCC) and cladoceran microfossils in northern Swedish lakes. Fundamental and Applied Limnology, 2011, 178(4): 315-324. DOI:10.1127/1863-9135/2011/0178-0315 |
| [19] |
Leavitt PR, Hodgson DA. Sedimentary pigments, Tracking environmental change using lake sediments. Dordrecht:Springer Netherlands, 2001, 295-325. |
| [20] |
李中杰, 郑一新, 张大为等. 滇池流域近20年社会经济发展对水环境的影响. 湖泊科学, 2012, 24(6): 875-882. DOI:10.18307/2012.0610 |
| [21] |
高伟, 陈岩, 徐敏等. 抚仙湖水质变化(1980-2011年)趋势与驱动力分析. 湖泊科学, 2013, 25(5): 635-642. DOI:10.18307/2013.0503 |
| [22] |
Kerfoot WC. The divergence of adjacent populations. Ecology, 1975, 56(6): 1298-1313. DOI:10.2307/1934698 |
| [23] |
Stenson JAE. Significance of predator influence on composition of Bosmina spp. populations. Limnology and Oceanography, 1976, 21(6): 814-822. |
| [24] |
Black RW. The nature and causes of cyclomorphosis in a species of the Bosmina longirostris complex. Ecology, 1980, 61(5): 1122-1132. DOI:10.2307/1936832 |
| [25] |
Sprules WG, Carter JCH, Ramcharan CW. Phenotypic associations in the Bosminidae (Cladocera):zoogeographic patterns. Limnology and Oceanography, 1984, 29(1): 161-169. DOI:10.4319/lo.1984.29.1.0161 |
| [26] |
de Stasio BT, Howard E, Hanson R et al. Cyclomorphosis in Eubosmina species in New England lakes, USA. Verhandlungen der Internationalen Vereinigung für Theoretische und Angewandte Limnologie, 1990, 24(1): 481-486. |
| [27] |
Post DM, Frost TM, Kitchell JF. Morphological responses by Bosmina longirostris and Eubosmina tubicen to changes in copepod predator populations during a whole-lake acidification experiment. Journal of Plankton Research, 1995, 17(8): 1621-1632. DOI:10.1093/plankt/17.8.1621 |
| [28] |
Amundsen PERA, Siwertsson A, Primicerio R et al. Long-term responses of zooplankton to invasion by a planktivorous fish in a subarctic watercourse. Freshwater Biology, 2009, 54(1): 24-34. DOI:10.1111/fwb.2008.54.issue-1 |
| [29] |
高礼存, 庄大栋, 迟金钊等. 太湖短吻银鱼移殖滇池试验研究. 湖泊科学, 1989, 1(1): 79-87. DOI:10.18307/1989.0110 |
| [30] |
刘恩生, 鲍传和, 吴林坤等. 太湖新银鱼的食物组成及与主要鱼类间关系的初步分析. 水利渔业, 2006, 26(5): 41-44. |
| [31] |
王忠泽. 滇池浮游动物的初步调查. 云南大学学报:自然科学版, 1985, 7: 53-72. |
| [32] |
彭琼英. 滇池浮游动物的调查分析. 水利渔业, 1995(6): 22-24. |
| [33] |
McQueen DJ, Johannes MRS, Post JR et al. Bottom-up and top-down impacts on freshwater pelagic community structure. Ecological Monographs, 1989, 59(3): 289-309. DOI:10.2307/1942603 |
| [34] |
Carpenter S, Kitchell J, Hodgson J. Cascading trophic interactions and lake productivity. BioScience, 1985, 35(10): 634-639. DOI:10.2307/1309989 |
| [35] |
McQueen DJ, Post JR, Mills EL. Trophic relationships in freshwater pelagic ecosystems. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(8): 1571-1581. DOI:10.1139/f86-195 |
| [36] |
Jeppesen E, Jensen JP, Søndergaard M et al. Top-down control in freshwater lakes: the role of nutrient state, submerged macrophytes and water depth. Hydrobiology, 1997, 342/343: 151-164. DOI:10.1023/A:1017046130329 |
 2015, Vol. 27
2015, Vol. 27 


