(2: 南京水利科学研究院水文水资源与水利工程科学国家重点实验室,南京 210029)
(2: Hydrology Water Resources and Hydraulic Engineering Science, Nanjing Hydraulic Research Institute, Nanjing 210029, P.R.China)
生态化学计量学(ecological stoichiometry)结合生态学和化学计量学的基本原理,是研究生命体所需的,并能影响生态系统生产力、营养循环以及食物网动态的多重化学元素(主要是碳(C)、氮(N)、磷(P))平衡的一门学科[1-3].研究生产者和消费者之间的相互关系是生态化学计量学的一个重要方向,在自然界中食物的碳和营养元素比值经常大大高于消费者[4-5],这种不平衡会显著影响生物体的新陈代谢、生长、繁殖乃至整个种群的动态和生态系统过程[3].然而,要判断消费者受元素限制的程度,我们需要知道食物中的元素比例及生命体生长和繁殖及维持生命活动时所需食物的最佳元素比例,消费者C、N、P含量是反映其对元素需求的一个重要指标.然而由于许多大型底栖无脊椎动物元素特征并不清楚,使得近期发展的生态化学计量学理论很难应用于底栖生态系统,将此理论应用于淡水底栖生态学的研究仍处于起步阶段[6-7].
近期的一些研究加深了对底栖动物元素组成变化特征的认识,对湖泊和溪流的研究发现不同分类单元底栖动物元素组成变化较大.研究发现不同营养水平湖泊沿岸带底栖动物元素组成变化较小[8],而对Lake Erken的研究发现底栖动物元素组成在不同季节和点位具有显著差异[9],可见底栖动物元素组成变化是复杂的.因此,要想充分认识底栖动物元素组成的变化特征,就需要获得各种环境条件下其元素组成.然而,目前关于这方面的研究仅集中在湖泊内部比较或少数几个湖泊间的比较,且研究地点主要在湖泊沿岸带,调查的种类主要是几个大的分类单元(软体动物、水生昆虫、甲壳类)[6].此外,相关研究区域主要集中在国外的湖泊[8-10],但由于物种区系的差异,几乎没有关于中国湖泊底栖动物元素组成特征的研究[11].另一方面,随营养水平的变化,底栖初级生产力和浮游植物初级生产力对底栖动物的食物贡献率也随之变化[12].已有研究表明水体富营养化可导致生产者和消费者之间的生态化学计量关系发生显著变化,但这些研究主要集中在溪流及浮游食物网[13-14].因此,研究浅水湖泊大型底栖动物元素组成对深入了解食物网动态及其在营养元素循环中的作用具有重要意义.
本文通过分析长江中下游地区5种常见底栖动物的碳、氮、磷元素含量和比值.基于其他学者对浮游动物及底栖动物的研究结果[6, 15],并根据生态化学计量学的理论基础,提出并检验以下两个假设:1)不同种类底栖动物元素组成具有显著差异;2)同一种类底栖动物元素组成保持动态平衡(homeostatic),即底栖动物元素在不同湖泊间不具有显著差异,且与湖泊的营养状态无关.
1 材料与方法 1.1 样品采集与分析本文选择长江中下游地区常见的5个种类,分别为铜锈环棱螺(Bellamya aeruginosa)、河蚬(Corbicula fluminea)、苏氏尾鳃蚓(Branchiura sowerbyi)、摇蚊属幼虫(Chironomus spp.)、中国长足摇蚊(Tanypus chinensis),它们属于不同的分类单元和功能摄食类群,铜锈环棱螺和河蚬分别为刮食者和过滤收集者,其它3种属于直接收集者.样品来源于东部平原71个湖泊,采集时间主要是2008年和2009年夏季,样品采集用改良1/16m2 Peterson采泥器,样品挑出后在清水中排泄24h,以排除底栖动物肠含物,减少对分析结果的影响.铜锈环棱螺和河蚬先量取体长,然后将软组织取出,每个个体单独存放;其它4个种类由于个体较小,为保证分析的样品量,每个样点的多个个体合并,所有样品用冷冻干燥机干燥72h,然后用玛瑙研钵研磨成细颗粒,再经烘箱50℃烘48h,最终样品放入离心管中,保存在干燥器中待测.在采集底栖动物样品的同时,现场测定透明度,并采集水样带回实验室分析总氮(TN)、总磷(TP)、叶绿素a (Chl.a)和高锰酸盐指数(CODMn),测定方法参照文献[16].
C和N含量的测定方法为:用百万分之一天平(CAHN C-33)称量0.5~0.7mg样品,装入6mm×4mm锡囊中,然后用元素分析仪测定.P含量的测定过程为:先称量1.0~2.0mg样品,然后放入50ml比色管中,加入25ml去离子水,并用碱性过硫酸钾溶液定容至50ml,然后在高压蒸气灭菌锅中120℃消解40min,样品冷却后用钼蓝比色法测定PO43--P浓度,该方法类似于测定水中TP含量的方法[16],Liess等在测定过程中也使用该方法[9],结果可靠.C、N、P含量的最后结果为百分比,C:N、C:P及N:P比为元素的摩尔比.
1.2 数据分析不同种类C、N、P含量用One-way ANOVA分析,多重比较采用Tukey's HSD比较.用MANOVA分析不同种类元素比值的差异显著性,这是因为C:N、C :P及N:P比相互之间并不是独立的,当MANOVA分析显示有显著差异时,再用One-way ANOVA分别对元素比值进行比较.比较同一湖泊内铜锈环棱螺和河蚬元素组成差异用t检验和Hotelling's T2检验.同一种类在不同湖泊间的元素组成差异检验用One-way ANOVA和MANOVA.统计分析前,元素含量和比值分别进行ArcSin和对数转换.
为分析元素含量和比值之间、以及与水体营养状态参数之间的关系,用Pearson相关分析和一元线性回归分析其相关性及对数据变异的解释量.在分析铜锈环棱螺和河蚬与营养状态参数之间的关系时,因有研究表明元素组成会随个体大小发生变化,故采用偏相关分析,以个体大小为协变量.由于未测量其他种类的大小,为保证结果的可靠性,本文不分析其它种类与营养状态参数之间的关系.同时考虑到营养状态参数仅反映某一时段的情况,结合使用Spearman秩相关对数据进行分析.
2 结果 2.1 不同种类元素组成5种大型底栖动物的元素含量变化较大(图 1),C和N含量分别介于31.6%~60.7%和5.2%~12.1%之间,最大值可达最小值的2倍,P含量变化范围为0.41%~2.28%,最大值为最小值的5倍.这也反映为3种元素含量的变异系数,可以看出,所有物种3种元素含量的变异系数按大小排列均为P>N>C(表 1).由于P含量变化较大,从而导致C :P和N :P变幅较大(变异系数分别为28.9%和23.0%),最大值分别可达最小值的5.7和4.0倍,相比之下C :N比变幅较小(变异系数为15.3%),最大值仅为最小值的1.99倍.
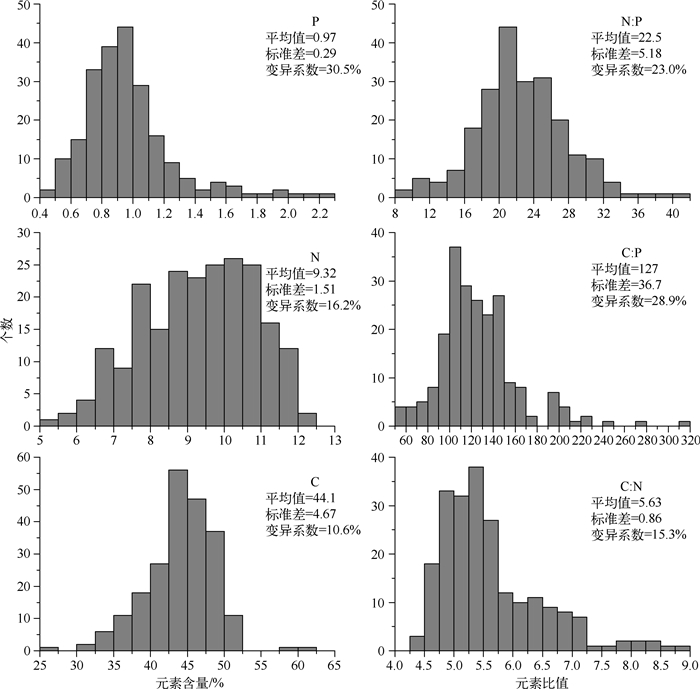
|
图 1 底栖动物碳、氮、磷元素含量和比值频率直方图(n=218) Fig.1 Frequency historgrams of macrozoobenthos tissue C%, N%, P%, N :P, C:P and C:N |
| 表 1 5种大型底栖动物碳、氮、磷元素含量和比值 Tab.1 C:N:P contents and ratios for five macrozoobenthic taxa |
One-way ANOVA分析结果表明不同种类元素含量差异显著(图 2,P<0.05).河蚬C含量显著高于其他种类,摇蚊属幼虫C含量最低,其它种类处于中间水平.N和P含量方面,摇蚊属幼虫显著低于其它种类,且在其它种类间无显著差异.MANOVA分析结果表明各物种间元素比值差异显著(Wilks’λ=9.44,P<0.001).河蚬和摇蚊属幼虫C :N比显著高于其他种类,C :P比变化趋势是摇蚊属幼虫显著高于铜锈环棱螺和长足摇蚊,N :P比则是苏氏尾鳃蚓和摇蚊幼虫显著高于河蚬.可以看出,C :P和N :P比在各物种间的变化趋势并不明显,这主要是由P含量变化较大导致的,进而导致各物种内C :P和N :P比变异较大.相关性分析发现,底栖动物N和P含量呈显著正相关关系(r=0.513,P<0.001,图 3).另外,底栖动物N :P比与P含量呈显著负相关,且相关性较强(r=-0.795,P<0.001),而与N含量无显著相关性.分别对每个种类作相关分析,发现仅河蚬和铜锈环棱螺身体N和P含量显著正相关,一方面可能与样本大小有关,另一方面也反映N和P含量的共变趋势在不同物种间是有差异的.各种类的N :P比均与P含量呈显著负相关(R2 : 0.478~0.895,P<0.001),仅有苏氏尾鳃蚓N :P比与N含量亦呈显著负相关,但决定系数较低(R2=0.184,P<0.001).N :P比与P含量的强相关性说明底栖动物N :P比变化主要是由P含量变化决定的.
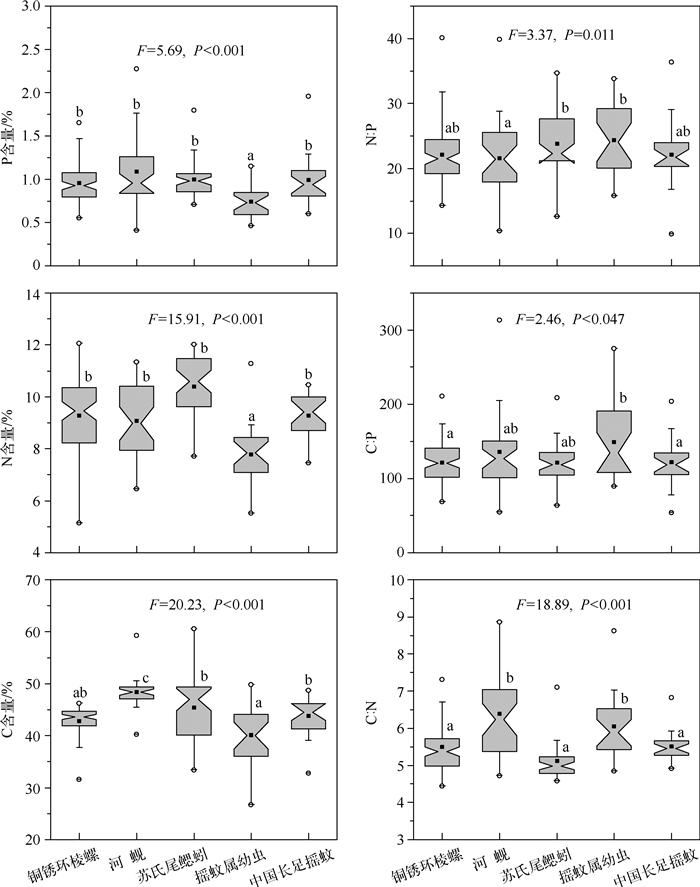
|
图 2 5种大型底栖动物元素含量和比值的箱线图 Fig.2 Notched box-and-whisker plots showing the elemental contents and ratios for five macrozoobenthic taxa |

|
图 3 底栖动物磷含量与氮含量及N :P比的相关性分析 Fig.3 Correlation analyses showing the relationships between P%, N% and N:P |
进一步比较同一湖泊内铜锈环棱螺和河蚬元素组成(图 4),发现太湖两物种的元素组成(N除外)均具有显著差异,鄱阳湖也表现出类似的结果(N :P比除外).铜锈环棱螺和河蚬元素含量和比值在2个湖泊的变异系数也较低,分别为3.36%~12.84%和2.81%~25.85%,较之前总体分析的结果低,表明底栖动物元素组成在不同湖泊间变化较大.
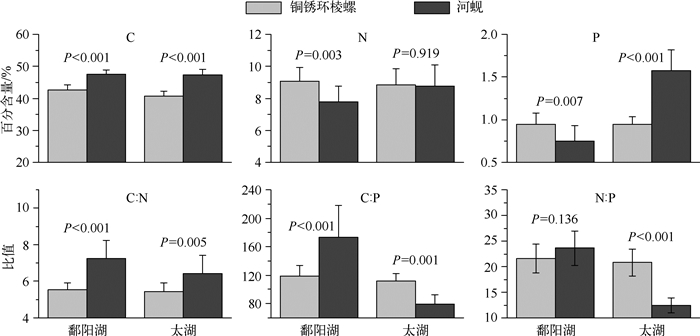
|
图 4 太湖和鄱阳湖铜锈环棱螺与河蚬元素组成比较分析 Fig.4 Comparison of elemental composition between B. aeruginosa and C. fluminea in Lake Taihu and Lake Poyang |
方差分析表明河蚬和铜锈环棱螺在不同湖泊间的元素组成具有显著差异.铜锈环棱螺元素含量和比值在两个草型湖泊(大冶湖、赤湖)间无显著差异(t检验,P:0.069~0.846),故将这两个湖泊数据合并与其他湖泊比较.结果表明除N :P比外的所有元素指标在不同湖泊间均具有显著差异(MANOVA,Wilks’λ=82,P<0.001,图 5A),C含量是鄱阳湖显著高于太湖,而与草型湖泊无显著差异,N和P的含量均是草型湖泊显著低于鄱阳湖和太湖,并导致C :N和C :P比呈现相反的变化趋势,值得注意的是,N :P在各湖泊间并无显著变化.
统计结果表明河蚬的元素含量和比值(MANOVA,Wilks’λ=42,P<0.001)在各湖泊间具有显著差异(图 5B).C含量为洞庭湖显著高于鄱阳湖和太湖,N和P含量并没有表现出一致的变化趋势,河蚬N含量为鄱阳湖最低,洞庭湖最高;P含量则是太湖(1.58%±0.24%)显著高于洞庭湖(0.91%±0.08%)和鄱阳湖(0.75%±0.18%),含量可达后者2倍左右.C :N和C :P比分别与N和P含量呈现相反的变化趋势,太湖河蚬高含量的P导致其N :P显著低于洞庭湖和鄱阳湖.
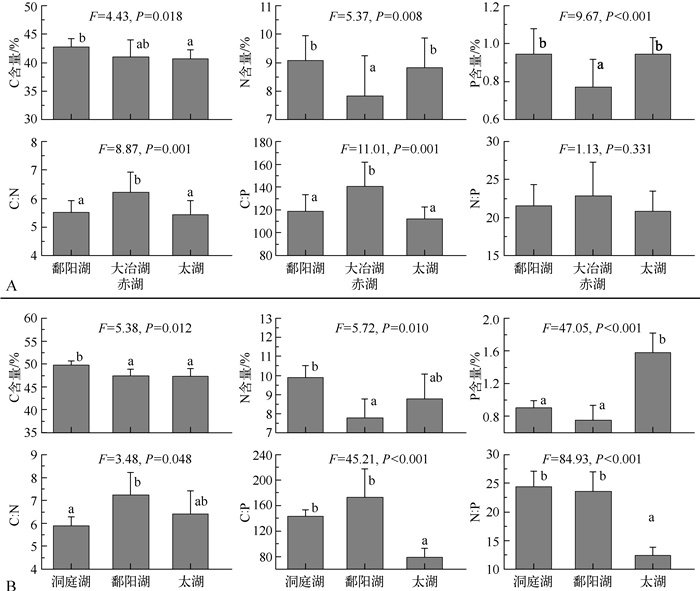
|
图 5 铜锈环棱螺(A)和河蚬(B)元素组成在不同湖泊间的变化 Fig.5 Changes in elemental composition for B. aeruginosa(A)and C. fluminea(B) from different lakes |
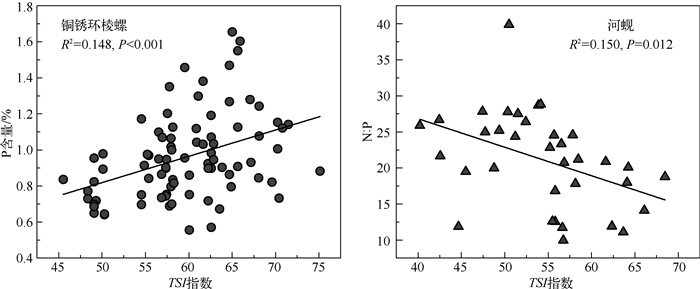
偏相关分析发现,铜锈环棱螺P含量与水体中Chl.a及TSI指数均呈显著正相关,其与TSI指数相关系数最高,线性回归分析表明TSI指数对P含量变化解释率最高(R2=0.148,P<0.001,图 6),N含量也与Chl.a及TSI指数呈显著正相关.Spearman相关分析也得出类似的结果,但元素含量和比值与更多水体理化指标显著相关.河蚬P含量仅与TP显著相关,但N :P比与TN、TP、Chl.a及TSI指数均显著相关(表 2),其与TSI指数的相关水平最高(R2=0.150,P=0.012,图 6).
| 表 2 铜锈环棱螺及河蚬元素组成与营养状态参数的相关性分析 Tab.2 Relationships between elemental composition and nutrient parameters for B. aeruginosa and C. fluminea |
|
图 6 铜锈环棱螺P含量及河蚬N :P比与营养状态指数之间的关系 Fig.6 Scatter plots of P% for B.aeruginosa and N :P for C.fluminea in relation to TSI index |
生态化学计量学的一个核心问题就是研究生命体保持元素组成动态平衡的能力.本研究结果发现不同湖泊底栖动物元素组成具有显著差异,这与国外大部分研究结果并不相同.如Evans-White等对北美两个地区溪流的研究发现底栖动物(水生昆虫、软体动物及甲壳动物)元素组成在不同地区变化较小,且元素组成在不同尺度下(溪流内的变化、同一地区不同溪流间的变化、不同地区的变化)的变动幅度是相似的[17].Liess等对加拿大8个不同营养水平湖泊的研究也发现元素组成在不同湖泊间变化很小[9].其它研究也表明某些无脊椎动物在不同环境条件下的的元素比值是较为稳定的.然而,元素组成的动态平衡对于某些物种可能并不是很严格.如腹足纲Theodoxus fluviatilis和双壳纲Dreissena polymorpha在Lake Erken不同样点间元素组成差异显著[9].Naddafi等也发现贝类D.polymorpha与食物的C :P和N :P比无显著差异,且C :P和N :P比可随食物发生变化[18].
本文将所有湖泊汇总分析时,发现元素组成的差异性并不是特别明显,N和P含量仅摇蚊属幼虫显著低于其他种类,而其它种类间均无显著差异,C :P和N :P也表现出类似的现象.然而,当比较同一湖泊铜锈环棱螺和河蚬的元素组成时,这4个参数表现出了显著差异,与之前的无显著差异形成了鲜明的对比.这表明不同湖泊环境条件的差异可导致元素组成发生变化,这可从不同湖泊同一种类的分析结果得到印证.铜锈环棱螺与河蚬元素组成的差异可能与其食物来源有关.河蚬为滤食者,主要滤食水体中的有机颗粒物,铜锈环棱螺为刮食者,主要摄食附着生物(periphyton).研究表明附着生物的N :P比(>30)[9]显著高于水体中的颗粒物(21.8±4.5)[18],因此可能导致消费者元素组成差异显著.
3.2 元素组成与营养状态之间的关系有研究表明底栖动物的元素组成可以反映其食物的元素组成情况.对环境条件类似的两条溪流进行营养盐(N和P)添加实验,发现某些昆虫(如毛翅目Trichoptera)身体P含量和C :P及N :P比可反映出其食物中P含量及N :P比的变化[4].本研究中,铜锈环棱螺和河蚬在富营养化严重的太湖中P含量均最高,特别是河蚬P含量显著高于鄱阳湖和洞庭湖,铜锈环棱螺则为太湖显著高于两个草型湖泊(大冶湖和赤湖),而与鄱阳湖无显著差异.然而,在比较加拿大8个不同营养水平湖泊时发现,总体而言底栖动物元素组成在不同湖泊间差异并不明显,但部分种类(如半翅目Hemiptera和毛翅目Trichoptera)变化较大[8].需要注意的是,这9个湖泊纬度介于49°40′~53°53′N之间,水体TP浓度范围介于4.1~176μg/L之间,较低温度可能限制了附着生物和浮游植物的生长,且用TP浓度并不能完全反映食物的元素组成情况,此外底栖动物的代谢活动与亚热带湖泊差异较大,从而可能导致元素组成变化并不显著.
相关分析表明铜锈环棱螺和河蚬元素组成与水体中反映营养状态的参数显著相关.水体中营养状态参数在一定程度上反映了食物的元素组成,先前研究表明水体中N :P比与浮游植物及附着藻类的N :P比呈显著正相关[19-20].因此,本文用营养盐参数在一定程度上也反映了不同湖泊潜在的食物质量,线性回归结果表明营养盐参数对元素组成变异的解释量较低(决定系数较低),一方面是因为测定的营养盐参数仅代表某一时间段,并不能反映底栖动物整个生长阶段的食物质量;另一方面,营养参数不能完全代表底栖动物的食物情况,浮游植物和附着藻类的生长可能受到其它因素的共同限制(如温度、微量元素),且底栖动物的摄食对象也不是单一的.因此,在后续的研究中应对食物资源—消费者间元素组成不平衡程度进行量化,并结合同位素等手段确定其食物来源.尽管如此,元素组成与营养盐参数的显著相关表明富营养化可能显著改变了底栖动物的元素组成.研究发现水体中溶解性N :P、颗粒物C :N比及Chl.a是预测D. polymorpha身体N :P的最佳变量[18],D. polymorpha元素组成随环境而变化也为解释其强入侵能力提供了有力证据[21].食物资源—消费者间元素不平衡在自然界是普遍存在的,消费者必须适应环境才能生存下去.根据其适应策略一般可分为两类:第一类是调节者(regulators),即生物通过各种新陈代谢活动维持自身的元素动态平衡;另一类是适应者(conformers),即生物的元素组成随所处环境而变化(非动态平衡),但适应也是有一定范围的,没有一种生物能达到任意的非动态平衡并且存活下去,相对而言,后一类策略的生物更易在多样的环境中生存.本文结果表明铜锈环棱螺和河蚬的元素组成不符合严格的动态平衡.此外,对于苏氏尾鳃蚓和摇蚊幼虫而言,由于未能排除个体大小的影响,在此未能分析,在后续的研究中应增加对不同分类单元多个物种的研究,使生态化学计量学理论更好地用于底栖生态学的研究,为揭示富营养化进程中底栖动物群落的演替机理提供证据.
| 附录Ⅰ 大型底栖动物元素组成分析样品统计 Appendix1 Statistics of specimen collected for elemental composition analysis |
| [1] |
曾德慧, 陈广生. 生态化学计量学:复杂生命系统奥秘的探索. 生态学报, 2005, 29(6): 1007-1019. |
| [2] |
贺金生, 韩兴国. 生态化学计量学:探索从个体到生态系统的统一化理论. 植物生态学报, 2010, 34(1): 2-6. |
| [3] |
Sterner RW, Elser JJ. Ecological stoichiometry: the biology of elements from molecules to the biosphere. Princeton: Princeton University Press, 2002.
|
| [4] |
Cross WF, Benstead JP, Rosemond AD et al. Consumer-resource stoichiometry in detritus-based streams. Ecology Letters, 2003, 6(8): 721-732. DOI:10.1046/j.1461-0248.2003.00481.x |
| [5] |
郝贝贝, 吴昊平, 史俏等. 云南高原10个湖泊沉水植物的碳、氮、磷化学计量学特征. 湖泊科学, 2013, 25(4): 539-544. DOI:10.18307/2013.0411 |
| [6] |
Cross WF, Benstead JP, Frost PC et al. Ecological stoichiometry in freshwater benthic systems: recent progress and perspectives. Freshwater Biology, 2005, 50(11): 1895-1912. DOI:10.1111/fwb.2005.50.issue-11 |
| [7] |
Frost PC, Cross WF, Benstead JP. Ecological stoichiometry in freshwater benthic ecosystems: an introduction. Freshwater Biology, 2005, 50(11): 1781-1785. DOI:10.1111/fwb.2005.50.issue-11 |
| [8] |
Frost PC, Tank SE, Turner MA et al. Elemental composition of littoral invertebrates from oligotrophic and eutrophic Canadian lakes. Journal of the North American Benthological Society, 2003, 22(1): 51-62. DOI:10.2307/1467977 |
| [9] |
Liess A, Hillebrand H. Stoichiometric variation in C :N, C :P, and N :P ratios of littoral benthic invertebrates. Journal of the North American Benthological Society, 2005, 24(2): 256-269. DOI:10.1899/04-015.1 |
| [10] |
Fink P, Elert EV. Physiological responses to stoichiometric constraints: nutrient limitation and compensatory feeding in a freshwater snail. Oikos, 2006, 115(3): 484-494. DOI:10.1111/oik.2006.115.issue-3 |
| [11] |
杨明生, 熊邦喜, 杨学芬. 武汉市南湖大型底栖动物的时空分布和氮磷评价. 湖泊科学, 2007, 19(6): 658-663. DOI:10.18307/2007.0606 |
| [12] |
Vadeboncoeur Y, Jeppesen E, Vander Zanden MJ et al. From Greenland to green lakes: cultural eutrophication and the loss of benthic pathways in lakes. Limnology and Oceanography, 2003, 48(4): 1408-1418. DOI:10.4319/lo.2003.48.4.1408 |
| [13] |
Singer GA, Battin TJ. Anthropogenic subsidies alter stream consumer-resource stoichiometry, biodiversity, and food chains. Ecological Applications, 2007, 17(2): 376-389. DOI:10.1890/06-0229 |
| [14] |
Shimizu Y, Urabe J. Regulation of phosphorus stoichiometry and growth rate of consumers: theoretical and experimental analyses with Daphnia. Oecologia, 2008, 155(1): 21-31. DOI:10.1007/s00442-007-0896-7 |
| [15] |
苏强. 生长速率假说及其在浮游动物营养动力学中的研究进展. 地球科学进展, 2012, 217(11): 1204-1210. |
| [16] |
金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990, 317.
|
| [17] |
Evans-White M, Stelzer R, Lamberti G. Taxonomic and regional patterns in benthic macroinvertebrate elemental composition in streams. Freshwater Biology, 2005, 50(11): 1786-1799. DOI:10.1111/fwb.2005.50.issue-11 |
| [18] |
Naddafi R, Eklv P, Pettersson K. Stoichiometric constraints do not limit successful invaders: zebra mussels in swedish lakes. PLoS ONE, 2009, 4(4): e5345. DOI:10.1371/journal.pone.0005345 |
| [19] |
Stelzer R, Lamberti G. Ecological stoichiometry in running waters: periphyton chemical composition and snail growth. Ecology, 2002, 3(4): 1039-1051. |
| [20] |
Hall S, Smith V, Lytle D et al. Constraints on primary producer N: P stoichiometry along N: P supply ratio gradients. Ecology, 2005, 86(7): 1894-1904. DOI:10.1890/04-1045 |
| [21] |
González AL, Kominoski JS, Danger M et al. Can ecological stoichiometry help explain patterns of biological invasions. Oikos, 2010, 199(5): 779-790. |
 2015, Vol. 27
2015, Vol. 27 


