水生植物广泛分布在江、河、湖泊等水体中,是自然景观的重要组成部分.水生植物生长的水塘或湿地很早就被利用来消纳污水[1].生物膜(又称为附植生物群落)是在水生植物水界面上附着的,由藻类、细菌、真菌等微生物构成的微生物群落,普遍存在于大、中型浅水湖泊中[2-3].附植生物群落的形成与宿主植物及周围水体环境联系密切[4],其不仅受水体营养盐、光照、温度等非生物环境因子影响,还与沉水植物、食草动物、浮游植物等水生生物类群间存在着复杂的相互作用[5].水生态系统中的水生植物,尤其是沉水植物为附植生物群落提供了较大的附着面积,进而形成了结构复杂的微生态类型[6].
这些水生植物及其表面附植生物群落是水体自净体系的重要组成部分,在污染物质转化及维持生态平衡方面起着重要作用[7-8].水生植物生长过程中不仅从水体中直接吸收/降解污染物质、吸附水体的悬浮物、固着沉积物以及为水生动物提供食物、栖息和产卵场所[9],还可通过光合作用释放氧气在水生植物叶片—生物膜—水界面形成“好氧”微环境,对水体中碳、氮等要素的转化有着较大影响.比如植物表面附着生物膜内的微生物群落对有机物及无机氮等具有较强的代谢能力,能够为水生植物提供有机复合物和二氧化碳、促进营养物质循环,且部分微生物还能抑制对水生植物有害微生物的生长,附植生物群落对水生植物的生长有着显著的影响[10-12].然而,当前世界范围内都面临着湿地面积降低、水生态系统退化严重,对受污染水体进行生态修复和污染治理,是目前国内外环境保护研究中的核心问题[13-14].
水生植物的恢复是提高水体自净能力的前提和基础[15-16].水生植物恢复将会大大提高其表面附着微生物群落的面积,两者对水生态系统功能的恢复起着不可替代的作用[17].但当前在受污染水体的水生植物恢复过程中,研究关注水生植物本身较多,而对水生植物表面附着生物膜特性及其对外界相关影响因素的响应关系研究得不足,这在对受损水体进行污染治理和水生态修复过程中会遇到较多问题.因此,对水生植物表面附着微生物群落特征以及水生植物与其附着微生物群落之间相互关系进行研究,对于水生态修复而言是十分必要的.
本研究以富营养化水体中附着在沉水植物表面的微生物为研究对象,利用荧光显微镜及电子显微镜观测水生植物表面附着微生物群落的分布特征、藻类组成及多样性,比较并分析了3种不同沉水植物表面附着微生物分布的差异性,以期增加人们对沉水植物表面附着微生物群落的了解.
1 材料与方法 1.1 材料水样(植物区和无植物区)及植物样品(菹草(Potamogeton crispus)、伊乐藻(Elodea nuttallii)和金鱼藻(Ceratophyllum demersum))采自南京市花神湖,采样时间为2013年4月下旬.植物区设4个取样点,包括湖区中心点4个、次岸边2个(距离岸边2m左右),每个点取约0.7~1kg新鲜植物样品和1000ml水样;无植物区设2个取样点(湖区中心点和次岸边各1个),每个取样点采集1000ml水样.花神湖位于南京市雨花台区,著名旅游景点雨花台以南2km,面积56000m2,同时也是市区城南最大湖泊,湖面呈长条形,东西向较窄,水面宽度平均200m左右,水体最深处可达18m2.在湖区的西北部生长着大量沉水植物,是花神湖自然景观的重要组成部分.取出的生物样品直接放入冰盒中,带回实验室待分析.
1.2 实验方法 1.2.1 水质的测定及富营养化评估水质均参照国标进行测定,水体的富营养化程度采用综合营养指数法进行界定.总氮浓度(TN)的测定采用碱性过硫酸钾消解紫外分光光度法(GB1-);总磷浓度(TP)的测定采用钼酸铵分光光度法(GB11831989);叶绿素a浓度(Chl.a)用叶绿素水下荧光分析仪测定;水体透明度(SD)用塞氏盘法测定;化学耗氧量(COD)采用碱性高锰酸钾法测定(GB/T5750.72006).
综合营养度计算公式为:
| $ TLI(TN) = 10(5.453 + 1.649\ln TN) $ | (1) |
| $ TLI(TP) = 10(9.436 + 1.624\ln TP) $ | (2) |
| $ TLI(Chl.a) = 10(2.5 + 1.086\ln Chl.a) $ | (3) |
| $ TLI(SD) = 10(5.118 - 1.94\ln SD) $ | (4) |
| $ TLI(COD) = 10(0.109 + 2.661\ln COD) $ | (5) |
综合营养状态指数计算公式为:
| $ TLI(\sum {} ) = \sum\limits_{j = 1}^m {{W_j} \bullet TLI(j)} $ | (6) |
式中,
为了说明湖泊富营养状态情况,采用0~100的一系列连续数字对湖泊营养状态进行分级:
采集一定量的植物叶片经简单清洗表面附着物后,根据植株生长特征分成两组进行以下处理:1)植株表面微生物数量分析,取每个取样点的15株完整同类植株的全部叶片,并称重;2)每个样品点的每类植株选取50株,分上、下部分取样(中间部分不用于分析),分别称重.上述样品取样后,分批次放置于50ml离心管中,加入pH为7.2冰冷的10ml PBS溶液(10mmol/L)及小型玻璃珠颗粒(直径约1mm),用恒温培养震荡器震荡5min,在超声波清洗器中以40W的功率清洗1min后,继续震荡5min.取出清洗后的叶片平铺在附有保鲜膜的玻璃板上,放在光下以直尺为对照进行拍照,计算叶片的表面积.对洗脱液分梯度稀释,选取适当浓度的洗脱液,并从中取100μl洗脱液用700μl浓度为10μg/ml的DAPI染色液避光染色30min后,过滤至0.22μm的滤膜上.将滤膜制片在荧光显微镜下观察、拍照[18-19].
1.2.3 沉水植物表面附生藻类的观测取全植株清洗样品用于分析植物表面附生藻类,洗脱方法同1.2.2,洗脱液加鲁哥试剂固定24h.充分混匀固定后的洗脱样品,滴3滴于浮游生物计数框中央,盖上盖玻片,在荧光显微镜40倍物镜下观察、计数及分类.
1.2.4 沉水植物表面微生物群落结构及特征的观测选择生长于植物顶部、中部以及靠近根部的叶片,用手术刀片用力均匀地快速切取3片位置相同的样品并转移至24孔板中.依次用30%、50%、70%、80%、90%的酒精脱水各15min,再用100%的酒精脱水两次,每次15min.脱水后的样品在冷冻干燥仪中干燥12h备用.将制备好的植物样品喷金后,使用日立S-4800场发射扫描电镜进行观察.选择生长于植物顶部、中部以及靠近根部的叶片,放置在盛有5μg/ml的DAPI染色液中避光染色30min后,使用100ml 0.1M PBS(pH=7.2)清洗3~5次后,放置在显微镜下观察.
1.2.5 统计分析实验数据主要利用四格表和双向无序R×C表进行统计分析.
水生植物表面附生藻类的多样性采用Shannon-Wiener多样性指数进行分析.Shannon-Wiener多样性指数用来估算群落多样性的大小, 公式为:
| $ {H^{'}} = \sum\limits_{i = 1}^s {{P_i} \bullet \ln {P_i}} $ | (7) |
式中,S表示总物种数,Pi表示i个种占总数的比例[20].当群落中只有一个居群存在时,Shannon-Wiener指数达最小值0;当群落中有两个以上的居群存在,且每个居群仅有一个成员时,Shannon-Wiener指数达到最大值ln k.
2 实验结果 2.1 花神湖水质水质测定结果为:Chl.a浓度为0.039mg/L;SD为0.5m;CODMn为45mg/L.无植物区TN含量为9.91±0.02mg/L,TP含量为0.90±0.01mg/L;植物区总氮含量为9.91±0.01mg/L,总磷含量为0.90±0.02mg/L.测定结果表明植物区和无植物区水样中的TN和TP含量基本无差别,说明花神湖水体的流动性较好,水质均匀.根据测定的各项水质指标计算出水体的综合营养状态指数
通过对菹草、伊乐藻和金鱼藻等3种植株表面的微生物进行洗脱及染色观察分析,发现在相同水域(外部营养盐水平、光照、溶解氧等均相同)条件下:单位叶片表面积下,菹草叶表面的微生物密度最大(7.20×105cells/cm2),其次为伊乐藻(4.86×104cells/cm2)和金鱼藻(2.78×104cells/cm2);在单位质量上,菹草叶表的微生物含量最大(4.04×107cells/g),而伊乐藻(3.24×106cells/g)和金鱼藻(3.48×106cells/g)间的差异不大.总体上,单位重量和面积的菹草叶片上附着的微生物的浓度远高于附着在伊乐藻和金鱼藻叶片上的.
2.3 3种沉水植物植株表面附生藻类组成 2.3.1 3种沉水植物植株表面附生藻类的组成藻类通常附着在沉水植物表面上,经过显微镜观察,共检测出26种藻类,其中18、17和15种藻类分别附着在菹草、伊乐藻和金鱼藻叶片上(表 1).有10种藻类在3种沉水植物叶片上都有检出.总体来讲这些植物表面藻类中,比例较高的前5类藻类依次为:小球藻、微囊藻、卵形藻、新月藻和丝藻.根据Shannon-Wiener指数,计算出菹草、伊乐藻和金鱼藻类表面附生藻类多样性指数分别为1.602、1.568和1.469.
| 表 1 水生植物表面附生藻类组成* Tab.1 The composition of epiphytic algae attached on aquatic macrophytes |
菹草表面附生藻类生物量大小为:绿藻门>硅藻门>蓝藻门>黄藻门>隐藻门;伊乐藻表面附生藻类生物量大小为:绿藻门>硅藻门>蓝藻门>黄藻门>隐藻门;金鱼藻表面附生藻类生物量大小为:绿藻门>硅藻门>蓝藻门>黄藻门(图 1).花神湖中菹草、伊乐藻和金鱼藻表面的附生藻类种类都很丰富,主要包括绿藻门、硅藻门、蓝藻门、黄藻门等(图 1和表 1).3种水生植物表面的藻类着生密度均以绿藻门最大,其次为硅藻门和蓝藻门.3种植物表面着生的藻类种类数量也存在差异:菹草表面附生藻类以硅藻门种类最多,其次为绿藻门、蓝藻门、黄藻门等;伊乐藻表面附生藻类也以硅藻门的种类最多,绿藻门次之,隐藻门最少;金鱼藻表面附生藻类则以绿藻门种类最多,其次是蓝藻门,再次是硅藻门.

|
图 1 各水生植物表面附生藻类比例情况 Fig.1 The proportion of epiphytic algae attached on three aquatic macrophytes |
单位叶片面积上的藻类密度大小依次为,菹草>金鱼藻>伊乐藻, 分别为1.42×104、6.46×103、1.23×104cells/cm2.从单位叶片质量上来讲,菹草的藻类密度最大(5.61×105cells/g),而金鱼藻(4.40×105cells/g)的略高于伊乐藻(4.18×105cells/g)的.
2.4 3种沉水植物表面微生物群落结构及特征的观测为了深入分析植物表面附着微生物群落的分布特征,本研究分别利用电子显微镜和荧光显微镜,从不同角度(尺度)分析微生物在植物叶片的附着特点及密度特征.
2.4.1 扫描电镜下的沉水植物表面附着微生物特点菹草顶层(图 2A)叶片上有典型的杆菌群落存在,但未形成类似生物膜的多种微生物和堆积状结果,而在底部叶片(图 2B)上有较多的藻类和群落特征.伊乐藻顶层叶片(图 2C)上有明显的球状菌和杆菌特征;而底部叶片(图 2D)上有藻类和微生物克隆等特征.金鱼藻叶片(图 2E)表面微生物群落较为丰富,但大都以细菌为主,而在底部叶片上有较多的藻类及其他微生物类型(图 2F).这些微生物通过自身分泌的物质粘连聚集在一起并附着在植物上,且可明显看出附着微生物群落没有完全覆盖水生植物表面.总体上,顶部叶片上以细菌等微生物为主,而底部则为藻类、细菌等构成的复杂微生物群落结构.
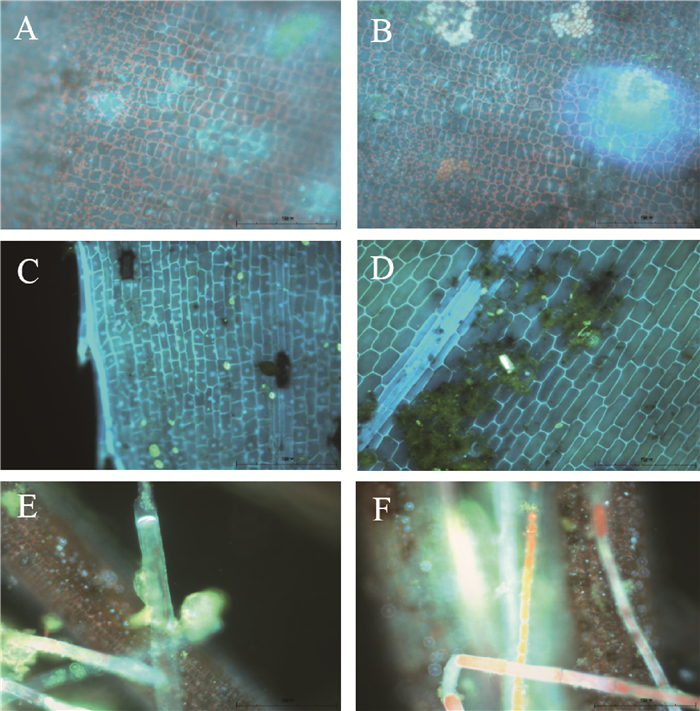
2.4.2 荧光显微镜下的3种沉水植物表面附着微生物特征菹草的叶片比伊乐藻和金鱼藻的要宽大,但后两种植物的叶片相对较多.与扫描电镜的结果相似,如图 3所示,植物顶部叶片表面附着的微生物不太明显,而在底部叶片上明显看出附着物.
2.4.3 沉水植物表面附着微生物的分布规律通过对3种沉水植物顶部和底部植物表面微生物进行分析显示:在单位面积和重量上,3种植物中,菹草的顶部和底部微生物密度均最高;同一种植物顶部植物微生物密度均小于底部植物叶片(表 2).这与2.3中测定的结果相符.
| 表 2 水生植物表面单位面积和单位质量附着微生物密度 Tab.2 Density of microorganisms on the surface area and in fresh mass of leaves at upper or lower parts of three aquatic plants |
水质分析结果表明,尽管花神湖处于中度富营养化状态,且比太湖(50~60)的营养状态指数高,与滇池营养状态指数(60~80)相当,但却并未导致花神湖湖泊水体出现水华,而处于相对较低富营养水平的太湖以及营养状态水平相当的滇池却在夏、秋季节经常出现水华现象.其主要原因可能与生长区域面积占整个湖泊面积40%的沉水植物有关,而菹草、伊乐藻和金鱼藻为该区域沉水植物的优势种群.已有研究表明,沉水植物是生态系统中的重要结构组成和调节者,V. americana的种植显著降低了浮游植物、细菌和丝状藻类的生物量[21].

|
图 2 扫描电镜下菹草(A、B)、伊乐藻(C、D)和金鱼藻(E、F)叶片表面微生物分布特征(A、C、E为植物顶部叶片表面;B、D、F为植物底部叶片表面) Fig.2 The distribution of microorganisms attached on Potamogeton crispus (A, B), Elodea nuttallii(C, D) and Ceratophyllum demersum (E, F) by scanning electron microscope (A, C and E show the leaf at upper part of each aquatic plant; B, D and F show the leaf of the lower part of plant) |
|
图 3 荧光显微镜紫外光照射下菹草(A、B)、伊乐藻(C、D)和金鱼藻(E、F)叶片表面微生物分布特征(A、C、E为植物顶部叶片表面,B、D、F为植物底部叶片表面) Fig.3 The distribution of microorganisms attached on Potamogeton crispus (A, B), Elodea nuttallii(C, D) and Ceratophyllum demersum (E, F) by fluorescence microscope(A, C and E show the leaf at upper part of each aquatic plant; B, D and F show the leaf of the lower part of plant) |
为了更深入地探讨沉水植物的作用,我们对沉水植物及其表面的附着微生物群落进行了观测分析.结果显示,水生植物表面的附着微生物总密度比附生藻类密度平均高两个数量级,即附着细菌、真菌及放线菌的密度要远大于附生藻类密度,这主要有两个方面的原因(图 1和图 3):一方面,细菌、真菌及放线菌的个体普遍小于藻类个体.细菌、真菌和放线菌大小主要介于0.5~10μm之间,虽然不同藻类大小相差悬殊,但其平均大小为几十微米.个体越小越易于粘附于植物表面,这是由最初粘附阶段的机理决定的.最初的粘附效应主要是一系列物理作用,它们对生物的粘附行为起促进或抑制作用.个体越小,其布朗热运动越激烈,随之它们与被粘附表面随机碰撞接触的几率越大,所以越容易附着于表面.另一方面,细菌表面分布有氨基、羧基和磷酸基等多种化学基团,细菌因此带有一定量的电荷,如果用甲醛掩饰氨基,或用EDC(碳二亚胺)和甲胺掩饰羧基来改变细菌表面电荷特征,就可以观察到细菌粘附行为的明显变化[22].通过静电作用,也使得细菌粘附于植物表面的可能性增大.此外,水生植物生长过程中分泌的代谢物质也是造成附着细菌、真菌及放线菌密度远高于附生藻类密度的重要影响因素[23].
附着在3种水生植物表面的附生藻类密度均以绿藻门最大,这可能是由这3种水生植物生长水域的较高营养盐浓度引起的.有研究表明,生长在正常营养盐水平自然水体中的菹草,在其整个生活史中,附生藻类的平均密度均以硅藻门最大,其次是绿藻门、蓝藻门等[12],但氨氮对附生藻类群落结构的影响非常明显[24].不同水生植物表面附着微生物密度存在差异性,菹草表面微生物群落密度最大,金鱼藻次之,而伊乐藻最小.沉水植物表面的附着微生物群落可能受到寄主植物和栖息环境影响[25].其主要原因一方面是由于不同植物的代谢产物不同,这些代谢产物影响其表面微生物群落,这符合相关研究的结果.有研究表明,M. spicatum分泌的含有酚类的化感物质能够抑制藻类、蓝细菌和异养细菌的生长,从而可能影响其表面附着生物群落组成[26].也有研究利用32P和14C同位素示踪技术证明,32P和光反应中14CO2的产物主要由虾形藻和大叶藻向其附生藻类输送,附生藻类同时也向海草叶片传递营养物质,但前者为主要存在形式[27].部分附着在沉水植物表面的藻类能充分吸收利用宿主植物分泌的可溶性有机物质进行生长[28].另一方面,沉水植物可以为其上的附植生物群落提供着生面积和固定的生存基质[17],而不同植物所能提供的着生面积各不相同,这也对其表面微生物群落的形成产生影响.与伊乐藻和金鱼藻相比较,菹草所能提供的着生面积明显更大.同时,研究还表明水生植物不仅能够分泌有机物为微生物提供有机碳源,还能够通过光照进行光合作用释放氧气等引起微生物膜“微环境”(溶解氧、氧化还原电位、pH值等)发生昼夜变化,从而影响其表面附着微生物群落结构[29-31].
在自然界中,附着植物叶片表面上附着有极其复杂的组成成分,除了微型生物群落(藻类、细菌、真菌、原生动物、轮虫、甲壳动物等),还包括衰老和死亡的细胞以及一些无机颗粒[2],这也与本实验的观测结果相一致.通过电镜观察及各水生植物不同部位表面单位面积和单位质量附着微生物比例情况分析,得知同种水生植物底部叶片表面的微生物群落生物量要大于植物顶部,底部叶片表面的生物膜结构更明显.菹草、伊乐藻和金鱼藻3种水生植物的不同部位表面附着微生物的密度、群落也存在差异性,植物底部表面的微生物密度及多样性均要大于其顶部表面.经过分析,认为和以下4方面有关:
1) 生物膜的形成过程.最近研究发现,微生物在其他固态介质表面的粘附是一个分阶段进行的过程,最初的粘附是可逆的.在这个阶段中,微生物与被粘附表面之间的作用力比较弱,用2.5%的NaCl溶液冲洗即可使粘附个体脱离表面[32].随着时间的推移,粘附逐渐发展为不可逆,这是微生物在粘附过程中不断分泌细胞外聚合物,增强表面间相互作用的结果[33].进入此阶段后,用2.5%的NaCl溶液冲洗也不能使粘附个体脱离表面.微生物粘附到表面后,在适宜的环境条件下会不断增殖扩展,最终在粘附表面形成比较稳定且复杂的微生物群落结构.
2) 植物的生长状态.首先,植物顶部多为新生叶片,其细胞生长分裂的速率要明显快于植物底部衰老的细胞,生长分裂的细胞代谢快.另外在外界的胁迫作用下会分泌某些次生代谢物质从而形成防御机制来抑制附生生物的生长.有研究表明,水生植物生长快时,其附着微生物密度和生物量较生长慢及衰亡时要低得多;年幼和年老的叶片上藻类的群集时间有长、短之别,尤其是年老叶片处于衰败阶段时,通过自溶作用能分泌出大量的溶解性有机物,促进附着微生物群落的生长[12].水生植物的不同生长状况是影响其表面附着微生物的重要因素[34].
3) 水流作用.水流是影响水体生物膜形成、结构与微生物群落组成的最主要因素之一[35],高流速水体中河床表面生物膜的厚度比低流速中的要小,而低流速下有利于提高生物膜生物量[36].水生植物生长在水中,其表面附着的微生物群落会受到水流的影响,上层水体比下层水体的运动要更加剧烈,植物顶部所处的水层比植物底部水流运动更加剧烈,从而使得原本附着在其表面的附着微生物群落脱离的几率增大.当流速过大时,会破坏其表面附着生物膜结构,甚至对植物产生机械损伤[37].
4) 叶片周围的微环境.由于沉积物中含有丰富的营养物质和微生物,远大于水体中的营养物质含量和微生物数量.在水体流动及水生动物活动的作用下沉积物中的营养物质和微生物被频繁地释放到水体中,然后在重力作用下又回到沉积物中,形成了下层水体的营养物质和微生物含量要高于上层水体的现象.有研究也表明,在浅水湖泊中,风浪作用强弱并未影响水体悬浮颗粒物浓度的垂向分布规律,即底层水体悬浮物含量要显著高于上层水体[38].相较于植物顶部,植物底部表面处于较下层的水体中,故其周围的营养物质和微生物的含量要更高,这有利于提高微生物附着及定植效率,有利于复杂微生物群落结构的形成.
4 结论以花神湖为例,分析高氮、磷等营养盐条件下,3种不同水生植物表面附着微生物群落、藻类的密度和分布特征,结果表明:沉水植物表面附着有微生物群落,并表现出较高的生物差异性,从数量看,群落内微生物以细菌、真菌和放线菌为主,且远大于附生藻类的数量.3种水生植物中,菹草表面微生物群落结构最为复杂,微生境最为丰富.附着微生物密度顺序为:菹草>金鱼藻>伊乐藻,而附生藻类种类数量大小顺序为:菹草>伊乐藻>金鱼藻.水生植物的差异性是影响其表面附着微生物群落生长的重要因素.单位质量和面积上,沉水植物顶层叶片上微生物的数量比底部叶片上的低.
| [1] |
倪乐意. 大型水生植物. 北京: 科学出版社, 1999, 224-241.
|
| [2] |
Allanson BR. The fine structure of the periphyton of Char asp and Potamogeton natans from Wytham Pond, Oxford, and its significance to the macrophyte-periphyton metabolic model of RG Wetzel and HLAllen. Freshwater Biology, 1973, 3(6): 535-542. DOI:10.1111/fwb.1973.3.issue-6 |
| [3] |
Bronmark C. Interactions between epiphytes macrophytes and freshwater snails a review. Journal of Molluscan Studies, 1989, 55(2): 299-311. DOI:10.1093/mollus/55.2.299 |
| [4] |
Gross EM, Claudia F, Andrea G. Epiphyte biomass and elemental composition on submersed macrophytes in shallow eutrophic lakes. Hydrobiologia, 2003, 559-565. DOI:10.1023/B:HYDR.0000008538.68268.82 |
| [5] |
顾詠洁, 王秀芝, 廖祖荷. 利用着生生物群落动态变化监测水质的研究. 华东师范大学学报:自然科学版, 2005(4): 87-94. |
| [6] |
纪海婷, 谢冬, 周恒杰等. 沉水植物附植生物群落生态学研究进展. 湖泊科学, 2013, 25(2): 163-170. DOI:10.18307/2013.0201 |
| [7] |
Jaschinski SD, Brepohl C. The tropic importance of epiphytic algae in a freshwater macrophyte system (Potamogeton perfoliatus L.): stable isotope and fatty acid analyses.. Aquatic Sciences, 2010, 73(1): 91-101. |
| [8] |
李博. 生态学. 北京: 高等教育出版社, 2007, 117-118.
|
| [9] |
刘玉超. 罗非鱼附着藻沉水植物相互关系研究进展. 生态环境学报, 2010, 19(10): 2511-2514. DOI:10.3969/j.issn.1674-5906.2010.10.044 |
| [10] |
Kim MA, Richardson JS. Effects of light and nutrients on grazer-periphyton interactions. Proceedings of a Conference on the Biology and Management of Species and Habitats at Risk, Kamloops, B. C., Kamloops, 1999: 497-502, 15-19.
|
| [11] |
Liborussen L, Jeppesen E. Temporal dynamics in epipelic, pelagic an d epiphytic algal production in a clear an d a turbid shallow lake. Freshwater Biology, 2003, 48(3): 418-431. DOI:10.1046/j.1365-2427.2003.01018.x |
| [12] |
苏胜齐, 沈盎绿, 姚维志. 菹草着生藻类的群落结构与数量特征初步研究. 西南农业大学学报, 2002, 24(3): 255-258. |
| [13] |
刘鸿亮. 湖泊富营养化控制. 北京: 中国环境科学出版社, 2011.
|
| [14] |
秦伯强. 太湖水环境演化过程与机理. 北京: 科学出版社, 2004.
|
| [15] |
种云霄, 胡洪营, 钱易. 大型水生植物在水污染治理中的应用研究进展. 环境污染治理技术与设备, 2003, 2(2): 36-40. |
| [16] |
吴建强, 黄沈发. 水生植物水体修复机理及其影响因素. 水资源保护, 2007, 7(4): 18-36. |
| [17] |
姚洁, 刘正文. 罗非鱼对附着藻类和浮游植物影响的初步研究. 生态科学, 2010, 29(2): 147-151. |
| [18] |
Cai X, Gao G, Yang J et al. An ultrasonic method for separation of epiphytic microbes from freshwater submerged macrophytes. Journal of Basic Microbiology, 2013. DOI:10.1002/jobm.201300041 |
| [19] |
李琳琳, 汤祥明, 高光等. 沉水植物生态修复对西湖细菌多样性及群落结构的影响. 湖泊科学, 2013, 25(2): 188-198. DOI:10.18307/2013.0203 |
| [20] |
Pielou EC. Ecological diversity. New York: John Wiley & Sons Inc, 1975.
|
| [21] |
Cathleen W, John W, Karin L et al. Effect of Vallisneria americana(L.) on community structure and ecosystem function in lake mesocosms. Hydrobiologia, 2000, 418(9): 137-146. |
| [22] |
Heckels JE, Blackett B, Ward ME et al. The influence of surface charge on the attachment of Neisseria gonohoeaeto human cells. Journal of General Microbiol, 1976, 96(3): 359-364. |
| [23] |
Gniazdowska A, Bogatek R. Allelopathic interactions between plants. Acta Physiologiae Plantarum, 2005, 27(3): 395-407. DOI:10.1007/s11738-005-0017-3 |
| [24] |
杨美玖, 宋玉芝. 氨氮浓度对苦草上附植藻类定植的影响. 环境科学与技术, 2012, 35(12): 6-9. DOI:10.3969/j.issn.1003-6504.2012.12.002 |
| [25] |
Melanie H, Maja B, Irmgard B et al. Epiphytic bacterial community composition on two common submerged macrophytes in brackish water and freshwater. BMC Microbiology, 2008, 8: 58. DOI:10.1186/1471-2180-8-58 |
| [26] |
Melanie H, Hans-Peter G, Gross EM. Community composition of bacterial biofilms on two submerged macrophytes and an artificial substrate in a pre-alpine lake. Aquatic Microbial Ecology, 2009, 58(1): 79-94. |
| [27] |
Harlin MM. Transfer of products between epiphytic marine algae and host plants. Journal of Phycology, 1973, 9(3): 243-248. |
| [28] |
Acs E, Kiss KT. Investigation of periphytic algae in the Danube at God(1669 river km, Hungary). Arch Hydrobiologia, 1991, 62(8): 47-67. |
| [29] |
Eriksson PG, Weisner SEB. An experimental study on effects of submersed macrophytes on nitrification and denitrification in ammonium-rich aquatic systems. Limnology and Oceanography, 1999, 44(8): 1993-1999. DOI:10.4319/lo.1999.44.8.1993 |
| [30] |
Hempel M, Grossart HP, Gross EM. Community composition of bacterial biofilms on two submerged macrophytes and an artificial substrate in a pre-alpine lake. Aquatic Microbial Ecology, 2009, 58(1): 79-94. |
| [31] |
Kreiling RM, Richardson WB, Cavanaugh JC et al. Summer nitrate uptake and denitrification in an upper Mississippi River backwater lake: the role of rooted aquatic vegetation. Biogeochemistry, 2011, 104(1/2/3): 309-324. |
| [32] |
罗岳平, 李益健. 细菌和藻类的粘附行为及其生态学意义. 生态学杂志, 1996, 15(5): 55-61. |
| [33] |
Marshall KC, Stout Ruby, Mitchell R et al. Mechanism of the initial events in the sorption of marine bacteria to surfaces. Microbiology, 1971, 68(3): 337-348. |
| [34] |
Cai X, Gao G, Tang X, Dong B et al. The response of epiphytic microbes to habitat and growth status of Potamogeton malaianus Miq. in Lake Taihu. Journal of Basic Microbiology, 2013, 53(10): 828-837. |
| [35] |
Woodcock S, Besemer K, Battin TJ et al. Modelling the effects of dispersal mechanisms and hydrodynamic regimes upon the structure of microbial communities within fluvial biofilms. Environ Microbiol, 2012. DOI:10.1111/1462-2920.12055 |
| [36] |
Battin TJ, Kaplan LA, Newbold J et al. Contributions of microbial biofilms to ecosystem processes in stream mesocosms. Nature, 2003, 426(6965): 439-442. DOI:10.1038/nature02152 |
| [37] |
Bornette G, Puijalon S. Response of aquatic plants to abiotic factors: a review. Aquatic Sciences, 2011, 73(1): 1-14. DOI:10.1007/s00027-010-0162-7 |
| [38] |
朱广伟, 秦伯强, 高光. 强弱风浪扰动下太湖的营养盐垂向分布特征. 水科学进展, 2004, 15(6): 676-680. |
 2015, Vol. 27
2015, Vol. 27 

