(2: 中国环境科学研究院环境基准与风险评估国家重点实验室,北京 100012)
(3: 环境保护部环境工程评估中心,北京 100012)
(4: 北京市环境保护科学研究院,北京 100037)
(2: State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, P.R.China)
(3: Appraisal Center for Environment & Engineering Ministry of Environmental Protection, Beijing 100012, P.R.China)
(4: Beijing Municipal Research Institute of Environmental Protection, Beijing 100037, P.R.China)
太湖是我国典型的大型浅水湖泊,水生植物是其生态系统重要组成部分且是湖泊内源有机质的重要来源之一[1].水生植物可分为挺水植物、沉水植物、浮叶植物和浮游植物4种[2],在太湖沿岸带广泛分布[3].这些水生植物具有水体产氧、参与氮循环、吸附沉积物、抑制浮游藻类繁殖、减轻水体富营养化、提高水体自净能力等重要功能[2, 4].然而,自1970s开始,太湖水质开始逐步恶化,1980s湖泊水体开始出现富营养化并频繁暴发蓝藻水华[5].对于营养盐过剩的湖泊生态系统而言,湖泊区域的陆生和水生植物凋谢衰亡后,植物残体在湖泊内的分解会造成湖泊水体的二次污染[4, 6].尤其是太湖典型的草型湖区——东太湖沉积物中的有机物质主要来源于水生植物[7].
氨基酸是生态系统中生命物质生长的物质基础和基本组分之一[8],同时也是湖泊水体和沉积物中有机质的重要组成部分,在湖泊生态系统营养物质的生物化学循环过程中扮演着十分重要的角色[6].湖泊中营养物质(碳、氮和磷等)的循环过程往往与有机质密切相关[9-12],而有机质中氨基酸的含量变化和组成特征的差异可以很好地指示有机质的来源和降解特征[13].近年来,国内外学者开展了对海洋中颗粒物[14-15]、溶解性有机物[16-17]、沉积物[13]、河流和湖泊水体中颗粒物[16, 18-19]的氨基酸的分析与研究.已有研究表明不同介质中有机质发生降解转变时,总水解氨基酸(THAAs)也随之改变.随着颗粒物粒径的减小[14-15]、水深的增加[16-17]和沉积物老化程度的增加[13],有机质降解程度增加而THAAs的浓度将减小.某些单个氨基酸组分含量亦随着有机质降解程度的变化而发生变化,如亮氨酸、异亮氨酸、苯丙氨酸、酪氨酸、谷氨酸含量随着有机质降解程度的增加而下降,而甘氨酸、丝氨酸、苏氨酸的含量则相反[13].尤其,D型氨基酸与L型氨基酸的比值大小可以表示氨基酸的来源[16].因此,对太湖水生植物氨基酸的组成特征及其差异的研究分析对于进一步了解湖泊生态系统氮循环和有机质归趋等具有重要的意义.
太湖水体[20-21]和沉积物[22]中的氨基酸组成特征等的研究已表明太湖溶解性氨基酸主要是内源输入,同时氨基酸也是太湖沉积物中有机质和有机氮的重要组成部分.太湖生态系统中典型陆生和水生植物是内源输入的重要来源.然而,对这些典型植物中氨基酸组成特征的研究尚未见报道,尤其是植物中氨基酸含量与太湖水体及沉积物中氨基酸来源的关系.因此,本研究选取并采集了广泛分布于太湖的8种优势水生植物和1种陆生植物,分析各植物体中氨基酸的含量和组成特征,对比不同植物来源氨基酸的组成特征,并进一步与太湖沉积物、水体中氨基酸组成特征进行对比.旨在揭示不同类型植物之间氨基酸组成特征的差异,分析植物来源的有机质和氨基酸对湖泊水体和沉积物中有机质和氨基酸的贡献.
1 材料与方法 1.1 样品采集与制备2011年8月在东太湖和贡湖各采集1种陆生植物和8种优势水生植物全株样品5~10株[3].陆生植物样品为狗尾巴草(Setaria);水生植物样品包括菱(Trapa)、狐尾藻(Myriophyllum)、荇菜(Nymphoides peltatum)、黑藻(Hydrilla)、眼子菜(Potamogeton)、芦苇(Phragmites adans)、茭草(Zizania)、分枝蓼(Polygonum).样品采集后经洗净晾干并置于105℃烘箱中杀青(15min),然后进一步风干、研磨备用.利用元素分析仪(Vario macro E1,Germany)测定典型植物体内基本元素组成特征,包括氮(N)、碳(C)、硫(S)、氢(H)的含量.经测定,东太湖水体总氮、总磷浓度分别为0.99、0.03mg/L,贡湖水体总氮、总磷浓度分别为1.51、0.05mg/L.
1.2 试剂和材料氨基酸标准样品:由于脯氨酸无法用邻苯二甲醛(OPA)衍生,半胱氨酸无法被FLD检测器吸收,色氨酸在酸水解过程中被破坏,本研究中的总水解氨基酸只测定了另外15种氨基酸.因此,购买氨基酸标准样品包括天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、丙氨酸(Ala)(质量分数≥98%,SIGMA试剂公司),组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、精氨酸(Arg)、酪氨酸(Tyr)、缬氨酸(Val)、甲硫氨酸(Met)、异亮氨酸(Ile)、苯丙氨酸(Phe)、亮氨酸(Leu)、赖氨酸(Lys)(质量分数≥98%,阿拉丁试剂公司).称取适量氨基酸标准样品,溶于0.09mol/L HCl溶液中,配制成浓度为0.6mmol/L的混标溶液备用.
衍生剂:0.3mol/L OPA(分析纯,SIGMA)β-巯基乙醇(分析纯,SIGMA)甲醇体积比1 :4溶液,5h内使用.
缓冲溶液:硼酸(0.5mol/L)与氢氧化钾(0.5825mol/L)混合配制的缓冲溶液(pH=10.4).
1.3 THAAs的分析测定准确称取100mg样品于安瓿管中,加入10ml 6mol/L盐酸溶液,100μl 12mmol/L抗坏血酸水溶液,充氮气烧结封管,移入110℃恒温箱中水解22h,取出冷却,中断水解过程.取1ml上清液,用6mol/L氢氧化钠水溶液中和,过0.45μm滤膜,处理后的样品溶液保存待分析.准确吸取300μl处理后的样品溶液,加入300μl OPA衍生剂和400μl缓冲溶液,充分混匀,再次利用0.45μm滤膜过滤,溶液置于2ml样品瓶中,衍生15min后采用高效液相色谱仪(Agilent 1200)配备荧光检测器(Agilent G1314BFLD)进行分析测定.
色谱分析条件:LiChrospher 100 RP-18色谱柱(250mm×4.6mm,5μm);流动相A:25mmol/L醋酸钠水溶液(pH=5.8):四氢呋喃=95 :5(V :V),摇匀,过0.45μm滤膜;流动相B:甲醇;流速:1.0ml/min;Em=340nm,Ex=450nm;进样量:10μl.梯度洗脱程序为0、12、20、22、31、35、40、50、52、60min时,流动相A的比例分别为90%、72%、70%、65%、63%、53%、45%、35%、90%、90%.
1.4 样品中氨基酸含量的计算与数据分析在上述样品前处理和高效液相色谱分析的条件下,60min内各种氨基酸可被完全分离. 15种氨基酸利用标准样品色谱峰保留时间定性,外标法定量.空白基质加标方法测定样品前处理方法的回收率如下:丝氨酸为75.1%±5.7%,丙氨酸为75.7%±4.5%,蛋氨酸为58.2%±21.7%,其它氨基酸的平均回收率在80%~98%之间, 相对标准偏差在4.8%以下.最后结果经空白扣除和回收率校正.
运用R2.15.2软件进行组间差异的参数检验,P>0.05,表示为未达到显著检验水平,0.01<P<0.05为显著水平,P<0.01为极显著水平.运用Matlab 7.9软件进行异常值检验.
2 结果与讨论 2.1 太湖典型植物中元素组成特征东太湖与贡湖植物体中C平均含量分别为39.0%和38.5%(图 1a),这是由于含有较高含量C元素的糖类、脂类和蛋白质等是构成植物生命体的基础物质.氮元素是蛋白质、核酸和磷脂等植物生长发育所必需化合物的重要构成部分,东太湖与贡湖植物的N平均含量为24.8%和21.7%(图 1b).另外,硫元素是植物含硫蛋白质(如胱氨酸、半胱氨酸、甲硫氨酸)的组成元素,其平均含量为0.5%(图 1d).对于不同湖区而言,同类型的植物中C、S、H的平均含量差别很小(图 1a、c、d).但是,对比分布于东太湖的植物和贡湖植物中N的平均含量,表明东太湖植物体中N平均含量较高.其中,来源于东太湖浮叶植物、挺水植物以及陆生植物的N平均含量均大于贡湖(图 1b).这可能是由于东太湖的无机氮浓度适合植物等生长发育,进而促进了植物对N的吸收[23].对比研究发现沉水植物中碳含量较低,这可能是由于CO2作为植物中的C源,其它3种植物可通过直接光照并吸收大气中CO2通过光合作用充分利用C,而沉水植物的光照强度弱和受水体中CO2来源的限制,对C的利用受到一定程度的影响[24];由于陆生植物只能通过地下部分根系吸收S元素,而水生植物还可以通过地上部分茎叶从水体中吸收利用S元素[25],因此,陆生植物的含硫量较低.

|
图 1 太湖不同植物中C、N、H、S组成 Fig.1 Compositions of C, N, H, S in typical plants from Lake Taihu |
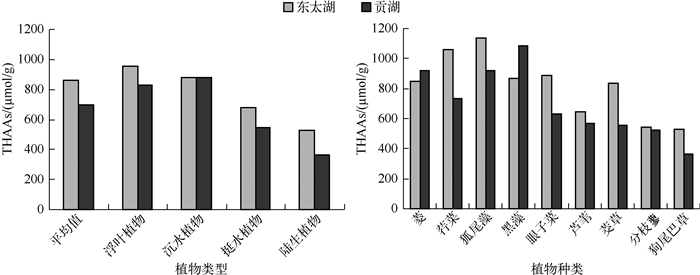
太湖不同湖区水生植物中THAAs含量及各氨基酸的相对摩尔百分含量见表 1.东太湖水生植物体中THAAs的含量介于544.5~1137.0μmol/g之间,平均含量为861.6±182.96μmol/g;贡湖水生植物体中THAAs的含量在366.8~1082.5μmol/g之间变化,平均含量为700.0±232.3μmol/g.分析不同类型植物表明,来源于东太湖的浮叶植物、沉水植物、挺水植物和陆生植物的平均THAAs含量分别为952.7、878.2、675.7和528.6μmol/g;来源于贡湖的4种类型植物的平均THAAs含量分别为829.6、877.1、547.4和366.8μmol/g.统计分析结果表明东太湖植物样品的THAAs含量显著高于贡湖样品(P<0.05)(图 2).富营养化水体在很大程度上不利于水生植物的生长,水中过高的N、P可能会对植物产生胁迫作用[26].贡湖富营养化程度较高,其水体总氮、总磷、氨氮均大于东太湖[27].因此,与贡湖相比,东太湖环境更利于植物的生长,从而促进氨基酸合成.
| 表 1 太湖典型植物体中各氨基酸相对摩尔百分含量 Tab.1 Molar compositions of amino acids intypical plants inlake Taihu |
|
图 2 不同植物THAAs含量 Fig.2 Total concentrations of THAAs in typical plants |
东太湖各类植物THAAs含量大小依次为浮叶植物>沉水植物>挺水植物>陆生植物,而贡湖为沉水植物>浮叶植物>挺水植物>陆生植物.这基本遵循沉水植物、浮叶植物>挺水植物>陆生植物的规律,表明植物体内的THAAs含量既与水体沉积物等外在环境有关,又与植物的生长形态相关[26].沉水植物从营养物质丰富的沉积物和底层水体中吸收营养物质;浮叶植物主要通过巨大叶片从水面吸收营养物质,也可以通过根系从沉积物中吸收营养物质;挺水植物主要利用根系吸收营养物质,通过茎运输到水上部分.两个湖区中水生植物体的THAAs含量均大于陆生植物,表明水生植物中氨基酸的含量相对较高,与水生植物总氮含量大于陆生植物一致,已有的研究报道也表明[28],与陆生植物相比,水生植物体内蛋白质含量更高.
太湖植物体中Glu、Ala、Lys、Arg和Asp的摩尔百分比均大于10.0%,其总和可达THAAs的50.0%以上,是植物氨基酸的主要组成部分.Lys、His、Arg的氨基数目大于羧基,属于碱性氨基酸;Glu、Asp则相反,属于酸性氨基酸;其余属于中性氨基酸.其中,东太湖植物的碱性氨基酸、酸性氨基酸和中性氨基酸的平均摩尔百分比依次为26.1%、22.6%和51.3%,而贡湖这3类氨基酸平均摩尔百分比分别为17.1%、25.5%和57.4%.结果表明中性氨基酸为植物体中氨基酸主要类型,东太湖植物碱性氨基酸含量高于酸性氨基酸,贡湖则相反.研究分析的15种植物氨基酸中,难降解的Ser、Ala和Lys浓度比较高,易于富集[20],东太湖和贡湖植物这3种氨基酸的平均比例之和分别为27.2%和22.2%.与其他介质的研究对比,表明不同来源有机质中Ser/(Ser+Ala+Lys)具有差异性.湖泊水生植物中Ser/(Ser+Ala+Lys)的变化范围为13.2%~35.2%,平均值为28.4%.陆生维管束植物中变化范围为25.6%~35.6%,平均值为26.3%;海洋浮游植物中变化范围为12.9%~21.8%,平均值为18.8%;浮游动物中均值为16.7%,在15.1%~19.4%间变化;细菌平均值为16.2%,其变化范围为12.3%~20.1%[29];淡水硅藻中平均值为50.3%,变化范围为41.2%~63.2%[30].综合分析表明,太湖水生植物中Ser/(Ser+Ala+Lys)值与陆生维管束植物较接近,而与海洋浮游植物、浮游动物、细菌、硅藻中的Ser/(Ser+Ala+Lys)值有差异.
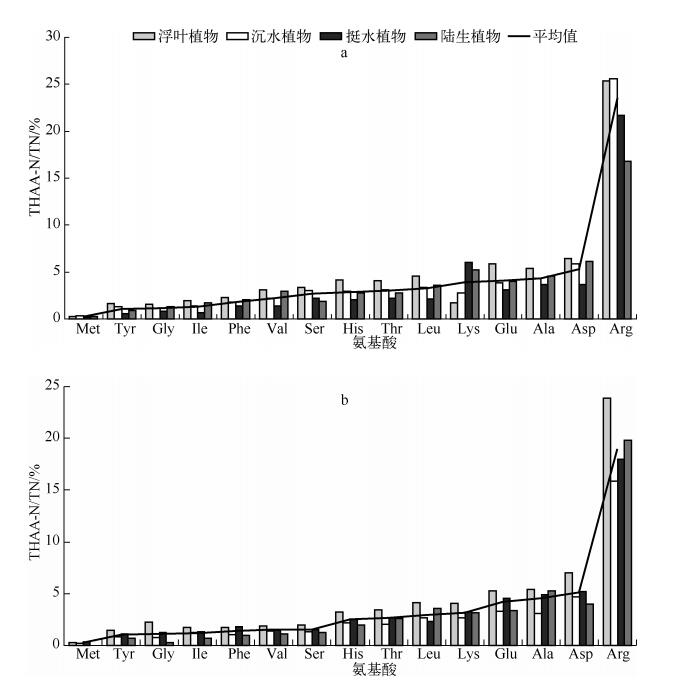
2.3 太湖典型植物体中THAAs-N/TN、THAAs-C/TC分析氨基酸中的碳(THAAs-C)和氮(THAAs-N)对TC和TN的贡献比例分别介于5.1%~19.2%和30.7%~94.7%之间.较高的THAAs-N/TN表明植物体中的氮大多以生物可利用性氨基酸氮的形式存在,是太湖生态系统中氮营养元素的重要来源之一.东太湖不同类型植物THAAs-C/TC大小依次为沉水植物>浮叶植物>陆生植物>挺水植物;THAAs-N/TN大小依次为浮叶植物>沉水植物>挺水植物>陆生植物.贡湖植物中THAAs-C/TC值大小依次为:沉水植物>浮叶植物>挺水植物>陆生植物;THAAs-N/TN值依次为浮叶植物>挺水植物>陆生植物>沉水植物.其中,东太湖狐尾藻中氨基酸碳所占比例最大(18.8%), 荇菜中氨基酸氮所占比例最大(94.7%).
不同类型植物的各种氨基酸中氮在总氮中所占的比例也存在差异(图 3),其中Arg中N占总氮的平均值达到15%以上,这是由于Arg的摩尔浓度在所有氨基酸中相对较大,且1个Arg分子中含有6个氮原子,是15种氨基酸中含有氮原子最多的氨基酸之一,因此Arg对氮的贡献最大.而易分解的Phe、Glu等[20]所占比例也较大,东太湖和贡湖这3种氨基酸N比例的总和分别为27.8%和24.3%.另外,难降解的Ser、Ala、Lys这3种氨基酸中的N比例在东太湖和贡湖来源的植物样品中分别为13.5%和8.2%,这部分氨基酸易于沉积.
|
图 3 东太湖(a)和贡湖(b)不同类型植物氨基酸氮与植物总氮的比例 Fig.3 THAAs-N/TN in typical plants of East Lake Taihu(a) and Gonghu Bay(b) |
东太湖植物样品与沉积物表层(0~3cm)[22]氨基酸浓度与THAAs浓度比例关系的对比见图 4.经过对植物样品与沉积物样品中的各氨基酸比例异常点检验,得出二者Gly、Arg、Asp组成差异较大,剩余11种氨基酸比例具有显著的相关性(P<0.05).东太湖沉积物中Ser/(Ser+Ala+Lys)的变化范围为19.8%~27.8%,平均值为24.8%.这与水生植物的比值较接近,表明东太湖广泛分布的植物可能是沉积物中氨基酸的主要来源[22, 31-33].植物来源的有机质和氨基酸进入沉积物后,与其他来源的氨基酸相混合,在微生物等作用下进行降解和转化,使得Arg、Asp比例减小,而Gly的比例增加.氨基酸组成特征可以用来指示有机质在湖泊生态系统中的降解程度[13, 34]. Dauwe等[13]在研究有机质降解过程中表明单个氨基酸含量随着降解程度的变化而发生变化,如Leu、Ile、Phe、Tyr、Glu含量随有机质新鲜度减小而下降,与之相反,Gly、Ser、Thr的含量则随之增加.与沉积物样品相比,植物样品中的Leu、Phe、Tyr、Glu含量相对较大,而Gly、Ser却相反.这可能表明植物是沉积物中有机质和氨基酸的重要来源之一.植物来源的有机质和氨基酸输入湖泊沉积物后,在微生物等作用下新鲜程度减小,降解程度增加.

|
图 4 东太湖植物、沉积物[22]和水体[21]中各氨基酸在THAAs中的相对比例 (引用数据中Met与Val合并,本图中表示为Met+Val) Fig.4 Differences of AA/THAAs in sediment, water and typical plants in East Lake Taihu |
与太湖水体中氨基酸组成特征[21]的比较,表明植物来源的His、Ile、Ser、Glu的比例与水体中的较相似(图 4).对植物和水体氨基酸比例进行异常值检验,表明二者的Lys比例差异较大,其余氨基酸比例没有显著相关性(P>0.05).同时,东太湖水体中Ser/(Ser+Ala+Lys)值的变化范围可达4.3%~31.1%,平均值为16.2%,且不同点位水体差别较大.这表明太湖周边河流氨基酸类营养盐的输入[35]和湖泊水体中氨基酸本身较易降解和转化[20]导致了植物和水体中氨基酸组成特征的差异.
综合比较表明植物来源的有机质和氨基酸是湖泊沉积物中有机质和氨基酸的重要来源,这些有机质在微生物等作用下参与湖泊中营养物质的生物地球循环,尤其是植物来源有机质中总可水解氨基酸可能对湖泊中氮生物地球化学循环具有重要的作用[36].
3 结论太湖典型植物体中的氨基酸含量变化依次为沉水植物、浮叶植物>挺水植物>陆生植物,其中东太湖植物样品中的氨基酸含量大于贡湖中的植物样品.其中,天冬氨酸、谷氨酸、精氨酸、丙氨酸、赖氨酸的摩尔百分比占到总量的50%以上,是THAAs主要组成部分.植物氨基酸中碳元素占到总碳的5.1%~19.2%,而植物氨基酸中氮元素是总氮的主要组成部分,占总氮的30.7%~94.7%,是太湖内源氮营养元素的主要来源.太湖生态系统中广泛分布的典型植物来源的有机质和氨基酸是沉积物中有机质和氨基酸的重要内源输入.
| [1] |
何俊, 谷孝鸿, 刘国锋. 东太湖水生植物及其与环境的相互作用. 湖泊科学, 2008, 20(6): 790-795. DOI:10.18307/2008.0618 |
| [2] |
李冬林, 王磊, 丁晶晶等. 水生植物的生态功能和资源应用. 湿地科学, 2011, 9(3): 290-296. |
| [3] |
2008年太湖健康状况报告. 水利部太湖流域管理局, 2008.
|
| [4] |
杨清心. 东太湖水生植被的生态功能及调节机制. 湖泊科学, 1998, 10(1): 67-72. DOI:10.18307/1998.0111 |
| [5] |
颜昌宙, 许秋瑾, 赵景柱等. 五里湖生态重建影响因素及其对策探讨. 环境科学研究, 2004, 17(3): 44-47. |
| [6] |
Davis J, Kaiser K, Benner R. Amino acid and amino sugar yields and compositions as indicators of dissolved organic matter diagenesis. Organic Geochemistry, 2009, 40(3): 343-352. DOI:10.1016/j.orggeochem.2008.12.003 |
| [7] |
李文朝. 东太湖水生植物的促淤效应与磷的沉积. 环境科学, 1997, 18(3): 9-12. |
| [8] |
王华静, 吴良欢, 陶勤南. 高等植物氨基酸生物效应的研究进展. 土壤通报, 2004, 34(5): 469-472. |
| [9] |
吴丰昌, 王立英, 黎文等. 天然有机质及其在地表环境中的重要性. 湖泊科学, 2008, 20(1): 1-12. DOI:10.18307/2008.0101 |
| [10] |
Wu FC, Mills RB, Evans RD et al. Kinetics of metal-fulvic acid complexation using a stopped-flow technique and three-dimensional excitation emission fluorescence spectrophotometer. Analytical Chemistry, 2004, 76(1): 110-113. DOI:10.1021/ac030005p |
| [11] |
Wu FC, Cai YR, Evans D et al. Complexation between Hg(Ⅱ) and dissolved organic matter in stream waters: an application of fluorescence spectroscopy. Biogeochemistry, 2004, 71(3): 339-351. DOI:10.1007/s10533-004-0058-5 |
| [12] |
吴丰昌, 金相灿, 张润宇等. 论有机氮磷在湖泊水环境中的作用和重要性. 湖泊科学, 2010, 22(1): 1-7. |
| [13] |
Dauwe B, Middelburg JJ. Amino acids andhexosamines as indicators of organic matter degradation state in North Sea sediments. Limnology and Oceanography, 1998, 43(5): 782-798. DOI:10.4319/lo.1998.43.5.0782 |
| [14] |
Davis J, Benner R. Seasonal trends in the abundance, composition and bioavailability of particulate and dissolved organic matter in the Chukchi/Beaufort Seas and western Canada Basin. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2005, 52(24): 3396-3410. |
| [15] |
Kaiser K, Benner R. Biochemical composition and size distribution of organic matter at the Pacific and Atlantic time-series stations. Marine Chemistry, 2009, 113(1): 63-77. |
| [16] |
Kaiser K, Benner R. Major bacterial contribution to the ocean reservoir of detrital organic carbon and nitrogen. Limnology and Oceanography, 2008, 53(1): 99. DOI:10.4319/lo.2008.53.1.0099 |
| [17] |
Dittmar T, Fitznar HP, Kattner G. Origin and biogeochemical cycling of organic nitrogen in the eastern Arctic Ocean as evident from D-and L-amino acids. Geochimica et Cosmochimica Acta, 2001, 65(22): 4103-4114. DOI:10.1016/S0016-7037(01)00688-3 |
| [18] |
Tremblay L, Benner R. Organic matter diagenesis and bacterial contributions to detrital carbon and nitrogen in the Amazon River system. Limnology and Oceanography, 2009, 54(3): 681-691. DOI:10.4319/lo.2009.54.3.0681 |
| [19] |
Jørgensen NO, Stepanaukas R, Pedersen AU et al. Occurrence and degradation of peptidoglycan in aquatic environments. FEMS Microbiology Ecology, 2003, 46(3): 269-280. DOI:10.1016/S0168-6496(03)00194-6 |
| [20] |
姚昕, 朱广伟, 秦伯强. 太湖北部水体溶解性氨基酸分布特征及其环境意义. 中国环境科学, 2010, 30(10): 1402-1407. |
| [21] |
姚昕, 朱广伟, 高光等. 太湖水体溶解性氨基酸的空间分布特征. 生态学报, 2013, 33(18): 5402-5407. |
| [22] |
Yao X, Zhu G, Cai L et al. Geochemical characteristics of amino acids in sediment of Lake Taihu, a large, shallow, eutropic freshwater Lake of China. Aquatic Geochemistry, 2012, 18(3): 263-280. DOI:10.1007/s10498-012-9160-9 |
| [23] |
张贵龙, 赵建宁, 刘红梅等. 不同水生植物对富营养化水体无机氮吸收动力学特征. 湖泊科学, 2013, 25(2): 221-226. DOI:10.18307/2013.0207 |
| [24] |
苏睿丽. 沉水植物光合作用的特点与研究进展. 植物学通报, 2005, 22(增刊): 128-138. |
| [25] |
武维华. 植物生理学. 北京: 科学出版社, 2008, 96-112.
|
| [26] |
雷泽湘, 徐德兰, 谢贻发等. 太湖水生植物氮磷与湖水和沉积物氮磷含量的关系. 植物生态学报, 2008, 32(2): 402-407. |
| [27] |
太湖健康报告. 水利部太湖流域管理局, 2011.
|
| [28] |
杨柳燕, 张奕, 肖琳等. 固体发酵提高水生植物发酵产物蛋白含量的研究. 环境科学学报, 2007, 27(1): 35-39. |
| [29] |
Cowie GL, Hedges JI. Sources and reactivities of amino acids in a coastal marine environment. Limnology and Oceanography, 1992, 37(4): 703-724. DOI:10.4319/lo.1992.37.4.0703 |
| [30] |
Hecky R, Mopper K, Kilham P et al. The amino acid and sugar composition of diatom cell-walls. Marine Biology, 1973, 19(4): 323-331. DOI:10.1007/BF00348902 |
| [31] |
王金权, 刘金玲. 太湖沉积物中氨基酸及其有机质的垂直分布与古生态意义. 微体古生物学报, 1994, 11(2): 249-257. |
| [32] |
Qin B, Xu P, Wu Q et al. Environmental issues of lake Taihu, China. Hydrobiologia, 2007, 581(1): 3-14. DOI:10.1007/s10750-006-0521-5 |
| [33] |
Meyers PA, Teranes JL. Sediment organic matter. Tracking Environmental change using lake sediments: Physical and geochemical methods. Dordrecht: Springer Netherlands, 2002, 239-269.
|
| [34] |
陈建芳, 张海生, 金海燕等. 北极陆架沉积碳埋藏及其在全球碳循环中的作用. 极地研究, 2004, 16(3): 193-201. |
| [35] |
陈小锋, 揣小明, 曾巾等. 太湖氮素出入湖通量与自净能力研究. 环境科学, 2012, 33(7): 2309-2314. |
| [36] |
李文朝. 东太湖沉积物中氮的积累与水生植物沉积. 中国环境科学, 1997, 17(5): 418-421. |
 2015, Vol. 27
2015, Vol. 27 

