(2: 中国科学院水生生物研究所,东湖湖泊生态系统试验站,淡水生态与生物技术国家重点实验室,武汉 430072)
(2: State Key Laboratory of Freshwater Ecology and Biotechnology, Donghu Experimental Station of Lake Ecosystems, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P.R.China)
微齿眼子菜(Potmogeton maackianus A. Benn)广泛分布于东亚地区几乎所有的淡水水体[1].它不仅是许多长江中下游湖泊及云贵高原湖泊的主要优势种之一,同时也是这些区域(特别是江汉湖群和洱海)沉水植物群落的主要建群种[2-4].作为沉水植物群落中的关键种,微齿眼子菜对湖泊生态系统的初级生产力、次级生产力、营养元素的生物地球化学循环以及清水稳态的维持均有重要的影响.然而近年来许多湖泊中的微齿眼子菜种群规模急剧萎缩(如洱海湖心平台的该种群于2003年左右消失)[5-7],甚至在一些湖泊中已经消失(如武汉东湖中该种群在1980s左右消失)[8-10].湖泊富营养化以及剧烈的水位波动可能是导致微齿眼子菜种群退化或消失的主要原因[4, 11].微齿眼子菜的扩张或衰退是一个种群水平上的问题,而富营养化和水位波动所引起的环境胁迫(如低氧、弱光、高营养、高水位等)主要通过影响个体行为进而影响不同生态尺度的微齿眼子菜种群动态.例如,不同区域湖泊生产力的差异,体现在个体行为对水体生产力响应的差异,进而经尺度上推至种群动态对水体生产力响应的整体差异;同一湖泊不同湖湾由于外源营养输入的差异而造成不同湖湾的个体行为乃至种群动态差异;同一湖湾中因不同种群所处的环境梯度(如水深)的不同而造成个体行为乃至种群动态差异等.微齿眼子菜虽然能通过风媒传粉进行有性繁殖,也能进行自花传粉,但是在自然界中的生长与扩张以无性繁殖(克隆生长)为主[12].研究表明微齿眼子菜种群的遗传多样性非常高(如长江中下游种群间的遗传多样性高达63.8%)[13],这说明微齿眼子菜功能性状在种内水平上具有极高的遗传变异来源[13].尽管有少数研究报道了微齿眼子菜相关功能性状(如株高、生物量分配、分枝长等)对环境因子(如水深、光照、营养盐)的响应[2, 14],但这些仅限于个体水平的实验研究,在反映野外条件下微齿眼子菜种群或个体的真实动态方面仍存在一定的局限性.更重要的是,这些研究往往将个体水平的研究结果均值化处理后去推测种群或更高水平的生态学事件(种群或群落衰退或消失).事实上这种处理方式(将所有个体均值化)使得各生态尺度的生态学过程(个体水平、种群水平、群落水平)之间的联系边界化,且维度(水平)越高边界化越严重(越远),与其生态学过程本质相差越大[15].各生态尺度的生态学过程本质上是相互联系相互作用的,MacArthur等[16]早在1967年就强调了物种之间的生态位均值(niche means,d)和种内的生态位幅度(niche widths,σ)同时决定该物种在生态系统中的位置以及与环境作用的强度.现代群落生态学理论的发展是以物种均值(d)为基础的,基本上忽视了其变异(σ).近年来人们意识到变异的重要性,因为它与均值一样是理解生态学过程的核心.
基于微齿眼子菜广泛的分布、较高的遗传多样性以及在湖泊生态系统中的重要作用,本研究主要关注微齿眼子菜的种内性状变异,因为其功能性状的变异显得比均值更加重要.这可以作为研究更复杂的群落水平(存在物种更替)的一个特例,即只有一个物种而不存在物种更替引起的潜在变异.因此,本文通过分级嵌套设计(hierarchical nested design)的采样方案,研究微齿眼子菜功能性状11个功能性状在不同生态尺度(不同湖泊、同一湖泊不同湖湾、同一湖湾不同水深、同一水深不同样方、同一样方不同个体)的差异,并将其在各生态尺度的变异分解,并进一步剖析各生态尺度的变异组成亦即环境引起的变异和个体发育引起的变异.
1 材料和方法 1.1 研究地点本研究选择的我国2个南方湖泊——洱海(25°52′N,100°06′E)和牛山湖(30°20′N,114°30′E),分别是云贵高原湖泊和东部平原湖泊(长江中下游)的典型代表,都以微齿眼子菜作为建群种或优势种.这2个湖泊在海拔、面积、容积、植物生长期(一年内温度在10℃以上的天数)、水深、温度(温差)、营养盐等方面均有显著差异[17],为方便比较,将这些差异体现为湖泊生产力.与牛山湖相比,洱海具有较高的生产力,具体表现为高营养(水和底质)、较高的浮游植物生物量、较低的透明度和较长的植物生长期[17].
1.2 野外采样方案为研究区域尺度不同湖泊内微齿眼子菜种群之间功能性状的变异,在两个不同生产力的湖泊(洱海和牛山湖)设置采样点[17].为研究同一生境不同样带微齿眼子菜种群之间功能性状的变异,在洱海和牛山湖分别设置了3、4条样带.为研究同一样带内不同水深微齿眼子菜种群之间功能性状的变异,在每条样带按水深梯度(每隔0.5m水深)设置3~10个25m2(根据微齿眼子菜的最大分布水深)的样点或水深层.为研究同一样点内不同样方(微环境)微齿眼子菜亚种群之间功能性状的变异,在每个样点内随机设置3个样方.为研究同一样方内不同个体之间功能性状的变异,在每个样方内随机选取3~10株完整个体.为控制因不同季节引起的时间变异,所有样品均采集于同样的生长季节,如牛山湖样品采集于2008年7月、洱海样品采集于2009年7月[17].而为研究个体发育所引起的变异,我们测量所有个体的植株生物量.所有样方和样品通过一个镰刀式采草器采集,各生态尺度的总样本量分别为:2个湖泊、7条样带、47个样点(水深)、141个样方、681个个体[17].
对每株植株的功能性状进行测定:株高是指从植株茎的基部(基质以上)到光合作用部分(叶片)的垂直距离,通过卷尺测量[17];叶片数量是指植株所有具有光合作用能力(已死亡或凋谢的叶片除外)的叶片数,直接计数[17];叶片面积是指所有具有光合作用能力叶片的总叶面积(两面),通过数码相机或者扫描仪扫描叶片(以坐标纸为背景)然后以像素比的方式计算;比叶面积是指单位叶片重量的叶面积,单片叶子的面积与干重的比值;总分枝长是指植株除主茎以外所有分枝的总长度,通过卷尺测量[17];节间数是指主茎的节间数,直接计数.通过将植株根、茎、叶分离、洗净、并在80℃烘干至恒重后称量干重;根茎比是指根重与茎叶重的比值[17];根、茎、叶重量的总和为植株生物量或植株大小.
1.3 统计分析所有统计分析均在R语言中进行,其中应用了nlme、lme、ape,smatr等程序包(R Development Core Team 2009).为分解功能性状在各生态尺度的变异组成,采用线性混合模型(Linear Mixed Effects model,LME)以及严格的最大似然估计法(Restricted Maximum Likelihood method,REML)进行统计分析,该模型为非平衡模型(样本量差异较大),所有数据经对数化(log10)转换后进行正态检验和方差齐性检验.这样做还有一个优点,因为性状的整体方差会随均值的变大而变大,经对数转化后使得均值与方差相互独立,亦即方差不会因均值的变化而变化.在混合模型中,功能性状为因变量(y),不设置任何自变量(x),将5个生态尺度作为随机变量,并以自下而上(个体、样方、水深、样带、湖泊)的顺序进行嵌套设计.然后再对模型进行方差成分分析(variance component analysis),计算出功能性状在各生态尺度的变异以及变异比例.通过这个模型计算出来的变异为总体变异(TV).
为了对功能性状的变异进一步分解,我们采用同样的方法建立另一个混合模型,其中功能性状为因变量(y),不设置任何自变量(x),将5个生态尺度作为随机变量,并以自下而上(个体、样方、水深、样带、湖泊)的顺序进行嵌套设计,唯一不同的是,在这个混合模型中本文引入植株大小作为协变量(covariate),然后再对模型进行方差成分分析,计算出功能性状在各生态尺度的变异以及变异比例[17].通过这个模型计算出来的变异为大小校准后的性状变异(SV),亦即环境引起的变异(EV)[17].
个体发育引起的变异(OV)为功能性状的总变异与大小校准后的变异之间的差值,即:OV=TV-EV.以株高为例介绍OV的计算方法,结果见表 1[17].
| 表 1 株高在5个生态尺度的变异* Tab.1 Variance partitioning of the full nested linear models on shoot height across five nested ecological scales |
另外,还计算了功能性状在各生态尺度的变异系数(CV),作为理解功能性状变异的一个辅助指标.
2 结果 2.1 功能性状的变异定量微齿眼子菜各功能性状的CV范围为0.40~1.21,大多数超过了0.60[17],其中总分枝长的CV最大(1.21),而叶片性状如叶重、总叶面积、总叶数的CV均超过了0.90(表 2).这说明微齿眼子菜在种内水平上有较高的变异,特别是个体之间的空间竞争能力(总分枝长)和光合作用能力(叶片性状)有极大的差异.
| 表 2 微齿眼子菜功能性状(n=681)的总体均值、标准差和变异系数 Tab.2 Mean values, standard deviations and coefficient variations of functional traits of Potamogeton maackianus |
微齿眼子菜各功能性状变异的空间结构具有很大差异,不同生态尺度对不同功能性状的影响有显著差异(图 1).湖泊尺度(生产力)不影响根重的变异、解释了茎重总变异的22.9%、叶重总变异的6.4%、总叶面积总变异的9.8%、节间数总变异的5.7%;样带(生境)尺度解释了根重总变异的1.7%、茎重总变异的1.8%、叶重总变异的8.8%、总叶面积变异的6.5%、比叶面积总变异的0.5%、节间数总变异的3.8%;样点尺度(水深梯度)解释了根重总变异的9.4%、茎重总变异的21.6%、叶重总变异的11.3%、总叶面积总变异的15.5%、比叶面积总变异的19.5%、节间数总变异的25.7%;样方尺度(微环境)解释了这些功能性状总变异的5% ~20%.个体尺度解释了根重总变异的73.9%、茎重总变异的43.8%、叶重总变异的68.5%、总叶面积总变异的60.6%、比叶面积总变异的70.4%、节间数总变异的44.1%.总体来说个体尺度解释了这些功能性状的大部分变异,湖泊和样点尺度解释了茎重的大部分变异,而样点和样方尺度解释了总叶面积和节间数的部分变异.
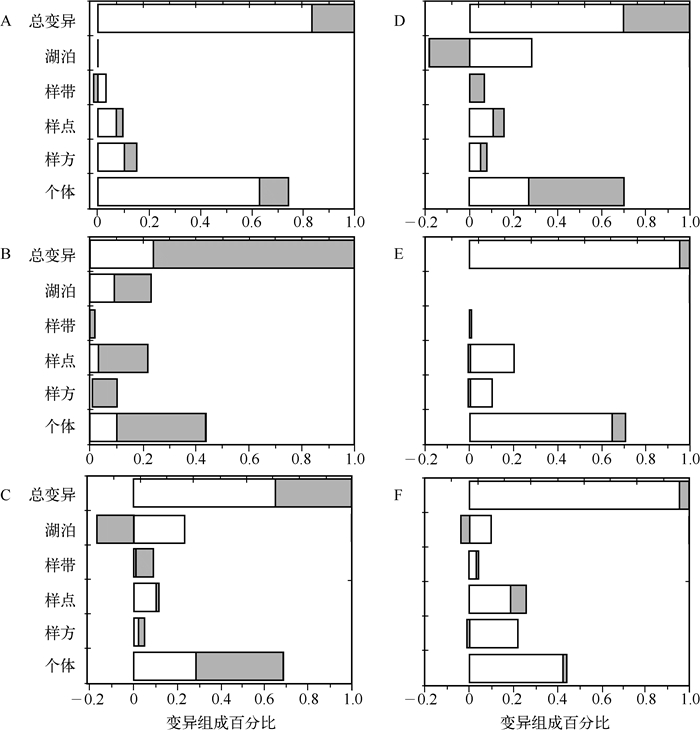
|
图 1 微齿眼子菜功能性状(A:根重;B:茎重;C:叶重;D:总叶面积;E:比叶面积;F:节间数)在5个生态尺度的变异组成百分比(其中空白部分为环境引起的变异;灰色部分为个体发育引起的变异) Fig.1 Decomposition of total variability in individual traits studied (A: root mass; B: stem mass; C: leaf mass; D: total leaf area; E: specific leaf area; F: internode number) across five nested ecological scales |
根据生态筛理论,外部筛过程(湖泊、样带和样点)解释了根重总变异的11.1%、茎重总变异的46.3%、叶重总变异的26.5%、总叶面积总变异的10.6%、比叶面积总变异的20%、节间数总变异的35.2%,这说明外部筛过程显著影响了茎重,其次为节间数、叶重和比叶面积(尽管内部筛过程为主要影响因子).内部筛对这些功能性状的影响较外部筛大(>50%),其中内部筛中主要是个体尺度解释了这些功能性状的大部分变异,说明密度效应或个体之间的竞争占主导作用.
个体发育引起的变异占各功能性状总变异的5% ~76%,其中根重占17%、茎重占76%、叶重占35%、总叶面积占30%、比叶面积占4.7%、节间数占5%.值得注意的是,OV在各生态尺度均有体现,占各生态尺度总变异的0~40%,这说明OV对功能性状的影响不可忽视.当OV为正值时表明功能性状与大小(植株生物量)呈线性关系,而当OV为负值时表明功能性状与大小呈非线性关系.例如在湖泊尺度个体发育对总叶面积变异的影响是负的,说明当不考虑个体大小时该性状的变异较小,而考虑大小后该性状的变异变大.
3 讨论 3.1 微齿眼子菜功能性状的种内变异本研究对微齿眼子菜分布在不同生产力湖泊、不同湖湾以及不同水深的种群进行了详细的分析,结果表明微齿眼子菜的功能性状具有极大的种内变异,大多数功能性状的变异超过了60%,特别是总分枝长(CV=1.21)和叶片性状(CV>0.90)[17].该物种功能性状的种内变异远远大于陆生植物某些功能性状的种内变异(CV在0.30左右),如智利一种陆生乔木植物Nothfagus pumilio的叶片性状单位叶面积的叶干重(Leaf Mass Area,LMA)种内变异仅为21.14%,而木质密度的种内变异只有10%左右[18].这说明水生植物(微齿眼子菜)的种群内及种群间较陆生单一优势种植物具有较高的功能多样性,并且种群分化或者个体分化水平也较陆生植物高,这可能解释了为什么湿地生态系统(包括湖泊)的许多单一优势种系统(如微齿眼子菜、黑藻、芦苇、狐尾藻等)具有极高的生物量与稳定性[17].另外,如此高的种内性状变异可能与其极高的遗传多样性有关.Li等[13]研究指出长江中下游湖泊的微齿眼子菜种群具有很高的遗传多样性,每个基因由多个等位基因组成,每个等位基因控制着功能性状的行为,种群之内或种群之间控制某个功能性状的基因或许是同一个基因的不同等位基因或同一个等位基因.除此之外,微齿眼子菜以无性繁殖为主,同一个湖泊中可能由一个克隆种群发展而来,有的种群仅有一个克隆,也有的种群由多个克隆组成,这些克隆可能是新生的也可能存在了很多年,这种克隆结构的多样性可能是微齿眼子菜功能性状种内变异较高的另一个原因.
总而言之,不论功能性状的种内变异来源于何处,这些变异使得我们在解释沉水植物群落多样性的形成以及对环境的响应时必须重新重视响应变量的变异或者方差,而不是仅仅注重整个种群的均值[19-21].Messier等[22]研究了巴拿马地区的热带森林,指出LMA和叶干物质比重(Leaf Dry Mass Content,LDMC)的种内变异几乎占总变异的一半,并说明了功能性状的种内变异在解释群落多样性形成机制方面有十分重要的作用.对于微齿眼子菜来说,较高的功能性状变异一方面有利于种群或个体之间的分化,另一方面提高了微齿眼子菜种群的功能多样性,使其能充分利用各种资源[17].如株高、总分枝长和总叶片数量较高的变异水平表明不同个体之间利用光资源的能力虽然差异较大,但这有效减少个体之间的竞争和自遮蔽作用,并且不同株高的个体使得该种群分布在水柱垂直方向的大部分位置;不同分枝长的个体占据了不同的空间,达到互补的作用;不同叶片数量的个体充分利用不同水深处的光资源[17].因此,功能性状的种内变异可能是微齿眼子菜种群在大部分水体中占据优势地位并维持群落稳定与多样性的重要原因.
3.2 微齿眼子菜功能性状在不同生态尺度的变异组成功能性状在不同生态尺度的变异组成与不同生态尺度的主要环境驱动因子有关,不同功能性状的变异组成取决于其对不同尺度环境驱动因子的响应方式.本研究中,微齿眼子菜不同功能性状的变异组成具有显著差异.根据生态筛理论,外部筛过程对茎重的影响较大.外部筛主要是湖泊尺度的生产力差异(包含透明度、营养、生长期、浮游植物等)和样点尺度的水深梯度.茎重的外在表现主要为茎的伸长与分枝的扩张.株高主要受到水深梯度的影响,其次受到湖泊生产力的影响,这两者构成了株高总变异的绝大部分[17].随水深增加株高增加.湖泊生产力越高、水体透明度越低、植株越倾向于增加高度.该结果与其他研究者在单一尺度(水深梯度或者湖泊生产力)关于沉水植物对水深或者透明度的响应结果一致,这些沉水植物包括微齿眼子菜[2, 14]、眼子菜科[23]、马来眼子菜[24]、狐尾藻[25]等.湖泊尺度对株高的影响远比水深梯度的影响深远,洱海(生产力高)的微齿眼子菜在整体上或者种群水平上较牛山湖(生产力低)的微齿眼子菜高,即使在一定的水深或者一定的发育阶段均是如此.这并非意味着洱海微齿眼子菜的光获取能力就一定比牛山湖微齿眼子菜强,而是对洱海高营养、低透明度、较强的浮游植物竞争作用的适应性响应,这种适应性响应是在整个湖泊尺度的种群水平上实现的,这点不同于水深梯度对株高的影响[17].
节间数、叶重和比叶面积的大部分变异发生在个体水平,因此根据生态筛理论[21, 26],它们主要受到内部筛过程的影响,且主要是密度效应或个体之间的竞争作用.事实上,微齿眼子菜种群的密度相当高,如洱海3 m水深以内的微齿眼子菜种群密度达5000~12000株/m2,如此高的密度说明微齿眼子菜种群内个体之间的相互作用必定非常激烈[17].而叶性状(叶重和比叶面积)是个体之间竞争空间和光资源的两个主要功能性状,内部筛过程(密度效应)促进了个体水平的分化,即充分分化种群内不同个体的生态位(空间即光资源利用),使得更多的个体能共存并充分利用空间和光,从而提高微齿眼子菜种群水平的竞争力.另外,根重不仅是个体之间竞争基质资源的主要功能性状,还是个体生活史策略的重要体现[27].内部筛过程对根比重的作用促进了种群内个体的生活史策略的分化,体现在个体功能(获取基质资源)的特化(individual function specialization),根比重大的个体特化为获取基质资源,根茎比小的个体特化为获取光资源或者占据空间[15].这种个体水平的特化过程可能与微齿眼子菜克隆生长的习性密切相关,因为种群内属于同一克隆的个体可以通过克隆整合来弥补个体特化所引起的功能缺陷[17].从这方面来讲,微齿眼子菜种群内的克隆个体之间可能存在互惠互利的协同作用,而非自私的竞争作用.
3.3 微齿眼子菜功能性状的变异来源经过个体大小校正后进行的嵌套分级模型分析,个体发育引起的变异OV占微齿眼子菜功能性状总变异的20% ~33%,并且OV几乎在所有5个生态尺度都占有一定的比例,这说明个体发育是微齿眼子菜功能性状变异的重要来源.OV主要是由个体之间发育速度的差异引起的,即在同一个种群内的所有个体处于不同的发育阶段,有的个体生长速度快或者有的个体(克隆)萌发较晚,功能性状的变异仍遵从其固定的发育轨迹(development trajectory)或者异速生长轨迹(allometric trajectory),如根茎比在发育早期较高,但随个体生长而逐渐变小,同一种群内因所有个体处于发育轨迹的不同阶段,故而个体之间根茎比的差异较大[28];这种模式还发生在种群之间,即同一区域内有的种群整体发育速度较高,如温带地区较寒带地区的植物种群发育早且快、高营养土壤中种植的植物较低营养地区发育速度快[29].
| [1] |
中国科学院《中国植物志》编辑委员会. 中国植物志(第八卷). 北京: 科学出版社, 1995.
|
| [2] |
Ni L. Growth of Potamogeton maackianus under low-light stress in eutrophic water. Journal of Freshwater Ecology, 2001, 16(2): 249-256. DOI:10.1080/02705060.2001.9663809 |
| [3] |
李伟. 洪湖水生植被及其演替研究[学位论文]. 武汉: 中国科学院水生生物研究所, 1995. http://www.irgrid.ac.cn/handle/1471x/208559?mode=full
|
| [4] |
倪乐意. 黄丝草的生态学水体光学性质研究[学位论文]. 武汉: 中国科学院水生生物研究所, 1988. http://www.irgrid.ac.cn/handle/1471x/208252?mode=full&submit_simple=Show+full+item+record
|
| [5] |
戴全裕. 洱海水生植被的初步研究. 见: 沈仁湘编. 云南洱海科学论文集. 昆明: 云南民族出版社, 1989: 235-243.
|
| [6] |
吴庆龙, 王云飞. 洱海生物群落的历史演变分析. 湖泊科学, 1999, 11(3): 267-273. DOI:10.18307/1999.0312 |
| [7] |
胡小贞, 金相灿, 杜宝汉等. 云南洱海沉水植被现状及其动态变化. 环境科学研究, 2005, 18(1): 1-5. |
| [8] |
陈洪达. 武汉东湖水生维管束植物群落的结构和动态. 海洋与湖沼, 1980, 11: 275-284. |
| [9] |
严国安, 马剑敏, 邱东茹等. 武汉东湖水生植物群落演替的研究. 植物生态学报, 1997, 21(4): 319-327. |
| [10] |
于丹, 涂芒辉, 刘丽华等. 武汉东湖水生植物区系四十年间的变化与分析. 水生生物学报, 1998, 22: 219-228. |
| [11] |
厉恩华, 王学雷, 蔡晓斌等. 洱海湖滨带植被特征及其影响因素分析. 湖泊科学, 2011, 23(5): 738-746. DOI:10.18307/2011.0511 |
| [12] |
靳宝锋, 郭友好. 微齿眼子菜繁殖生物学特性的初步研究. 水生生物学报, 2001, 25(5): 439-448. |
| [13] |
Li W, Xia LQ, Li JQ et al. Genetic diversity of Potamogeton maackianus in the Yangtze River. Aquatic Botany, 2004, 80(4): 227-240. DOI:10.1016/j.aquabot.2004.07.003 |
| [14] |
Yang Y, Yu D, Xie Y et al. Phenotypic plasticity of two submersed plants in response to flooding. Journal of Freshwater Ecology, 2004, 19(1): 69-76. DOI:10.1080/02705060.2004.9664514 |
| [15] |
Clark JS, Bell DM, Hersh MH et al. Individual-scale variation, species-scale differences: inference needed to understand diversity. Ecology Letters, 2011, 14(12): 1273-1287. DOI:10.1111/ele.2011.14.issue-12 |
| [16] |
MacArthur R, Levins R. The limiting similarity, convergence, and divergence of coexisting species. American Naturalist, 1967, 101(921): 377-385. DOI:10.1086/282505 |
| [17] |
Fu H, Yuan G, Zhong J et al. Environmental and ontogenetic effects on intraspecific trait variation of a macrophyte species across five ecological scales. PLoS ONE, 2013, 8(4): e62794. DOI:10.1371/journal.pone.0062794 |
| [18] |
Fajardo A, Piper FI. Intraspecific trait variation and covariation in a widespread tree species (Nothofagus pumilio) in southern Chile. New Phytologist, 2011, 189(1): 259-271. DOI:10.1111/j.1469-8137.2010.03468.x |
| [19] |
Jung V, Violle C, Mondy C et al. Intraspecific variability and trait-based community assembly. Journal of Ecology, 2010, 98(5): 1134-1140. DOI:10.1111/jec.2010.98.issue-5 |
| [20] |
Albert CH, Grassein F, Schurr FM et al. When and how should intraspecific variability be considered in trait-based plant ecology?. Perspectives in Plant Ecology, Evolution and Systematics, 2011, 13(3): 217-225. DOI:10.1016/j.ppees.2011.04.003 |
| [21] |
Violle C, Enquist BJ, McGill BJ et al. The return of the variance: intraspecific variability in community ecology. Trends in Ecology and Evolution, 2012, 27(4): 244-252. DOI:10.1016/j.tree.2011.11.014 |
| [22] |
Messier J, McGill BJ, Lechowicz MJ. How do traits vary across ecological scales? A case for trait-based ecology. Ecology Letters, 2010, 13(7): 838-848. DOI:10.1111/ele.2010.13.issue-7 |
| [23] |
Maberly SC. Morphological and photosynthetic characteristics of Potamogeton obtusifolius from different depths. Journal of Aquatic Plant Management, 1993, 31: 34-39. |
| [24] |
崔心红, 蒲云海, 陈家宽. 水深梯度对竹叶眼子菜生长和繁殖的影响. 水生生物学报, 1999, 23(3): 269-272. |
| [25] |
Strand JA, Weisner SEB. Morphological plastic responses to water depth and wave exposure in an aquatic plant Myriophyllum spicatum. Journal of Ecology, 2001, 89(2): 166-175. DOI:10.1046/j.1365-2745.2001.00530.x |
| [26] |
Keddy PA. Assembly and response rules: two goals for predictive community ecology. Journal of Vegetation Science, 1992, 3(2): 157-164. DOI:10.2307/3235676 |
| [27] |
Grime JP. Evidence for the existence of three primary strategies in plants and its relevance to ecological and evolutionary theory. The American Naturalist, 1977, 111: 1169. DOI:10.1086/283244 |
| [28] |
Weiner J. Allocation, plasticity and allometry in plants. Perspectives in Plant Ecology Evolution and Systematics, 2004, 6(4): 207-215. DOI:10.1078/1433-8319-00083 |
| [29] |
Müller I, Schmid B, Weiner J. The effect of nutrient availability on biomass allocation patterns in 27 species of herbaceous plants. Perspectives in Plant Ecology Evolution and Systematics, 2000, 3(2): 115-127. DOI:10.1078/1433-8319-00007 |
 2015, Vol. 27
2015, Vol. 27 

