(2: 江苏省碳氮循环过程与污染控制重点实验室,南京 210023)
(3: 江苏省地理信息资源开发与利用协同创新中心,南京 210023)
(2: Jiangsu Provincial Key Laboratory of Carbon and Nitrogen Cycle Process and Pollution Control, Nanjing 210023, P.R.China)
(3: Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, P.R.China)
水体富营养化是目前我国面临的重大水环境问题.沉积物是水生生态系统的重要组成部分,它既是营养物质的蓄积库又是水体中氮、磷等营养盐的重要来源,与水体富营养化密切相关[1],在沉积物中,微生物是极为敏感并易受环境影响的生物类群[2].它们不仅是系统中生物量的重要组成部分,而且也可以影响沉积物中营养物质的分布及转化,因此沉积物微生物群落结构是水体环境变化和演替的重要标志[3].沉水植物是水生生态系统中的重要组成部分,对维护健康的水生生态系统至关重要[4],它们不仅可以改善水质,同时也可以改变微生物的群落结构.
苦草(Vallisneria natans)为多年生沉水植物,是我国常见沉水植物之一,由于其生态适应性广,吸污能力和耐污性强,常被作为富营养化水体植被恢复工程的主要选用品种[5].沉水植物对微生物群落的研究多集中于比较不同沉水植物的作用.俞振飞等[6]比较了黑藻和苦草两种沉水植物对沉积物中磷的去除效率,结果表明苦草对沉积物各形态磷含量降低的影响大于黑藻;李琳琳等[7]研究表明苦草和菹草不仅可以改善水质,同时也可以显著提高水体中细菌的多样性,改变细菌的群落结构;Zhao等[8]比较了太湖3种沉水植物金鱼藻、菹草、苦草对沉积物中微生物群落的影响,结果表明不同沉水植物作用下,沉积物中微生物群落结构不同.
本文以沉水植物苦草为研究对象,应用磷脂脂肪酸(PLFAs)分析方法研究了在苦草的不同生长时期,表层沉积物中的微生物群落结构变化特征,以深入了解沉水植物生长过程对沉积物中微生物的影响,以期为浅水湖泊沉积物内源释放的微生物作用机理提供依据.
1 材料与方法 1.1 实验材料构建室内模拟生态系统:选取高密度聚乙烯桶(顶直径×底直径×高=55cm×45cm×75cm),内放置聚乙烯小桶(顶直径×底直径×高=10cm×10cm×20cm).苦草取自南京采月湖,在温室内驯化15 d.沉积物分别过100目筛去除其中的植物残体、石块等杂质后, 平铺于聚乙烯小桶.然后选取生长状况基本一致、长势良好驯化后的苦草进行移栽,每小桶8株苦草.实验组设置6个平行样,没有种植苦草的对照组设置3个平行样.实验在江苏省环境演变与生态建设重点实验室的水环境生态修复中试平台玻璃房内进行,实验时间为2013年6-12月,分别在生长初期(第20 d)、生长旺盛期(第80 d)、衰亡期(第160 d)采集样品,每次采集6个实验组平行样和3个对照组平行样,6个实验组平行样中3个用来分析苦草根系生长状况,另外3个用来研究苦草对沉积物微生物群落结构的影响.由于前3cm的表层沉积物中苦草根系的生物量分配质量分数达到50%,因此选取前3cm作为研究对象.将采集的新鲜样品分成2份.一份立即处理测定微生物活性,测定前除去沉积物样品中可见植物残体.另一份经冷冻干燥后在-70℃保存,一周内完成PLFAs及磷形态测定.
1.2 分析项目与测定方法含水率通过测定105℃烘干至恒重时的失重获得(GB 7172-1987);烧失率通过950℃灼烧1 h达恒定质量后,测定失重获得(GB 7876-1987);有机质含量通过烧失率获得[9-10].
沉积物中总磷的分析采用Ruban等[11-12]在欧洲标准测试委员会框架下发展的SMT分离方法.
底泥中微生物活性采用FDA(荧光素双醋酸酯)法[13],称取2 g左右湿沉积物于50 ml的反应管中,加入15 ml 60 mmol磷酸盐缓冲液(pH=7.6)后再加入0.2 ml FDA溶液,启动反应.不添加FDA底物作为空白对比.混合均匀后在30℃下100转/min摇床培养20 min.培养结束后,立即加入体积比为2:1的氯仿/甲醇15 ml,以终止反应并摇匀.2000转/min离心3 min,提取上清液并过滤,490nm下测吸光度.转换成单位质量干泥的活性强度.
PLFAs由Agilent GC7890A GC相色谱仪及MIDI Sherlock®全自动脂肪酸微生物鉴定系统检测:色谱柱:P/N 19091J-413;HP-5毛细柱:30 m,320μm×0.25μm;GC条件:进样口温度250℃,柱温300℃,载气为高纯氮气(20 ml/min),不分流进样,进样量1μl.PLFAs标样选用Supelco公司的Bacterial Acid Methyl Esters Mix和478852-U内含37种FAMEs(fatty acid methyl esters)脂肪酸甲酯混合标样, 可涵盖沉积物中常见微生物的特征PLFAs.
脂肪酸的命名:以“X:YωZ(c/t)”表示, 其中“X”代表脂肪酸分子的碳原子总数, “Y”代表不饱和烯键的数目, “Z”为烯键或环丙烷链的位置, “ω”代表烯键距离羧基的位置.前缀i(iso)表示顺式支链, a(antieso)表示反式支链,“cy”代表环丙基支链,后缀“c”和“t”分别代表顺式和反式双键.特征脂肪酸是不同微生物类群的生物标志物,根据现有的研究成果总结,细菌源脂肪酸为14:0、15:0、16:0、17:0、i15:0、a15:0、il6:0、16:1ω9、il7:0、cyl7:0;真菌源脂肪酸以18:1ω9c+t、18:2ω6c+t、18:3ω3表示;革兰氏阴性菌(G-)以cy17:0表示;革兰氏阳性菌(G+)以il5:0、al5:0、il6:0和il7:0表示[14].
数据用统计软件SPSS 17.0进行单因素方差分析(One way ANOVA),以比较实验组与对照组间差异的显著性;用PRIMER 5对PLFA数据进行MDS和SIMPER分析.
2 结果与分析 2.1 苦草的不同生长时期对沉积物有机质及磷的影响从苦草生长初期到旺盛期,沉积物的含水率发生显著变化(P < 0.05),在生长旺盛期达到57.93%.含水率的大小直接影响到磷在沉积物与上覆水之间的重新分配[15].苦草对沉积物中的磷有一定的吸收能力,从生长初期到旺盛期,沉积物中的总磷、有机磷、无机磷的含量都显著下降(P < 0.05).有机质含量呈先下降再上升的趋势(表 1).生长初期到旺盛期有机质含量下降,可能是由于有机质腐解过程中,微生物优先利用易降解的有机物和简单的有机物(可溶性糖、淀粉、有机酸等)进行生命活动,有机碳的分解速率加快;而在后期随着沉水植物的衰亡有机质含量快速增加,是苦草在衰亡期有一定的残体沉积引起的.植物残体等的沉积是沉积物有机质的主要来源,占有机质来源的90%以上[16].
| 表 1 苦草不同生长时期沉积物理化指标* Tab.1 The physical and chemical indicators of sediment at different growth stages of Vallisneria natans |
沉积物中的有机质与沉积物-水界面磷的生物地球化学循环密切相关[17],有机质的矿化过程能导致沉积物中氧化还原电位和pH值的改变, 从而影响沉积物中磷化合物的吸附解析和相互转化过程[18].从苦草生长前期到旺盛期总磷含量快速下降,可能是因为沉水植物在生长过程中可以通过茎、叶和根系吸收上覆水和沉积物中的磷,以合成体内的蛋白质、核酸和酶等物质来满足自身生长的需求[19].苦草是一种根系发达的沉水植物,对营养盐的吸收能力较强,因此,在前期沉积物中总磷的含量快速下降.在后期随着苦草的生长速度缓慢直至衰亡,对沉积物中营养盐的吸收量减少,因此后期总磷含量呈缓慢下降趋势.
2.2 苦草的生长对沉积物微生物活性的影响从图 1可以看出,从苦草生长初期到旺盛期,沉积物微生物活性显著上升(P < 0.05),实验组微生物活性由生长初期的238.73 μg/(g·h)上升到旺盛期的299.42 μg/(g·h).在生长初期和旺盛期,实验组的沉积物微生物活性大于对照组,而在衰亡期空白组的沉积物微生物活性略高于实验组.这可能是由于植物根系分泌物含有较高浓度的糖类、氨基酸和维生素等物质,为根际微生物的生存和繁殖提供所需的营养和能源物质,从而影响根际微生物的数量和活性[6].对照组的沉积物微生物活性随时间的变化逐渐上升,从最初的210.43 μg/(g·h)上升到结束时的299.46 μg/(g·h),这可能与温度和微生物种群有关,对照组没有苦草等其他外界的干扰,微生物群落结构向着有利方向改变,适合生长的微生物种群能够快速生长[20].孙芳等[21]提出底泥中的微生物活性(FDA)和碱性磷酸酶活性(APA)能够影响底泥中氮、磷营养盐形态转换,碱性磷酸酶的分泌主要受微生物活性的影响,即APA与FDA活性之间相关性极显著,而APA与磷含量变化趋势呈显著正相关,因此可以推断微生物活性与磷含量也呈正相关.而本实验结果却得出实验组微生物的活性与总磷呈极显著负相关(P < 0.01).高光等[22]也认为APA与磷浓度呈负相关, 这是由于当水体中磷浓度较低时, APA得以激发.
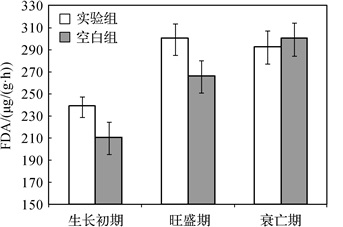
|
图 1 苦草不同生长时期对沉积物微生物活性的影响 Fig.1 Impact of sediment microbial activity at different growth stages of Vallisneria natans |
应用PLFAs技术分析了苦草不同生长时期表层沉积物微生物群落结构的变化.整个生长周期共检测出C10~C20共60种脂肪酸,其中旺盛期检测出47种脂肪酸,而衰亡期检测出36种脂肪酸,检测出的脂肪酸种类随苦草的生长而减少,可能是由于沉水植物的生长吸收了大量的营养盐,导致微生物种类降低[4].对指示不同微生物类群的特征脂肪酸进行归纳和总结, 可以将为生物群落分为细菌、真菌、放线菌3大类, 其中细菌还可以分为G+、G-、好氧菌等几类.从图 2可以看出,在整个苦草生长周期沉积物中细菌占主要成分,且在细菌中G+占主要优势,而G-则随苦草的生长呈下降趋势.一般认为G-大多对养分变化比其它类型的微生物敏感[23], G+/G-比值与沉积物的有机质含量呈负相关, 沉积物的有机质含量越高, 则G+/G-比值越小[24],这与本实验在衰亡期有机质含量增加而G+/G-增加不相符,可能是因为在衰亡期温度下降和苦草残体的分解影响了沉积物微环境.在3个不同时期G+/G-比值依次增加,这可能是由于苦草在生长过程中对沉积物中有机质的吸收使可利用碳源减少,这与裴雪霞及李越蜀等的研究相一致[23, 25].
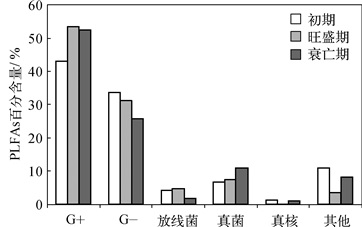
|
图 2 苦草不同生长时期各类微生物的PLFAs百分含量 Fig.2 The percentage of all kinds of PLFAs at different growth stages of Vallisneria natans |
通过沉积物微生物特征与理化性质的相关性分析(表 2),表明G-与有机磷、无机磷都呈显著正相关,而G+与总磷和无机磷呈显著负相关,可能由于底泥微生物群落是推动氮、磷循环转化的主要因素,微生物群落活性及多样性的升高有助于氮、磷元素的固定以及沉积物自净能力的提高[3],这与董黎明等[26]的研究结果相一致,说明磷可能是影响沉积物中微生物群落结构及丰富度的限制性营养因素.
| 表 2 沉积物微生物含量与理化性质的相关性分析 Tab.2 Correlations between microbiological contents and physicochemical properties in sediment |
在苦草3个生长时期检测到PLFAs包括饱和脂肪酸、支链脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸等,其中,饱和脂肪酸包括12:0、13:0、14:0、16:0、17:0、18:0,这6种是沉积物中含量最丰富的脂肪酸种类,其相对含量为19.1% ~49.9%.对苦草不同生长时期PLFAs数据进行MDS(多维标度法)分析可以看出,在苦草不同生长时期,沉积物微生物群落结构发生了明显变化,微生物的组成结构差异显著(R=0.678,P < 0.01,图 3).进一步对PLFAs数据进行SIMPER分析得出:3个不同时期共同的脂肪酸主要有16:0、15:0 iso、15:0 anteiso、16:1 w7c、18:1 w7c等,从差异度来讲,生长初期与旺盛期差异度为25.89%,与衰亡期的差异度为44.42%,而生长旺盛期与衰亡期的差异度为44.76%,由此可以看出,在苦草生长的不同时期沉积物的微生物群落结构发生了明显的变化.

|
图 3 苦草不同生长时期沉积物微生物群落结构变化 Fig.3 Changes of microbial community structure in sedimentat different growth stages of Vallisneria natans |
在苦草不同生长时期对照组的微生物群落结构也发生了一定的改变(图 3),可能由于随时间的变化,温度、光照等外界环境的改变促使微生物群落结构向着有利方向改变[27],对PLFAs数据进行SIMPER分析得出:不同时期共同的脂肪酸主要有16:0、16:1 w7c、15:0 iso、15:0 anteiso等,从差异度来讲,生长初期与旺盛期差异度为26.41%,与衰亡期的差异度为34.54%,而生长旺盛期与衰亡期的差异度为31.33%,与实验组不同时期的差异度相比明显降低,这可能是由于苦草根系的分泌物为微生物的生长提供碳源,根系对水分的吸收改变底泥通风状态,从而影响气体和溶解态营养物质的扩散,且苦草能够从大气中输送不同的气体(氧气、气态氮)到底泥中去[28],同时,植物通过根系分泌物向沉积物中输入大量酶和生长因子,可以改善微生物群落结构,促进其良性发展[29].而微生物的生长繁殖及活性也受到温度变化的显著影响,植物在不同季节的生长状况和代谢活动不同,对有机质的吸收利用存在差异, 导致植物根际微生物群落的变化[30],同时由于根系的分泌物和脱落物对微生物具有选择和富集的作用,必然导致植物根际微生物群落多样性的变化[31].
3 结论1) 苦草可以有效地减少沉积物中有机质及磷含量,衰亡期磷含量显著低于生长初期(P < 0.05),生长初期到衰亡期总磷、有机磷、无机磷分别下降8.97%、7.81%、10.28%.
2) 从苦草生长初期到旺盛期微生物活性显著上升(P < 0.05),实验组的微生物活性大于对照组,说明沉水植物对沉积物微生物活性有一定影响;在衰亡期,对照组的微生物活性略高于实验组,可能是由于根际分泌物的影响.
3) 沉水植物的生长可以增加沉积物中革兰氏阳性菌的百分含量,同时降低革兰氏阴性菌的百分含量,改变其微生物群落组成及生态学功能.相关性分析表明革兰氏阳性菌与总磷、无机磷呈显著负相关,而革兰氏阴性菌与有机磷、无机磷呈显著正相关,磷可能是影响沉积物中微生物活性及群落结构的限制性营养因素.
致谢: 南京师范大学地理科学学院韩城博士、范婤博士、张丁予硕士等在采样和分析中给予帮助, 在此表示感谢!| [1] |
金相灿. 沉积物污染化学. 北京: 中国环境科学出版社, 1992.
|
| [2] |
Cotner JB, Biddanda BA. Small players, large role: microbial influence on biogeochemical processes in pelagic aquatic ecosystems. Ecosystems, 2002, 5(2): 105-121. DOI:10.1007/s10021-001-0059-3 |
| [3] |
朱亮, 孙凌宇, 储如花等. 城市纳污河流沉积物微生物群落结构特征. 水科学进展, 2013(1): 132-137. |
| [4] |
Hilt S, Gross EM. Can allelopathically active submerged macrophytes stabilise clear-water states in shallow lakes?. Basic and Applied Ecology, 2008, 9(4): 422-432. DOI:10.1016/j.baae.2007.04.003 |
| [5] |
宋玉芝, 杨美玖, 秦伯强等. 苦草对富营养化水体中氮磷营养盐的生理响应. 环境科学, 2011, 32(9): 2569-2575. |
| [6] |
陈晓娟, 吴小红, 刘守龙等. 不同耕地利用方式下土壤微生物活性及群落结构特性分析:基于PLFA和MicrorespTM方法. 环境科学, 2013, 34(6): 2375-2382. |
| [7] |
李琳琳, 汤祥明, 高光等. 沉水植物生态修复对西湖细菌多样性及群落结构的影响. 湖泊科学, 2013, 25(2): 188-198. DOI:10.18307/2013.0203 |
| [8] |
Zhao D, Liu P, Fang C et al. Submerged macrophytes modify bacterial community composition in sediments in a large, shallow, freshwater lake. Canadian Journal of Microbiology, 2013, 59(4): 237-244. DOI:10.1139/cjm-2012-0554 |
| [9] |
John B. A comparison of two methods for estimating the organic matter content of sediments. Journal of Paleolimnology, 2004, 31(1): 125-127. DOI:10.1023/B:JOPL.0000013354.67645.df |
| [10] |
朱广伟. 水动力作用与浅水湖泊磷的内源负荷研究. 中国科学院南京地理与湖泊研究所(博士后研究工作报告), 2003.
|
| [11] |
Ruban V, Brigault S, Demare D et al. An investigation of the origin and mobility of phosphorus in freshwater sediments from Bort-Les-Orgues Reservoir, France. Journal of Environmental Monitoring, 1999, 1(4): 403-407. DOI:10.1039/a902269d |
| [12] |
Ruban V, Lopez-Sanchez JF, Pardo P et al. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-a synthesis of recent works. Fresenius' Journal of Analytical Chemistry, 2001, 370(2/3): 224-228. |
| [13] |
Schnürer J, Rosswall T. Fluorescein diacetate hydrolysis as a measure of total microbial activity in soil and litter. Applied and Environmental Microbiology, 1982, 43(6): 1256-1261. |
| [14] |
孙芳, 郑忠明, 陆开宏等. 铜锈环棱螺(Bellamya aeruginosa)生物扰动对藻华水体沉积物微生物群落结构的影响. 海洋与湖沼, 2012(2): 357-362. DOI:10.11693/hyhz201202025025 |
| [15] |
朱广伟, 高光, 秦伯强等. 浅水湖泊沉积物中磷的地球化学特征. 水科学进展, 2003, 14(6): 714-719. |
| [16] |
朱广伟, 陈英旭. 沉积物中有机质的环境行为研究进展. 湖泊科学, 2001, 13(3): 272-279. DOI:10.18307/20010312 |
| [17] |
易文利. 有机质对磷素在沉积物-水-沉水植物间迁移转化的影响[学位论文]. 杨凌: 西北农林科技大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008102436.htm
|
| [18] |
Wang S, Jin X, Zhao H et al. Effect of organic matter on the sorption of dissolved organic and inorganic phosphorus in lake sediments. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2007, 297(1): 154-162. |
| [19] |
王立志. 沉水植物对湖泊沉积物-上覆水中磷迁移转化的影响[学位论文]. 南京: 南京师范大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10319-1011187572.htm
|
| [20] |
杨磊, 林逢凯, 胥峥等. 底泥修复中温度对微生物活性和污染物释放的影. 环境污染与防治, 2007, 29(1): 22-25. |
| [21] |
孙芳, 郑忠明, 陆开宏等. 底泥微生物活性对蓝藻水华水柱及沉积物间隙水氮磷分布的影响. 生态科学, 2011, 30(3): 217-222. |
| [22] |
高光, 秦伯强, 朱广伟等. 太湖梅梁湾中碱性磷酸酶的活性及其与藻类生长的关系. 湖泊科学, 2004, 16(3): 245-251. DOI:10.18307/2004.0309 |
| [23] |
裴雪霞, 周卫, 梁国庆等. 长期施肥对黄棕壤性水稻土生物学特性的影响. 中国农业科学, 2010, 43(20): 4198-4206. DOI:10.3864/j.issn.0578-1752.2010.20.010 |
| [24] |
Peacock AG, Mullen MD, Ringelberg DB et al. Soil microbial community responses to dairy manure or ammonium nitrate applications. Soil Biology and Biochemistry, 2001, 33(7): 1011-1019. |
| [25] |
李越蜀, 郑忠明, 翟海佳等. 不同模式凡纳滨对虾(Litopenaeus vannamei)养殖池塘沉积物酶活性及其微生物群落结构分析. 海洋与湖沼, 2012, 43(6): 1154-1260. |
| [26] |
董黎明. 利用磷脂脂肪酸表征白洋淀沉积物微生物特征. 中国环境科学, 2011, 31(11): 1875-1880. |
| [27] |
白震, 何红波, 解宏图等. 施肥与季节更替对黑土微生物群落的影响. 环境科学, 2008, 29(11): 3230-3239. DOI:10.3321/j.issn:0250-3301.2008.11.042 |
| [28] |
邢鹏, 孔繁翔, 陈开宁等. 生态修复水生植物根际氨氧化细菌的研究. 环境科学, 2008, 29(8): 2154-2159. |
| [29] |
陆松柳, 张辰, 徐俊伟. 植物根系分泌物分析及对湿地微生物群落的影响研究. 生态环境学报, 2011, 20(4): 676-680. |
| [30] |
梁威, 吴振斌, 詹发萃等. 人工湿地植物根区微生物与净化效果的季节变化. 湖泊科学, 2004, 16(4): 312-317. DOI:10.18307/2004.0404 |
| [31] |
Wasaki J, Rothe A, Kania A et al. Root exudation, phosphorus acquisition, and microbial diversity in the rhizosphere of white lupine as affected by phosphorus supply and atmospheric carbon dioxide concentration. Journal of Environmental Quality, 2005, 34(6): 2157-2166. DOI:10.2134/jeq2004.0423 |
 2015, Vol. 27
2015, Vol. 27 

