(2: 中国科学院重庆绿色智能技术研究院,重庆 400714)
(3: 中国科学院水库水环境重点实验室,重庆 400714)
(2: Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714, P. R. China)
(3: Key Lab of Reservoir Water Environment, Chinese Academy of Sciences, Chongqing 400714, P. R. China)
藻类是水生生态系统中的初级生产者,决定着淡水生态系统的能量流动和物质循环[1-2].近年来河湖普遍呈现富营养化趋势,优势藻种的疯狂繁殖打破了水生生态系统平衡,并引起一系列严重的生态环境问题,尤以蓝藻有害“水华”为甚[3-4].已有调查发现,水华鱼腥藻(Anabaena flos-aquae)是蓝藻水华中的典型优势藻种[5-6].它具有固氮功能,在氮相对匮乏、磷相对丰足的水体中易于形成优势,诱发水华并可能分泌藻毒素[7],危害环境.
光照、温度和磷浓度是影响水华鱼腥藻生长的主要生境要素.巫娟等[8]研究了光照对水华鱼腥藻的细胞比重和藻丝长度的影响,表明光强对其细胞比重的影响总体不大,而藻丝长度对光强却反映强烈. Robarts等[9]认为温度对水华鱼腥藻光合作用、呼吸速率和生长速率的影响呈现出单峰趋势.夏建荣等[10]发现CO2浓度升高有助于水华鱼腥藻光合作用的进行,其生物量、光饱和光合速率、光合效率显著提高,但对无机碳的亲和力却降低.但目前仍鲜见对水华鱼腥藻在光强、温度、磷浓度等多重生境要素交互作用下的生长动力学研究.在不同磷浓度条件下,本研究选择不同的光照、温度梯度,对水华鱼腥藻进行室内培养.在求取Monod模型参数基础上,基于Lehman模型和Steele模型建立水华鱼腥藻“磷-光强”和“磷-温度”协同变化条件下的生长动力学模型,为水华鱼腥藻生态过程预测提供依据.
1 材料与方法 1.1 材料所用化学试剂均为分析纯试剂;水华鱼腥藻FACHB-245购自中国科学院水生生物研究所.
1.2 方法 1.2.1 水华鱼腥藻培养以BG-11培养基为基础,采用新鲜去离子水配制成无磷培养基(其他营养盐保持充足),pH值调节至7.5左右.按实验所需质量浓度加入相应量的磷(K2HPO4),磷摩尔浓度分别设置为0、0.1、0.2、0.5、0.75、1.0、2.5、5.0 μmol/L;相对应的质量浓度分别为0、3.1、6.2、15.5、23.25、31.0、77.5、155.0 μg/L.将培养基放入灭菌锅,在121℃下高压蒸汽灭菌30 min.将藻种扩大培养1周,饥饿培养48 h,取一定体积培养液(含藻种)以4200转/min的速度离心15 min,移走上清液后加适量碳酸氢钠溶液(15 mg/L)洗涤后离心,重复洗涤3次,用无菌水稀释后接种,保持初始藻密度为3×105cells/ml左右[11].
采用250 ml三角瓶进行藻的序批培养,实验条件参考表 1设置,光暗比12 h:12 h,每个样品设置两个平行,培养期间每天人工摇动3~4次.每天上午8:00取1.0 ml藻液至定量瓶中并加鲁哥试剂固定.采用浮游植物计数框计数,每个样品计数2次并保证其误差<5%,每次50个视野,取其平均数计算藻密度.
| 表 1 实验变量设计 Tab.1 Design of experimental variables |
基于Monod模型原理,设置8个磷营养盐(PO43--P)梯度:0、0.1、0.2、0.5、0.75、1.0、2.5、5.0 μmol/L,参照野外监测结果和文献[12-14],设置15、20、25、30℃4个温度水平和1000、2000、3000、5000 lx 4个光强水平,研究不同磷浓度下温度和光强变化对水华鱼腥藻生长的影响.藻类采用序批式培养,为避免3类环境变量交互影响,采用单因素实验设计,具体方案如表 1所示.
1.2.3 模型(1) Monod生长动力学模型.
Monod动力学方程用于描述微生物生长速率与营养盐浓度的关系,适用于稳态状况下细胞外环境营养盐浓度与生物增长之间的动力学描述[15-16].在藻类生态学领域,针对不同藻种及各种营养盐形态,许多学者对Monod方程进行了广泛深入的研究,并认为该模型能定量描述稳态时营养盐限制条件下藻类增长速率与外环境营养盐水平之间的关系[17].
| $ \mu = \frac{{{\mu _{\max }} \cdot S}}{{{K_{\rm{S}}} + S}} $ | (1) |
式中,μ为藻类比生长速率(d-1);μmax为最大比生长速率(d-1);S为限制性营养盐浓度(μg/L);KS为半饱和常数(μg/L),即当藻类比生长速率达到最大比生长速率一半时的限制性营养盐浓度.根据该动力学方程可以作图求出藻类的动力学参数μmax和KS.
应用Leneweaver-Burk作图法[18],将Monod方程两边分别取倒数得到公式(2),通过最小二乘法求得回归直线斜率KS/μmax和截距1/μmax,最终求解动力学参数KS和μmax值.
| $ \frac{1}{\mu } = \frac{{{K_{\rm{S}}}}}{{{\mu _{\max }}}} \cdot \frac{1}{S} + \frac{1}{{{\mu _{\max }}}} $ | (2) |
在Monod模型基础上,为进一步建立藻类在不同温度、光强下的生长动力学,还需其他动力学模型的协助.最常用的是Lehman温度限制生长模型和Steele光强限制生长模型.通过Lehman模型和Steele模型不仅可以分别求出动力学参数,对藻类进行动力学模型研究,而且还能得到藻类的最适生长温度和光强.另外,3个模型得到的动力学参数之间可以相互印证,从而进一步验证模型对藻类生长动力学研究的适用性和模型间的互通性.
(2) Lehman温度限制生长模型.
Lehman模型用以描述连续温度变化下微生物的生长动力学:
| $ {\mu _{{\rm{m}}T}} = \frac{{{\mu _{{\rm{max}}}}\cdot S}}{{{K_{\rm{S}}} + S}}\exp ( - 2.3({T_{{\rm{opt}}}} - T)/T_{\rm{m}}^2) $ | (3) |
式中,μmT为T温度下藻类比生长速率(d-1),Topt是最佳生长温度(℃),T是藻类生长温度(℃),Tm为最佳生长温度与最低生长温度的差值(℃),其余参数同上.运用非线性回归方法求出模型参数.
(3) Steele光限制动力学模型.
为揭示光照强度由低向高连续变化下水华鱼腥藻的生长速率响应特征,本研究运用Steele模型对光强、磷含量水平和水华鱼腥藻生长速率三者间关系进行分析.
| $ {\mu _{{\rm{m}}L}} = \frac{{{\mu _{{\rm{max}}}}\cdot S}}{{{K_{\rm{S}}} + S}}\left( {\frac{I}{{{I_{\rm{k}}}}}{\rm{exp}}\left( {1 - \frac{I}{{{I_{\rm{k}}}}}} \right)} \right) $ | (4) |
式中,μmL为L光强下藻类比生长速率(d-1),I为光照强度(lx),Ik为饱和光强(lx),其余参数同前.运用非线性回归方法求出模型参数.
2 结果与讨论 2.1 不同光强、温度条件下水华鱼腥藻密度变化特征从不同光强、温度条件下水华鱼腥藻密度的变化特征可以看出(图 1),水华鱼腥藻的生长过程主要分为3个阶段:适应期、指数增长期和衰亡期;在不同磷浓度条件下,水华鱼腥藻在指数增长期内均呈现出明显的指数生长趋势;在光照实验下,水华鱼腥藻的指数增长期(第3~7 d)相比温度实验下的指数增长期(3~8 d)略短,且各磷浓度下藻类增长较缓慢;高光强下水华鱼腥藻指数增长期短于低光强;当磷营养盐浓度越高时,水华鱼腥藻密度越大,实验中水华鱼腥藻在低于1 μmol P/L浓度条件下,细胞数量增长较为缓慢.随着温度和光照强度的升高,水华鱼腥藻的现存最大密度逐渐增大,分别在20℃和3000 lx条件下达到最大值,随后,温度和光强的增高则会抑制水华鱼腥藻的生长;高光强下,高浓度磷条件下水华鱼腥藻对光强的耐受能力强于低浓度磷;在5000 lx、0~1.0 μmol P/L磷浓度下,水华鱼腥藻密度在第6 d已达最高值,而在2.5~ 5.0 μmol P/L内其在第7 d仍处于稳定生长期.
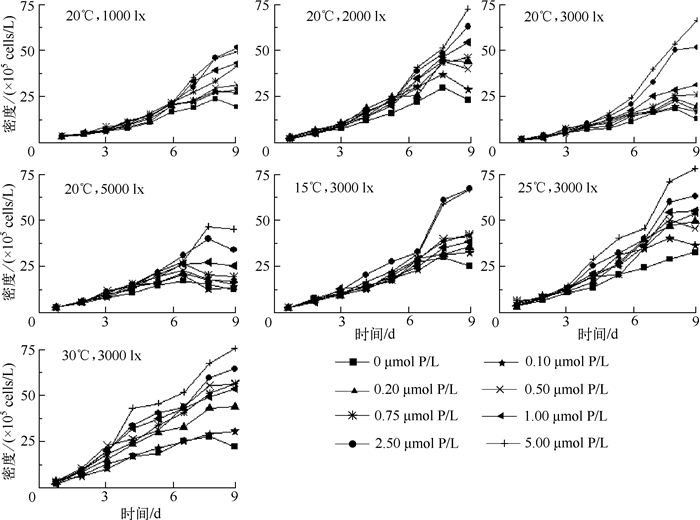
|
图 1 不同温度、光强条件下水华鱼腥藻密度变化 Fig.1 Density variations of Anabaena flos-aquae under different temperature and light intensity conditions |
Monod生长动力学方程计算得到的水华鱼腥藻在各磷浓度下不同光照、温度影响时的动力学参数可知,水华鱼腥藻的最大比生长速率μmax在15、20、25和30℃下分别为0.380、0.447、0.384和0.355 d-1,随着温度升高,μmax呈现出先增大后减小的单峰趋势,20℃时达到最高(表 2).半饱和常数KS变化趋势与μmax相似,15、20、25和30℃下,水华鱼腥藻KS分别为0.044、0.081、0.040和0.021 μmol P/L.光强为1000、2000、3000和5000 lx条件下,水华鱼腥藻最大比生长速率分别为0.349、0.407、0.447、0.371 d-1.随着光强升高,μmax并未出现一直增大的趋势,而是在3000 lx达到最高,光强继续增强则将对水华鱼腥藻生长产生一定的抑制作用,导致μmax下降.随光强的升高,半饱和常数KS的变化趋势与μmax相似,1000、2000、3000和5000 lx下,水华鱼腥藻KS分别为0.025、0.034、0.081、0.035 μmol P/L(表 2).综上,可得出水华鱼腥藻的最适生长温度和光强分别为20℃和3000 lx.虽然Monod方程能够较好地描述各温度和各光强下的水华鱼腥藻生长速率与PO43--P间的动力学关系,但却只能得到实验选定的一系列光热条件中的某一温度和光强为生长最适值,不能描述温度和光照连续变化条件下水华鱼腥藻的生长情况,因而不能获得更细的最适生长温度和光强值.
| 表 2 不同温度、光强下Monod动力学参数结果 Tab.2 Kinetic parameters of Monod model under different temperature and light intensity conditions |
Lehman模型拟合得到的拟合结果见图 2.为保证拟合度,对Lehman模型拟合结果进行显著性检验,其残差平方和RSS=0.082,决定系数R2=0.60,表明拟合效果较好. Lehman模型拟合得到4个动力学参数μmax、KS、Topt、Tm分别为0.421±0.011 d-1、0.055±0.009 μmol P/L、21.22±0.98℃、8.12±2.21℃.回归分析结果表明,温度连续变化下水华鱼腥藻比生长速率随温度增高(0~50℃)呈现出先增大后减小的单峰趋势,在最佳生长温度(21.22±0.98℃)处达到最大值.
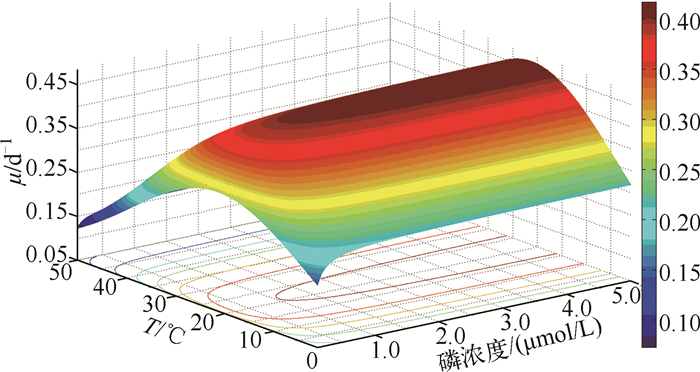
|
图 2 不同温度下的Lehman模型拟合 Fig.2 Nonlinear fitting on Lehman model under different temperatures |
运用藻类生长模型中的有光抑制的指数模型Steele模型(式4)对光强、PO43-含量水平和水华鱼腥藻生长速率三者间关系进行分析,以求得水华鱼腥藻在光照、PO43-连续变化条件下的生长动力学参数.模型拟合结果见图 3.为了检验各参数估计值是否具有可信性,对Steele模型进行显著性检验,得到其残差平方和RSS=0.103,决定系数R2=0.448.3个动力学参数μmax、KS、Ik分别为0.461±0.010 d-1、0.051±0.009 μmol P/L、2650.93±88.19 lx.回归分析结果表明,在不同磷浓度条件下,光强连续变化时水华鱼腥藻的最适生长光强约为2650.93±88.19 lx.
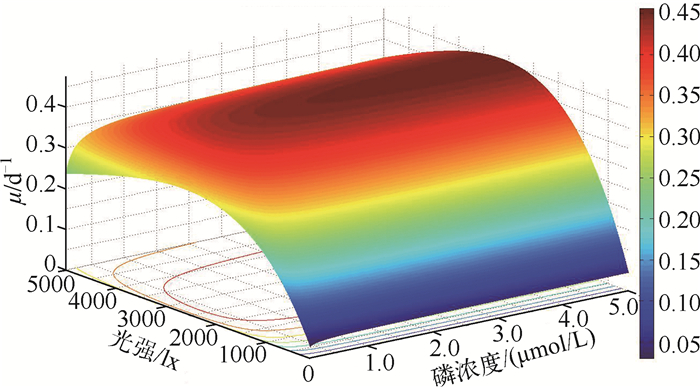
|
图 3 不同光强下的Steele模型拟合 Fig.3 Nonlinear fitting on Steele model under different light intensities |
Monod方程是描述稳态下限制性营养盐浓度与藻类生长速率间关系的重要动力学模型,Lehman模型和Steele模型则可以分别用于描述温度和光强由低向高连续变化下水华鱼腥藻生长速率的响应特征.通过Monod动力学方程、Lehman模型和Steele模型的拟合计算可以得到不同磷浓度和不同光、热条件下水华鱼腥藻的生长动力学参数μmax与KS,还可以得到温度和光照从低到高连续变化过程中水华鱼腥藻的最适生长温度和光强. μmax和KS作为主要的动力学参数具有一定的生物学意义,μmax为限制性底物浓度足够充裕时(趋向无穷大)藻类的比生长速率;KS则通常用以衡量藻类对底物营养盐的亲和性[19].对不同营养盐水平下的μmax和KS进行对比,可以推测出藻类在不同营养盐限制下的生长状况和藻类的最适宜生长条件.
Monod模型拟合结果表明,水华鱼腥藻μmax和KS在15~30℃内呈现出先增大后减小的单峰趋势,20℃时分别达到最大值0.447 d-1、0.081 μmol P/L;光强为1000~5000 lx下,水华鱼腥藻μmax和KS均呈先增大后减小的趋势,在光强为3000 lx时达到最大值. Lehman拟合结果表明,不同磷浓度条件下温度从低到高连续变化时,动力学参数μmax、KS、Topt分别为0.421±0.011 d-1、0.055±0.009 μmol P/L、21.22±0.98℃,由图 2可知水华鱼腥藻的最大比生长速率呈先增大后减小的单峰趋势,在20~25℃内水华鱼腥藻比生长速率始终维持在较高水平,这可能与温度对酶的活性影响有关,低温抑制酶活性而高温则使酶失活,因而低温和高温条件下酶的活性都不高,从而影响其催化的酶促反应速率. Foy等[14]的研究表明水华鱼腥藻在温度高于25℃以后生长将受到抑制,本文的拟合结果与其一致.
Steele模型拟合得到3个动力学参数μmax、KS、Ik分别为0.461±0.010 d-1、0.051±0.009 μmol P/L、2650.93±88.19 lx,和Lehman模型拟合结果有着相同的单峰趋势,在光强为2650.93±88.19 lx时μmax达到最大值(图 3),这与Litchman[12]和de Nobel等[20]的研究结果相近.出现单峰可能与藻类的光合作用相关,低光照时,由于缺乏光合作用所需能量使得μmax较低;而当光照强度太强时,水华鱼腥藻则容易被光杀死,因而其μmax也很小.这可能与光照对水华鱼腥藻藻丝(水华鱼腥藻浮沉关键因子)的影响有关[8].此外Oliver等[21]研究表明:将水华鱼腥藻从低光照移至高光照环境其浮力明显减小,认为这是由过大的光强导致水华鱼腥藻体内伪空胞破裂造成的.此外,对比3个模型拟合结果可以看出,3个模型分别拟合得到的水华鱼腥藻最大比生长速率μmax和半饱和常数KS并无显著性差异,其中Lehman模型和Steele模型结果更接近,而二者与Monod模型拟合结果相差稍大,这可能是由于Lehman模型和Steele模型都是描述水华鱼腥藻对连续变化的生境要素的响应,而Monod模型则是用于拟合藻对离散的光强和温度响应的缘故.同时,通过对比Lehman拟合图和Steele拟合图可以看出,虽然不同磷浓度条件下μmax变化趋势一致,但PO43--P浓度较低时(约为<1.0 μmol/L),水华鱼腥藻的μmax明显低于高PO43--P浓度条件下的μmax值,这可能是由于磷是水华鱼腥藻生长的限制性营养盐,低磷浓度时水华鱼腥藻处于磷限制状态,生长缓慢.低磷浓度下,水华鱼腥藻不耐高光强,这可能是由于光照强度增强时,多糖的生成增加,使得其自身重量增加,水华鱼腥藻失去了伪空胞的浮力调节作用[22].
春季蓝藻水华的出现与蓝藻对温度和光照的响应有关,温度被认为是影响蓝藻复苏和优势藻种形成的重要因素[23],同时,光照则为水华鱼腥藻的光合作用提供能量支持.水华鱼腥藻生长动力学模型研究结果为解释水华鱼腥藻多于夏末春初暴发提供了理论依据[24-25].
3 结论μmax是限制性底物浓度足够充裕时(趋向无穷大)藻类的比生长速率,表征藻类的最大生长能力;KS则可以衡量藻类对底物营养盐的亲和性.通过比较不同藻类μmax和KS,可以得知不同藻种对同一营养盐的需求和亲和性. Monod模型表明,水华鱼腥藻的μmax和KS随温度的增大而增大,20℃时分别达到最大值0.447 d-1和0.081 μmol P/L;光强对水华鱼腥藻的μmax和KS影响亦呈单峰趋势,光强为3000 lx时最大.
从Lehman和Steele动力学模型不仅可以得到相应的藻类生长动力学参数,而且还可以得到藻类比生长速率随温度和限制性营养盐、光照和限制性营养盐连续变化时的变化趋势.由Lehman模型计算得到μmax和KS分别为0.421±0.011 d-1、0.055±0.009 μmol P/L,Topt为21.22±0.98℃;Lehman模型拟合表明随着温度升高(0~50℃),其比生长速率先增大后减小. Steele动力学模型拟合结果表明μmax、KS分别为0.461±0.010 d-1、0.051±0.009 μmol P/L,Ik为2650.93±88.19 lx;Steele模型拟合表明,水华鱼腥藻的比生长速率与光强(0~5000 lx)亦呈先增大后减小的单峰趋势.
| [1] |
Baines SB, Pace ML. The production of dissolved organic matter by phytoplankton and its importance to bacteria: patterns across marine and freshwater systems. Limnology and Oceanography, 1991, 36(6): 1078-1090. DOI:10.4319/lo.1991.36.6.1078 |
| [2] |
Borsheim KY, Vadstein O, Myklestad SM et al. Photosynthetic algal production, accumulation and release of phytoplankton storage carbohydrates and bacterial production in a gradient in daily nutrient supply. Journal of Plankton Research, 2005, 27(8): 743-755. DOI:10.1093/plankt/fbi047 |
| [3] |
Zhang ZS, Mei ZP. Effects of human activities on the ecological changes of lakes in China. GeoJournal, 1996, 40(1): 17-24. |
| [4] |
姚玲爱, 赵学敏, 周广杰等. 广东省高州水库春季蓝藻水华成因初步探讨. 湖泊科学, 2011, 23(4): 534-540. DOI:10.18307/2011.0407 |
| [5] |
李哲, 方芳, 郭劲松. 三峡小江回水区段2007年春季水华与营养盐特征研究. 湖泊科学, 2009, 21(1): 36-44. |
| [6] |
贾晓会, 施定基, 史绵红等. 巢湖蓝藻水华形成原因探索及"优势种光合假说". 生态学报, 2011, 31(11): 2968-2977. |
| [7] |
张成武. 淡水蓝藻毒素研究概况. 湖泊科学, 1992, 4(3): 87-94. |
| [8] |
巫娟, 陈雪初, 孔海南. 光照度对水华鱼腥藻细胞比重与藻丝长度的影响研究. 中国环境科学, 2012, 32(5): 875-879. |
| [9] |
Robarts RD, Zohary T. Temperature effects on photosynthetic capacity, respiration, and growth rates of bloom-forming cyanobacteria. New Zealand Journal of Marine and Freshwater Research, 1987, 21(3): 391-399. DOI:10.1080/00288330.1987.9516235 |
| [10] |
夏建荣, 高坤山, 叶海波. 水华鱼腥藻生长与光合作用对大气CO2浓度升高的响应. 植物生态学报, 2002, 26(6): 652-655. |
| [11] |
郑朔方, 杨苏文, 金相灿. 铜绿微囊藻生长的营养动力学. 环境科学, 2005, 26(2): 152-156. |
| [12] |
Litchman E. Growth rates of phytoplankton under fluctuating light. Freshwater Biology, 2000, 44(2): 223-235. DOI:10.1046/j.1365-2427.2000.00559.x |
| [13] |
Chudoba J, Cech J, Farkac J et al. Control of activated sludge filamentous bulking: Experimental verification of a kinetic selection theory. Water Research, 1985, 19(2): 191-196. DOI:10.1016/0043-1354(85)90198-8 |
| [14] |
Foy RH, Gibson CE, Smith RV. The influence of daylength, light intensity and temperature on the growth rates of planktonic blue-green algae. European Journal of Phycology, 1976, 11(2): 151-163. |
| [15] |
Monod J. La technique de la culture continue, théorie et applications. Annales de Institute Pasteur Paris, 1950, 79(4): 390-410. |
| [16] |
Thomann RV, Winfield RP, Di Toro DM. Modeling of phytoplankton in Lake Ontario (IFYGL). International Assoc of Great Lakes Res, 1974, 135-149. |
| [17] |
Fuhs G, Demmerle S, Canelli E et al. Characterization of phosphorus-limited plankton algae (with reflections on the limiting nutrient concept). Am Sot Limnol Oceanogr Spec Symp, 1972, 113-133. |
| [18] |
戚以政, 汪叔雄. 生化反应动力学与反应器:第2版. 北京: 化学工业出版社, 1999.
|
| [19] |
崔启武. 生物种群增长的营养动力学. 北京: 科学出版社, 1991.
|
| [20] |
de Nobel WT, Matthijs HCP, von Elert E et al. Comparison of the light-limited growth of the nitrogen-fixing cyanobacteria Anabaena and Aphanizomenon. New Phytologist, 1998, 138(4): 579-587. DOI:10.1046/j.1469-8137.1998.00155.x |
| [21] |
Oliver RL, Walsby AE. Direct evidence for the role of light-mediated gas vesicle collapse in the buoyancy egulation of Anabaena flos-aquae (cyanobacteria). Limnology and Oceanography, 1984, 29(4): 879-886. DOI:10.4319/lo.1984.29.4.0879 |
| [22] |
Konopka A, Kromkamp J, Mur LR. Regulation of gas vesicle concept and buoyancy in light-or phosphate-limited cultures of Aphanizomenon flos-aquae(Cyanophyta). Journal of Phycology, 1987, 23(2): 70-78. |
| [23] |
Rengefors K, Karlsson I, Hansson LA. Algal cyst dormancy: a temporal escape from herbivory. Proceedings of the Royal Society of London Series B: Biological Sciences, 1998, 265(1403): 1353-1358. DOI:10.1098/rspb.1998.0441 |
| [24] |
Ohkubo N, Yagi O, Okada M. Studies on the succession of blue-green-algae, Microcystis, Anabaena, Oscillatoria and Phormidium in lake Kasumigaura. Environmental Technology, 1993, 14(5): 433-442. DOI:10.1080/09593339309385311 |
| [25] |
Laamanen M, Kuosa H, Maximum S. Annual variability of biomass and heterocysts of the N2-fixing cyanobacterium Aphanizomenon flos-aquae in the Baltic Sea with reference to Anabaena spp. and Nodularia spumigena. Boreal Environment Research, 2005, 10(1): 19-30. |
 2015, Vol. 27
2015, Vol. 27 


