(2: 中国科学院水生生物研究所, 武汉430072)
(3: Institute of Biology/Aquatic Ecology, Ecology Building, Lund University, Lund SE 22362, Sweden)
(4: 中国科学院大学, 北京100049)
(2: Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: Institute of Biology/Aquatic Ecology, Ecology Building, Lund University, Lund SE 22362, Sweden)
(4: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
功能多样性是研究生物多样性的关键因子,它不仅指示了生物在生态系统中的地位,而且愈加成为生态系统功能动力的一项重要指标[1-2].测量功能多样性通常可以通过测量任何影响物种生物学特性的功能性状(比如捕食效率、摄食、觅食策略、大小、运动方式、繁殖和栖息地)或者测量一组具有生态学意义和功能的形态学指标[2-5].形态学为生物多样性提供了一个非常有潜力的指标,它强调多样性,而不仅仅是作为分类学和系统发育的指标[6].在鱼类群落研究中,功能性形态特征研究主要集中在觅食、运动和栖息地利用3个方面[7-13],然而这些研究大多只关注鱼类的传统形态与生态变量的相关性,例如植食性鱼类与相对肠长呈正相关,而肉食性鱼类相对肠长较短[14];口裂的相对或绝对大小与食物大小呈正相关[15],也与鱼食性呈正相关[16-17];眼位、眼径、口位和口须与食物在水体中的垂直位置相关[15].使用传统的形态和生态变量可能掩盖生态形态的关系,可能因为进化史的混淆影响,或者因为这些变量与重要的功能关系不相干[18],且缺乏鱼类整体形态对于鱼类在其营养级位置(trophic position,TP)的关系研究.近年来,数字摄影和图像处理技术以及形态学统计理论的发展,使得快速、准确地处理生物体的几何形态信息成为可能,利用基于界标分析(landmark analysis)的几何形态测量法(geometric morphometrics)能够很好地解决这一问题.几何形态测量法是以生物形态的轮廓作为数据的计算方法,虽然目前尚未被国内研究者广泛采用,但自1930s变量统计学的理论成熟以来,这一方法的理论基础和软件算法在国外得到迅速发展,至今已成为近代生物学(neontology)和古生物学形态研究领域的一个常用工具.基于界标的几何形态测量依赖于二维或者三维坐标点对所研究对象的原始形状进行复原并描述其变异,并通过叠合方法(superimposition)剔除标本的摆放位置、趋向、尺寸等非形状因素的影响[19].
食物网和食物链是研究生态系统中营养关系最重要的工具,食物网描述了生态系统中生物体之间能量传递存在着一种错综复杂的网状关系,食物链描述的是包含在复杂的食物网中从初级生产者到顶级消费者之间的线性能量流动或是作用强度[20].而食物网和食物链都是定性概述有机体之间的能量流动和物质循环关系.因此,食物网和食物链在水生生态系统的定量研究对于修复、保护和管理湖泊生态系统有着重要的意义.传统方法将有机体划分营养级,营养级仅仅指示食物网中生物体的相对营养位置,并不能完全反映食物网内生物体间的营养关系,例如整数的相对营养级就无法反映食物网内的杂食现象[21].杂食性是指其食物对象可以经常变动,某一时期以某种食物为主,另一时期又可更换[22],而营养级位置是一个连续的变量,它综合考虑了食物网中杂食性、物质循环和能量流动等.本文采用肠含物定量分析法(gut content analysis,GCA)计算鱼类营养级,这种方法不仅能计算营养级位置,还可以观察到鱼类食物的具体种类[23].
研究生态形态学(ecomorphology)能够让我们更加清楚地了解生态因子(包括物理的与生物的)与功能性形态之间的关系,生态形态学有一个主要的理论假设,即一种生物的生态与其形态是相关的.这个假设主要考虑两方面:(1)在一个生态组(ecological group)内,物种形态可能是相似的,但在两个生态组间可能是不同的,这取决于物种所利用的资源属性及其利用策略;(2)形态的变化是对选择压力的响应,并导致趋同现象的出现,即系统发育上不亲近的物种具有形态的相似性[24].大多数生态形态学的研究是针对热带气候区或者北温带海洋性气候区内淡水河流或者海洋性的辐鳍鱼类(actinoptreygian fishes)[25-28],而地处于亚热带气候区的长江中下游洪泛平原湖泊,各湖泊营养条件多样,从中营养型湖泊到超富营养型湖泊[29],水文条件差异大[30],杂食性鱼类众多[31],关于鱼类生态形态学研究较少,仅有少量报道.本文通过对长江中下游泛滥平原湖泊中常见的鱼类功能性形态与对应的营养级位置的相关关系进行定量研究,以期解释亚热带区域洪泛平原湖泊中鱼类形态与其营养级位置之间的关系.
1 材料与方法 1.1 用食性数据计算营养级位置 1.1.1 收集食性数据通过大量的文献检索和二次检索从已发表的文献、数据库、鱼类志等获得鱼类食性数据,这些食性数据都是对中国河流、湖泊中的鱼类研究所得,95%以上的鱼类都是来自长江中下游及其泛滥平原湖泊.不同文献中食性数据的分类也不一样,大多是按照年份、季节、月份、鱼类个体的大小等.为了减少偏差,本文只使用成年个体的食性数据.也将同一个研究中不同时间样品数据取平均值,然后将不同研究中对同一种鱼的食性数据也求平均值.所有这116种鱼的食性数据来自226个鱼类群落,总计16267尾鱼.所有的食性数据最后都按照统一标准转换成为不同食物在鱼类肠含物中所占的重量比例[31].本研究中通过定量数据计算鱼类营养级位置的共有62种,占整个鱼类群落种类的53.4%,通过定性数据计算鱼类营养级位置的共有54种,占整个鱼类群落种类的46.6%.
1.1.2 定量数据计算鱼类的营养级位置鱼类的食性数据都是从文献和书籍中检索所得,不同文献中食性数据的表达方式不一致,分别是肠含物中各种类的重量百分比、数量百分比、质量百分比和出现率,计算鱼类营养级之前统一将出现率的数据按式(1)转化为重量百分比:
| $ {W_i} = {C_i}/\sum {{C_i}} $ | (1) |
式中,Wi是第i种食物所占的重量比例,Ci是第i种食物在某种鱼类肠含物中的出现率.
用食性数据计算鱼类营养级位置的一个必要条件是确定食物的营养级位置,因此恰当地确定肠含物中各种类的营养级位置很重要.虽然肠含物中鉴定细分到种的鱼变化多样,但还是可以根据鱼类的食性划分为如下几大类:鱼、浮游动物、杂食性底栖昆虫、肉食性昆虫、甲壳动物、软体动物、底栖性初级生产者、浮游性初级生产者(表 1).对于一些凶猛性的食鱼性鱼类,如鳜、翘嘴鲌、红鳍原鲌等,根据其具体食性细分到种.删除食性数据中的“其他”、“无法鉴定的种类”等类似无法确定的数据,重新根据剩下的各类计算它们占的比例保持和为100%.把浮游植物、植物、碎屑以及其他初级生产者的营养级位置都定为“1”,把浮游动物、软体动物、其他初级消费者的营养级位置定为“2”.对于杂食性动物,鉴于无脊椎动物复杂的营养关系到目前为止并不清楚,本文只是根据推测将杂食性无脊椎动物如端足类、十足类和杂食性昆虫的营养级都定为“2.5”,肉食性的昆虫和无法辨认种类的鱼类残体的营养级位置都定为“3”.对于凶猛性的食鱼性鱼类,如鳜、翘嘴鲌、红鳍原鲌,将“鱼”这一类细分到确定的种,所以在用食性方法计算这些鱼类之前,先将其他鱼的营养级位置计算出来,再计算这些食鱼性鱼的营养级位置.采用Winemiller[32]和Vander Zanden等[23]的方法用食性数据计算营养级位置:
| $ T{P_a} = \sum {({W_i}\cdot T{P_i})} + 1 $ | (2) |
| 表 1 假定各类食物的营养级位置比例 Tab.1 Estimated trophic position values for prey organisms applied in dietary approach calculation of fish trophic position |
式中,TPa是第α种鱼的营养级位置,Wi是第i种食物在肠含物中所占的重量百分比.尽管大多数食物种类假定的营养级位置是整数,但是由于本研究中鱼类的普遍杂食性,所以计算出的鱼类营养级位置大多是小数.
1.1.3 定性数据计算鱼类的营养级位置本研究中有些鱼类不是经济鱼类,只有少数研究者关注过它们的食性,从文献和书中很难找到这些鱼类的详细食性数据,但是一些鱼类志的作者根据野外观察记录了关于这些鱼的描述性数据.将这些描述性数据定义为定性的食性数据,根据描述中用的表示食物丰度的词语来转化为定量的比例,划分为5个等级:非常多、多、常见、偶见、很少(具体的等级归类见表 2),然后给这些等级赋值打分,“非常多”赋值为100,“多”赋值为75,“常见”赋值为40,“偶见”赋值为5,“很少”赋值为1,根据这种方法给每一类食物赋值,然后按照如下公式转化为每一类食物的在肠含物中所占的比例:
| $ {W_i} = \sum\limits_{i = 1}^n {S} $ | (3) |
| 表 2 用食性方法计算鱼类营养级比例时鱼类各类食物的贡献得分标准 Tab.2 Estimated contribution score for prey organisms applied in dietary approach calculation of fish trophic position |
式中,Wi第i种食物所占的重量比例,S是第i种食物所赋的值,某种鱼的食物的种类数.计算每种食物的比例后再按照定量食性数据的方法计算鱼类的营养级.
1.1.4 摄食功能团本文按照计算好的每种食物所占的重量百分比编排数据,参考de Mérona等[33]的方法,并按照本文的实际情况(鱼类的食物的种类)稍做改动将所研究的鱼类划分为5类摄食功能团:滤食性鱼类、肉食性鱼类、无脊椎动物食性鱼类、植食性鱼类、杂食性鱼类.具体步骤如下:
第1步:浮游生物重量占肠含物总量的70%以上的种类划分为滤食性鱼类;
第2步:鱼类和甲壳类(主要是虾和蟹)重量占肠含物总量的70%以上的种类划分为肉食性鱼类;
第3步:昆虫和软体动物的重量占肠含物总量70%以上的种类划分为无脊椎动物食性鱼类;
第4步:底栖性初级生产者的重量占肠含物总量70%以上的种类划分为植食性鱼类;
第5步:如果其它几类都不是,则划分为杂食性鱼类.
1.2 鱼类几何形态测量分析 1.2.1 图片来源本研究中涉及到116种鱼类,在初步研究中每一种鱼类选择一张标准左视图片,这一张鱼类图片代表此鱼类物种的形态,图片来自于《长江鱼类》[34]和《江苏鱼类志》[35].当多物种之间进行形态比较时,假设同种物种之间的形态差异小于物种间的形态差异.在动物学研究中,运用单个个体形态来描述整个物种的形态已经屡见不鲜.过去的研究表明,在十足类中,种间形态变异远远大于种内变异[36],在硬骨鱼纲中也有相同的结论[37-39].
1.2.2 形态特征数据提取利用基于界标分析的几何形态测量法,形态特征可以快速、精确地从数字图像中提取,数据提取结果能够在坐标轴中定量且直观地展示.每种鱼类依次选择27个界标点(图 1),界标点是指生物体形态中同源性点位,即具有的某些可被定义的解剖位点,这些界标点对物体表面形态能够足够地覆盖,能重复且稳定地出现在物体表面,且位于同一平面内.

|
图 1 用几何形态测量学分析的27个界标点位置——以马口鱼(Opsariichthys bidens)为例[34] Fig.1 Identification of 27 landmarks used in the geometric morphological analysis: An example of Opsariichthys bidens |
使用图像分析处理软件TPS Dig ver.2.16对左视图像界标点的x轴和y轴进行数字化[40]. TPS(thin plate spline)可以通过变形网格将一个形状向另外一个形状变化的具体细节可视化,于是,不同形状之间的变化可以通过描述物体网格的变形来反映.数字化后的数据在软件中用数学算法叠加(或称叠合)起来,以去除原始图片数据中标本位置、比例、角度及其他非形态变异.一旦非形态变异的干扰能够去除,形态变异的变量可作为比较不同样本间的统计工具,图形化的比较也成为可能.两个特定物体之间或者一个物体与平均图形之间的变形可以分解为统一和非统一两个成分.在两维空间里有6种统一成分,前4个是在GPA部分提到的非形状变量,分别是沿着x轴和y轴的平移、校正及旋转,他们不改变形状,而另外两个成分——压缩或扩展/修剪能够改变形状,但是在反映形状变化时不改变变形网格线的曲度,使得网格线之间始终保持平行,这在非统一成分方面是不一样的,因为后者能够反映形状内部的相对变化,所以在变形时网格线被扭曲.这样就使得非统一成分需要弯曲能量,这种能量能够衍生出一组描述形状变化的非常有效的参数——部分扭曲值(partial warp scores),它可以在比较不同物体之间形状差异的统计分析中用作形状变量.而一个相关的方法就是相对扭曲度分析(relative warp analysis,RW),该值对应于部分扭曲值的主成分分析,可以将总的变量数降低至几个主要的独立变量,这几个独立变量可以概括一个样本组的主要变异,以2或3个主成分轴(即相对扭曲度轴)将标本的关系(分布)表现出来[19].用TPS Relw ver.1.49软件完成这些操作[41].
1.3 统计分析由于鱼类的食性与其形态特征之间的相互关系错综复杂,简单的线性分析有时不足以解释两者之间的关系,需要进行非线性分析.所以本文引用广义加性模型(generalized addictive models,GAM)探讨食性与其形态特征的相互关系. GAM为广义线性模型的非参数化扩展,常被用来探察应变量与多个预测变量之间的函数形式.拟合出的加性模型总是用图形方式来表达的.本文中应变量为鱼类的营养级位置(TP),鱼类形态特征的相对扭曲度值(RW)为解释变量建立GAM模型. GAM模型的方程一般形式为:
| $ {y_i} = {\beta _0} + \sum\nolimits_j {{f_j}} ({x_{ij}}) + { \in _i} $ | (4) |
式中,j=1,…,k,fj是未指明的函数,需要非参数式予以估计.当k=1时,加性模型就退化为散点图平滑. “非参数”这个词是指函数fj不是用参数来定义的,然而,模型残差项被假设为服从正态分布.本文中GAM的建立由统计软件R ver.3.0.2中的mgcv包完成.
2 结果 2.1 食性结果计算得到的每种摄食功能群的食物比例见表 3,其中有20种肉食性鱼类,这些鱼的食物来源主要是鱼类,占食物总量的70.35%.有23种为植食性鱼类,底栖性初级生产者平均占植食性鱼类食物组成的85.68%;19种鱼划分为无脊椎动物食性鱼类,这类鱼的食物主要由无脊椎动物组成,其中杂食性昆虫平均占39.93%,肉食性昆虫平均占6.39%,软体动物平均占42.48%;最多的为杂食性鱼类,共计47种,发现杂食性鱼的食谱非常广,其中昆虫平均占27.39%,浮游生物平均占23.17%,甲壳动物平均占11.26%,其他为底栖性生产者和软体动物,分别占15.63%和11.83%;6种鱼划分为滤食性鱼类,发现浮游生物平均占它们食物组成的97.44%.食性数据计算的鱼类营养级最低的为2.40,最高为4.20.
| 表 3 不同摄食功能团鱼类的平均食性分类* Tab.3 Mean dietary data on different feeding guilds |
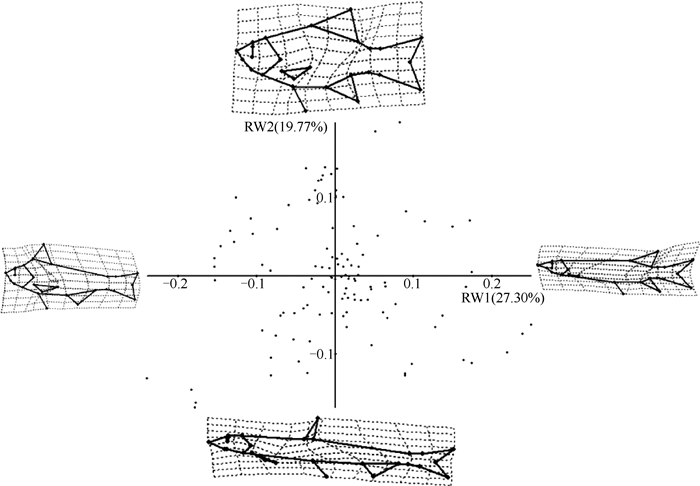
由TPS Relw软件界标点数据文件计算出的平均鱼类侧视形态以及所有样本界标点数据重叠后的效果图如图 2,相对扭曲度主成份分析提取了多达50个主成份,前3个主成份贡献率分别为27.30%、19.77%、14.67%,累积解释率为61.74%. RW1和RW2主成份得分散点图效果最好(图 3).从图 2可以看出影响第一轴的主要是体高、背鳍位置、胸鳍大小、腹鳍位置.对第二轴影响大的主要是背鳍大小、眼径大小、头高、尾柄高和体型.
|
图 2 相对扭曲度分析:前两个主轴(坐标轴四端的曲线图像为各自的极端扭曲图像) Fig.2 Relative warp analysis: Plot of the first two axes |
|
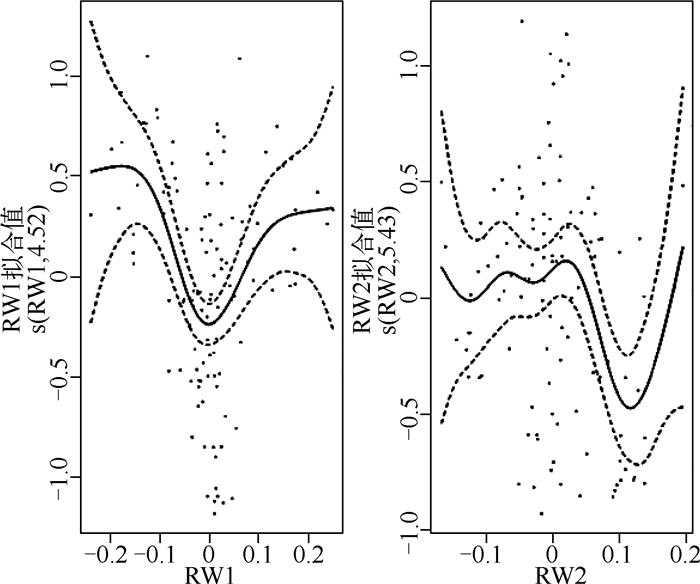
图 3 鱼类营养级位置与相对扭曲度值的GAM模型结果 Fig.3 GAM model results of fish trophic position and relative warp values |
GAM模型结果表明,以营养级位置为响应变量,RW为解释变量,显著检验显示,RW1极显著(P<0.001),RW2显著(P<0.01),两者的总解释度为41.7%.如图 3所示,当RW1<-0.15时,营养级处于相对稳定状态;随着RW1增加,营养级位置开始下降,且当RW1=0时,营养级位置处于最低,且在该位置有较多的鱼类分布;随着RW1值的增加,营养级位置升高,且当RW1>0.15时,营养级位置趋于平稳;营养级位置随着RW1增加,整体呈现先平稳后下降,再上升至一平稳值的趋势. RW2在值较低时(>0时),营养级位置呈现先下降后上升的微小波动.当0<RW2<1时,营养级位置呈下降趋势,当RW2>1时,营养级位置随RW2增加而上升.
3 讨论 3.1 长江中下游洪泛平原湖泊鱼类营养级位置分析用食性的方法计算鱼类连续的营养级位置,既能考虑杂食现象和其他营养关系,也能提供鱼类详细的食物种类的分类信息.因此,在有大量相关食性数据文献存在的情况下,用食性数据计算营养级位置是一个不错的选择.本研究的数据结果显示,在计算长江中下游洪泛平原湖泊中鱼类营养级位置时,仍会存在一些缺陷.首先,如前面方法部分所述,用肠含物方法计算鱼类的营养级位置需要假定食物的营养级位置,这个假定可能会在计算鱼类营养级位置时引入误差.例如本研究把无法辨认的鱼类残体的营养级位置定为3,本文的计算结果显示,长江中下游洪泛平原湖泊鱼类的营养级位置在2.0~4.2间变化,因此统一把无法辨认的鱼类残体的营养级位置定为3可能会影响计算结果.然而结果也显示在长江中下游这个大的集合群落中鱼类的平均营养级位置为3左右,因此本研究中将鱼类残体营养级位置定为3能代表一个平均水平.摄食功能团划分结果(表 3)显示,本研究中长江中下游鱼类群落集合中将近40%的鱼类为杂食性鱼类.杂食在水生食物网中是一个普遍现象,尤其是在鱼类群落间更常见[31, 42-44].
3.2 鱼类几何形态测量学几何形态学应用效果很大程度上取决于界标点的选择.本研究选取的27个界标点涵盖了鱼类的头部(包括口裂、眼径、头高、头长等)、鳍(鳍位置、大小、形状)、体型等整体外部信息.从图 2可以看出影响第一主轴RW1的因子主要为鳍的位置和大小,随着RW1值的增加,背鳍和腹鳍由靠近头部逐渐变为靠近尾部,尾鳍面积减少且瘦长,眼睛位置由靠上逐步变为靠下;影响第二主轴RW2的主要因子为头部形态特征和体型特征,随着RW2值的增加,眼径、头高、胸鳍面积、背鳍面积、尾柄高增加,口裂减小,叉尾程度降低,体型由梭型变为侧扁型.前两轴的解释度为47.1%,虽然解释度偏低,但是116种鱼类的散点示意图效果较好,能够很好地用前两轴去解释鱼类的整体形态.解释度偏低可能是由于界标点位数量较多,导致每个界标点位的解释率偏低,这也是几何形态测量学优于传统形态测量的地方.因为在研究初期无需预先设定界标点位置,传统形态的距离测量往往都是根据研究者的经验判断侧重于某些区域结构,这样可能导致一些重要信息的遗漏或者次要信息的干扰.而本研究中选用的界标点位几乎全面涵盖了样本所有外部形态的变化情况,以期指出结果中形态的主要变化因子.这不仅能够引导未来研究中鱼类界标点位与功能特征之间的权衡,也更有利于鱼类形态相关领域更深层次的研究[45-47].另外本研究中用于鱼类几何形态测量的图片全部是来源于《长江鱼类》[34]和《江苏鱼类志》[35]的人工描绘图,与鱼类实际形态不能完全一致,也可能导致几何形态结果产生偏差.
3.3 鱼类营养级位置与其形态之间的关系在研究长江中下游洪泛平原湖泊鱼类营养级位置与其形态之间关系时发现,当鱼类处在高营养级位置与低营养级位置时,有特化的功能性形态与之对应,当处于鱼类中型营养级位置时,无特化的功能性形态.如图 3的RW1负轴所示,即伏击型肉食性鱼类,如鳜(Siniperca chuatsi),有较大的头面积、头高,背鳍靠前,眼睛较大且靠上,纺锤形体型,这些特征都适合于伏击型鱼类的形态特征;而追击型肉食性鱼类如图 3的RW1正轴所示,该区域的鱼类身体呈梭形,背鳍和尾鳍靠后,有较深的叉尾,较长且较窄的尾柄,头部面积较小,这些形态特征都有利于鱼类在追击时能够持续加速,如翘嘴鲌(Culter alburnus)、鳤(Ochetobius elongatus)等,这些肉食性鱼类大多栖息于水体上层,食物来源基本为浮游性的小型鱼虾;偏草食性鱼类如图 3中的RW2正轴所示,有较小的口裂,身体几乎呈椭圆形,如鳑鲏类(Rhodeus sp.)[10, 25, 48]. GAM模型结果显示只有处于高营养级位置和低营养级位置才有相对稳定的形态特征与之相对应.而处于中型营养级位置的鱼类在本研究中无更多证据证明有特化的外部形态,需要进一步研究.
综上所述,长江中下游洪泛平原湖泊鱼类杂食率较高,这可能是由于鱼类生存环境的复杂性,使得鱼类形态与食性之间的关联性不甚显著,但是对于偏植食性鱼类和肉食性鱼类而言,在一定范围内还是存在特化的功能性形态特征与之相适应.
| [1] |
Villéger S, Mason NW, Mouillot D. New multidimensional functional diversity indices for a multifaceted framework in functional ecology. Ecology, 2008, 89(8): 2290-2301. DOI:10.1890/07-1206.1 |
| [2] |
Farré M, Tuset VM, Maynou F et al. Geometric morphology as an alternative for measuring the diversity of fish assemblages. Ecological Indicators, 2013, 29: 159-166. DOI:10.1016/j.ecolind.2012.12.005 |
| [3] |
Mouillot D, Gaillard S, Aliaume C et al. Ability of taxonomic diversity indices to discriminate coastal lagoon environments based on macrophyte communities. Ecological Indicators, 2005, 5(1): 1-17. DOI:10.1016/j.ecolind.2004.04.004 |
| [4] |
Somerfield PJ, Clarke KR, Warwick RM et al. Average functional distinctness as a measure of the composition of assemblages. ICES Journal of Marine Science: Journal du Conseil, 2008, 65(8): 1462-1468. DOI:10.1093/icesjms/fsn118 |
| [5] |
Albouy C, Guilhaumon F, Villéger S et al. Predicting trophic guild and diet overlap from functional traits: statistics, opportunities and limitations for marine ecology. Marine Ecology Progress Series, 2011, 436: 17-28. DOI:10.3354/meps09240 |
| [6] |
Roy K, Foote M. Morphological approaches to measuring biodiversity. Trends in Ecology and Evolution, 1997, 12(7): 277-281. |
| [7] |
Wimberger PH. Plasticity of fish body shape. The effects of diet, development, family and age in two species of Geophagus (Pisces: Cichlidae). Biological Journal of the Linnean Society, 1992, 45: 197-218. DOI:10.1111/bij.1992.45.issue-3 |
| [8] |
Motta PJ, Clifton KB, Hernandez P et al. Ecomorphological correlates in ten species of subtropical seagrass fishes: diet and microhabitat utilization. Environmental Biology of Fishes, 1995, 44: 37-60. DOI:10.1007/BF00005906 |
| [9] |
Ruzzante DE, Walde SJ, Cussac VE et al. Trophic polymorphism, habitat and diet segregation in Percichthys trucha (Pisces: Percichthyidae) in the Andes. Biological Journal of the Linnean Society, 1998, 65: 191-214. |
| [10] |
Hjelm J, Svanbäck R, Bystrom P et al. Diet-dependent body morphology and ontogenetic reaction norms in Eurasian perch. Oikos, 2001, 95: 311-323. DOI:10.1034/j.1600-0706.2001.950213.x |
| [11] |
Xie S, Cui Y, Li Z. Dietary-morphological relationships of fishes in Liangzi Lake, China. Journal of Fish Biology, 2001, 58(6): 1714-1729. DOI:10.1111/jfb.2001.58.issue-6 |
| [12] |
Langerhans RB, Layman CA, Langerhans AK et al. Habitat-associated morphological divergence in two Neotropical fish species. Biological Journal of the Linnean Society, 2003, 80(4): 689-698. DOI:10.1111/j.1095-8312.2003.00266.x |
| [13] |
Webb P. Body form, locomotion and foraging in aquatic vertebrates. American Zoologist, 1984, 24(1): 107-120. DOI:10.1093/icb/24.1.107 |
| [14] |
Fryer G, Iles TD. Their biology and distribution. In: Oliver and Boyd. The Cichlid fishes of the great lakes of Africa. Edinburdge: Cambridge University Press, 1972: 21-22.
|
| [15] |
Gatz AJ. Ecological morphology of freshwater stream fishes. Tulane Studies in Zoology and Botany, 1979, 21(2): 91-124. |
| [16] |
Winemiller KO, Kelso-Winemiller LC, Brenkert AL. Ecomorphological diversification and convergence in fluvial cichlid fishes. Environmental Biology of Fishes, 1995, 44. |
| [17] |
Piet JG. Ecomorphology of a size-structured tropical freshwater fish community. Environmental Biology of Fishes, 1998, 51(1): 67-86. DOI:10.1023/A:1007338532482 |
| [18] |
张堂林. 扁担塘鱼类生活史策略、营养特征及群落结构研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2005. http://cdmd.cnki.com.cn/Article/CDMD-80119-2005152036.htm
|
| [19] |
邢松, 周蜜, 刘武. 中国人牙齿形态测量分析--近代人群上, 下颌前臼齿齿冠轮廓形状及其变异. 人类学学报, 2010(2): 132-149. |
| [20] |
Lindeman RL. The trophic-dynamic aspect of ecology. Ecology, 1942, 23(4): 399-417. DOI:10.2307/1930126 |
| [21] |
Kling GW, Fry B, O'Brien WJ. Stable isotopes and planktonic trophic structure in arctic lakes. Ecology, 1992, 73(2): 561-566. DOI:10.2307/1940762 |
| [22] |
李明德. 鱼类形态与生物学. 厦门: 厦门大学出版社, 2011, 121-122.
|
| [23] |
Vander Zanden MJ, Cabana G, Rasmussen JB. Comparing trophic position of freshwater fish calculated using stable nitrogen isotope ratios (δ15N) and literature dietary data. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(5): 1142-1158. DOI:10.1139/f97-016 |
| [24] |
张堂林, 李钟杰, 曹文宣. 鱼类生态形态学研究进展. 水产学报, 2008(1): 152-160. |
| [25] |
Costa C, Cataudella S. Relationship between shape and trophic ecology of selected species of Sparids of the Caprolace coastal lagoon (Central Tyrrhenian sea). Environmental Biology of Fishes, 2007, 78(2): 115-123. DOI:10.1007/s10641-006-9081-9 |
| [26] |
Riedlecker E, Herler J. Trophic morphology of the coral-associated genus Gobiodon (Teleostei: Gobiidae) from the Red Sea. Journal of Zoological Systematics and Evolutionary Research, 2009, 47(2): 160-170. DOI:10.1111/jzs.2009.47.issue-2 |
| [27] |
Davis AM, Pusey BJ, Pearson RG. Trophic ecology of terapontid fishes (Pisces: Terapontidae): the role of morphology and ontogeny. Marine and Freshwater Research, 2012, 63(2): 128-141. DOI:10.1071/MF11105 |
| [28] |
Oliveira EF, Goulart E, Breda L et al. Ecomorphological patterns of the fish assemblage in a tropical floodplain: effects of trophic, spatial and phylogenetic structures. Neotropical Ichthyology, 2010, 8(3): 569-586. DOI:10.1590/S1679-62252010000300002 |
| [29] |
秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301 |
| [30] |
杨达源, 李徐生. 长江中下游湖泊的成因与演化. 湖泊科学, 2000, 12(3): 226-232. DOI:10.18307/2000.0306 |
| [31] |
Zhang H, Wu G, Zhang P et al. Trophic fingerprint of fish communities in subtropical floodplain lakes. Ecology of Freshwater Fish, 2013, 22(2): 1-11. |
| [32] |
Winemiller KO. Spatial and temporal variation in tropical fish trophic networks. Ecological Monographs, 1990, 60(3): 331-367. DOI:10.2307/1943061 |
| [33] |
de Mérona B, Vigouroux R, Horeau V. Changes in food resources and their utilization by fish assemblages in a large tropical reservoir in South America (Petit-Saut Dam, French Guiana). Acta Oecologica, 2003, 24(3): 147-156. DOI:10.1016/S1146-609X(03)00065-1 |
| [34] |
湖北省水生生物研究所鱼病研究室. 长江鱼类. 北京: 科学出版社, 1976.
|
| [35] |
伍汉霖. 江苏鱼类志. 北京: 中国农业出版社, 2006.
|
| [36] |
Sardà S, Company JB, Costa C. Shape, habitat and behaviour: A preliminary approach to the distribution of the decapod crustaceans in the water column. Marine Biology, 2005, 147: 611-618. DOI:10.1007/s00227-005-1576-y |
| [37] |
Costa C. Lo studio della forma in ittiologia: Morfometria geometrica e analisi dei profili[Dissertation]. Rome: University Rome Tor Vergata, 2004.
|
| [38] |
Recasens L, Lombarte A, Sànchez P. Teleostean fish assemblages in an artificial reef and a natural rocky area in Catalonia (northwestern Mediterranean): an ecomorphological approach. Bulletin of Marine Science, 2006, 78(1): 71-82. |
| [39] |
Pulcini D, Costa C, Aguzzi J et al. Light and shape: a contribution to demonstrate morphological differences in diurnal and nocturnal teleosts. Journal of Morphology, 2008, 269(3): 375-385. DOI:10.1002/(ISSN)1097-4687 |
| [40] |
Rohlf F. tpsDig v. 2. 16. Department of Ecology and Evolution. State Univ of New York, Stony Brook, NY: Distributed by author, 2010,
|
| [41] |
Rohlf F. tpsRelw, version 1. 49. Department of Ecology and Evolution, State University of New York at Stony Brook. New York, 2010.
|
| [42] |
Diehl S. Fish predation and benthic community structure: the role of omnivory and habitat complexity. Ecology, 1992, 73(5): 1646-1661. DOI:10.2307/1940017 |
| [43] |
Drenner RW, Smith JD, Threlkeld ST. Lake trophic state and the limnological effects of omnivorous fish. Hydrobiologia, 1996, 319(3): 213-223. DOI:10.1007/BF00013734 |
| [44] |
Vanni MJ, Arend KK, Bremigan MT et al. Linking landscapes and food webs: effects of omnivorous fish and watersheds on reservoir ecosystems. BioScience, 2005, 55(2): 155-167. DOI:10.1641/0006-3568(2005)055[0155:LLAFWE]2.0.CO;2 |
| [45] |
Adams DC, Rohlf FJ, Slice DE. Geometric morphometrics: ten years of progress following the 'revolution'. Italian Journal of Zoology, 2004, 71(1): 5-16. DOI:10.1080/11250000409356545 |
| [46] |
Park PJ, Aguirre WE, Spikes DA et al. Landmark-based geometric morphometrics: What fish shapes can tell us about fish evolution. Proceedings of the Association for Biology Laboratory Education, 2013, 34: 361-371. |
| [47] |
Clabaut C, Bunje PM, Salzburger W et al. Geometric morphometric analyses provide evidence for the adaptive character of the Tanganyikan cichlid fish radiations. Evolution, 2007, 61(3): 560-578. DOI:10.1111/evo.2007.61.issue-3 |
| [48] |
Pouilly M, Lino F, Bretenoux JG et al. Dietary-morphological relationships in a fish assemblage of the Bolivian Amazonian floodplain. Journal of Fish Biology, 2003, 62(5): 1137-1158. DOI:10.1046/j.1095-8649.2003.00108.x |
 2015, Vol. 27
2015, Vol. 27 


