(2: 中国科学院大学,北京 100049)
(3: 江苏省淡水水产研究所,南京 210017)
(2: University of Chinese Academy of Sciences, Beijing 100049, P.R.China)
(3: Freshwater Fisheries Research Institute of Jiangsu Province, Nanjing 210017, P.R.China)
非经典生物操纵技术已广泛应用于湖泊、水库及池塘等淡水水体的控藻实践中,但这一方法至今仍存在分歧,其焦点是滤食鱼类放养可能会导致浮游动物个体小型化及微型藻类暴发,从而影响控藻效果[1].一方面,滤食鱼类对于粒径小于其鳃耙间距的藻类滤食效率低,而且还会因降低浮游动物对浮游藻类的摄食而使浮游藻类生物量增加[2];另一方面,系统中有机物质矿化加速可能与鱼类投入有关,即潜在的“鱼类富营养化”,最终导致水体中营养盐水平较高[3].小型藻较大型藻更易吸收水体中的营养物质,有利于小型藻生物量激增[4].蓝藻暴发期间,鲢(Hypophthalmichthys molitrix)、鳙(Hypophthalmichthys nobilis)肠道内微囊藻(Microcystis)贡献率最高达到80% ~100%[5],但鱼对微囊藻消化利用率却极低[6].关于鱼摄食微囊藻后排泄物氮是否直接对藻类增殖做出贡献的研究报道较少,而该问题的研究对于深入探讨滤食鱼类控藻效果和对环境的影响具有重要指导意义.
稳定同位素具有特定组成、分析结果精确稳定、迁移转化时组成稳定等特点,已被广泛应用于水生生态系统中[7-8].Reisinger等利用15N稳定同位素示踪技术研究大西洋鲑鱼(Salmo salar)产卵对各生物相中同位素值的影响后指出,不同溪流中鲑鱼释放氮量不同,并且环境因素能影响生物同位素值[9].Gribsholt等通过15NH4Cl的示踪,定量研究了沼泽生态系统外源氮在溶解、颗粒氮库的分配和硝化、反硝化所占份额,并指出利用同位素添加技术追踪氮素的吸收和转化可以有效排除系统内由氮素营养物质浓度显著波动而产生的干扰[7].利用稳定同位素示踪技术来研究鱼类排泄物氮在水体中的迁移转化鲜见报道.研究控藻鱼类排泄物迁移转化途径,对非经典生物操纵鱼类选择和有效避免鱼类“富营养化”具有重要意义.
鲢是典型的滤食鱼类,体长大于1.5cm后主食浮游藻类,罗非鱼是植食为主的杂食性鱼类,鲢、罗非鱼均能有效滤食微囊藻群体[10].本次实验通过15N稳定同位素示踪技术,以鲢、罗非鱼为实验鱼类,研究鲢和罗非鱼摄食微囊藻干粉后排泄氮对水环境和浮游生物群落结构的影响及迁移转化.并从排泄物角度评价鲢鱼和罗非鱼控藻生态后效,以期为非经典生物操纵机理的探讨和可行性分析提供参考依据.
1 材料与方法 1.1 材料与标记实验于2012年6-8月在中国科学院太湖湖泊生态系统观测研究站进行.将用15#浮游生物网收集的浮游生物分装于盛有湖水的水族馆中进行浮游动物、浮游藻类分离,随后将藻投入另一盛有经0.45μm孔径滤膜预滤湖水的水族馆中.将1 g 15NH4Cl (98 atom%15N)溶于去离子水并定容至1 L,然后将15NH4Cl溶液于8:00-16:00分5次添加到盛有藻的水族馆中,每2 h添加1次并搅拌均匀,当天完成藻类15N富集.将标记的藻类用去离子水冲洗干净,去除残留15NH4Cl干扰.收集藻类冷冻干燥,随后用玛瑙研钵研磨成粉末,均匀添加微量诱食剂制成藻食物粒待用.
实验用桶9个,桶总容积约150 L(高120cm、顶部直径70cm、底部直径55cm),注水体积为总容积的2/3.桶内盛有湖水(去除大颗粒杂质)、30个环棱螺(Bellamya aeruginosas)和1个沉积碎屑捕获器.1#~3#桶各放鲢鱼(体重: 65.44±3.25 g,体长: 15.54±0.62cm) 6条、4#~6#桶各放罗非鱼(体重:62.95±4.42 g;体长:16.18± 0.41cm) 6条,7#~9#桶不放鱼,作为对照.为保证鱼类存活率,24 h曝气.实验开始前鱼类在实验桶暂养3周,每天投喂适量藻浆对鱼类进行驯化.
实验开始,用标记的藻食物粒饲喂3 d,随后停止喂食,直至实验结束.喂食时,小心将鱼移至持续曝气的水族馆中,分别等量喂食,期间若有排泄物出现,立即收集投入对应桶内,以此减少实验误差,实验期间没有鱼类死亡.于投喂前一天、投喂当天和第5、10、15、20 d采集样品.实验期间,采集水样进行营养盐浓度和水体溶解态NH4+稳定同位素比值δ15N(NH4+),叶绿素a浓度(ρ(Chl.a)),浮游动物和浮游藻类丰度、种类及生物量测定;采集鱼、浮游藻类、浮游动物、沉积腐质和螺测定15N稳定同位素比值,分别记为δ15N(罗非鱼)、δ15N(鲢鱼)、δ15N(浮游藻类)、δ15N(浮游动物)、δ15N(沉积腐质)和δ15N(螺),同位素比值单位为‰.
1.2 测定项目及分析方法 1.2.1 营养盐、悬浮颗粒物和叶绿素a浓度测定总氮浓度(ρ(TN))、总磷浓度(ρ(TP))、总溶解氮浓度(ρ(TDN))、总溶解磷浓度(ρ(TDP))、铵盐浓度(ρ(NH4+))、硝酸盐浓度(ρ(NO3-))、亚硝酸盐浓度(ρ(NO2-))、磷酸盐浓度(ρ(PO43-))和悬浮颗粒物浓度(ρ(SS))依据湖泊富营养化调查规范[11]中所述方法进行测定.叶绿素a浓度(ρ(Chl.a))测定方法为:经热乙醇法[12]提取后,利用紫外分光光度计比色测定后计算得出.
1.2.2 浮游藻类、浮游动物鉴定及计数藻细胞密度:将所取藻样用超声波击散均匀后稀释成不同梯度,分别测定各梯度藻液在680nm处的吸光度(A680),同时采用流式细胞仪测出各梯度相应的细胞密度,即可得到细胞密度(C,cells/ml)和A680之间的线性关系:C=A·A680+B.实验期间,每次同一时间取样,同样方法测定吸光度,以此确定浮游藻类密度.
取混合定量样品1 L,加鲁哥试剂10~15 ml固定后,经36~48 h沉淀,浓缩至30 ml.将浓缩水样充分摇匀后,吸出0.1 ml置于0.1 ml计数框内,在高倍显微镜下观察100~200个视野(重复3次),以确定浮游藻类的种类和数量[13].利用5 L有机玻璃采水器取水两次,随后用福尔马林溶液固定,静置24 h后浓缩至50 ml.移取1 ml浓缩匀液至1 ml计数框,在显微镜下全片计数浮游动物种类及数量(平行3次)[14].
1.3 鱼、螺、浮游动物、浮游藻类及沉积腐质同位素值测定鱼背部肌肉、螺肉用去离子水冲洗干净,从沉积碎屑捕获器中直接收集沉积腐质样品,浮游藻类、浮游动物利用浮游生物网浓缩、分离并冲洗干净,随后浮游动物在过滤湖水中暂养24 h排空肠含物,消除对同位素测定值的影响,以上样品均冷冻保存.随后取出冷冻干燥、研磨后经Flash EA1112元素分析仪燃烧,所得N2分别送入Finnigan MAT公司的Deltaplus Advantage稳定同位素质谱仪进行测定,氮稳定同位素组成计算公式为δ15N(‰)=[(Rsample-Rstandard)/Rstandard]×1000.同位素以大气氮为参考标准,测定精度为0.1 ‰.
1.4 溶解态15N-NH4+同位素值测定溶解态15N-NH4+稳定同位素值按照Holmes等[15]提供的方法进行预处理,方法如下:
将阳离子树脂加等量温热蒸馏水浸泡过夜,再加等量8% (2N) NaOH溶液浸泡0.5 h,并不断搅拌,然后用蒸馏水洗去碱液(至pH为8~9),再用7% (2N)盐酸处理3次,每次用等量盐酸浸泡0.5 h,除去杂质,使树脂成氢离子型,先用蒸馏水洗至pH为4~5,再用去离子水洗至pH为6~7,备用.
称取4 g阳离子交换树脂放入柱中,用去离子水润洗5遍.将过滤后的水样(2 L)通过交换柱后用30 ml 2 mol/L氯化钾进行洗脱,洗脱速率为15 ml/h.将洗脱液收集在圆底烧瓶中,加入0.5 g氧化镁粉末,在另外的圆底烧瓶中加入2.5 ml 0.1 mol/L硫酸,连接两个圆底烧瓶,在50℃条件下扩散10 d.将扩散收集到的硫酸铵溶液密封,送样测定.
1.5 数据处理与分析文中数据方差及相关分析采用Excel、SPSS Statistics 17.0软件,利用SigmaPlot 12.5软件完成作图.
2 结果 2.1 营养盐浓度、ρ(SS)、ρ(Chl.a)及C的变化实验期间,罗非鱼组各营养盐浓度总体高于对照组,而鲢鱼组各营养盐浓度与对照组相应值相差很小.罗非鱼组ρ(TN)、ρ(TP)、ρ(TDN)、ρ(NO3-)、ρ(NH4+)、ρ(PO43-)实验前期与对照组对应值差别较小,但从第5 d开始明显增大,到实验末期极显著高于另外两组.罗非鱼组ρ(TN)、ρ(TP)、ρ(TDN)、ρ(NO3-)、ρ(NH4+)和ρ(PO43-)最大值分别为7.96、0.34、7.2、1.55、4.6和0.0087 mg/L,分别是对照组的5.97、5.04、5.98、12.66、9.79和1.76倍,但ρ(NO2-)和ρ(TDP)变化略有不同,罗非鱼组ρ(NO2-)在整个实验期间均明显高于其它两组,而ρ(TDP)仅在实验末期有较大增幅.鲢鱼组营养盐浓度变化不明显,总体上与对照组浓度相当(图 1).
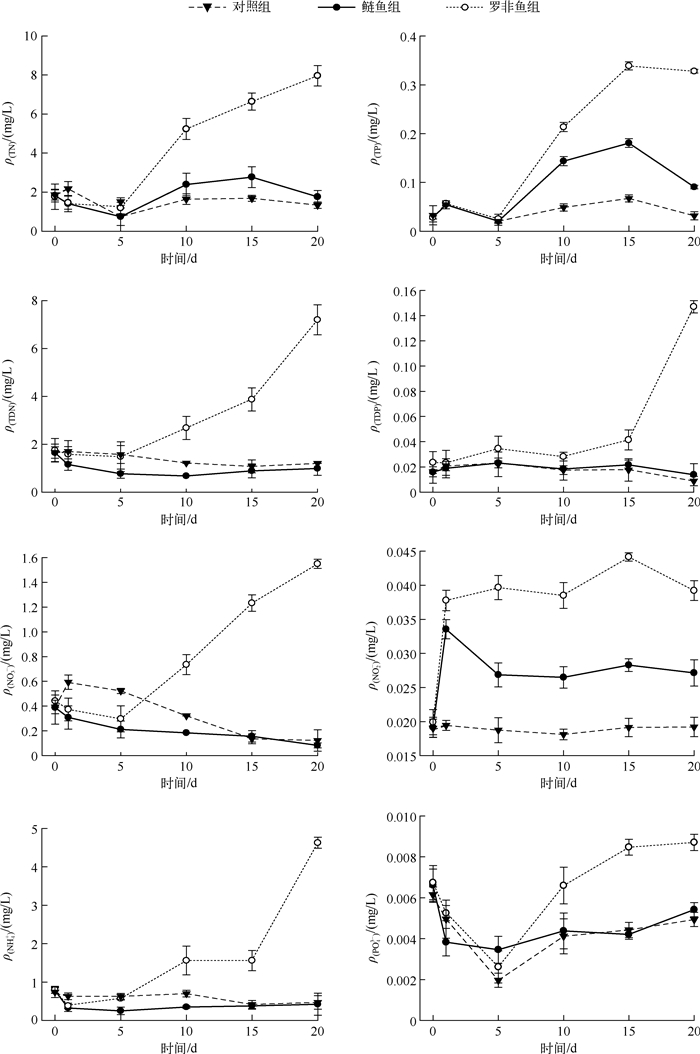
|
图 1 实验期间水体营养盐浓度变化 Fig.1 The variations of nutrient contents during the experiment |
ρ(SS)、ρ(Chl.a)和C值的变化如图 2,对照组ρ(SS)在实验中期稍有增大,但整个实验期间变化极小,最大波动幅度为3.4%,鲢鱼组的ρ(SS)在实验前中期一直增大,第15 d时达到最大值52.9 mg/L,约为对照组的2倍,而罗非鱼组的ρ(SS)第10 d即达到最大值68.7 mg/L,约为对照组的5倍,且罗非鱼组的ρ(SS)整个实验期间均高于其它两组.ρ(Chl.a)变化趋势与ρ(SS)相似,总体趋势是先升高后降低,但对照组ρ(Chl.a)变化幅度明显较有鱼组小,ρ(Chl.a)值仅在3.3~44.8 μg/L之间波动.罗非鱼组和鲢鱼组ρ(Chl.a)分别于第10 d和第15 d达到最大值,罗非鱼组最大值(374.5 μg/L)显著高于鲢鱼组的最大值(191.3 μg/L).C值变化趋势总体上与ρ(SS)相同,但第10~15 d时C变化略有差异,即罗非鱼组C值第10~15 d有小幅增加,而鲢鱼组C值第10~ 15 d增幅明显减小.罗非鱼组、鲢鱼组与对照组在第10 d最大差值为1.78×106cells/ml、1.06×106cells/ml,罗非鱼组C值始终高于其它组.
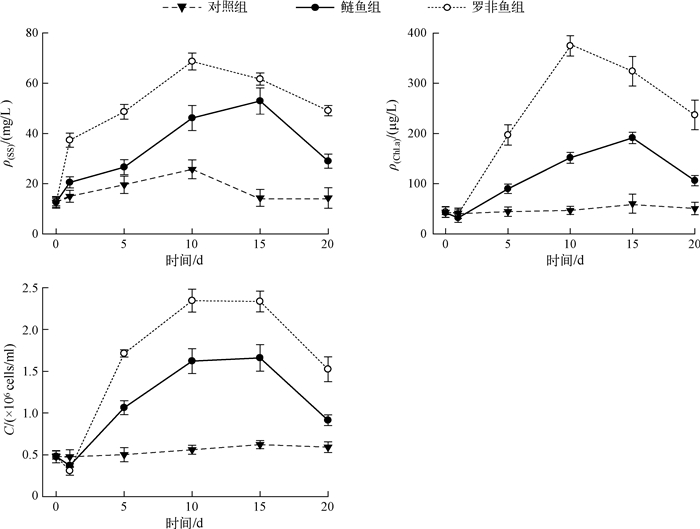
|
图 2 实验期间ρ(SS)、ρ(Chl.a)和C值的变化 Fig.2 The variations of suspended substance content, Chl.a content and phytoplankton cell density during the experiment |
实验共鉴定出17种藻,分属蓝藻门、绿藻门、硅藻门和隐藻门(表 1).初期浮游藻类总生物量组成为:蓝藻54.7%、绿藻28.6%、硅藻10.2%、裸藻6.5%.蓝藻门包含微囊藻、平裂藻和水华鱼腥藻,其中微囊藻为绝对优势种,占蓝藻生物量的88.2%,绿藻门主要由斜生栅藻、四角藻、四星藻和纤维藻等组成,4种藻生物量占绿藻总生物量的81.6%,硅藻门中脆杆藻生物量占硅藻总生物量的98.5%.鱼类投入后,蓝藻占藻类总生物量的比例先降低后升高最后再降低,第10 d所占比例最大,鲢鱼组和罗非鱼组蓝藻生物量分别占总生物量的71.9%和69.0%;蓝藻生物量也在第10 d达到最大值,鲢鱼组和罗非鱼组蓝藻生物量比初始值增大87.8和138.82 mg/L,对照组蓝藻生物量仅增加了13.12 mg/L.绿藻生物量占藻类总生物量比例恰好与蓝藻相反,鲢鱼组和罗非鱼组绿藻第5 d生物量占总生物量比值最大,分别为53.2%、62.1%;两处理组绿藻生物量均于第10 d达到最大值(34.31和62.37 mg/L),分别为对照组的3.4和6.2倍.鱼类对硅藻和隐藻生物量影响较小,变化不明显,仅造成蓝藻和绿藻生物量增加.
| 表 1 实验期间浮游藻类群落结构和生物量变化 Tab.1 The variations of phytoplankton community structure and biomass during the experiment |
共鉴定出浮游动物6种,分属桡足类和枝角类.鉴定出的桡足类包含无节幼体、桡足幼体、镖水蚤和剑水蚤4种,而无节幼体占绝对优势.枝角类包含网纹溞和弯尾溞,其中网纹溞占绝对优势.无节幼体和网纹溞密度占总浮游动物密度的95%以上,桡足幼体较少.投入鲢鱼和罗非鱼组后,无节幼体分别降低31.9%和67.2%,而网纹溞生物量却增加4~5倍.滤食鱼类投入导致浮游动物生物量显著降低,从第5 d开始,鲢鱼组和罗非鱼组浮游动物密度显著低于对照组,至实验第10 d,罗非鱼组浮游动物几乎被滤食殆尽,而鲢鱼组浮游动物密度也显著低于实验初期(表 2).
| 表 2 实验期间浮游动物群落结构和密度变化 Tab.2 The variation of zooplankton community structure and density during the experiment |
实验第1 d δ15N(罗非鱼)、δ15N(鲢鱼)即增加,δ15N(鲢鱼)在第5 d达到最大值36.22 ‰,δ15N(罗非鱼)在第15 d达到最大值151.53 ‰,此时δ15N(鲢鱼)却达到中后期的极小值;实验期间,δ15N(罗非鱼)始终大于δ15N(鲢鱼),中后期达到极显著水平.罗非鱼组δ15N(NH4+)、δ15N(浮游藻类)、δ15N(浮游动物)、δ15N(沉积腐质)和δ15N(螺)第1 d均急速增大,分别为背景值的4.0、49.9、57.6、23.4和2.1倍,随后δ15N(NH4+)、δ15N(浮游藻类)和δ15N(浮游动物)开始减小,直至实验结束,而δ15N(沉积腐质)、δ15N(螺)继续增加,分别在第5 d、第10 d后开始降低.鲢鱼组δ15N(NH4+)和δ15N(浮游藻类)变化趋势与罗非鱼组一致,但变化幅度小;鲢鱼组δ15N(浮游动物)和δ15N(沉积腐质)前期变化与罗非鱼组相似,中后期增大,第10 d后δ15N(浮游动物)和δ15N(沉积腐质)大于罗非鱼组相应值.有鱼组各类物质的δ15N值始终较对照组高,部分值极显著高于对照组,而对照组各类物质δ15N值总体稳定(图 3).
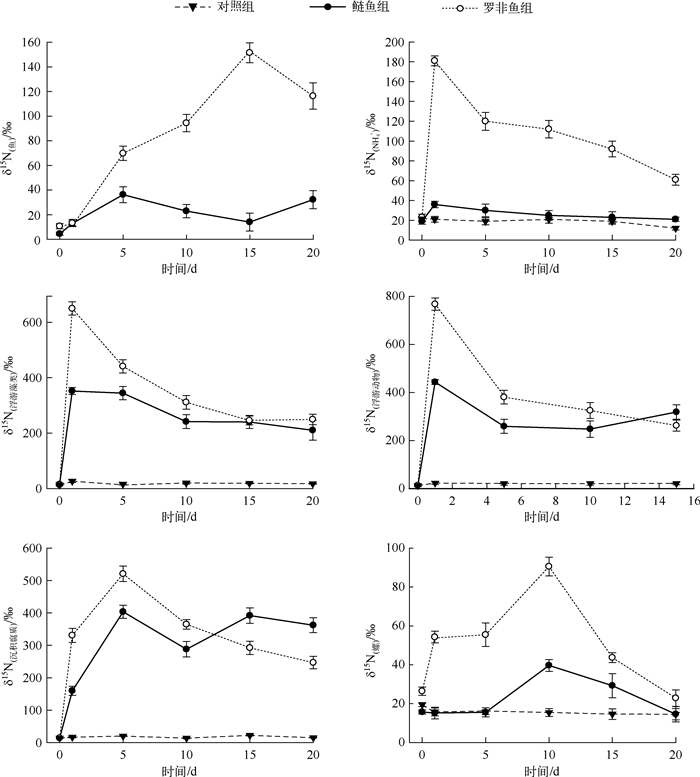
|
图 3 实验期间各组生物和非生物相中δ15N值的变化 Fig.3 δ15N values of biota and nonbiota of different groups during the experiment |
食物来源15N在生物和非生物相中迁移转化随时间有所变化;鱼类摄食微囊藻干粉后,部分氮经同化进入鱼组织器官,部分通过鱼鳃和肠道等排出进入水体,参与水生生态系统营养盐循环.两种鱼摄食微囊藻干粉后,第1 d δ15N(罗非鱼)、δ15N(鲢鱼)、δ15N(NH4+)、δ15N(浮游藻类)、δ15N(浮游动物)、δ15N(沉积腐质)和δ15N(螺)均增大,且δ15N(NH4+)、δ15N(浮游藻类)和δ15N(浮游动物)达到最大值,而后δ15N(沉积腐质)、δ15N(螺)分别于第5 d、第10 d达到最大值,显示出排泄物氮在水生生态系统中的迁移转化过程.多变量方差分析可知(表 3),不同鱼类摄食微囊藻颗粒排泄物对水体中各生物相及非生物相造成的影响有显著差异(P < 0.05).另外,各测定参数随时间的变化也有所差异,除磷酸盐浓度随时间没有显著变化(P>0.05)外,其余各参数随时间变化显著(P < 0.05).鱼种类和时间交互作用对铵盐、硝酸盐、亚硝酸盐和总溶解磷等营养盐及叶绿素a和悬浮颗粒物浓度没有显著影响(P>0.05),而对总氮、总溶解氮、总磷等浓度及细胞密度影响显著(P < 0.05).鱼的种类和时间及其交互作用均对各稳定同位素测定值造成极显著影响(P < 0.01).稳定同位素比值相关分析表明,有鱼组的δ15N(NH4+)与δ15N(浮游藻类),δ15N(浮游藻类)与δ15N(浮游动物),δ15N(沉积腐质)与δ15N(螺)呈显著正相关关系(P < 0.05),而δ15N(沉积腐质)与δ15N(NH4+)呈显著负相关(P < 0.05),其它各组之间总体上表现为正相关,但未达到显著水平(表 4).
| 表 3 各测定生物相和非生物相不同时段测定值之间的方差分析 Tab.3 Repeated-measures ANOVA of several biota and nonbiota at different times |
| 表 4 各测定生物相和非生物相稳定同位素比值的相关关系 Tab.4 Correlation analysis of several biota and nonbiota 15N stable isotope rates |
研究指出,放养滤食鱼类牧食水华蓝藻,可以控制蓝藻生物量,消除蓝藻水华和改善水质[16].然而滤食鱼类还存在“鱼类富营养化”现象,加速系统中营养物矿化,使得营养物质再次进入水体.本次研究罗非鱼类放养后,TN、TP浓度显著升高,Tang等进行鲢鱼控藻实验后也指出,TN、TP等部分营养盐浓度升高[17],但也有研究得出相反结论[18].研究结果差异主要源于实验环境的不同,蔡建楠等指出,若实验水体TN、TP浓度维持在较高水平,鱼类放养不会对水体造成显著影响,不同深度水体也会有不同的实验结果,在浅水中,鱼类活动会造成底部沉积物泛起,对水体营养盐浓度控制造成负面影响[19].除此之外,鱼类对藻类消化摄食能力强弱也会影响水体中营养盐浓度,有研究指出,罗非鱼胃液pH较低,能够将藻类粘液胶鞘破坏,最终彻底消化吸收[20],且罗非鱼排泄周期短,由此加剧水体营养物质的再生.鲢鱼滤食不能彻底破坏具有粘液胶鞘藻类,且排泄周期长,藻停留时间长,导致营养物质再生速率降低[21],因此鲢鱼潜在富营养化能力远小于罗非鱼,这也与重复测量方差分析结果一致.鉴于不同情况下鱼类放养对水体影响不同,Zhang等[22]系统总结了国内外30个鲢、鳙鱼控藻研究后指出,当外界环境温度较高、大型枝角类不占优势、浮游藻类以群体蓝藻占优势时,放养鲢、鳙鱼能降低水体中营养盐含量,从而可以净化水质和规避滤食性鱼类的“鱼类富营养化”影响.
鲢鱼的放养能有效降低浮游生物量[23],但同时会造成小型浮游藻类过度繁殖,最终结果是整个浮游生物群落生物量增加[4].本实验中,浮游动物生物量随实验进行而不断降低,最终几乎被滤食殆尽,说明鱼类滤食会显著降低浮游动物生物量[24].滤食性鱼类主要滤食逃避能力弱的浮游动物,本实验鲢鱼滤食最终导致浮游动物群落呈现以逃避能力强的种类(桡足类)为主[25],但罗非鱼可能由于滤食强度较大,最终浮游动物生物量基本为零.适当密度鱼类放养能够短期有效地控制部分藻类的暴发,但其控制的仅为颗粒较大的藻,小粒径藻类不能有效被鱼类滤食.本实验前期,藻生物量降低,随后微囊藻生物量逐渐增加,说明两种鱼滤食未对藻类造成致命损伤,且鱼类排泄物进入水体后刺激藻类生长,致使微囊藻生物量剧增[26-27],微囊藻群体胶鞘是应对不利环境而形成的,在营养物质丰富情况下,群胶鞘破坏有利于其繁殖.绿藻粒径基本小于滤食鱼类腮耙间距,且易吸收营养物质,因此大量增殖.藻类增殖主要取决于营养盐浓度与氮磷比,说明鱼类能够加速有机物矿化,随之引起藻类生物量增加.
生态系统中各生物与非生物相同位素比值有较大差异,同位素在传递过程中会产生具有一定规律性的分馏效应,最终各研究对象稳定同位素呈现一定的差异,这一特点使研究者能够明确得出各研究对象之间的差异,因此,稳定同位素示踪技术被广泛应用到水生生态系统研究中[7].而将稳定同位素添加到浮游藻类,制作成食物颗粒后喂食鱼类,并以此来确定鱼类控藻过程中排泄物氮对水生生态系统影响的报道较少.本研究将15N稳定同位素加进浮游藻类,制作成食物颗粒后喂食鱼类,最终15N经鱼类排泄进入水生生态系统参与循环.随后根据15N稳定同位素比值变化探讨排泄物来源氮在水生生态系统中的迁移规律.鱼类摄食15N添加干粉微囊藻后,δ15N(罗非鱼)、δ15N(鲢鱼)均在实验前5 d达到最大值,说明两种鱼均能有效消化吸收干粉微囊藻,罗非鱼对干粉微囊藻的同化效率高于鲢鱼.实验开始后,第1 d δ15N(NH4+)值迅速增加,氮进入水体有多种途径:鱼类排泄物中氮浸出;沉积腐质中含氮化合物经微生物分解后进入水体;鱼鳃分泌以铵盐为主的化合物进入水体[28].δ15N(浮游藻类)第1 d急剧增大,说明浮游藻类能够快速有效地利用水体中的含氮无机盐[29].δ15N(浮游藻类)与δ15N(NH4+)同时迅速增大,说明浮游藻类增殖能够快速吸收水体中溶解态15N-NH4+,故两者变化趋势基本一致[30].浮游动物是一类经常在水中浮游但本身不能制造有机物的异养无脊椎动物和脊索动物幼体的总称,在水中营浮游性生活的动物类群,主要以浮游藻类、细菌和一些食物碎屑为食.本次实验中的食物碎屑以鱼类未消化的干粉微囊藻颗粒为主,而初期排出未消化食物颗粒中15N含量相对较高,同时δ15N(浮游藻类)也在第1 d值最大,因此δ15N(浮游动物)也在实验第1 d出现最大值.实验后期,由于鱼类的持续滤食,导致浮游动物生物量减少,无法收集到足够的浮游动物进行测定.沉积腐质主要由鱼类排泄物组成,水体中悬浮颗粒物也是沉积碎屑的重要组成部分,且氮素能够较快进入悬浮颗粒物中.按推测δ15N(沉积腐质)最大值应出现在第1 d,但事实上δ15N(沉积腐质)在第5 d达到最大,造成这种结果主要有以下原因:(1)排泄物进入水体初期,表面有一层胶状物,使其大部分以悬浮态存在,故第1 d测定的沉积腐质主要是原水体中各种残体和颗粒物,其中仅包含极少一部分鱼类排泄物;(2)初期水底鱼类排泄物较少,且部分经水中细菌等微生物分解而再次进入水体,随实验进行,达到水底的排泄物增多,而细菌等微生物分解能量有限,最终排泄物为沉积腐质的主要组成部分.Burford等指出,沉积物中的细菌等微生物群体能够快速将有机物矿化,最终以无机氮形态进入水体[28].随实验进行,排泄物氮不断浸出,微生物将排泄物分解,排泄物中15N含量降低,加之鱼类和浮游动物等对悬浮颗粒物滤食等因素造成δ15N(沉积腐质)降低.δ15N(螺)在第10 d时才达到最大值,这与摄食习性、食性和消化吸收效率有关[31],而环棱螺的食源物实验初期较少,且营养物质转化成环棱螺肌肉等硬组织的时间也相对较长,故最大值出现时间晚.根据实验中15N稳定同位素出现时间和食物链相关知识可知,干粉微囊藻中氮素简易迁移过程,鱼类摄食后,少部分被同化成为鱼类有机体组成部分,其它部分经鱼类分泌、排泄等方式进入水体.可溶态的无机氮部分被浮游藻类生长利用,随后经摄食进入浮游动物体内;不溶的悬浮颗粒物和沉积腐质部分经滤食而进入螺内.
滤食性鱼类放养在短期内能有效控制部分藻类生长,但与此同时出现的鱼类“富营养化”也不容忽视,因为营养盐也是导致藻类增殖的原因之一[32].本次研究结果显示,鲢、罗非鱼摄食干粉微囊藻后,排泄物氮进入水体直接参与水中营养物循环,为藻类增殖提供有利条件.若仅从鱼类食性和消化吸收效率方面考虑,鲢鱼和罗非鱼不适合进行水体控藻实践.但在一定实验水体,放养合适密度滤食鱼类,基于强大的牧食压力和多次重复滤食,鱼类也能够有效控制藻类生物量[22, 33].将该理论应用于大型湖泊(如太湖)时,很多条件都无法得到满足,且可能会对湖泊水生生态系统结构造成不良影响,因此需要谨慎.同时如何有效减缓鱼类有机物质矿化速率及阻止排泄物参与水体营养盐循环,有待进一步研究.
| [1] |
Havens KE. Lake eutrophication and plankton food webs. In: Abid AA, Sarvajeet SG eds. Eutrophication: Causes, consequences and control. Dordrecht: Springer Netherlands, 2014: 73-80.
|
| [2] |
Prokopkin IG, Gubanov VG, Gladyshev MI. Modeling the effect of planktivorous fish removal in a reservoir on the biomass of cyanobacteria. Ecological Modeling, 2006, 190(3/4): 419-431. |
| [3] |
Olin M, Rask M, Ruuhijarvi J et al. Effects of biomanipulation on fish and plankton communities in ten eutrophic lakes of southern Finland. Hydrobiologia, 2006, 553(1): 67-88. DOI:10.1007/s10750-005-0786-0 |
| [4] |
Domaizon I, Devaux J. Experimental study of the impacts of silver carp on plankton communities of eutrophic Villerest reservoir (France). Aquatic Ecology, 1999, 33(2): 193-204. |
| [5] |
Ke ZX, Xie P, Guo LG. In situ study on the control of toxic Microcystis blooms using phytoplanktivorous fish in the subtrophical Lake Taihu of China: A large fish pen experiment. Aquaculture, 2007, 265(1/2/3/4): 127-138. |
| [6] |
张国华, 曹文宣, 陈宜瑜. 湖泊放养渔业对我国湖泊生态系统的影响. 水生生物学报, 1997, 12(3): 271-280. |
| [7] |
Gribsholt B, Boschker S, Struyf E et al. Nitrogen processing in a tidal freshwater marsh: A whole-ecosystem 15N labeling study. Limnology and Oceanography, 2005, 50(6): 1945-1959. |
| [8] |
Sinnatamby RN, Reist JD, Power M. Identification of the maternal source of young-of-the-year Arctic charr in Lake Hazen, Canada. Freshwater Biology, 2013, 58(7): 1425-1435. |
| [9] |
Reisinger AJ, Chaloner DT, Ruegg J et al. Effects of spawning Pacific salmon on the isotopic composition of biota differ among southeast Alaska streams. Freshwater Biology, 2013, 58(5): 938-950. |
| [10] |
Datta S, Jana BB. Control of bloom in a tropical lake: grazing efficiency of some herbivorous fishes. Journal of Fish Biology, 1998, 53(1): 12-24. DOI:10.1111/jfb.1998.53.issue-1 |
| [11] |
金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990.
|
| [12] |
陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519 |
| [13] |
Utermhl H. Zur Vervollkommung der quantitativen phytoplankton methodik. Mitteilung Internationale Vereinigung fuer Theoretische and Amgewandte Limnologie, 1958, 9: 1-38. |
| [14] |
Paggi JC, de Paggi S. Primeros estudios sobreel zooplancton de las aguas lóticas del Paraná medio. Physis, 1974, 33(86): 91-114. |
| [15] |
Holmes R, McClelland W, Sigman DM et al. Measuring 15N-NH4+ in marine, estuarine, and fresh waters: an adaptation of the ammonium diffusion method for samples with low ammonium concentrations. Marine Chemistry, 1998, 60(3): 235-243. |
| [16] |
Radke RJ, Kahl U. Effect of a filter-feeding fish[silver carp, Hypophthalmicthys molitrix (Val.)] on phyto-and zooplankton in a mesotrophic reservoir: results from an enclosure experiment. Freshwater Biology, 2002, 47(12): 2337-2344. |
| [17] |
Tang HJ, Xie P, Lu M et al. Studies on the effects of silver carp (Hypophthalmichthys molitrix) on the phyto-plankton in a shallow hypereutrophic Lake through an enclosure experiment. International Review of Hydrobiology, 2002, 87(1): 107-119. |
| [18] |
Chen KN, Bao CH, Zhou WP. Ecological restoration in eutrophic Lake Wuli: a large enclosure experiment. Ecological Engineering, 2009, 35(11): 1646-1655. DOI:10.1016/j.ecoleng.2008.10.009 |
| [19] |
蔡建楠, 潘伟斌, 王建华等. 鲢和奥尼罗非鱼对池塘蓝藻水华及水质的影响. 水生态学杂志, 2008, 29(1): 56-61. |
| [20] |
Ceccaldi H. A synopsis of the morphology and physiology of the digestive system of some crustacean species studied in France. Reviews in Fisheries Science, 1998, 6(1/2): 13-39. |
| [21] |
Xie P, Liu JK. Studies on the influence of planktivorous fishes (silver carp and bighead carp) on the water bloom in a shallow, eutrophic Chinese lake (Lake Donghu) using enclosure method. Annual Report of FEBL, 1991, 21-24. |
| [22] |
Zhang X, Xie P, Huang XP. A review of nontraditional biomanipulation. The Scientific World Journal, 2008, 8: 1184-1196. DOI:10.1100/tsw.2008.144 |
| [23] |
Starling F. Control of eutrophication by silver carp (Hypophthalmichthys molitrix) in the tropical Paranoa Reservoir (Brasilia, Brazil):a mesocosm experiment. Hydrobiologia, 1993, 257(3): 143-152. |
| [24] |
Lacerot G, Kruk C, Lurling M et al. The role of subtropical zooplankton as grazers of phytoplankton under different predation levels. Freshwater Biology, 2013, 58(3): 494-503. DOI:10.1111/fwb.2013.58.issue-3 |
| [25] |
Drenner RW, Denoyelles FJ, Kettle D. Selective impact of filter-feeding gizzard shad on zooplankton community structure. Limnology and Oceanography, 1982, 27(5): 965-968. DOI:10.4319/lo.1982.27.5.0965 |
| [26] |
王银平, 赵勇, 曾庆飞等. 杂食性鱼类排泄物中藻类光能活性研究. 中国环境科学, 2013, 33(3): 524-529. |
| [27] |
王银平, 谷孝鸿, 曾庆飞等. 控(微囊)藻鲢、鳙排泄物光能与生长活性. 生态学报, 2014, 34(7): 1707-1715. |
| [28] |
Burford M, Williams K. The fate of nitrogenous waste from shrimp feeding. Aquaculture, 2001, 198(1): 79-93. |
| [29] |
Burford M, Glibert P. Short-term nitrogen uptake and regeneration in early and late growth phase shrimp ponds. Aquaculture Research, 1999, 30(3): 215-227. DOI:10.1046/j.1365-2109.1999.00314.x |
| [30] |
Dortch Q. The interaction between ammonium and nitrate uptake in phytoplankton. Marine Ecology Progress Series, 1990, 61(1): 183-201. |
| [31] |
Alfaro AC, Dewas SE, Thomas F. Food and habitat partitioning in grazing snails (Turbo smaragdus), Northern New Zealand. Estuaries and Coasts, 2007, 30(3): 431-440. DOI:10.1007/BF02819389 |
| [32] |
Naylor R, Goldburg R, Mooney H et al. Nature's subsidies to shrimp and salmon farming. Science, 1998, 282(5390): 883-884. |
| [33] |
陈少莲, 刘肖芳. 鲢、鳙对鱼粪消化利用的研究. 水生生物学报, 1989, 42(3): 250-258. |
 2015, Vol. 27
2015, Vol. 27 


