藻源性湖泛是指湖泊富营养化水体在藻类大量暴发、积聚和死亡后,在适宜的气象、水文条件下,与底泥中的有机物在缺氧和厌氧条件下产生生化反应,释放硫化物、甲烷和二甲基三硫等硫醚类物质,形成褐黑色伴有恶臭的“黑水团”,从而导致水体水质迅速恶化、生态系统受到严重破坏的现象[1].湖泛是蓝藻水华暴发的严重后果之一,相对于蓝藻水华本身的危害,湖泛对于水体水质,特别是水源地饮用水安全影响更为直接,危害更大[2].
水体发黑是湖泛区别于自然水体最显著的特征.目前对于水体水色变化的研究主要集中在理化性质方面,认为非晶态硫化亚铁是导致黑色水体发黑的主要原因[3]. Fe2+和∑S2-被证实是湖泛发生过程中的敏感因子[4],其浓度升高是湖泛水体发黑的原因[5].而湖泛水体颜色变化实质上是一种光学变化过程,更应从水色光学角度给予解释,而非单从理化性质方面进行说明.而在水体光学方面,对于黑水的研究最早始于1993年,但仅是通过遥感分辨出黑水区域[6].随后不同学者针对不同区域的“黑水团”水体光学参数进行研究,结果表明不同区域“黑水团”水体致黑原因不同,如佛罗里达礁群(Florida Keys)[7]水体中有色可溶性有机物浓度(CDOM)普遍偏高,而我国长江口东南海域黑水区域CDOM浓度相对于其它水体增高并不显著,但其颗粒后向散射系数值极小[9].而对太湖湖泛的遥感研究发现,湖泛发生时水体除CDOM浓度显著高于普通水体,无机颗粒物浓度也普遍偏低,并认为二者的共同贡献造成水体的“低散射、高吸收”,导致湖泛水体反射率显著低于周边正常水体而呈现黑色[10].另外,对湖泛发生整个过程中的光学特性持续变化研究发现,各吸收系数都在发生变化,但只有CDOM吸收系数ag随水体发黑而不断增大,其他参数都呈不规律性变化[11].因此,水体中CDOM浓度显著升高可能是导致湖泛水体发黑的主要原因之一.
目前,虽然已有研究证实CDOM的存在会使水体颜色发黑,但对于湖泛引起的“黑水团”现象,特别是从大量藻颗粒聚集的绿色水体,到湖泛形成后水体呈现黑色,这一生态过程中CDOM的连续变化特性研究还比较欠缺.本文通过模拟湖泛发生过程,分析水体的基本理化指标和CDOM变化及其变化对水色的影响,揭示水体发黑的主要原因.该研究对于湖泛水体定量遥感监测和早期预报具有重要的科学意义和实际应用价值.
1 材料与方法 1.1 采样地点与方法实验所需的底泥沉积物、湖水以及蓝藻颗粒,于2014年4月在太湖竺山湾水域(31.38°N,120.04°E)同步采集.通过25#浮游生物网采集蓝藻颗粒,湖水用25L聚乙烯桶收集;使用重力式沉积物采泥器(Rigo Co.内径110mm×长50cm)采集30cm左右沉积物柱状样,并带原位上覆水约20cm,用橡胶塞将柱状样塞紧保存.在整个采集过程中要保证沉积物界面无扰动.
1.2 实验方法及模拟条件控制在无扰动的条件下,将采集的沉积物柱状样上半部分20cm和湖水分别装入模拟装置的模拟柱中(图 1),水深达到180cm,待水体平静后再在每柱中加入47.5g(约5000g/m2)采集的蓝藻颗粒.控制环境温度为29±1℃,每天下午模拟3.2m/s的风浪并持续4h,整个过程保持自然光照.实验开始后,每天进行溶解氧(DO)、色度的监测.同时,将采集后的水样过滤后冷冻保存,统一进行分析.由于造成水体散发异味的原因较多,且并非所有散发异味气味的水体都发生了湖泛现象,因此从光学角度,将实验过程中水体最终变黑作为判断湖泛发生的依据.

|
图 1 Y-型沉积物再悬浮发生装置及湖泛模拟 Fig.1 Y-shape apparatus used for the black water simulation |
CDOM吸收系数(ag)的测定:用孔径22 μm的Minipore膜过滤水样,在UV-2600上测定滤液的吸光度,用空白作对比,然后根据Bricaud等[12]提出的方法对散射效应进行校正,并计算得到ag(λ).
叶绿素a浓度(Chl.a)的测定:用GF/C膜(孔径1.2μm)过滤水样,将滤膜反复冻融进行细胞破碎,用90 %丙酮溶液提取叶绿素,依次测定750、664、647、630 nm波长处的吸光度,最后计算出Chl.a浓度.悬浮物(SS)浓度采用GB/T 11901 1989的烘干称重法进行测定.DO浓度利用溶解氧仪进行测定.水体黑度值则采用分析FeS浓度的方法来指示[13].
1.4 水色推演首先,应用Hydrolight模拟出由于CDOM浓度变化(0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 m-1)而改变的水体离水辐亮度(Lw)、遥感反射比(Rrs)等.在此模拟过程中,水色参数Chl.a浓度(25.22 μg/L)、无机悬浮颗粒物(SPIM)浓度(10.83 mg/L)采用其在实验过程中的均值,比吸收系数和比散射系数取太湖夏季野外测量的均值,风速(3.2m/s)、水深(1.8 m)和太阳天顶角(30、60、90°)等均取固定值.结合CIE标准色度学,将光谱信息转化为CIE XYZ坐标,转化方程如下:
| $ X = {K_m}\int_{400}^{700} {{L_{\rm{w}}}\left( \lambda \right)\overline x {\rm{ }}\left( \lambda \right){\rm{d}}\lambda } $ | (1) |
| $ Y = {K_m}\int_{400}^{700} {{L_{\rm{w}}}\left( \lambda \right)\overline y {\rm{ }}\left( \lambda \right){\rm{d}}\lambda } $ | (2) |
| $ Z = {K_m}\int_{400}^{700} {{L_{\rm{w}}}\left( \lambda \right)\overline z {\rm{ }}\left( \lambda \right){\rm{d}}\lambda } $ | (3) |
再将XYZ信息转换为人眼可见的RGB值.
| $ \left[ \begin{array}{l} R\\ G\\ B \end{array} \right] = \left[ \begin{array}{l} 3.240479\;\; - 1.537150\;\; - 0.498535\\ - 0.969256\;\;\;1.875992\;\;\;\;0.041556\\ 0.055648\;\;\; - 0.204043\;\;\;\;1.057311 \end{array} \right]_z^x\cdot y $ | (4) |
此过程通过Dierssen[14]提出的Matlab代码来实现,再量化为颜色.
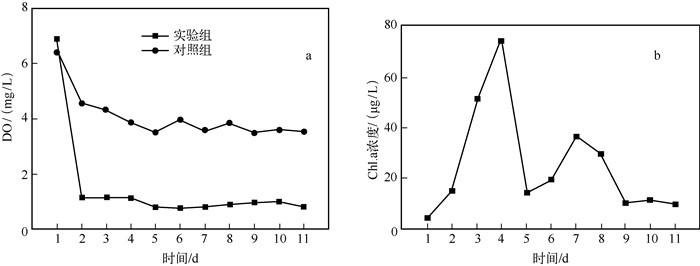
2 结果与讨论 2.1 水体DO浓度的变化水体中DO水平是湖泛发生的重要影响因子[15],当湖泛发生时,水体呈现缺氧甚至厌氧的状态.实验过程中,对照组和实验组的DO浓度在第2 d都明显下降,对照组的DO浓度下降幅度不大,并维持在3.5~4.0 mg/L左右;而实验组DO浓度急剧下降,由初始的6.90 mg/L下降到1.33 mg/L,水体达到厌氧状态,之后持续稳定(图 2a).在对照组中,主要受到水沉积物中生物和有机质矿化的影响,水中DO浓度稍有下降,其后浓度变化趋势比较平稳.而实验组水体表层被藻类覆盖,藻类的生长、代谢及降解将消耗氧气,而水体中的气体无法与外界进行正常交换,导致DO浓度急剧下降,水体呈现缺氧-厌氧状态.因此,藻类的暴发和降解是使水体中DO浓度急剧下降并维持在低浓度水平的主要原因. DO的不足甚至缺失,将导致需氧生存的水生生物死亡或者向有氧水域迁移,从而造成死亡区域形成.水体氧化还原环境从有氧氧化环境向缺氧厌氧还原态环境转变[16],使得水环境中高价Fe3+和SO42-等向低价还原态转变,同时产生大量主要致臭物质——挥发性有机硫化物(VOSCs).因此,水体DO浓度水平,被认为是影响湖泛发生与消退的重要环境因子.
|
图 2 水体中DO(a)和Chl.a(b)浓度变化 Fig.2 The changes of DO (a) and chlorophyll-a(b) concentrations in the water |
湖泛是湖泊富营养化水体在藻类大量暴发、积聚和死亡后形成的一种水环境污染问题.通过实验得知,加入藻类的实验组水体出现了湖泛,而未加入藻类的对照组水体没有发生湖泛现象.这也证实藻类是引发湖泛发生的最主要原因.湖泛发生过程中,水体中Chl.a浓度变化较为复杂(图 2b),整体呈现先增大后减小、再增大再减小的规律.这是由于在前期,水体条件适宜藻类生长,藻类暴发生长使得水中Chl.a浓度迅速增加.随着水体DO浓度下降,水体环境由好氧状态转为缺氧状态,藻类大量死亡,水体中Chl.a浓度急剧下降.藻类死亡分解会产生有机物,大量的有机物为藻类生长提供营养.在充足的营养物质下,未死亡的藻出现再暴发,水中Chl.a浓度出现小幅度增加.最后,终因水体处于厌氧状态,藻类绝大部分将死亡,Chl.a浓度较小.
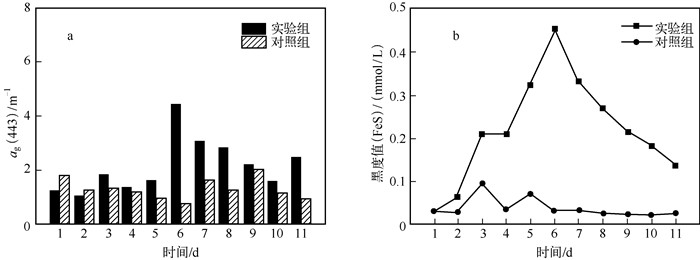
2.3 CDOM吸收系数的变化CDOM作为水体中的一个重要的光吸收物质,其浓度和组成能改变水下光场[16].由于CDOM吸收系数在短波处差异较大,通常用443 nm波长处的吸收系数ag(443)来表征CDOM浓度[17].实验组的ag(443)普遍大于对照组的ag(443),实验组的ag(443)在第6 d出现最大值,之后ag(443)都远大于实验第1 d的ag(443)初始值(图 3a).
|
图 3 ag(443)(a)和水体黑度(b)变化 Fig.3 Changes of absorption spectral of CDOM(a) and blackness(b) |
自然界水体中,CDOM的来源主要有两种类型:一种是浮游植物自身降解带来的产物,另一种来源于陆地地表.内源型的CDOM主要来自土壤和水生植物降解产物,由腐质酸和富里酸等物质组成[18].在模拟实验过程中,没有外源性污染有机物的输入,也无其他水生植物的存在,属于内源型,CDOM主要来自实验水体中藻类的降解.在厌氧条件下,蓝藻可被微生物分解成分子结构复杂的腐殖质类物质[19].伴随实验组水体好氧-缺氧-厌氧的状态,水中藻类出现死亡分解.分解过程中产生大量腐殖质,导致水体中CDOM增加,ag(443)变大.
2.4 水体水色的变化水体发黑、发臭是湖泛发生的两大主要特征[20].湖泛发生时,可以观察到此区域水体与周围正常水体形成强烈的色差对比,水体发黑是湖泛发生的显著特征[21].本研究也已证实,实验组的水体黑度明显高于对照组(图 3b).对照组水体的水色随时间的变化不大,说明在正常条件下水体的水色趋于稳定.而实验组的水体水色在湖泛发生过程中水体黑度相对于第1 d的初始水色都在变大,在湖泛发生时达到最大值,而后出现减小的趋势.湖泛水色变化可能与藻类死亡分解导致CDOM浓度增加有关.
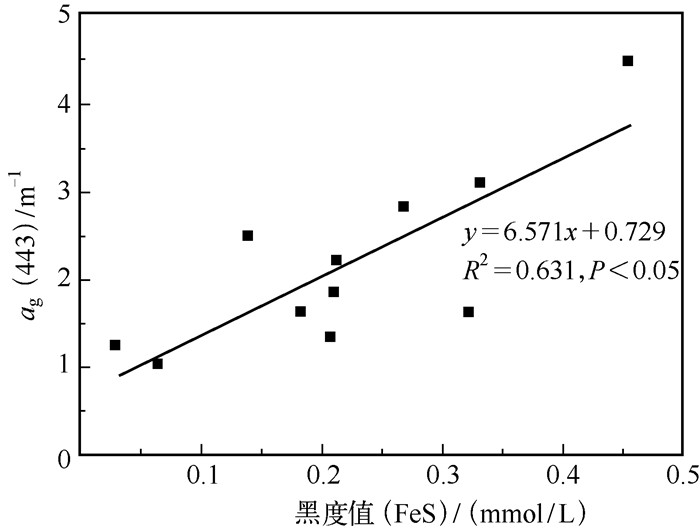
2.5 CDOM对水色的影响 2.5.1 CDOM与水色变化的关系因为水体中的黄色物质不会散射光线,CDOM高度集中的水域会显示出黑色,如佛罗里达礁群(Florida Keys)[7-8]、圣约翰河(the Lower St. Johns River)[20]和波罗的海[21]因为有着很高浓度的CDOM而呈现黑色.因此,高浓度的CDOM会形成黑色或棕色的水面.通过实验组可以发现,CDOM与水体黑度呈现一定的正相关(R2=0.631)(图 4). CDOM的最大值(4.48 m-1)出现在第6 d,而在第6 d时黑度值也最大.第6 d之后,黑度值开始下降,而ag(443)也呈现出减小的趋势.因此,湖泛过程水色变化主要受水体中CDOM浓度变化的影响.
|
图 4 ag(443)与水体黑度相关性 Fig.4 Relationship between blackness and ag(443) |
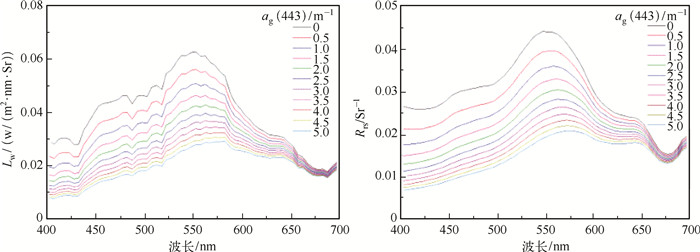
水体的表观光学特性是指受光场角分布以及受水体中物质性质和数量影响的那些光学特性,其中离水辐亮度(Lw)和遥感反射比(Rrs)能直接反映水色信息.通过Hydrolight模拟不同梯度ag(443)下的Lw和Rrs,当模拟梯度变化时SPIM和Chl.a取固定均值.不同CDOM浓度(0~5.0 m-1)下Lw和Rrs的光谱曲线见图 5.随着CDOM浓度增大,水体对光的吸收增强,光反射减小,因此水体比周围正常水体发暗发黑.
|
图 5 不同梯度ag(443)下Lw和Rrs的光谱曲线 Fig.5 Spectral curves of Lw and Rrs under different gradient of ag(443) |
水色变化受多种因素的影响,但在相同背景下,水体颜色变化是由于离水辐亮度的直接变化引起的.由Dierssen提出的Matlab代码,可将Lw转换为RGB颜色,此颜色为不受太阳耀斑和明亮天空作对比的影响下,人眼正面朝下观测到的水色.人眼的观察角度不同,看到的水体颜色也不尽相同,这就是为什么我们从远处看湖泛水体发黑,但实际走近之后发现水体真实颜色并不黑的原因.太阳角为30°和60°时,随ag(443)由0增至5 m-1,水体颜色逐渐由绿色转为棕色;当太阳角为90°时,水体颜色逐渐由蓝绿色转为棕色(图 6).因此,随水体中ag(443)增加,水体颜色由短波向长波方向移动.

|
图 6 不同梯度ag(443)下水色模拟 Fig.6 Surface color based on water-leaving radiance using the CIE color matching functions |
通过对湖泛发生过程中水体理化性质和光学特性进行分析,利用Hydrolight和CIE颜色匹配函数模拟出水体颜色,分析其水色变化规律.结果表明:(1)水体由好氧状态变为缺氧、厌氧状态,水体的黑度在前期逐渐增大而后期又将慢慢消失,Chl.a浓度变化比较复杂,总体呈现先增加后减少的趋势.(2)由于藻类死亡分解,水中藻类残体降解导致ag(443)不断增大.(3) ag(443)变化与水体黑度变化相似,先增大后减小,且ag(443)与水体黑度呈正相关(R2=0.631,P < 0.05).(4)随ag(443)的增大,Lw和Rrs相应不断变小,水体颜色也逐渐由绿色转为棕色.
| [1] |
陆桂华, 马倩. 太湖水域"湖泛"及其成因研究. 水科学进展, 2009, 20(3): 438-442. |
| [2] |
申秋实, 周麒麟, 邵世光等. 太湖草源性"湖泛"水域沉积物营养盐释放估算. 湖泊科学, 2014, 26(2): 177-184. DOI:10.18307/2014.0202 |
| [3] |
Stahl JB. Black water and two peculiar types of stratification in an organically loadedstrip-mine lake. Water Researsh, 1979, 13(5): 467-471. DOI:10.1016/0043-1354(79)90040-X |
| [4] |
Shen QS, Liu C, Zhou QL et al. Effects of physical and chemical characteristics of surface sediments in the formation of shallow lake algae-induced black bloom. Journal of Environmental Sciences, 2013, 25(12): 1-8. |
| [5] |
Shen QS, Zhou QL, Shang JG et al. Beyond hypoxia:Occurrence and characteristics of black blooms due to the decomposition of the submerged plant Potamogeton crispus in a shallow lake. Journal of Environmental Sciences, 2014, 26(2): 281-288. DOI:10.1016/S1001-0742(13)60452-0 |
| [6] |
Nichol JE. Remote sensing of tropical blackwater rivers:a method for environmental water quality analysis. Applied Geography, 1993, 13(2): 153-168. DOI:10.1016/0143-6228(93)90056-7 |
| [7] |
Hu CM, Keith EH, Michael KC et al. The 2002 ocean color anomaly in the Florida Bight: A cause of local coral reef decline-Geophysical Research Letters, 2003, 30 (3): 1-4. https://agupubs.onlinelibrary.wiley.com/doi/full/10.1029/2002GL016479
|
| [8] |
Hu CM, Frank EM, Gabriel AV et al. Linkages between coastal runoff and the Florida Keys ecosystem:A study of a dark plume event. Geophysical Research Letters, 2004, 31(15): 1-4. |
| [9] |
何贤强, 唐军武, 白雁等. 2003年春季长江口海域黑水现象研究. 海洋学报:中文版, 2009, 31(3): 30-38. |
| [10] |
Duan HT, Ma RG, Steven AL et al. Optical characterization of black water blooms in eutrophic waters. Science of the Total Environment, 2014, 482: 174-183. |
| [11] |
李佐琛, 段洪涛, 张玉超等. 藻源型湖泛发生过程水色变化规律. 中国环境科学, 2015(2): 524-532. |
| [12] |
Bricaud A, Morel A, Prieur L. Absorption by dissolved organic matter of the sea (yellow substance) in the UV and visible domains. Limnology and Oceanography, 1981, 26(1): 43-53. DOI:10.4319/lo.1981.26.1.0043 |
| [13] |
Feng ZY, Fan CX, Huang WY et al. Microorganisms and typical organic matter responsible for lacustrine "black bloom". Science of the Total Environment, 2013, 470: 1-8. |
| [14] |
Dierssen HM, Kudela RM, Ryan JP et al. Red and black tides:Quantitative analysis of water-leaving radiance and perceived color for phytoplankton, colored dissolved organic matter, and suspended sediments. Limnology and Oceanography, 2006, 51(6): 2646-2659. DOI:10.4319/lo.2006.51.6.2646 |
| [15] |
申秋实, 邵世光, 王兆德等. 太湖月亮湾湖泛发生过程模拟及水土物化性质的响应. 水科学进展, 2011, 22(5): 710-719. |
| [16] |
Diaz RJ, Rosenberg R. Spreading dead zones and consequences for marine ecosystems. Science, 2008, 321(5891): 926-929. DOI:10.1126/science.1156401 |
| [17] |
Castillo CED, Coble PG. Seasonal variability of the colored dissolved organic matter during the 1994 95 NE and SW monsoons in the Arabian Sea. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2000, 47(7): 1563-1579. |
| [18] |
Kirk JTO. Light and photosynthesis in aquatic ecosystem. Britain:Cambridge University Press, 1994, 528. |
| [19] |
尚丽霞, 柯凡, 李文朝等. 高密度蓝藻厌氧分解过程与污染物释放实验研究. 湖泊科学, 2013, 25(1): 47-54. DOI:10.18307/2013.0107 |
| [20] |
Gallegos CL. Optical water quality of a blackwater river estuary:the Lower St. Johns River, Florida, USA.. Estuarine, Coastal and Shelf Science, 2005, 63(1): 57-72. |
| [21] |
Berthon JF, Zibordi G. Optically black waters in the northern Baltic Sea. Geophysical Research Letters, 2010, 37(9): 1-6. |
 2015, Vol. 27
2015, Vol. 27 

