(2: 中国科学院重庆绿色智能技术研究院,重庆 400030)
(3: 中国长江三峡集团,北京 100030)
(4: 中国科学院水库水环境重点实验室,重庆 400030)
(2: Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing400030, P.R.China)
(3: China Three Gorges Corporation, Beijing100030, P.R.China)
(4: Key Laboratory of Reservoir Water Environment for Chinese Academy of Sciences, Chongqing400030, P.R.China)
磷是水生生态系统的重要生源要素,为藻类等初级生产者的必需营养物质[1],但却常为水体初级生产者生长的限制因子.通常,采用钼锑抗分光光度法所测得的溶解性正磷酸盐被称之为溶解态反应性磷(soluble reactive phosphorus,SRP),其他形态的磷只有转化成SRP才能够被藻类直接利用.在上述转化过程中,碱性磷酸酶可以催化悬浮态颗粒磷和溶解态有机磷(dissolved organic phosphorus,DOP)水解成藻类可直接利用的生物活性磷,并在浮游植物吸收利用DOP的过程中起重要作用[2].
水体中碱性磷酸酶是由细菌、浮游动植物及其残体在活性磷缺乏时分泌的一种促进水体有机磷矿化的混合物.碱性磷酸酶与SRP间为典型的“抑制-诱导”关系,即当水体SRP缺乏时,碱性磷酸酶分泌便会增多、活性增大,以便将水体中的DOP及悬浮态颗粒磷转化成能够被细菌和藻类直接利用的SRP;当水体SRP充足时,碱性磷酸酶的分泌及其活性则受到抑制.其活性高低可反映营养物质转化和能量代谢等的强弱[3],Matavulj等[4-6]认为水中碱性磷酸酶是正磷酸盐来源的补偿载体,提出将碱性磷酸酶活性(APA)作为评价水质的新的生化参数.此外,碱性磷酸酶还与维持一定的细胞磷及N/P比有关[7].Huang等[8]研究海湾中藻利用DOP与APA间的关系,结果表明碱性磷酸酶在藻利用DOP的过程中起着重要的作用.
近年,碱性磷酸酶与磷的地球化学循环间的关系广受关注.然而,研究大多都集中在海洋[9-10]、浅水湖泊[11-12]以及土壤[13]中碱性磷酸酶分布、性质及活性研究.三峡水库支流中碱性磷酸酶的相关报道却不多见[14],有关三峡水库中碱性磷酸酶与磷形态转化间的关系更是鲜见报道.本文选择三峡中段澎溪河高阳平湖为研究区域,研究冬季高阳平湖碱性磷酸酶与不同磷形态转化的关系,以期说明冬末水华暴发与冬季蓄水导致的磷积累有直接联系.
1 材料与方法 1.1 样品采集前期研究表明,冬季高水位期间澎溪河高阳平湖冬季末水华主要发生在每年的2 3月,3月下旬消失.该期间水华现象主要与同期易出现持续约2周的冬旱[15]以及连晴回暖的气象条件有关.
为研究水华暴发前至水华结束期间水体中碱性磷酸酶活性及藻-磷关系,实验时间设为2013年1 3月,涵盖整个冬季末期水华易发季节并延续至冬季末期水华现象结束,地点选在水体流动相对较弱且较易发生水华的高阳平湖李家坝库湾野外试验平台(31.104°N,108.674°E,图 1).

|
图 1 高阳平湖库湾野外试验平台位置 Fig.1 The field experiment platform in Lake Gaoyang |
Trimbee等[16-17]认为藻类群落结构(多样性和演替速率)对外界扰动响应显著的时段为5~15d;Reynolds[18]研究表明淡水水体中藻类世代周期一般为3~4d,两到三倍世代周期(6~16d)可反映藻类群落演替特征.因此,选择采样频次为1 2月每月2次,3月水华暴发,每周1次.采样时间为每天9:30 16:30.为了把握磷库垂向空间特征,采用分层采样,水样分别采自0.5、5、10、20、30、35m水深处(三峡坝前水位为163.76~172.42m,此时高阳平湖水深约为35m).采样时将一部分水样放入预先经高压灭菌的玻璃瓶中用于酶的分析.
1.2 测定指标及方法 1.2.1 常规指标测定方法水温(T)用YSI63型pH计现场测得;水质测定指标有SRP、溶解性总磷酸盐(DTP)、DOP、总磷(TP)和叶绿素a(Chl.a). TP浓度的测定水样为原水样,其余指标的测定水样均经0.45μm滤膜抽滤处理.所有指标的测定均参照《水和废水监测分析方法(第四版)》进行[19].
1.2.2 水体碱性磷酸酶活性(TAPA)和藻类碱性磷酸酶活性(PAPA)的测定碱性磷酸酶能催化水解对硝基苯磷酸二钠(p-NPP)产生黄色稳定的对硝基苯酚,通过比色法测定对硝基苯酚的产生速率以确定碱性磷酸酶活性(APA)[20-21].实验测定方法在李学礼等[20-21]的方法上改进而得:6ml水样加入1ml浓度为0.1mol/L的Tris缓冲液,2ml浓度为1mmol/L的p-NPP,于pH=8.4、温度为30℃条件下反应6h后用紫外可见分光光度计在405nm波长下测定.空白实验采用灭菌蒸馏水代替水样,其他处理相同.碱性磷酸酶活性的计算公式为:
| $ APA = \frac{C}{{t \cdot V}} $ | (1) |
式中,APA为碱性磷酸酶活性(μmol/(L·h)),C为水解反应后产生对硝苯酚的量(μmol),V为水样的体积(L),t为反应时间(6h).
忽略天然水体中浮游动物体内的碱性磷酸酶,故理论上采用3.0μm滤膜(Whatman公司)过滤可将藻类与细菌进行分离.过滤后滤液中的碱性磷酸酶活性为细菌碱性磷酸酶和溶解性碱性磷酸酶活性之和(BAPA+DAPA),上述值同未过滤水样所测得的总碱性磷酸酶活性(TAPA)之差可视为水中藻类生物体的碱性磷酸酶活性,即PAPA=TAPA-(BAPA+DAPA).
1.2.3 碱性磷酸酶动力学参数测定设置0.5、1.0、1.5、2.0、2.5和3.0mmol/L共6个不同的底物(p-NPP)浓度,分别测定碱性磷酸酶的活性(APA),进而通过Michaelis-Menten方程求得碱性磷酸酶动力学参数:
| $ V = \frac{{{V_{\max }} \cdot {C_{\rm{s}}}}}{{{K_{\rm{m}}} + {C_{\rm{s}}}}} $ | (2) |
式中,V为碱性磷酸酶的反应速率(μmol/(L·h)),Km为米氏常数(μmol/L),Cs为底物浓度(μmol/L).
应用Leneweaver-Burk作图法[22],将Michaelis-Menten方程两边分别取倒数得公式(3),通过最小二乘法求得回归直线斜率Km/Vmax和截距1/Vmax,最终求解动力学参数Km和Vmax,水华暴发期间碱性磷酸酶动力学参数拟合结果如图 2所示.
| $ \frac{1}{V} = \frac{{{K_{\mathop{\rm m}\nolimits} }}}{{{K_{{\rm{max}}}}}} \cdot \frac{1}{{{C_{\rm{s}}}}} + \frac{1}{{{V_{\max }}}} $ | (3) |
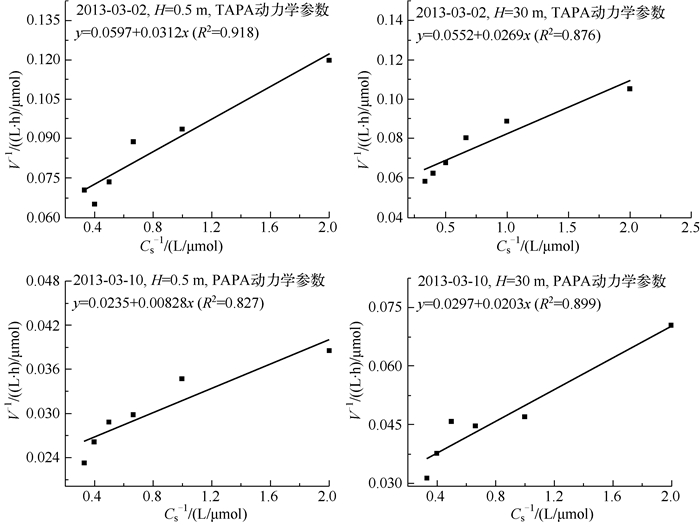
|
图 2 水华期高阳平湖碱性磷酸酶动力学参数拟合 Fig.2 Kinetic linear regression of TAPA and PAPA during the algal bloom in Lake Gaoyang |
研究期间高阳平湖TAPA和Vmax的均值分别为11.20±6.53和30.45±19.55μmol/(L·h).TAPA和Vmax随时间变化差异极显著(P<0.01),研究期间,TAPA变化范围为4.75~28.62μmol/(L·h),变异系数为58.29 %,呈现出先小幅增加,随后下降而后再次增加的趋势,并在3月中旬出现最大值.总碱性磷酸酶Vmax的变化范围为12.83~87.35μmol/(L·h),变异系数为64.20 %,其变化趋势基本与TAPA一致,于2月中旬出现小幅度增加并在3月中旬出现最大值(图 3).

|
图 3 高阳平湖TAPA和Vmax的垂向变化 Fig.3 Vertical variations of TAPA and Vmax in Lake Gaoyang |
研究期间不同水层的TAPA及其Vmax差异不显著(P>0.05),水体混合均匀,分层现象不明显,仅在水华暴发期和水华后期(3月上旬至3月中旬)同时出现了较明显的垂向分层,差异较显著(P<0.05),这与该时期水温出现的弱分层以及水华暴发时水体中Chl.a浓度出现的分层相吻合.
2.1.2 水体中藻类碱性磷酸酶活性及其动力学参数的时空变化采用藻类碱性磷酸酶活性与叶绿素a所代表的生物量的比值(PAPA/Chl.a)作为特异性活性来表征单位生物量所表现的活性,从实质上反映酶的内在催化效力.研究期间高阳平湖水体中特异性碱性磷酸酶活性(PAPA/Chl.a)、藻类碱性磷酸酶Vmax和PAPA/TAPA的均值分别为:1.05±1.06mol/ (mg·h)、14.78±13.32μmol/(L·h)和36.91 % ±14.99 %.从时间分布上来看,PAPA/Chl.a、Vmax和PAPA/TAPA随着时间的变化差异极显著(P<0.01),研究期间,PAPA/Chl.a的变化范围为0.093~3.680mol/(mg·h),变异系数为101.15 %,总呈现先增加后减少再增加的变化趋势,于1月下旬和3月中旬呈现出两个峰值;藻类碱性磷酸酶Vmax的变化范围为0.50~60.87μmol/(L·h),变异系数为90.14 %,其变化趋势与PAPA/Chl.a变化趋势大体一致,在2月中旬出现小幅上升后下降并在3月中旬出现最大值;PAPA/TAPA的最大值出现在2月中旬,并在3月中旬出现一个短暂增长后回落(图 4).
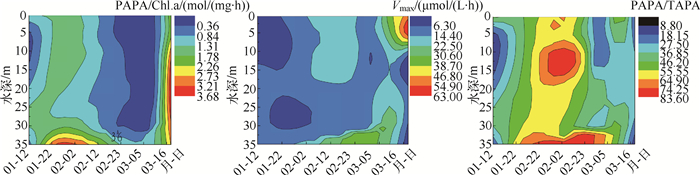
|
图 4 高阳平湖PAPA/Chl.a、碱性磷酸酶Vmax和PAPA/TAPA的垂向变化 Fig.4 Vertical variations of PAPA/Chl.a, Vmax and PAPA/TAPA in Lake Gaoyang |
空间上,研究期间不同水深的PAPA/Chl.a、藻类碱性磷酸酶Vmax和PAPA/TAPA差异并不显著(P>0.05),水体混合均匀,分层不明显,仅藻类碱性磷酸酶Vmax在水华后期(3月中旬至下旬)的表层水体中出现纵向递减现象,但不同水层之间差异并不显著,这与此时水温出现弱分层以及水体Chl.a浓度出现的分层一致.
2.1.3 不同形态磷浓度、叶绿素a和水温的时空变化研究期间,水体中TP、SRP、DOP、Chl.a和水温的均值分别为:0.071±0.012g/m3、0.044±0.015g/m3、0.011±0.007g/m3、8.60±10.85mg/L和13.33±1.86℃,其时空变化趋势如图 5所示.从时间分布上来看,在整个研究期间,TP、SRP和DOP浓度均呈先减小后增大的趋势,其变化范围分别为0.049~0.096、0.010~0.058和0~0.026g/m3,其中DOP浓度在1月下旬至2月下旬期间降到整个研究期间最低值(0.0036±0.0019g/m3),SRP浓度在3月中旬降至最低(0.014±0.0020g/m3),而后逐渐升高;Chl.a浓度的变化范围为1.15~47.85mg/L,其变化趋势却同SRP浓度变化趋势相反,总体呈先增加后下降的趋势,在3月中旬达峰值(29.64±14.27g/m3),而后逐渐下降;水温的变化范围为11.2~18.9℃,其变化趋势与TP和SRP浓度的变化趋势一致.从空间分布上来看,在整个研究期间不同水深的TP、SRP和DOP浓度差异并不显著(P>0.05),水质混合较均匀,水质分层现象总体并不明显.随着气温回暖,在研究末期(3月中旬至下旬)水温出现弱分层现象,受温度和光照的影响Chl.a浓度也在该时段出现一定的分层,垂向空间差异并不显著(P>0.05).
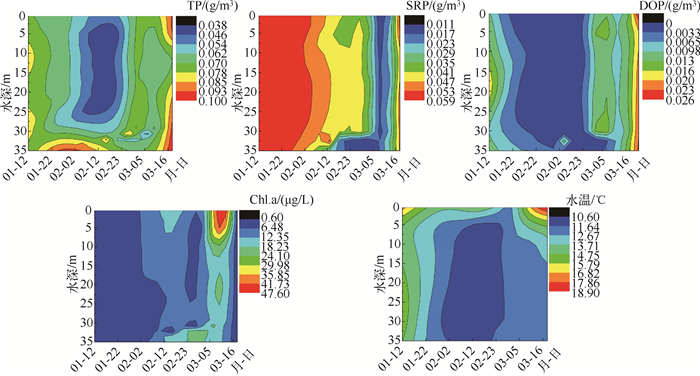
|
图 5 高阳平湖TP、SRP、DOP、Chl.a浓度和水温的垂向变化 Fig.5 Vertical variations of TP, SRP, DOP, Chl.a concentrations and water temperature in Lake Gaoyang |
TAPA及其Vmax、PAPA及其Vmax、各种形态磷浓度、Chl.a浓度等均随时间变化显著,这主要是受温度和水体活性磷的影响.温度可以影响酶活性,低温抑制酶活性,一定范围内温度升高则会使酶活性增加,周易勇等[23]研究表明水体碱性磷酸酶活性表达的最佳温度范围为25~40℃,温度过高或过低均不利于活性的表达.SRP则通过与碱性磷酸酶间的“抑制-诱导”关系来影响其含量及活性,从而影响水体中各种形态的磷浓度;由于SRP是藻类等直接利用的磷营养盐,因而其与水体Chl.a浓度呈现出典型的正相关关系.它们在纵向上差异较小,表明研究期间水体总体混合较均匀;然而水华后期(3月中旬至下旬),水体呈现较明显的垂向分布,可能是由水温的弱分层及光照变化引起Chl.a呈现出分层的原因引起,这也与图 2中0.5m处的藻类碱性磷酸酶内在催化活性高于30m处的研究结果相符.水华暴发时(约3月中旬),水体表层Chl.a浓度陡增,且整个水体呈现出较明显的分层现象,由于能够被藻类利用的磷主要是SRP,因此,水华暴发时,水体SRP含量降到了最低(图 5).
磷素通常是水体的限制性营养盐,能够被藻类和细菌直接利用的活性磷SRP仅占总磷的5 %左右[24].Vmax和Km是酶的两个动力学参数,Vmax表征酶的内在催化速率,而Km表征对底物的亲和力,其值越小则表明对底物的亲和力越强[21],Km/Vmax则可以表征DOP的周转时间,其值越小,DOP的周转时间越短[25].表 1显示,实验中TAPA及其动力学参数Vmax与SRP浓度呈显著负相关,这和碱性磷酸酶与SRP间的“抑制-诱导”机制相符,当水体SRP浓度不能满足细菌和藻类生长需要时,细菌或藻类便会分泌碱性磷酸酶以分解溶解性有机磷和悬浮态有机磷从而使水体中SRP得到补偿[26-27],水体碱性磷酸酶活性增大,催化反应速率加快;当SRP充足时,其活性便会受到抑制,藻类、细菌等分泌碱性磷酸酶的能力亦受到抑制.此外,TAPA与Chl.a浓度呈显著正相关(表 1),这与Jones的研究相符[28],表明总碱性磷酸酶含量可以在一定程度上表征水体生物量.TAPA与水温、DOP、TP浓度均呈正相关,总碱性磷酸酶Vmax与各环境变量间的相互关系与TAPA一致.TAPA及其Vmax与环境因子间呈现的相关关系均为温度、SRP、磷素等综合影响的结果.
| 表 1 TAPA及其动力学参数Vmax与环境因子的相关性分析 Tab.1 Correlation analysis among TAPA, Vmax and the environmental factors |
根据碱性磷酸酶及环境因子的变化规律,可初步将2013年高阳平湖高水位水华期划分成4个阶段.Ⅰ阶段(1月中旬至2月中旬)为水华暴发前期,当SRP浓度降到0.057g/m3时,水体中SRP浓度已不能满足藻类对磷浓度的吸收要求,藻类被诱导产生大量AP,特异性碱性磷酸酶活性相对较高,期间水体中AP主要是藻类碱性磷酸酶,约占50 %.由此可知,研究期间高阳平湖藻类对SRP浓度降低的反应较细菌敏感,这与Fitzgerald等[29]研究结果一致.Ⅱ阶段(2月中旬至3月上旬),水体中SRP浓度已不能满足藻类和细菌的需求,但此时水温太低不利于碱性磷酸酶活性的表达[30],水体中TAPA和PAPA/Chl.a及其相关动力学参数值均较低.Ⅲ阶段(3月上旬至中旬),光热条件适合藻类生长,冬季末暴发水华,水体中藻类、浮游动物和细菌等对SRP消耗增加,SRP浓度持续降低,当降至0.041g/m3时,SRP已不能满足细菌生长需要,细菌被刺激而大量分泌碱性磷酸酶,TAPA逐渐增大,PAPA/Chl.a较小,在3月中旬SRP降至最低值、Chl.a浓度达到最大值,水体中的碱性磷酸酶主要由细菌产生.Ⅳ阶段(3月中旬至下旬),冬季末水华结束,藻类逐渐死亡,TAPA达到最大以分解藻类合成的有机物质,SRP浓度逐渐回升,水中碱性磷酸酶主要来自于细菌.文中藻类对水体缺磷的响应阈值相比高光等[31]研究太湖得到的藻类碱性磷酸酶分泌阈值大,这也体现了三峡水库水体的独特性.水华期各阶段内碱性磷酸酶及环境因子均值变化如图 6所示.

|
图 6 高阳平湖高水位水华期不同阶段碱性磷酸酶及环境因子均值变化 Fig.6 Changes of average TAPA and different environmental factors during algal blooms in Lake Gaoyang |
水体中碱性磷酸酶诱导-抑制机制复杂,在Ⅰ阶段特异性磷酸酶活性升高,水体中碱性磷酸酶以PAPA为主,而在水华暴发的Ⅲ阶段,特异性碱性磷酸酶活性却相对较低.水华和特异性碱性磷酸酶合成时间出现不匹配现象,可能是因为PAPA受PO43-浓度的显著影响,而细菌碱性磷酸酶由于Km值较大,受PO43-抑制不明显[30-31],因此藻类对PO43-的响应较细菌敏感.Ⅰ阶段水体PO43-浓度降低,由于PAPA对其响应敏感,使得藻类碱性磷酸酶大量分泌且活性较高;水华暴发的Ⅲ阶段由于水体PO43-的大量消耗,水体活性磷降至细菌碱性磷酸酶作用的阈值,致使对PO43-浓度变化不太敏感的细菌亦明显感到活性磷的缺乏而分泌大量的碱性磷酸酶,此时在细菌-藻类之间形成一个短程循环,同时由于细菌分泌的大量碱性磷酸酶的抑制作用,使得藻类分泌碱性磷酸酶的能力减弱,因而水华暴发期间水体碱性磷酸酶主要来自于细菌.
4 结论1) 2013年三峡高水位高阳平湖冬末水华过程中,PAPA/TAPA及其动力学参数Vmax、水体TAPA及其Vmax均呈现出先增加后减小再增加的趋势,约2月中旬和3月中旬出现峰值;PAPA/TAPA先增加后减小,水华暴发前期达最大值,表明水华暴发前水体中活性磷主要来自藻类碱性磷酸酶;水体Chl.a浓度呈先增加后减小的趋势,于3月中旬达到最大,SRP浓度变化趋势则与Chl.a浓度相反;影响藻类和细菌碱性磷酸酶合成的SRP浓度分别为0.057和0.041g/m3,表明藻类对于磷浓度降低的反应较细菌敏感.
2) 根据碱性磷酸酶活性变化特征,高阳平湖冬末水华过程可分为4个阶段.Ⅰ阶段为诱导期,水体活性磷主要来自藻类碱性磷酸酶分解的有机磷,藻类对磷过度摄取.Ⅱ阶段为过渡期,温度低,水体碱性磷酸酶活性相对较低.Ⅲ阶段为水华时期,水中碱性磷酸酶主要来源于细菌,Chl.a浓度达到最大,SRP浓度达到最低.Ⅳ阶段为水华末期,水体Chl.a浓度逐渐下降,SRP浓度回升,水中碱性磷酸酶主要来源于细菌.
| [1] |
Wetzel RG. Limnology-Lake and river ecosystems:third edition. New York: Academic Press, 2001, 266-269.
|
| [2] |
Chrost RJ, Siuda W, Halemejko GZ. Long term studies on alkaline phosphatase activity(APA) in a lake with fish-aquaculture in relation to lake eutrophication and phosphorus cycle. Archiv für Hydrobiologie Supplement, 1984, 70(1): 1-32. |
| [3] |
Nannipier P, Bollag JM. Use of enzymes to detoxify pestucide-contaminated soils and waters. Journal of Environmental Quality, 1991, 20(3): 510-517. |
| [4] |
Matavulj M, Gajin S, Gantar M et al. Phosphatase activity as an additional parameter of water condition estimate in some lakes of Vojvodina Province. Actaboilingosl, 1984, 21(1): 53-62. |
| [5] |
Matavulj M. The nonspecific phosphomonoester-hydrolases of microorganisms and their significance in phosphorus cycle in aquatic environments[Dissertation]. Serbian: University of Zagreb, 1986.
|
| [6] |
Matavulj M, Gajin S, Erbeznik M et al. Phosphatase activity of water as a parameter of the river tisa water monitoring. Tiscia(Szeged), 1989, 23: 29-36. |
| [7] |
Waiser MJ, Robarts RD. Microbial nutrient limitation in prairie saline lakes with high sulfate concentration. Limnology and Oceanography, 1995, 40(3): 566-574. DOI:10.4319/lo.1995.40.3.0566 |
| [8] |
Huang BQ, Hong HS. Alkaline phosphatase activity and utilization of dissolved organic phosphorus by algae in subtropical coastal waters. Marine Pollution Bulletin, 1999, 39(1-12): 205-211. DOI:10.1016/S0025-326X(99)00006-5 |
| [9] |
Huang B, Ou L, Wang X et al. Alkaline phosphatase activity of phytoplankton in East China Sea coastal waters with frequent harmful algal bloom occurrences. Aquatic Microbial Ecology, 2007, 49(2): 195. |
| [10] |
唐洪杰, 杨茹君, 张传松等. 几种海洋微藻的碱性磷酸酶性质初步研究. 海洋科学, 2006, 30(10): 61-64. DOI:10.3969/j.issn.1000-3096.2006.10.013 |
| [11] |
徐爽, 刘存歧, 董梦荟等. 白洋淀水体和沉积物中碱性磷酸酶活性的时空分布及其影响因素. 环境科学学报, 2013, 33(12): 3317-3323. |
| [12] |
张成艳, 成小英, 王建军等. 傀儡湖水体中碱性磷酸酶活性的时空变化及其影响因素. 应用与环境生物学报, 2013, 19(3): 489-494. |
| [13] |
姜经梅, 赵慧, 沈铭能等. 长江口潮滩表层沉积物中碱性磷酸酶活性及其影响因素. 环境科学学报, 2011, 31(10): 2233-2239. |
| [14] |
袁轶君, 毕永红, 朱孔贤等. 三峡水库沉积物中碱性磷酸酶的活性. 环境科学与技术, 2014, 37(1): 60-64. |
| [15] | |
| [16] |
Trimbee AM, Harris G. Use of time-series analysis to demonstrate advection rates of different variables in a small lake. Journal of Plankton Research, 1983, 5(6): 819-833. DOI:10.1093/plankt/5.6.819 |
| [17] |
Gaedeke A, Sommer U. The influence of the frequency of periodic disturbances on the maintenance of phytoplankton diversity. Oecologia, 1986, 71(1): 25-28. DOI:10.1007/BF00377315 |
| [18] |
Reynolds CS. Scales of disturbance and their role in plankton ecology. Hydrobiologia, 1993, 249(1-3): 157-171. DOI:10.1007/BF00008851 |
| [19] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002, 243-285.
|
| [20] |
李学礼, 周晓霞. 生物化学与分子生物学实验技术教程. 上海: 同济大学出版社, 2008.
|
| [21] |
高光, 朱广伟, 秦伯强等. 太湖水体中碱性磷酸酶的活性及磷的矿化速率. 中国科学:D辑:地球科学, 2005, 35(Ⅱ): 157-165. |
| [22] |
戚以政, 汪叔雄. 生化反应动力学与反应器:第2版. 北京: 化学工业出版社, 1999.
|
| [23] |
周易勇, 付永清. 水体磷酸酶:来源, 特征及其生态学意义. 湖泊科学, 1999, 11(3): 274-282. DOI:10.18307/1999.0313 |
| [24] |
Halemejko GZ. The role of phosphatases in phosphorus mineralization during decomposition of lake phytoplankton blooms. Archiv für Hydrobiologie, 1984, 101(4): 489-502. |
| [25] |
Reynolds S, Wolff GA, Williams RG et al. Phosphorus cycling in the North and South Atlantic Ocean subtropical gyres. Nature Geoscience, 2008, 1(7): 439-443. DOI:10.1038/ngeo232 |
| [26] |
孔繁翔, 宋立荣. 蓝藻水华形成过程及其环境特征研究. 北京: 科学出版社, 2011.
|
| [27] |
Hapman A, Foster I, Lees J et al. Particulate phosphorus transport by sub-surface drainage from agricultural land in the UK. Environmental significance at the catchment and national scale. Science of the Total Environment, 2001, 266(1): 95-102. |
| [28] |
Jones JG. Studies on freshwater micro-organisms:phosphatase activity in lakes of differing degrees of eutrophication. The Journal of Ecology, 1972, 60: 777-791. DOI:10.2307/2258564 |
| [29] |
Fitzgerald GP, Nelson TC. Extractive and enzymatic analyses for limiting or surplus phosphorus in algae. Journal of Phycology, 1975, 11(S1): 32-37. DOI:10.1111/j.1529-8817.1975.tb04539.x |
| [30] |
Healey F, Hendzel L. Fluorometric measurement of alkaline phosphatase activity in algae. Freshwater Biology, 1979, 9(5): 429-439. DOI:10.1111/fwb.1979.9.issue-5 |
| [31] |
高光, 高锡芸, 秦伯强等. 太湖水体中碱性磷酸酶的作用阈值. 湖泊科学, 2000, 12(4): 353-358. DOI:10.18307/2000.0409 |
 2015, Vol. 27
2015, Vol. 27 

