随着湖泊富营养化日益严重,湖泊沉积物作为水环境的重要组成部分,在水体污染研究中具有特殊的重要性,沉积物是各种营养盐的主要存储仓库,承担着对上覆水的净化功能[1].但是作为内源的湖泊沉积物,在受到扰动时营养盐会再释放回水体中,维持湖泊的富营养化状态[2].浅水湖泊的沉积物易受波浪、湖流、疏浚以及船只航行等外力扰动而发生再悬浮,悬浮过程中由于吸附-解吸作用造成营养盐在悬浮颗粒物和水体间迁移,导致上覆水中营养盐浓度突然上升[3-5].自然水体中氮:磷比通常为20 : 1或更高,而大多数藻类旺盛生长的最适氮:磷比为7 : 1,水体磷浓度已成为评价水体富营养化的主要指标之一[6].因此,控制水体磷含量使其保持较低水平是防止藻类旺盛生长和水体藻化的重要手段.
湖泊沉积物中生长的大型沉水植物可保护沉积物表面,减小风浪等动力扰动,抑制湖泊沉积物的再悬浮,并且可以吸收、吸附一定量的水体污染物,从而降低上覆水中营养盐浓度[7-8].水生植物在生长过程中需要吸收大量的磷,如每平方米香蒲(Typha orientalis)每年可吸收磷0.00403kg[9].王旭明[10]利用水芹(Oenanthe decumbens)在室内净化污水,3d内水芹对总磷(TP)的吸收率达到73.7 %,而且净化率随温度的增加不断增加.目前植物对磷吸收的静态实验研究已比较成熟.由文辉等[11]在富营养化水体中,利用人工基质无土栽培水生植物净化水质的静态实验结果表明,在5 10月,水蕹菜(Ipomoea aquatica Forsk)对TP的去除率为94.77 %.刘嫦娥等[12]污水厂尾水的净化研究也表明苦草对磷有较强的去除能力.Kern等[13]用芦苇床处理生活污水的动态实验表明,总磷的去除率在80 % ~99 %之间.但是水动力条件下水生生物对沉积物磷再释放的影响研究还不够充分.苦草是浅水湖泊(如太湖)中重要的水生生物,对去除水环境中沉积物和上覆水中的磷有着重要的作用[14-15].因此,在水动力作用下,研究有、无大型水生植物覆盖两种环境下沉积物-水界面的磷释放对评价沉积物中营养盐的动态循环、分析大型水生植物对湖泊底泥营养盐的环境作用、把握湖泊水污染发生机制、控制水体富营养化均具有重要意义.
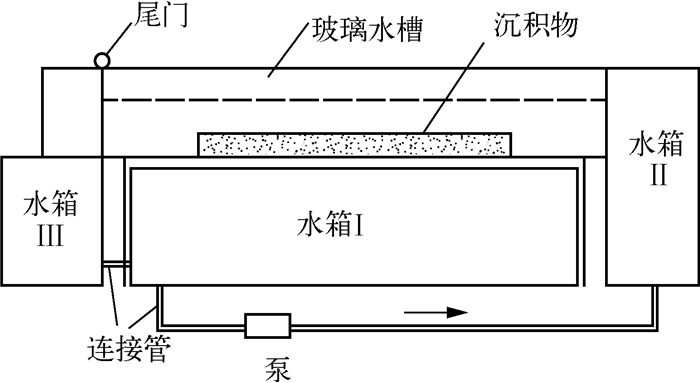
1 材料与方法 1.1 装置与材料 1.1.1 装置实验主要装置为水可独立循环的动水槽,剖面结构如图 1所示.实验由两组相同的动水槽装置(D1槽和D2槽)组成,同时用2组静水槽装置(J1槽和J2槽)作为对照.
|
图 1 实验动水槽装置 Fig.1 Experimental set-up of dynamic water tank |
动水槽上部的玻璃水槽被分为3个平行水槽,每个平行水槽尺寸为2m(长)×0.3m(宽)×0.4m(高),并连接着循环水系统.沉积物(1.5m×0.3m×0.1m)铺在每个平行水槽的底部.1m3的水储存在水箱Ⅰ中.水流通过水泵从水箱Ⅰ中抽出,流经右侧的Ⅱ号水箱,再同时经过上部的3个平行水槽,通过出水端的尾门,最后经左部的回流水箱Ⅲ流回底部水箱Ⅰ,如此循环.水泵的最大流量为100m3/s.上部水槽的出水端设有叶栅式尾门,与水泵共同作用来调节水体的流速和水位.水箱Ⅱ中的水同时流经3个平行水槽,能够使平行水槽的水流条件一致,达到平行实验的要求.当装置运行稳定后,可用ADV流速仪来测定水体流速,并通过调节流量和尾门以达到期望的流速和水深.
静水槽(2m×1m×0.8m)内根据动水槽的泥水比和水深,设计3个泥槽(0.85m×0.17m×0.1m)用于铺放沉积物,保证静水槽和动水槽泥水比及水深一致,各泥槽用挡板隔开,互为平行.
1.1.2 材料底泥取自太湖梅梁湾,用彼得森采泥器采集表层泥,采集的样品保存于洁净的聚乙烯袋中(排出空气),迅速带回实验室.
沉水植物苦草由杭州清清水环境修复技术有限公司提供.在实验环境下静水槽驯养30d,期间保持曝气.30d后取少量苦草进行室内分析,其余均匀种植于各槽所铺沉积物上.
1.2 设计与方法为了更好地接近自然环境,实验装置置于顶楼的玻璃房内,有自然条件下的通风与光照.实验周期内,室温为28~35℃,水温为24~31℃.在D1动水槽和J1静水槽中只铺沉积物,D2动水槽和J2静水槽铺上沉积物后种植苦草,8株1簇,每排3簇,共15排.为了给水流预留缓冲带,将采集的底泥均匀铺在动水槽平行水槽中间位置,长度为1.5m,厚度为8cm,两端用挡板固定(图 1).静水槽中的沉积物铺于小泥槽中.实验用水采用除氯自来水.动水槽、静水槽水深均为18cm.
装置运行前的时间为第0d,静沉1d后开始运行并采样.采样时间为第0、1、3、6、12、20、30、40d.每次采样时间固定为上午9点.沉积物TP含量采用欧洲标准测试委员会框架下发展的SMT分离法中的灰化-钼锑抗比色法测定[16];水样经过硫酸钾高压消解后采用钼酸铵分光光度法测定上覆水TP;水样过滤后用硫酸钾高压消解后采用钼酸铵分光光度法测定上覆水总溶解态磷(TDP);水样过滤后采用钼酸铵分光光度法测定上覆水正磷酸盐(PO43--P)[17].
1.3 质量控制与数据分析实验所用玻璃及聚乙烯器皿均以30 %的HCl溶液充分浸泡24h以上,用超纯水充分清洗.试剂为分析纯和优级纯,实验用水为超纯水(>18MΩ).每个样品测定时设置3个平行样,取平均值作为结果.数据处理采用Excel 2010、Origin 8.5和SPSS 13.0 for Windows进行统计分析.
2 结果与分析 2.1 动、静水条件下苦草对沉积物中磷含量的影响为保证实验过程中沉积物不受扰动,本文只采集实验初始和实验末的沉积物,并对沉积物柱样进行分层分析.
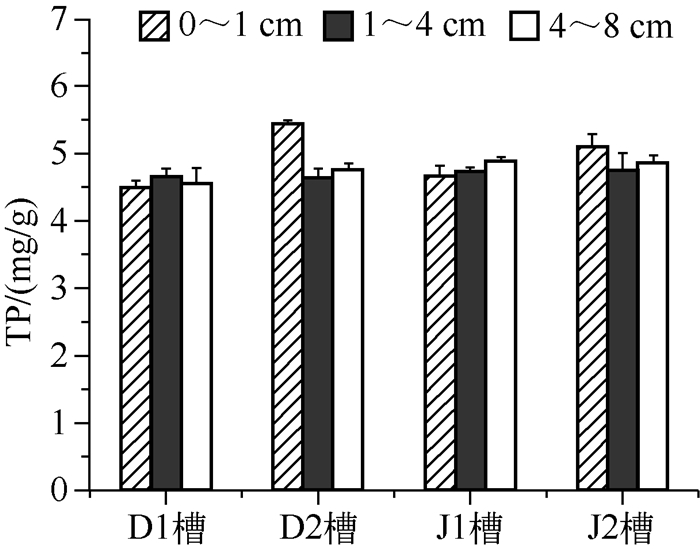
4组实验水槽中沉积物TP初始含量为5.843mg/g,40d后D1、D2、J1和J2水槽TP含量分别降到4.367、4.810、4.745和5.149mg/g,相对于第0d分别下降21.8 %、17.7 %、18.8 %和11.9 % (图 2).沉积物TP分层含量(图 2)表明,4个水槽沉积物各层TP含量均下降,下降幅度与平均含量下降幅度相近.D1和J1水槽上层沉积物TP含量下降幅度较大,但D2和J2水槽0~1cm表层沉积物TP含量明显较D1和J1槽高.即TP含量动水条件下都低于静水条件,说明水动力可以加强沉积物中TP向上覆水中释放.而有苦草处理的水槽中,表层0~1cm沉积物TP含量较高,1cm以下沉积物TP含量较低,造成该现象可能的原因有两点:一是种植苦草的水槽减少了水动力的作用,降低TP从表层沉积物中的释放,苦草在生长期能够直接吸收沉积物中的磷作为营养物质,从而减少下层沉积物中的TP含量;二是实验中有苦草的枯萎叶片沉降到沉积物表面,吸收到叶片中的磷重新释放到沉积物表面,造成表层沉积物TP含量较高.沉水植物的根及其地上部分都有吸收矿质营养的能力,但根、茎、叶对营养盐的选择性有所不同.研究表明沉水植物生长所需要的磷主要是通过根系吸收[18].本实验所选取的苦草在实验期间处于生长旺盛期[19],需吸收大量的营养来满足自身的生长,导致植物根际沉积物中TP含量减少.此外,苦草根部周围特有的共生菌可以促进植物对磷的吸收及植物生长[20].
|
图 2 4个实验组40d后沉积物总磷含量分层变化 Fig.2 Total phosphorus concentrations in different sediment layers at day 40 in four groups |
苦草可以从沉积物和上覆水中吸收磷,降低上覆水中的磷浓度.上覆水TP和TDP浓度由实验测定,上覆水总颗粒态磷(TSP)=TP-TDP.
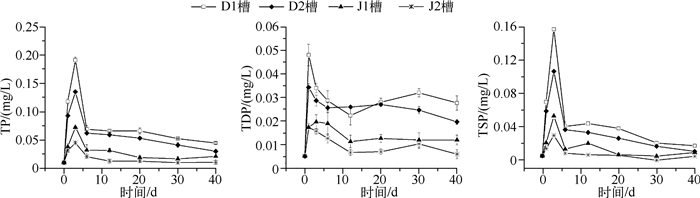
上覆水TP和TSP浓度随时间的变化规律相似.4个水槽上覆水中TP与TSP浓度均呈极显著相关性(表 1,P<0.01).2个动水槽的TP和TSP浓度均明显大于静水槽,说明水动力条件能大大促进磷从底泥中的释放.在前3d 4个水槽上覆水中TP浓度大幅增加,从0.01mg/L分别升到0.19、0.14、0.07、0.05mg/L.孙小静等[21]的底泥搅动实验表明,没有植物的条件下,水体TP浓度在第0.5d达到最大值(0.272mg/L).D2水槽TP浓度比D1水槽稍低,这是由于D2水槽水生植物的截留作用,减少水动力对沉积物的扰动作用.第3d后,4个水槽的TP浓度大幅下降,第6d后分别下降到较低值,并在之后的34d中保持稳定.上覆水TDP浓度在第1d就大幅增加并达到最大值,从0.005mg/L分别增加到0.048、0.034、0.017、0.017mg/L,持续下降到第12d后保持稳定.在实验初始阶段进入到上覆水中的TP主要通过颗粒态的形式进入.
|
图 3 上覆水总磷、总溶解态磷和总颗粒态磷浓度随时间的变化 Fig.3 The concentrations of total phosphorus, total dissolved phosphorus and total suspended phosphorus in surface water over time |
| 表 1 上覆水总磷、总溶解态磷、总颗粒态磷之间的相关性 Tab.1 The relationships among total phosphorus, total dissolved phosphorus andtotal suspended phosphorus in surface water |
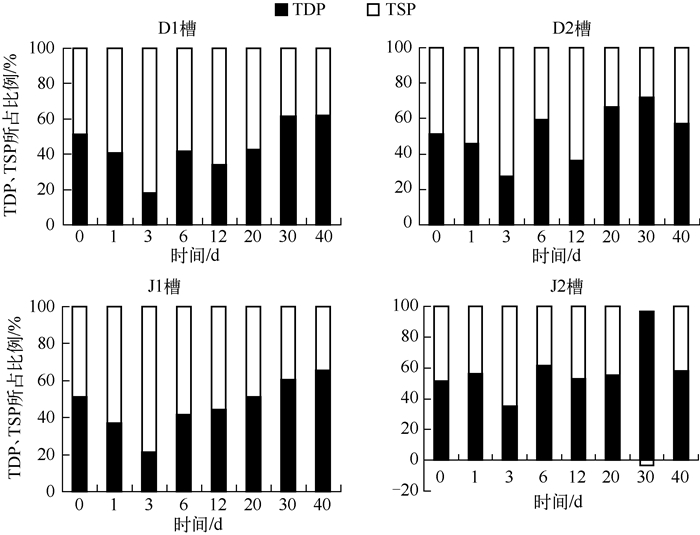
实验的40d内2个动水槽TSP相对于TDP占有较大比例,静水槽中比例相近(图 4).这说明磷从沉积物中释放与沉积物颗粒的再悬浮密切相关,上覆水中的磷大部分来自悬浮颗粒物.动水槽运行的前期,特别是第3d TSP的比例增加较明显,也是由前3d受水动力影响悬浮颗粒大量悬浮引起的.有、无沉水植物对上覆水TDP和TSP的分布没有明显影响.
|
图 4 4个水槽中总溶解态磷与总颗粒态磷比例随时间的变化 Fig.4 The proportion of TDP and TSP in surface water in four flumes over time |
正磷酸盐(PO43--P)是植物可以直接利用的磷.4个水槽上覆水PO43--P浓度变化有较大的差别,特别是动水槽(图 5).无苦草水槽PO43--P浓度在第1d上升到最大值,为0.084mg/L,后下降再缓慢上升,最终浓度为0.039mg/L.有苦草D2水槽PO43--P浓度明显较小,第3d达到最大值0.027mg/L,后缓慢下降,40d后达到0.008mg/L.静水槽无苦草组PO43--P平均浓度比D2槽稍大,有苦草组浓度最低,40d后达到0.003mg/L.相关性分析可以看出,PO43--P与TP、TDP和TSP没有规律性的相关性(表 2).在无苦草的动水槽中PO43--P与TDP显著相关,在有苦草的动水槽中PO43--P与TP、TSP显著相关.以上分析表明苦草对水中PO43--P的去除有明显作用.Dierberg等[22]研究以麝香草为代表的沉水性植物的磷移除机理,表明金鱼藻、麝香草、瓜达鲁帕茨藻可以清除不同化学种类的磷-磷块、可溶活性磷和PO43--P.另外,研究表明[23],湖泊水体中PO43--P浓度很低时,水生生物能通过外部负荷、再循环或内部负荷等途径,得到可利用的PO43--P.其中沉水植物根系分泌碱性磷酸是重要方面[24].当水体中PO43--P浓度较低时,碱性磷酸酶的活性增加,使得水体中有机磷的分解、释放速率加快,导致水体中PO43--P浓度增加;随着PO43--P浓度的增加,水体中碱性磷酸酶的活性受到抑制,从而使得水体中有机磷的分解、释放速率减缓,再加上藻类、细菌的生长利用,导致水体中PO43--P浓度又逐渐减少.
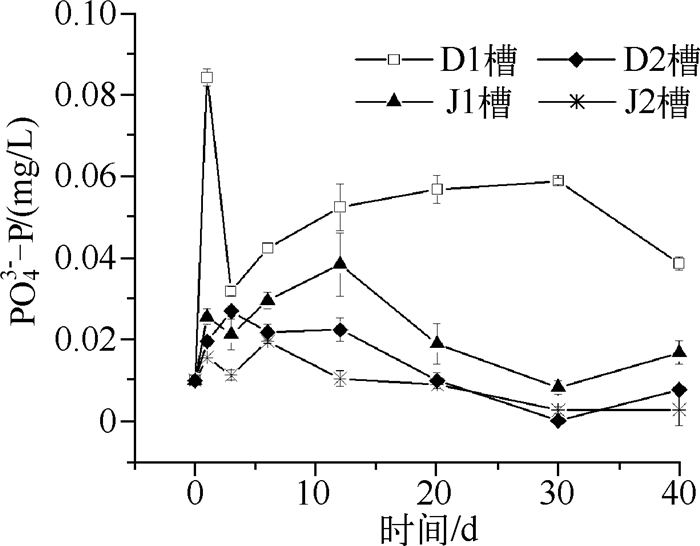
|
图 5 上覆水正磷酸盐浓度随时间的变化 Fig.5 The concentration of orthophosphate in surface water over time |
| 表 2 上覆水正磷酸盐与总磷、总溶解态磷、总颗粒态磷之间的相关性 Tab.2 The relationships between orthophosphate and total phosphorus, total dissolved phosphorus, total suspended phosphorus in surface water |
相对于静水条件,沉积物磷在水动力条件下有明显的释放.水动力加速表层沉积物TP的释放速率,使表层沉积物磷含量降低,但是对于底层沉积物磷含量的影响并不显著.在水动力条件下进入上覆水的磷中TSP相对于TDP占有较大的比例.苦草的存在减少水槽水流紊动,使得表层沉积物的磷含量受到水动力的扰动较小,从而减少其释放量.但是对TDP和TSP在上覆水中所占比例没有显著影响.枯萎腐烂的苦草叶片落在沉积物表层,可以在一定程度上增加磷含量.由于苦草的生长需要,其根系从周围沉积物中吸收磷,1~4cm沉积物层的吸收量大于4~8cm沉积物层.在实验初始阶段,磷主要通过悬浮颗粒进入上覆水,而通过间隙水和沉积物表层溶解释放的磷含量较小但较稳定.苦草降低磷从沉积物中的释放量并且对水中正磷酸盐的去除有显著作用.
| [1] |
秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301 |
| [2] |
罗玉兰. 城市内河沉积物营养盐污染特性及释放规律研究[学位论文]. 南京: 河海大学, 2007.
|
| [3] |
Achman DR, Brownawell BJ, Zhang L. Exchange of polychlorinated biphenyls between sediment and water in the Hudson River Estuary. Estuaries, 1996, 19(4): 950-965. DOI:10.2307/1352310 |
| [4] |
Domagalski JL, Kuivila KM. Distribution of pesticides and organic contaminants between water and suspended sediment, San Francisco Bay, California. Estuaries, 1993, 16(3A): 416-426. |
| [5] |
Sehneider A, Porter E, Baker A. Polychlorinated biphenyl release from resuspended Hudson River sediment. Environmental Science and Technology, 2007, 41(4): 1097-1103. DOI:10.1021/es0607584 |
| [6] |
朱广伟, 秦伯强, 高光等. 长江中下游浅水湖泊沉积物中磷的形态及其与水相磷的关系. 环境科学学报, 2004, 24(3): 281-288. |
| [7] |
杨荣敏, 李宽意, 王传海等. 大型水生植物对太湖底泥磷释放的影响研究. 农业环境科学学报, 2007, 26(增刊): 274-278. |
| [8] |
吴强亮, 谢从新, 赵峰等. 沉水植物苦草(Vallisneria natans)对沉积物中磷赋存形态的影响. 湖泊科学, 2014, 26(2): 228-234. DOI:10.18307/2014.0209 |
| [9] |
贺锋, 吴振斌. 水生植物在污水处理和水质改善中的应用. 植物学通报, 2003, 20(6): 641-647. |
| [10] |
王旭明. 水芹菜对污水净化的研究. 农业环境保护, 1999, 18(1): 34-35. |
| [11] |
由文辉, 刘淑媛, 钱晓燕. 水生经济植物净化受污染水体研究. 华东师范大学学报, 2000, 3(1): 99-102. |
| [12] |
刘嫦娥, 赵健艾, 易晓燕等. 静态条件下沉水植物净化污水厂尾水能力研究. 环境科学与技术, 2011, 12(34): 271-275. |
| [13] |
Kern J, Idler C. Treatment of domestic and agricultural waste water by reed bed systems. Ecological Engineering, 1999, 12: 13-25. DOI:10.1016/S0925-8574(98)00051-2 |
| [14] |
Emily R, Benson JM, O'Neil WC et al. Using the aquatic macrophyte Vallisneria americana(wild celery) as a nutrient bioindicator. Hydrobiologia, 2008, 596: 187-196. DOI:10.1007/s10750-007-9095-0 |
| [15] |
王立志, 王国祥, 俞振飞等. 苦草(Vallisneria natans)生长期对沉积物磷形态及迁移的影响. 湖泊科学, 2011, 23(5): 753-760. DOI:10.18307/2011.0513 |
| [16] |
Ruban V, López-Sánchez JF, Pardo P et al. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments A synthesis of recent works. Fresenius' Journal of Analytical Chemistry, 2001, 370(2/3): 224-228. |
| [17] |
刘鸿亮. 湖泊富营养化调查规范:第2版. 北京: 中国环境科学出版社, 1990, 239-275.
|
| [18] |
Chambers PA, Prepas EE, Bothwell ML et al. Roots versus shoots in nutrient uptake by aquatic macrophytes in flowing waters. Canadian Journal of Fisheries and Aquatic Sciences, 1989, 46: 435-439. DOI:10.1139/f89-058 |
| [19] |
熊秉红, 李伟. 我国苦草属(Vallisneria L.)植物的生态研究. 武汉植物学研究, 2000, 18(6): 500-508. |
| [20] |
Wigand C, Stevenson CJ, Cornwell JC. Effects of different submersed macrophytes on sediment biogeochemistry. Aquatic Botany, 1997, 56: 233-244. DOI:10.1016/S0304-3770(96)01108-4 |
| [21] |
孙小静, 秦伯强, 朱广伟等. 持续水动力作用下湖泊底泥胶体态氮、磷的释放. 环境科学, 2007, 28(6): 1223-1229. |
| [22] |
Dierberg FE, De Busk TA, Jackson SD et al. Submerged aquatic vegetation-based treatment wetlands for removing phosphorus from agricultural runoff: response to hydraulic and nutrient loading. Water Research, 2002, 36: 1409-1422. DOI:10.1016/S0043-1354(01)00354-2 |
| [23] |
胡俊. 滇池的内源磷及其与蓝藻水华的关系研究[学位论文]. 北京: 中国科学院研究生院, 2005.
|
| [24] |
Jasson M. Nitrate as a catalyst for phosphorus mobilization in sediments. In: Sly PG ed. Sediments and water interactions. New York: Springer-Verlag, 1986, 387-391.
|
 2015, Vol. 27
2015, Vol. 27 

