(2: 东北林业大学野生动物资源学院,哈尔滨 150040)
(2: Wildlife Resource College, Northeast Forestry University, Harbin 150040, P.R.China)
水库及其流域水系是内陆水体的重要组成部分,也是人类生产、生活和社会发展需要的重要基础.随着水库流域经济的发展,其接受的污染负荷日益增加,从而导致其水环境质量恶化,水体富营养化加速,已成为制约我国社会经济可持续发展的限制性因素[1].据2009年《中国环境状况公报》数据,在我国26个国控重点湖泊(水库)中,Ⅳ类及以下水质有20个.尽管大部分湖库已经严重富营养化并部分暴发蓝藻水华,但仍不得不作为饮 用水源地[2],从而对居民饮水安全埋下隐患.浮游植物是生态系统中的初级生产者[3],其种类组成和群落结构的动态变化将直接影响水生态系统的结构与功能,对维持淡水生态系统平衡起到至关重要的作用[4-5].已有研究发现,营养盐、水温、光照强度及浮游动物的捕食是影响浮游植物群落结构的主要因素[6-7].氮或者磷通常成为淡水、河口和沿海生态系统中生物初级生产力的限制因子[8],水温对太湖浮游植物组成起到重要作用[2],但目前对我国东北地区的水库及河流藻类研究较少,尤其是哈尔滨这一北部高寒区与其他地区显著不同,如温度低、降水少、营养盐远低于我国南方平原库区.2005年松花江水污染事件后,西泉眼水库作为哈尔滨市第二饮用水源地,对其研究不断增多.如王越等[9]、迟晋峰等[10]对西泉眼水库的营养盐来源、水环境现状进行初步分析,陈翠翠等[11]对西泉眼水库消落带的水生植物群落结构进行研究,高孜娟等[12]对西泉眼水库鱼类多样性与群落结构进行初步分析,吕东珂[13]对西泉眼水库这一泥炭型水库水-气界面CO2通量进行研究.然而,已有研究往往缺少对浮游植物种群动态与水环境因子更深层次的分析与探讨,且未对水库和来源入库河流水体进行对比性分析研究.因此,本文对西泉眼水库夏季浮游植物群落特征与水环境因子的主要驱动因子动态变化关系进行研究,可为我国东北地区重要水源地的保护和生态治理提供基础依据.
1 材料与方法 1.1 调查区域概况西泉眼水库(45°12′~45°20′N,127°17′~127°25′E)位于哈尔滨市境内,于1996年竣工,大(Ⅱ)型水库,常水位库容为4.78×108m3,平均水深约为12m.该水库是拦蓄松花江一级支流阿什河而成,并另有二道河和黄泥河汇入.西泉眼水库控制流域面积为1146km2,占全流域面积的32%;流域内生长着大片次生林,土壤为黑土,周边森林覆盖率高.该区域属于大陆性温带季风气候,夏季高温、多雨,多年平均降雨量为563mm,其中6 9月份降水占全年降水量的70%.
1.2 调查方法 1.2.1 样点位置根据西泉眼水库库盆形状及流域地理特征,本研究共布设13个采样点(图 1),具体如下:1#、2#和3#(阿什河入库口左、中、右);4#(黄泥河入库口);5#、6#和7#(库心左、中、右);8#(双龟山);9#(大坝出水口);10#(平山铁路桥);11#(平山西桥);12#(平山南桥);13#(阿什河二道河汇流处).同时,采样点用Garmin公司生产的GPS12型全球卫星定位系统定位.采样时间为2010年7、8月.
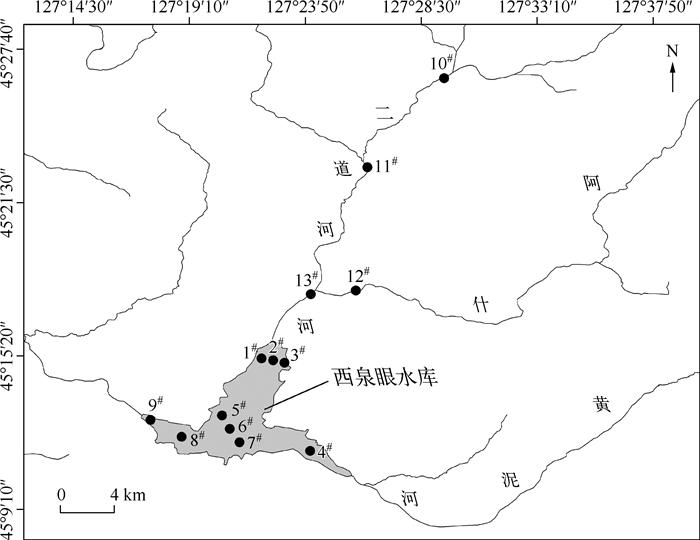
|
图 1 西泉眼水库浮游植物采样点 Fig.1 Sampling sites of phytoplankton in Xiquanyan Reservoir |
定性样品采用25#浮游生物网在水面下0.5m处进行“∞”字形捞取.定量样品采用5L采水器根据水层深度分表层(水下0.5m)、中层、底层(距底0.5m)采集混合水样,所有样品均用鲁哥试剂固定,静置24h后虹吸,再静置48h后浓缩至30ml.吸取0.1ml水样置于0.1ml浮游生物计数框内用Motic BA400显微镜计数、分析、鉴定[14].
1.2.3 水环境理化指标测定水温、pH、溶解氧(DO)、电导率(COND)等指标用美国YSI-6200多功能水质分析仪于现场测定;透明度用塞氏盘法测定;总氮(TN)、总磷(TP)、硝态氮(NO3--N)、氨态氮(NH3-N)、叶绿素a(Chl.a)、高锰酸盐指数(CODMn)和Cl-均参照文献[15]进行测定.
1.3 数据分析浮游植物丰度、生物量的计算参照《淡水浮游生物研究方法》[16];按照Lampitt等提出的优势度指数(y),以优势度y>0.02来确定优势种[17];并采用Shannon-Wiener多样性指数(H′)[18]对浮游植物生物多样性进行分析.典范对应分析(CCA)是基于种类数据和环境数据集合的排序方法[19-20],本文在对环境因子进行正态分布检验后,应用CCA对西泉眼水库浮游植物群落与水环境因子进行相关分析.
数据统计分析及制图运用OriginPro 8.1软件.利用CANOCO 4.5软件包进行CCA分析,采用浮游植物丰度指标来反映浮游植物种群与水环境的关系,为浮游植物丰度的数据获得正态分布,对浮游植物丰度值进行lg(x+1)转换.
2 结果与分析 2.1 西泉眼水库水体理化参数研究期间,西泉眼水库水深在0.3~16.5m之间,库区显著高于入库河流区;水温在18.65~26.25℃之间,库区略高于入库河流区;透明度在0.30~1.35m之间,浊度在5.1~34.4FTU之间,与透明度呈相反的变化趋势;pH值在7.4~9.92之间,库区略高于入库河流区;DO浓度在4.75~7.53mg/L之间,入库河流区明显高于库区水体;COND在0.002~0.204μS/cm之间,入库河流区明显高于库区水体;Cl-浓度在2.7~13.5mg/L之间;NO3--N浓度在0.21~1.67mg/L之间,入库河流区明显高于库区水体;CODMn在3.0~6.4mg/L之间,库区略高于入库河流(表 1).总体来看,西泉眼水库库区与入库河流区的理化指标之间差异显著(P<0.05,n=10),夏季水温的逐渐上升也比较适于大部分浮游植物种类的快速生长,尤其是绿藻门和蓝藻门种类.
| 表 1 西泉眼水库夏季水环境因子时空分布特征 Tab.1 The spatial-temporal disrtibution of environmental variables in the summer in Xiquanyan Reservoir |
同时,根据GB 3838 2002评价标准,西泉眼水库的NH3-N总体优于Ⅲ类水质标准;TP和TN浓度在大多数监测点位超出了Ⅲ类水质标准,尤其在7月(除2#、9#等个别点位外),均明显高于8月份(图 2),表明夏季水库库区及入库河流区的营养盐浓度较高,为浮游植物的快速生长提供了营养源.此外,根据Chl.a富营养化评价标准[21],8月Chl.a浓度明显高于7月,既表明水体已呈现富营养化趋势,也表明浮游植物丰度对营养物质的响应呈一定的滞后性.总体来看,7月和8月的水环境因子中Chl.a浓度差异显著(P<0.05,n=10),其余各指标整体差异不显著(P>0.05,n=10).
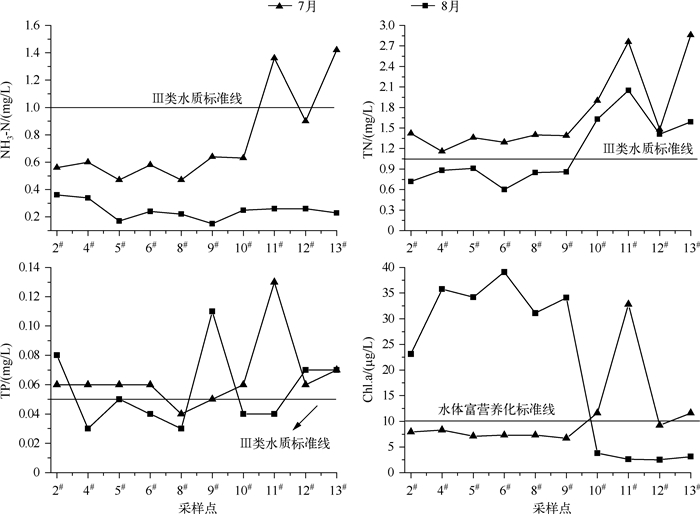
|
图 2 西泉眼水库主要营养盐及Chl.a浓度时空变化特征 Fig.2 The spatial-temporal variations of the main nutrients and chlorophyll-a concentration in Xiquanyan Reservoir |
经镜检,共鉴定出浮游植物7门169种(含变种及变型),其中绿藻门最多,83种,占总种数的49.11 %;硅藻门次之,47种,占总种数的27.81 %;蓝藻门15种,占总种数的8.88 %,而裸藻门(12种,7.10 %)和金藻门(6种,3.6 %)相对较少,甲藻门(4种,2.4 %)和隐藻门(2种,1.2 %)则最低.结果表明,西泉眼水库夏季浮游植物群落以绿藻-硅藻-蓝藻型为主.
水库库区的浮游植物群落结构为绿藻-硅藻-蓝藻型,而入库河流则为硅藻-绿藻-蓝藻型;库区绿藻和蓝藻种数分别为入库河流区的3倍多,而入库河流区的硅藻种数则是库区的近2倍(图 3).对比研究发现,西泉眼水库库区与入库河流区浮游植物群落结构的差异显著(P<0.05,n=13).分析认为,由于水库绿藻和蓝藻种数远多于入库河流区,说明水库库区暴发绿藻、蓝藻水华的潜在风险较大,尤其8月份库区各采样点的Chl.a浓度均超出10μg/L;而入库河流区的天然流水生境比库区缓流水体更适宜硅藻生存.
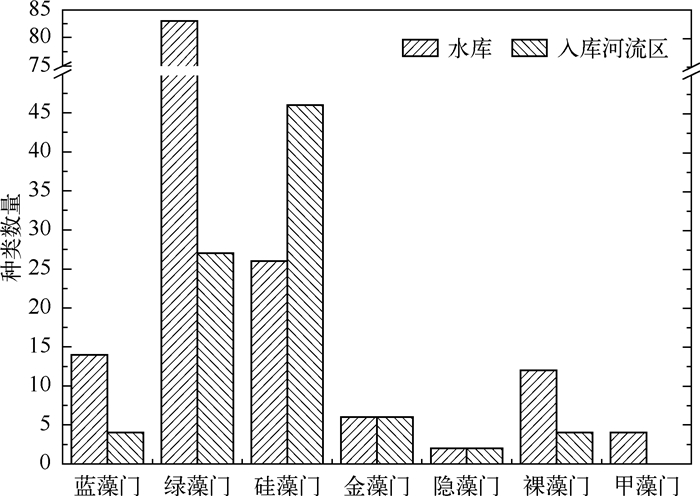
|
图 3 西泉眼水库夏季库内与入库河流区浮游植物定量种类组成对比 Fig.3 The species of phytoplankton in reservoir areacompared with inflow-river area in Xiquanyan Reservoir |
根据浮游植物在各采样点出现的频率与丰度,夏季7月和8月共发现优势种10种,形成以硅藻门、绿藻门和蓝藻门占优势地位的群落结构(表 2).而且,从浮游植物优势种的污染指示等级来看,西泉眼水库已处于中度富营养水平,并呈现出由中度富营养型水体向重度富营养型过渡的趋势.
| 表 2 西泉眼水库夏季浮游植物优势种及其丰度、污染指示等级* Tab.2 Dominant species and abundance, environmental indicator class of phytoplankton in summer in Xiquanyan Reservoir |
另外,值得注意的是,在夏季7月,蓝藻门中的阿氏席藻丰度低于肘状针杆藻和尖针杆藻,为第三优势种;在夏季8月虽然绿藻门优势种类相对较少,但是绿藻门中的游丝藻丰度却最高,为第一优势种,阿氏席藻仍为第三优势种.研究表明,西泉眼水库蓝藻种群具备良好的种质资源,一旦水温适宜、营养物质充足,蓝藻种群的某些种类可能会急剧生长,甚至暴发水华.
2.3 浮游植物丰度、生物量及群落多样性西泉眼水库库区浮游植物的丰度和生物量从阿什河入库口(1#、2#和3#)和黄泥河入库口(4#)向库心处(5#、6#和7#)、大坝口处(8#和9#)呈递减趋势;入库河流区各样点浮游植物丰度和生物量变化波动不大,差异不明显;同时,库区内各采样点浮游植物的丰度和生物量均大于入库河流水体各采样点;而且,阿什河入库口(1#、2#和3#)和黄泥河入库口(4#)浮游植物的丰度和生物量远高于其他采样点(图 4).此外,8月5#采样点的Chl.a浓度略低于6#采样点和4#采样点,但其生物量最高;分析认为,这与8月5#采样点浮游植物定量样品中采集到数量较多且个体较大的尖针杆藻和某种游丝藻有关,而其个体体积对生物量的贡献量高过其对Chl.a浓度的影响.
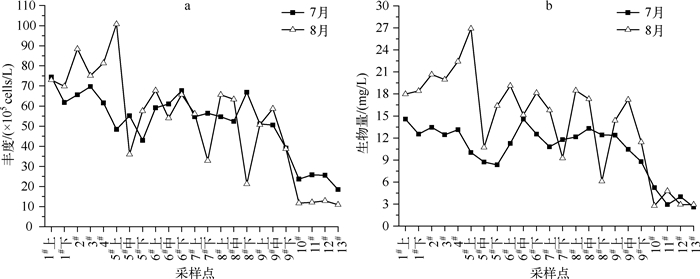
|
图 4 西泉眼水库及入库河流夏季浮游植物丰度(a)和生物量(b)的空间分布 Fig.4 The spatial distribution of phytoplankton's abundance(a)and biomass(b) in Xiquanyan Reservoir and the inflow-rivers |
总体上看,西泉眼水库库区浮游植物丰度和生物量在7月和8月变化趋势高度拟合.分析认为,在水库库区这一缓流水体中更适于绿藻和蓝藻种类的生长,而入库河流区的天然流水则对硅藻尤其对着生硅藻更为适宜;而河流与水库交汇处,则由于营养盐充足且水体流态多样,从而为藻类大量繁衍提供了良好的生境条件.
西泉眼水库及其入库河流浮游植物Shannon-Wiener指数的空间异质性分布变化特征见图 5.根据评价标准[21],7月仅有5#采样点的H′为2.73,低于中污染水平基准线,其余各采样点位均高于此标准;8月5#~9#采样点位的H′均低于中污染基准线,其余采样点位高于此标准.同时,入库河流浮游植物的Shannon-Wiener指数均高于库区.结果表明,入库天然河流的水质整体上要优于水库缓流水体,且水库库区的水质从河流入库口处到库心区,再到大坝口处,水质呈一定的恶化趋势.
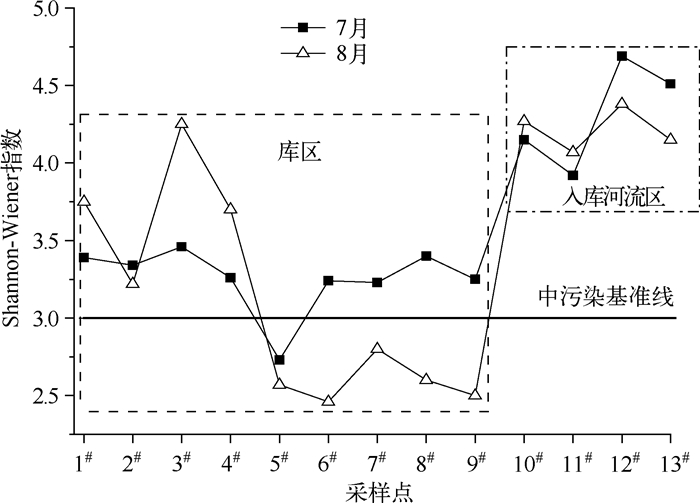
|
图 5 西泉眼水库及入库河流浮游植物Shannon-Wiener指数变化趋势 Fig.5 The distribution trend of Shannon-Wiener index of phytoplankton in Xiquanyan Reservoir and the inflow-rivers |
对西泉眼水库库区6个典型样点和入库河流区的4个样点,按出现频度及其丰度进行选择,并将夏季7、8月环境因子数据和浮游植物丰度合并分析:库区种类:频次≥4;入库河流区种类:频次≥3;在丰度上保证所选种类丰度占整个水库浮游植物丰度的95 %以上,以确保所选主要浮游植物种类构成及丰度与西泉眼水库整体状况基本一致(表 3).
| 表 3 西泉眼水库及入库河流夏季浮游植物主要种类组成及编码 Tab.3 Phytoplankton species composition and codes of Xiquanyan Reservoir and the inflow-rivers in summer |
参照董旭辉等[22]的研究成果,对包括所有环境变量的数据库进行初步CCA分析,对膨胀因子(VIF)大于20的环境变量进行选择性删除.通过CCA表明,环境变量中的水深、水温、透明度、pH值、浊度5个变量的VIF均大于20,予以删除.
西泉眼水库浮游植物群落CCA分析的统计信息(表 4)可以看出,水库库区的总变量为0.3761,可解释拟合变量占85.64 % (可解释变量占76.77 %);排列测试结果显示所有轴pseudo-F=3.2,P=0.002;入库河流区的总变量为0.3071,可解释拟合变量占81.60 % (可解释变量占74.25 %);排列测试结果:所有轴pseudo-F=4.3,P=0.005.总体来看,西泉眼水库库区和入库河流区轴1的特征值均明显大于其它各轴的特征值,能够更好地描述物种与环境因子的关系;同时,轴1贡献的可解释变量的累计百分比、可解释拟合变量的累计百分比均比其余各轴高.因此CCA分析可以很好地反映浮游植物群落与环境因子之间的相关关系.
| 表 4 CCA排序图各轴的特征值及种类与环境排序轴间的统计量 Tab.4 Eigen values and correlation coefficients of species and environmental factors on the axes of CCA |
CCA分析结果(图 6A,B)表明,浮游植物物种与环境因子的排序,大体反映了该物种的综合环境生态位和生态学特征.即排序图中空间位置聚集在一起的物种,其对水环境因子等生境要求较为相近;而空间位置分散的物种,说明物种之间对生境的要求差异较大.
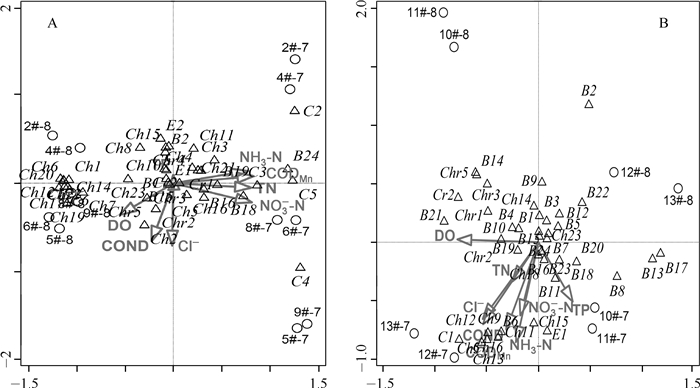
|
图 6 西泉眼水库夏季浮游植物丰度与环境因子的CCA三维排序图(A:库区;B:入库河流) (① Δ:物种;О:样点;→:环境因子.②浮游植物编码见表 3.③采样断面的编码为“样点编号+采样月份”,如“2#-7”表示“2#断面7月份样品”) Fig.6 CCA triplots between phytoplankton abundance and environmental factors in summer in Xiquanyan Reservoir (A: reservoir area; B: inflow-rivers) |
CCA排序图 6A和图 6B显示,在西泉眼水库库区和入库河流区均明显地将夏季7月和8月划分开来,其中库区以轴2为界,入库河流区以轴1为界,表明相同区域相同季节内不同月份也呈现明显的时间异质性.同时,还可以看出,库区样点河流入库口处(2#和4#)、库心(6#和8#)、大坝口处(9#)空间异质性分布规律明显;入库河流样点上游(10#和11#)、中游(12#)和下游(13#)空间异质性分布显著.
此外,从库区的浮游植物种类组成来看(图 6A),蓝藻门和部分绿藻门、硅藻门的种类主要分布在轴2右侧,而部分绿藻门、金藻门、裸藻门和隐藻门的藻类主要分布在轴1左侧,尤其蓝藻门种类全部集中分布在轴2右侧,而左侧的绿藻门种类明显多于右侧.同时,轴1与NO3--N、NH3-N、TN浓度和CODMn呈显著正相关,表明库区氮类营养盐和CODMn是蓝藻门种类和部分喜氮绿藻门的主要环境变量;而与DO、电导率则呈显著负相关,也表明库区充足的DO、电导率也是大部分绿藻门和金藻门种类的主要环境变量.从入库河流区的浮游植物种类组成来看(图 6B),金藻门和大部分硅藻门种类主要分布在轴1上方,表明入库河流中充足的DO是金藻和大部分硅藻的主要环境变量;而绝大多数绿藻门种类、部分硅藻门种类,以及某些裸藻门种类主要分布在轴1下方,表明入库河流中氮类营养盐和CODMn是其主要环境变量.总体来看,库区浮游植物种类组成及丰度主要与NH3-N等氮类营养盐浓度显著相关,却几乎不受TP浓度的影响;而入库河流区浮游植物种类组成及丰度则受氮、磷等营养盐物的双重影响.
3 讨论 3.1 浮游植物种类组成西泉眼水库作为大型(Ⅱ)水利枢纽工程,为半天然半人工的水体,近年来水环境质量日益恶化,导致水体富营养化加速;而入库河流为天然水体,水环境质量相对较好.为此本研究鉴定出浮游植物种数要明显高于单一类型水体(图 3).同时,研究表明,西泉眼水库库区以绿藻门、硅藻门和蓝藻门为主.然而,库区蓝藻门种数要明显高于入库河流区,一方面表明西泉眼水库库区水质由于流动性较低而比入库河流区差,即从入库河流区到库区水质有恶化的趋势;另一方面也表明水库这种静止水体蓝、绿藻水华暴发的潜在几率要高于天然流动水体.西泉眼水库已有研究[23]也表明,库区浮游植物种类以绿藻门、蓝藻门和硅藻门为主,而且夏季丰水期种类最多.镜泊湖[24]、海浪河[25]浮游植物的调查研究发现,其浮游植物种类组成同样以绿藻门、硅藻门和蓝藻门为主.对比来看,即使同处于高纬度地区,藻类组成相似,但在天然湖泊与人工湖泊(水库)之间、天然河流之间的浮游植物种数具有区域性的差异.
西泉眼水库的优势种群主要是硅藻门、绿藻门和蓝藻门的种类,金藻门和隐藻门的个别种类也为优势种.其中夏季8月的游丝藻丰度、生物量和优势度均最高,属于第一优势种,而取样时TP浓度在30~110mg/m3之间,均值为60mg/m3.Jensen等对比了丹麦境内不同营养水平的湖泊,总结出当湖泊中TP浓度超出1000mg/m3时,蓝藻通常被绿藻所取代[26].而在我国太湖,当TP浓度在150~200mg/m3时,丝状绿藻中的某种游丝藻在藻类暴发时占优势[2].Scheffer研究认为,这种现象有可能是依赖于湖泊的自然环境、纬度以及浮游植物种群的“内稳态”机制[27].然而,本研究中游丝藻急剧增加时,其TP浓度并不高;通过CCA排序图(图 6A)也表明,TP浓度与游丝藻无显著相关性.分析认为,某种游丝藻占明显优势,不仅要分析TP浓度的影响,还应将其纳入到浮游植物群落层次进行探讨.
3.2 浮游植物丰度与生物量的变化西泉眼水库夏季浮游植物丰度和生物量的时空分布特征变化趋势较为一致(图 4).在温带地区,水温是引起水体浮游生物季节性变化的主要因素之一[28].当夏季7月水温最高时,浮游植物蓝藻的种类数量、丰度、生物量达到峰值,尤其在水库库区各样点.同时,夏季浮游植物丰度和生物量大量增加,与营养盐的增加有密切联系.而本文选取夏季作为典型季节,其各月的水体温差相对较小,但在CCA排序图中仍将7月(均值为24.16℃)和8月(均值为21.88℃)的采样断面明显分开,表明水温对浮游植物群落结构在同一季节内仍有明显的影响.同时,西泉眼水库7月水温高于8月,其蓝藻丰度和生物量也明显高于8月,在一定程度上表明,水温与蓝藻丰度及其生物量存在显著正相关关系.分析认为,一方面由于采样月份的水温均较高,另一方面,采样月份西泉眼水库属于丰水期,营养盐来源相对较多,面源污染物可能有所增加.
水环境质量决定生物种群和群落结构特征,而生物种群和群落也对水环境质量的变化及时作出响应,可以客观反映水体质量的变化.实际应用中,Shannon-Wiener指数是使用最多的多样性指数[29].生物多样性分析表明,西泉眼水库库区夏季属于中度富营养型水体,入库河流属于轻度富营养型水体.分析认为,入库河流区流经低山丘陵区,森林覆盖率高达80 %,加之常年流动,水质相对较好;而库区水体由于流动性差,加上建库时淹没的大量农田和林地,库底存在大量的营养盐类沉积物,在水温较高和丰水期冲刷的干扰下,沉积物中营养盐上泛,从而导致其水质下降.
3.3 浮游植物与环境因子的关系研究表明,浮游植物与水环境因子之间的关系非常密切[30].浮游植物的生长需要在一定的光照和水温下进行,在温带和寒带地区,水温通常是限制因子,影响着浮游植物的生长[3, 31].Komarkova等通过CCA分析发现,微囊藻与较高的水温和高Na+浓度有较强的相关性,而脆杆藻和甲藻则与夏季水温上升有关[32].Chen等对太湖的研究表明,短时期浮游植物消长基本上受水温、风和浊度的影响,而长期浮游植物生物量的动态变化则受到营养水平的影响[2].在亚热带地区,水温和营养盐负荷是影响大镜山水库浮游植物群落结构动态变化的主要驱动因子[33],而降雨、水温及水力滞留时间则是影响富春江水库浮游植物群落结构及密度变化的主要驱动因子[34].本研究表明,西泉眼水库属于温带地区,夏季水温显著增高,其中7月水温均值为24.16℃、8月为21.88℃,满足浮游植物蓝藻门和绿藻门种类快速繁殖的温度条件,水温与藻类种数、丰度呈一定的正相关.此外,研究发现,西泉眼水库库区多数绿藻门和蓝藻门种类与NH3-N等氮类营养盐浓度呈显著的正相关关系,而入库河流区的多数绿藻门、隐藻门和硅藻门种类与NH3-N等氮类营养盐、TP浓度呈显著正相关关系,表明NH3-N、NO3--N、TN和TP浓度是影响西泉眼水库浮游植物群落结构及丰度的主要驱动因子.
同时,Smith研究表明,当淡水湖泊中TN/TP<29时,蓝藻就出现急剧暴发水华的趋势;而当TN/TP>29时,蓝、绿藻丰度就出现减少的趋势[35].本研究表明,西泉眼水库夏季TN/TP平均为25.37(其中,7月为26.84、8月为24.25),加上充足的氮源和磷源供给,更有利于蓝藻和绿藻门浮游植物的急剧生长,在一定程度上导致蓝藻和绿藻丰度急剧升高.而且,根据浮游植物CCA排序图监测断面分析(图 6),总体上将西泉眼水库分为库区生态系统和入库河流生态系统两个部分,又进一步将7月和8月的时间差异性凸显,符合西泉眼水库生态环境现状,又能够更好地解释两种生态系统各自的特征.
4 结论及建议1) 经调查分析,西泉眼水库夏季浮游植物的丰度和生物量相对较高.丰度在10.92×105~88.44×105cells/L间波动,以夏季8月的3#采样点最高;生物量在2.61~22.44mg/L之间波动,以夏季8月5#采样点最高.Shannon-Wiener指数在2.46~4.69之间,以夏季7月12#采样点最高.夏季以梅尼小环藻、肘状针杆藻、阿氏席藻和游丝藻为主要优势藻类,卵形隐藻、棕鞭藻和固氮鱼腥藻为次优势藻.
2) 运用CCA分析得出,NH3-N、NO3--N、TP和TN等营养盐浓度是影响浮游植物的主要环境变量,其次是水温、水深、透明度和浊度等因子.同时,总体上将西泉眼水库分为水库生态系统和河流生态系统两部分,以及7月和8月两个采样时间段,符合实际状况.而且,在库区样点河流入库口处、库心、大坝口处空间异质性分布规律明显;入库河流样点来源、中游和下游空间异质性分布显著.
3) 西泉眼水库库区水体处于中度富营养型向重度富营养型水体过渡阶段.为此,建议水库管理部门建立水生态系统健康监测与评估预警体系和相应的水生态管理制度,并采取适宜的生态修复技术等生态管理措施,以确保哈尔滨市供水水源安全.
致谢: 感谢任磊、鞠永富、梁雄伟、费滕、高孜娟、李佳娟、陈翠翠等同学和西泉眼水库管理处在采样及制图方面提供的帮助.| [1] |
刘建康. 东湖生态学研究(二). 北京: 科学出版社, 1995.
|
| [2] |
Chen YW, Qin BQ, Teubner K et al. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu, a large shallow lake in China. Journal of Plankton Research, 2003, 25(4): 445-453. DOI:10.1093/plankt/25.4.445 |
| [3] |
Reynolds T, Cliff N. An interactive preference ordering model and its monte carlo evaluation. Psychometrika, 1984, 49(2): 247-255. DOI:10.1007/BF02294175 |
| [4] |
Irigoien X, Harris RP, Verheye HM et al. Copepod hatching success in marine ecosystems with high diatom concentrations. Nature, 2002, 419(6905): 387-389. DOI:10.1038/nature01055 |
| [5] |
Cardinale BJ, Palmer MA, Collins SL. Species diversity enhances ecosystem functioning through interspecific facilitation. Nature, 2002, 415(6870): 426-429. DOI:10.1038/415426a |
| [6] |
Figueredo CC, Giani A. Seasonal variation in the diversity and species richness of phytoplankton in a tropical eutrophic reservoir. Hydrobiologia, 2001, 445(1/2/3): 165-174. |
| [7] |
Negro AI, DE Hoyos C, Vega JC. Phytoplankton structure and dynamics in Lake Sanabria and Valparaíso reservoir(NW Spain). Hydrobiologia, 2000, 424(1/2/3): 25-37. |
| [8] |
Downing JA. Marine nitrogen: phosphorus stoichiometry and the global N:P cycle. Biogeochemistry, 1997, 37(3): 237-252. DOI:10.1023/A:1005712322036 |
| [9] |
王越, 孙强, 吴昊. 西泉眼水库富营养化的源分析. 北方环境, 2005, 30(2): 29-30, 6. |
| [10] |
迟晋峰, 刘玉黛, 迟晋旭. 哈尔滨市西泉眼水库水环境现状及水源保护对策. 黑龙江水利科技, 2010, 38(1): 174-175. |
| [11] |
陈翠翠, 于洪贤, 姚允龙等. 西泉眼水库消落带水生植物群落及分布特点. 东北林业大学学报, 2012, 40(1): 110-113. |
| [12] |
高孜娟, 于洪贤, 马成学等. 西泉眼水库鱼类多样性与群落结构初步研究. 水产学杂志, 2012, 25(1): 19-24. |
| [13] |
吕东珂. 哈尔滨周边泥炭型水库水-气界面CO2通量研究[学位论文]. 哈尔滨: 东北林业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10225-1013359259.htm
|
| [14] |
胡鸿钧, 魏印心. 中国淡水藻类:系统、分类及生态. 北京: 科学出版社, 2006.
|
| [15] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.
|
| [16] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [17] |
Lampitt S, Wishner E, Turley M et al. Marine snow studies in the Northeast Atlantic Ocean: distribution, composition and roles as a food source for migrating plankton. Marine Biology, 1993, 116: 680-702. |
| [18] |
Shannon CE. A mathematical theory of communication. ACM SIGMOBILE Mobile Computing and Communications Review, 2001, 5(1): 3-55. DOI:10.1145/584091 |
| [19] |
胡胜华, 张世羊, 贺锋等. 武汉月湖水体主要元素与浮游植物的PCA与CCA分析. 生态环境学报, 2010, 19(1): 17-22. |
| [20] |
TER Braak CJF. CANOCO an extension of DECORANA to analyze species-environment relationships. Hydrobiologia, 1989, 184(3): 169-170. DOI:10.1007/BF02392953 |
| [21] |
沈韫芬, 章宗涉, 龚循矩等. 微型生物监测新技术. 北京: 中国建筑工业出版社, 1990.
|
| [22] |
董旭辉, 羊向东, 王荣等. 长江中下游地区湖泊硅藻-总磷转换函数. 湖泊科学, 2006, 18(1): 1-12. DOI:10.18307/2006.0101 |
| [23] |
张颖, 白羽军, 白昕等. 西泉眼水库富营养化状况及浮游藻类群落分析. 哈尔滨商业大学学报:自然科学版, 2007, 23(5): 523-525, 567. |
| [24] |
马成学, 刘曼红, 黄璞祎等. 镜泊湖枯水期和丰水期浮游植物群落结构. 东北林业大学学报, 2010, 38(2): 35-37. |
| [25] |
张丽娜. 海浪河浮游植物群落结构特征和水质营养状态评价[学位论文]. 哈尔滨: 东北林业大学, 2010. http://www.cnki.com.cn/Article/CJFDTOTAL-HYFZ198003014.htm
|
| [26] |
Jensen J, Jeppesen E, Olrik K et al. Impact of nutrients and physical factors on the shift from cyanobacterial to chlorophyte dominance in shallow Danish lakes. Canadian Journal of Fisheries and Aquatic Sciences, 1994, 51(8): 1692-1699. DOI:10.1139/f94-170 |
| [27] |
Scheffer M. Ecology of shallow lakes. New York: Springer, 2004.
|
| [28] |
Reynolds C. The ecology of freshwater phytoplankton. Cambridge: Cambridge University Press, 1984.
|
| [29] |
Sournia A. Phytoplankton manual:Monographs on oceanographic methodology. UNESCO, 1971, 6(1): 337. |
| [30] |
Scala S, Carels N, Falciatore A et al. Genome properties of the diatom Phaeodactylum tricornutum. Plant Physiology, 2002, 129(3): 993. DOI:10.1104/pp.010713 |
| [31] |
Sommer U. The impact of light intensity and daylength on silicate and nitrate competition among marine phytoplankton. Limnology and Oceanography, 1994, 39(7): 1680-1688. DOI:10.4319/lo.1994.39.7.1680 |
| [32] |
Komarkova J, Tavera R. Steady state of phytoplankton assemblage in the tropical Lake Catemaco(Mexico). Hydrobiologia, 2003, 502(1): 187-196. |
| [33] |
李秋华, 韩博平. 基于CCA的典型调水水库浮游植物群落动态特征分析. 生态学报, 2007, 27(6): 2355-2364. |
| [34] |
盛海燕, 虞左明, 韩轶才等. 亚热带大型河流型水库——富春江水库浮游植物群落及其与环境因子的关系. 湖泊科学, 2010, 22(2): 235-243. |
| [35] |
Smith VH. Low nitrogen to phosphorus ratios favor dominance by blue-green algae in lake phytoplankton. Science, 1983, 221(4611): 669. DOI:10.1126/science.221.4611.669 |
 2015, Vol. 27
2015, Vol. 27 

