南四湖(34°26′~35°20′N,116°34′~117°21′E)属淮河流域泗河水系,是我国北方最大的淡水湖,水域面积约1266km2,自北向南由南阳、独山、昭阳和微山4个相连的湖区组成,周边接纳了来自鲁、苏、豫、皖4省53条河流的来水,属河迹洼地浅水型湖泊[1].1960年二级坝枢纽工程将南四湖分成上级湖和下级湖,经过多年的治理和建设,南四湖承担着蓄水、防洪、排涝、渔业、灌溉、航运、南水北调东线工程重要输水通道和调蓄湖泊等多种功能.
刀鲚(Coilia ectenes)又名长颌鲚,主要分布在中国、日本和朝鲜半岛[2],隶属鲱形目鳀科鲚属,为溯河洄游性鱼类,但太湖、洪泽湖、巢湖等淡水湖泊分布着能够自然繁殖的陆封型群体(即淡水定居性刀鲚)[3].袁传宓等[4]根据形态和生态方面的差异将太湖群体定为刀鲚的新亚种,即太湖湖鲚(Coilia ectenes taihuensis).随着长江洄游性刀鲚的资源下降甚至消失,一些具有较大敞水面的长江中、下游湖泊(如太湖和巢湖)中定居性湖鲚却因湖泊鱼类资源小型化以及繁殖保护措施的实施,资源量大幅增长[5].
根据李思忠的《中国淡水鱼类分布区划》,南四湖鱼类属于江河平原区的河海亚区,鱼类区系组成以我国特有的江河平原复合体鱼类为主[6].受东亚季风气候、南四湖夺泗入淮、黄河的多次泛滥改道以及京杭大运河航运的影响,黄河、淮河、长江和钱塘江水系相互贯通,促进了各水域间鱼类的相互渗透.黄河溯河洄游的刀鲚曾是南四湖、东平湖的主要经济鱼类[7-8].1950s南四湖北与黄河水系贯通,洄游性鱼类经东平湖进入南四湖大量繁殖,其中刀鲚年产量达2500t;1960s由于闸坝的兴建洄游性鱼类通道被阻断,受气候因素、湖区水文波动和高强度的选择性捕捞影响,1980s末洄游性鱼类资源逐渐枯竭[1].
2002年南四湖遭遇枯水年份,南四湖的4个湖区几乎全部干涸,水生生物和渔业资源遭受毁灭性破坏.2002年12月,国家防汛抗旱总指挥部和水利部实施了长江向南四湖应急生态补水工程.利用京杭大运河苏北段作为输水路线,串联洪泽湖、骆马湖等湖库,经9级泵站提水北上,实现了江、淮、沂3大水系跨流域调水,1.1×108km3长江水补入南四湖[9].自2007年以来,南四湖内湖鲚(C. ectenes taihuensis)、间下鱵(Hyporhamphus intermedius)和大银鱼(Protosalanx hyalocranius)等鱼类渔获比例逐年增大,种群分布由航道逐步扩展到敞水区,现已成为湖区自然渔业资源的优势物种.
探明南四湖湖鲚种群的来源以及扩散途径是客观评价南水北调东线工程生态影响的现实问题.本研究以太湖、洪泽湖和南四湖的湖鲚为研究材料,采用线粒体控制区(D-loop)扩展终止序列相关区(ETAS)序列研究不同水域种群的遗传变异,揭示其遗传多态性水平和种群扩散的途径,探讨南四湖湖鲚的地理亲缘关系,为评价南水北调东线工程对输水沿线湖泊水环境生态影响提供基础数据.
1 材料与方法 1.1 样品采集南水北调东线工程调水路线与太湖(30°55′~31°32′N,119°52′~120°36′E)、洪泽湖(33°06′~33°40′N,118°10′~118°52′E)、南四湖(34°26′~35°20′N,116°34′~117°21′E)湖鲚采样点如图 1所示,标本采集于2008年9月至2010年11月,分析标本45尾,样点信息见表 1.
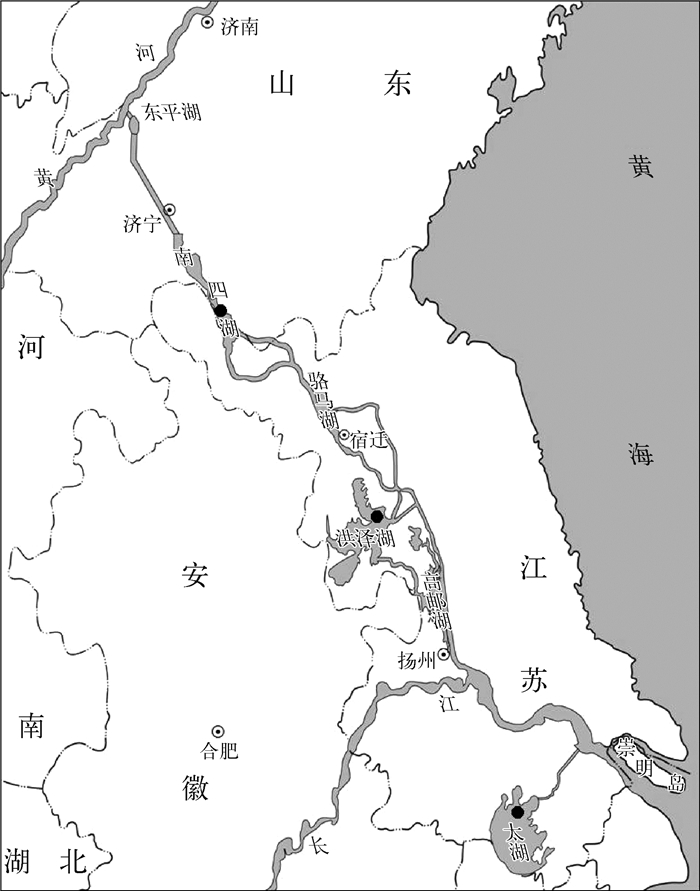
|
图 1 南水北调东线工程调水路线与湖鲚采样点 Fig.1 The channel of the East Route of South-North Water Transfer Project and the sampling sites of C. ectenes taihuensis |
| 表 1 样点信息和多样性统计 Tab.1 Information of sampling sites and diversity statistics |
采用标准的酚/氯仿法提取基因组DNA[10].参考Kocher等[11]的方法设计引物,扩增引物为DL:5′-ACC CCT GGC TCC CAA AGC-3′;DH:5′-ATC TTA GCA TCT TCA GTG-3′. PCR扩增反应程序为:94℃预变性2min;94℃变性30 s;55℃退火45 s,72℃延伸1 min;经40个循环后72℃延伸10min.采用Qiagen的QIAquick PCR产物纯化试剂盒进行回收纯化,在ABI 377 DNA测序仪进行双向测序.所有序列已递交到GenBank数据库,登录号为KP053927~KP053956.
1.3 DNA序列数据分析采用软件ClustalX1.83[12]、SeaView[13]对测定后的序列进行校正和排列.采用Arlequin 3.5.1.2[14]软件统计种群核苷酸多样性(π)、单倍型多样性(h)、Tajima's D和Fu's中性检验.种群间的成对遗传分化系数(Fst)分析群体间的分化程度,采用分子变异分析方法(AMOVA)评估湖鲚不同地理种群间遗传变异的分布.以七丝鲚(C. grayii)(GenBank登录号为EF419831和JX030383)mtDNA控制区序列作为外群,采用NJ法(neighbour-joining)[15]和贝叶斯法(bayesian inferences,BI)[16],重建单倍型间的系统发育关系.NJ分析采用MEGA 6.0[17]软件,系统树分支的置信度采用自引导法(bootstrap analysis,BP)1000次重复检测.贝叶斯分析选用MrBayes v3.1.1程序[16],运算代数为1000000,burnin为20 %.最适替代模型的选择采用jModelTest 2.1.4程序[18],选择最适模型为HKY+I.
2 结果 2.1 mtDNA控制区序列变异分析对所有序列进行排列人工校对后,采用D-loop左侧高变区序列长度为499bp进行分析.序列222~225bp之间存在6~7个38碱基(TTATGGTATAGTACATACTATGTATTATATTACATATA)串联重复.在所有湖鲚样本中,共检测到30种单倍型,除3种单倍型在多个种群间共享外,其余的单倍型在各种群之间不共享.其中,2种单倍型(单倍型h1和h2,图 2)在3个湖泊中均有分布,1种单倍型(单倍型h3)在2个湖泊中有分布,不同种群的私有单倍型数目均约为10个.共检测到35个多态位点,简约位点13个,其中26个为碱基转换,转换/颠换比例为2.6.所有个体的单倍型多样性(h)为0.9646,核苷酸多样性(π)为0.0097(表 1).不同种群间的h较相似,均大于0.9,而π范围较大,为0.0057~0.0124.
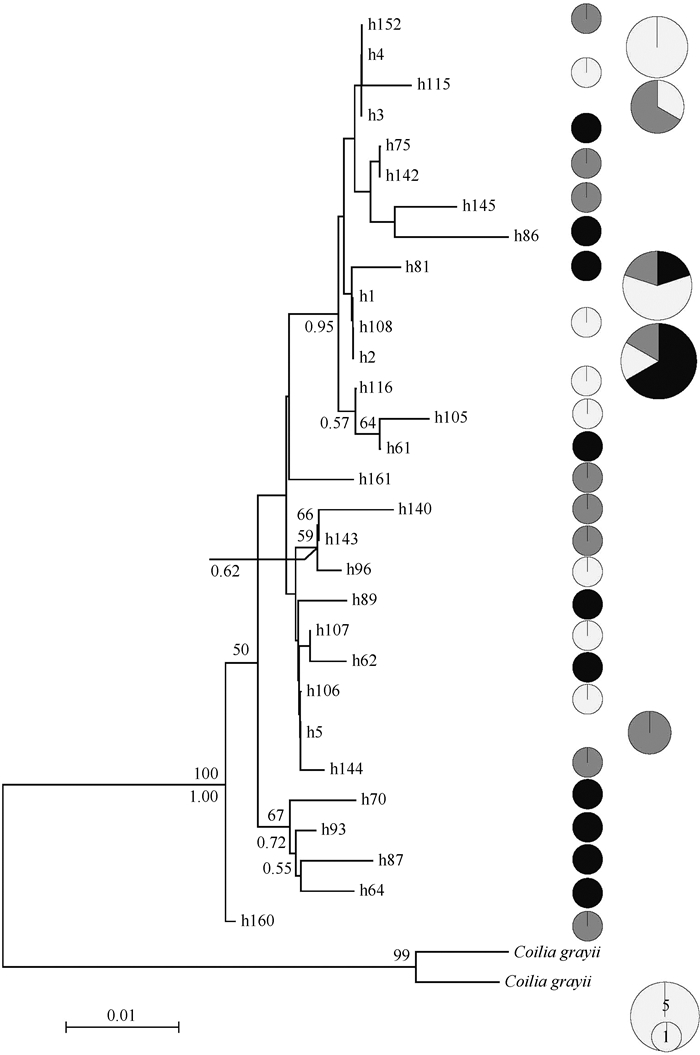
|
图 2 基于D-loop的ETAS序列构建的3个湖鲚种群系统发育关系 (分支上的数值为NJ分析1000次重复抽样检验得到的大于50的支持率;分支下的数值为BI分析后验概率;右侧圆形的面积和颜色分别表示个体数和种群来源;黑色:太湖;灰色:洪泽湖;白色:南四湖) Fig.2 Phylogenetic relationships of ETAS sequence based on the D-loop region of C. ectenes taihuensis |
不同种群间成对Fst分析表明,3个湖鲚种群间的分化指数较低,太湖与洪泽湖湖鲚种群间差异最大,为0.0675,达到显著分化水平(P=0.0344);太湖与南四湖湖鲚种群间差异最小,为0.0236(P=0.1825)(表 2).3个湖鲚种群的Tajima's D和Fs值均为负值,其中Tajima's D的范围为-1.0912~-0.6527之间,Fs的范围为-6.4409~-4.2061之间(表 1).AMOVA分析表明,遗传变异主要发生在种群内,为总变异的95.63 %,而种群间变异仅为4.37 % (表 1).
| 表 2 3个湖鲚种群间Fst统计值* Tab.2 The Fst value among three geographic populations of Coilia ectenes taihuensis |
邻接法构建湖鲚种群的系统发育树形成3个分支,但除来自太湖的h64、h70、h87和h93 4个单倍型聚成较高支持率的一支外(BP=67,BI=0.72),其他分支支持率较低.各分支中均有3个湖泊个体,缺少明显的可区分的系统结构(图 2).除来自太湖个体h160位于内类群的基部外,BI和NJ结果在拓扑结构上基本一致,3个地理种群所有单倍型也没有聚成各自的分支.系统发育关系并没有显示出明显的地理位置与单倍型间的对应关系.
3 讨论 3.1 南四湖湖鲚的遗传多态性大量研究表明虽然长江流域刀鲚的资源量下降,但种群内仍存在较高的遗传多样性.长江口邻近水域不同刀鲚种群间存在较高的遗传多样性[19-21],采用RAPD和ISSR标记分析长江口刀鲚种群也得到相似的结果[22].唐文乔等[23]的研究也表明,刀鲚、湖鲚及短颌鲚的线粒体控制区全序列中没有发现共享单倍型的存在,说明刀鲚(含湖鲚及短颌鲚)虽然资源量减少,但仍具有较高的遗传多样性.高单倍型多样性与其洄游、广布、寿命较短、性成熟早等生活史特征有关[3, 24].刀鲚为洄游性鱼类,每年春、夏季由海入江河进行生殖洄游,在长江上游干支流或湖泊的缓流区产卵,产卵后返回近海索饵越冬.刀鲚的这种具有高扩散潜能的生活习性增加了长江干支流或湖泊各群体之间的基因交流,稀释了它们之间由于地理隔离产生的变异,从而维持不同种群间较高的遗传多样性[25].虽然刀鲚种群具有较高的单倍型多样性,但其核苷酸多态性相对较低,私有单倍型较多.这可能是环境因子改变,有效种群数量降低后,种群快速扩张加速积累新突变所致[20, 26].Tajima's D和Fs值检验均表明湖鲚种群经历过种群扩张,在变异的产生过程中,点突变虽可形成新的单倍型,快速增加种群的单倍型多样性,但对π影响较小,π的增加需要比h的增加积累更长的历史时间.本研究3个湖鲚种群显示较高的h,这与Cheng等[19]、Ma等[20]的研究结果一致.
外来种群往往由于奠基者效应(founder effect)导致遗传多样性的降低,但有些物种在入侵后,种群遗传多样性并没有显著降低,其原因为进入新的环境后通过杂交或变异,遗传多样性得以增加[27].程起群等[28]采用线粒体cyt b分析刀鲚与湖鲚的遗传关系,得出刀鲚的π值小于湖鲚的结论;认为湖鲚遗传多样性水平增加是由于太湖自2000年夏季启动的“引江济太”工程,每年引入10×108~15×108m3长江水补充太湖,刀鲚有可能随长江水进入太湖,并与湖鲚相互杂交,形成基因流,增加湖鲚遗传多样性水平和遗传变异性.本研究3个湖泊中的湖鲚种群单倍型数占总样本数的67 %,总体h较高,表明湖泊种群中湖鲚存在丰富的遗传变异.本研究Fst分析表明,3个湖泊中湖鲚种群间的分化系数较低,太湖与洪泽湖湖鲚种群间差异最大,为0.0675,达到显著分化水平,太湖与南四湖湖鲚种群间差异最小,为0.0236,遗传变异主要发生在种群内,为总变异的95.63 %,表明种群间存在较高的基因流.
3.2 湖鲚在南水北调湖群间的种群扩散Ma等[20]采用线粒体控制区序列分析我国东部地区10个种群刀鲚遗传多样性,AMOVA和Fst分析均显示10个种群之间存在一定的分离,基因交流受到限制.本研究通过邻接法构建湖鲚种群的系统发育树、贝叶斯树和NJ拓扑结构上基本一致,3个地理种群所有单倍型虽然没有聚成各自的分支、没有显示出明显的地理位置与单倍型间的对应关系,但另一方面解释了南四湖湖鲚和长江淮河水系中群体亲缘关系较近.
湖泊中外来鱼类的移入包括人工增殖放流和水体间自然交流,其中水系间的连通是鱼类扩散的主要途径.历史上南四湖由南北大运河连接,北接东平湖连通黄河,南经骆马湖、洪泽湖可达长江,京杭大运河使上述湖沼湿地水体间存在联系和交流,是我国东部水系间南北物种交流的一条重要廊道.然而最近几十年来在气候变化及人为干扰下大运河廊道已处于瘫痪状态,仅在夏季暴雨时南四湖才向淮河下游泄洪,2002年12月,利用京杭大运河向南四湖生态补水打破物种原有湖泊间的隔离,为生物类群提供一个短期、快速迁移的机会.根据洪泽湖[29]、骆马湖[30-31]鱼类资源状况调查结果,湖鲚、大银鱼、间下鱵等敞水区上层鱼类分别为上述湖中的优势种群.虽然目前的分子生物学结果还不能提供充分的证据支持南四湖群体来自洪泽湖,但是结合历史渔业资料[32-33]和监测数据,我们初步推测湖鲚是2002年经由京杭大运河从长江和淮河水系的洪泽湖、骆马湖生态补水进入南四湖扩散建群的,为长江刀鲚一个陆封型群体.进一步采用其他标记(如微卫星)、增加样本量和地理群体有助于探讨这一科学问题.
湖鲚独特的生态习性和生活史特征使其更易拓殖新的栖息地并快速建群和扩张.湖鲚喜集群,游泳迅速,具有较强的种群扩散能力[5],而且湖鲚性成熟早,当年鱼即可参加产卵群体,而且鱼卵分批产出,持续时间长,湖鲚产卵期为4月底至7月底,产浮性卵,为多次分批产卵,这样保证了幼鱼的存活率和食料的可得性.渔获物中湖鲚一冬龄个体占90 %以上,补充群体数量较大[5, 34-35].本课题组2007年渔业资源监测结果表明:湖鲚在南四湖渔获物中所占比例逐年增大,种群分布范围湖鲚分布区从下级湖到上级湖,从运河主航道扩展到整个湖的敞水区,低龄个体呈现快速增加的趋势.2008年9月以来,南四湖下级湖以微山岛、西平水域较多,上级湖以两城水域较多,湖区湖鲚日捕捞产量在1000kg以上.体长一般为20~30cm,丝网捕捞单船日产量为15kg左右,捕捞一直能持续到11月.2010年11月,在下级湖单船日最高捕捞产量达到750kg,表明迁入的湖鲚已成为南四湖自然渔业资源的优势种群之一.
南水北调工程是我国实现水资源优化配置的战略举措,东线工程从长江下游扬州抽引水,利用京杭大运河及与其平行的河道逐级提水北送,并连接起调蓄作用的洪泽湖、骆马湖、南四湖和东平湖.南水北调工程的运行将使地区间的物种迁移和基因交流变得更为频繁,从而深刻地影响着输水沿线和受水区的生态过程.2002年南四湖生态补水作为南水北调东线调水的一次预演,为东线调水对沿线湖泊水生生物的影响提供了证据.2013年南水北调东线工程全线通水运行后,南四湖湖鲚已沿梁济运河进入东平湖成功建群就是一个例证[36],其能否进入黄河有待进一步的监测.
| [1] |
济宁市科学技术委员会. 南四湖自然资源调查及开发利用研究. 济南: 山东科学技术出版社, 1987, 1-273.
|
| [2] |
张世义. 中国动物志(硬骨鱼纲):鲟形目·海鲢目·鲱形目·鼠鳝目. 北京: 科学出版社, 2001, 148-156.
|
| [3] |
袁传宓. 长江中下游刀鲚资源和种群组成变动情况及其原因. 动物学杂志, 1988, 23(3): 12-15. |
| [4] |
袁传宓, 林金榜, 秦安舲等. 关于我国鲚属鱼类分类的历史和现状. 南京大学学报, 1976(2): 1-12. |
| [5] |
倪勇, 伍汉霖. 江苏鱼类志. 北京: 中国农业出版社, 2006.
|
| [6] |
李思忠. 中国淡水鱼类分布区划. 北京: 科学出版社, 1981.
|
| [7] |
周才武, 蔡德霖, 李镇钦等. 山东南四湖鱼类研究. 山东大学学报, 1959(4): 12-40. |
| [8] |
周才武, 李镇钦. 山东南四湖渔业问题的初步探讨. 山东大学学报, 1960(4): 31-45. |
| [9] |
黄海田, 仇宝云, 朱月新. 从长江向南四湖应急生态补水运行分析. 南水北调与水利科技, 2003, 6: 22-25. |
| [10] |
萨姆布鲁克J, 拉塞尔DW著. 黄培堂等译. 分子克隆实验室指南: 第3版. 北京: 科学出版社, 2002: 463-618.
|
| [11] |
Kocher TD, Thomas WK, Meyer A et al. Dynamics of mitochondrial DNA evolution in animals: Amplication and sequencing with conserved primers. Proceedings of the National Academy of Sciences, 1989, 86: 6196-6200. DOI:10.1073/pnas.86.16.6196 |
| [12] |
Thompson JD, Gibson TJ, Plewniak F et al. The Clustal X windows interface: flexible strategies for multiple sequences alignment aided by quality analysis tools. Nucleic Acids Research, 1997, 25: 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [13] |
Gouy M, Guindon S, Gascuel O. Sea View version 4: a multiplatform graphical user interface for sequence alignment and phylogenetic tree building. Molecular Biology and Evolution, 2010, 27(2): 221-224. DOI:10.1093/molbev/msp259 |
| [14] |
Excoffier L, Laval G, Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis. Evolutionary Bioinformatics Online, 2005(1): 47-50. |
| [15] |
Saitou N, Nei M. The neighbor-joining method: A new method for reconstruction phylogenetic trees. Molecular Biology and Evolution, 1987, 4: 406-425. |
| [16] |
Huelsenbeck JP, Ronquist F. MrBayes: Bayesian inference of phylogeny. Bioinformatics, 2001, 17: 754-755. DOI:10.1093/bioinformatics/17.8.754 |
| [17] |
Tamura K, Dudley J, Nei M et al. MEGA4: Molecular Evolutionary Genetics Analysis(MEGA) software version 4.0. Molecular Biology and Evolution, 2007, 24: 1596-1599. DOI:10.1093/molbev/msm092 |
| [18] |
Darriba D, Taboada GL, Doallo R et al. jModelTest 2: more models, new heuristics and parallel computing. Nature Methods, 2012, 9(8): 772. |
| [19] |
Cheng QQ, Zhang QY, Ma CY et al. Genetic structure and differentiation of four lake populations of Coilia ectenes(Clupeiformes: Engraulidae) based on mtDNA control region sequences. Biochemical Systematics and Ecology, 2011, 39: 544-552. DOI:10.1016/j.bse.2011.08.002 |
| [20] |
Ma CY, Cheng QQ, Zhang QY. Genetic diversity and demographical history of Coilia ectenes(Clupeiformes: Engraulidae) inferred from the complete control region sequences of mitochondrial DNA. Mitochondrial DNA, 2012, 23(5): 396-404. DOI:10.3109/19401736.2012.710202 |
| [21] |
杨金权, 胡雪莲, 唐文乔. 长江口邻近水域刀鲚的线粒体控制区序列变异与遗传多样性. 动物学杂志, 2008, 43(1): 8-15. |
| [22] |
张媛, 胡则辉, 周志刚等. 利用RAPD-PCR与ISSR-PCR标记技术分析长江口刀鲚的群体遗传结构. 上海水产大学学报, 2006, 15(4): 390-397. |
| [23] |
唐文乔, 胡雪莲, 杨金权. 从线粒体控制区全序列变异看短颌鲚和湖鲚的物种有效性. 生物多样性, 2007, 15(3): 224-231. |
| [24] |
董文霞, 唐文乔, 王磊. 长江刀鲚繁殖群体的生长特性. 上海水产大学学报, 2014, 23(5): 669-674. |
| [25] |
Avise JC, Neigel JE, Arnold J. Demographic influences on mitochondrial DNA lineage survivorship in animal populations. Journal of Molecular Evolution, 1984, 20: 99-105. DOI:10.1007/BF02257369 |
| [26] |
Rogers AR, Harpending H. Population growth makes waves in the distribution of pairwise genetic differences. Molecular Biology and Evolution, 1992, 9: 552-569. |
| [27] |
陈毅峰, 严云志. 生物入侵的进化生物学. 水生生物学报, 2005, 29(2): 220-224. |
| [28] |
程起群, 温俊娥, 王云龙等. 刀鲚与湖鲚线粒体细胞色素b基因片段多态性及遗传关系. 湖泊科学, 2006, 18(4): 425-430. DOI:10.18307/2006.0416 |
| [29] |
林明利, 张堂林, 叶少文等. 洪泽湖鱼类资源现状、历史变动和渔业管理策略. 水生生物学报, 2013, 37(6): 1118-1127. |
| [30] |
周化民, 白延明. 骆马湖鱼类的初步研究. 徐州师范学院学报, 1994, 12(2): 53-56. |
| [31] |
冯照军, 王光标, 赵彦禹等. 江苏骆马湖湿地鱼类资源及其保护. 四川动物, 2007, 26(1): 126-129. |
| [32] |
李传印, 李殿香. 南四湖鱼类物种多样性衰减原因初步分析. 水利渔业, 2003(2): 49-50. |
| [33] |
李殿香, 孙文, 李传印等. 南四湖鱼类种群调查初报. 山东省农业管理干部学院学报, 2005, 21(3): 128-132. |
| [34] |
孙雪兴, 仇延舫. 太湖湖鲚年龄与生长的研究. 海洋与湖沼, 1987, 18(1): 39-47. |
| [35] |
刘恩生, 刘正文, 陈伟民等. 太湖湖鲚渔获量变化与生物环境间相互关系. 湖泊科学, 2005, 17(4): 340-345. DOI:10.18307/2005.0410 |
| [36] |
山东省淡水渔业研究院资环室. 南水北调试通水后东平湖出现大量湖鲚. http://www.sdfwi.cn/newshow.aspx?id=376, 2013-8-22.
|
 2015, Vol. 27
2015, Vol. 27 
