浮游动物通常是指后生浮游动物,包括桡足类、枝角类和轮虫,其群落结构的变化受水温、食物、捕食、营养盐等多种因素影响[1].在热带地区,富营养型水库中浮游动物种类相对较少,优势类群以轮虫和小型甲壳类动物为主[2],枝角类常以象鼻溞属(Bosmina)和裸腹溞属(Moina)等的种类为优势种,轮虫常以龟甲轮属(Keratella)、多肢轮属(Polyarthra)、晶囊轮属(Asplanchna)的种类为优势种[3],桡足类常以剑水蚤属(Mesocyclops)和温剑水蚤属(Thermocyclops)的种类最为常见[4].在热带水体中,由于水温这一关键环境因子的季节变化幅度相对较小,且全年维持较高水平,因此普遍认为浮游动物群落的种类组成、丰度和生物量较为稳定[5].在富营养化水库中,藻类总生物量相对稳定,从而更有利于浮游动物群落结构的稳定.在热带水库中,鱼类放养普遍且产量相对较高,鱼类对浮游动物的捕食压力较大,限制了大型枝角类在水体中成为优势类群[6].在影响浮游动物种类组成和数量的主要因素中,鱼类生物量(捕食压力)在估算上存在很大的不确定性,特别是与浮游动物采样时间相对应的数据也难以获得.因此,研究人员关于鱼类对浮游动物的影响多数是根据浮游动物组成来间接推断的.受夏季风的影响,我国热带水库水位通常变化较大,沿岸区难以形成稳定的水生植被,敞水区成为水库的主要生境类型.我国热带水库的降水和水位存在明显的水文节律性,即全年可分为明显的枯水期和丰水期[7].降水和水位是影响水库生物群落和生态系统整体性的宏观变量,它们影响营养盐浓度、水温和水柱的混合强度,也对浮游动物具有直接的影响(排水损失)[8-9]和间接影响(通过营养盐等改变食物)[10-11].因此,热带水库浮游动物群落的结构与动态是受多因素影响的复杂过程,特别受水文变量的影响较为严重.
大沙河水库位于广东省开平市马岗镇,是江门市的主要供水水库,水库目前处于富营养状态.本文以大沙河水库为例,基于2012-2013年的逐月监测数据,对后生浮游动物的群落结构及变化特征进行分析,为了解热带大型富营养化水库的浮游动物群落结构的变化及其主要影响因素提供参考.
1 材料与方法大沙河水库(22°32′N,112°30′E)位于热带和亚热带过渡区,是一座大型的供水水库,其总库容为2.39×108 m3.水位的变化主要受人为因素供水安全保障的调节.水库采用人工放养鱼类,鱼类以鳙(Aristichthys nobilis)、鲢(Hypophthalmichthys molitrix)、草鱼(Ctenopharyngodon idellus)、鲤鱼(Cyprinus carpio)和鲮鱼(Cirrhinus molitorella)为主,浮游植物的主要优势种有铜绿微囊藻(Microcystis aeruginosa)和卷曲鱼腥藻(Anabaena circinalis)等.采样点位于副坝前的敞水区(22°51′58″N,112°43′23″E),是全库中相对较宽敞的水域,该采样点也是水库水质常规采样点.
2012年1月至2013年12月,每月在该采样点进行1次采样.浮游动物定性样品用25#(孔径为64 μm)浮游生物网于水平与垂直方向拖网; 浮游动物定量样品用5 L采水器从水面以下0.5 m处开始每2 m采样至水库底部,因季节性水位变化,共采集水样25~50 L,用孔径38 μm的浮游生物网当场过滤浓缩.用5 %的甲醛溶液对样品进行固定,经沉淀后浓缩.甲壳类浮游动物在显微镜与解剖镜下进行种类鉴定和计数[12],根据Koste分类系统在显微镜下进行轮虫定种与计数[13].浮游动物个体的生物量按浮游动物体积近似计算公式[14]计算.同时,pH值、水温、溶解氧等用YSI水质分析仪进行现场测定,透明度用塞氏黑白盘测定.在0.5、5和10 m水深处采集水样,分别测定水体中的总磷(TP)、总氮(TN)和叶绿素a(Chl.a)浓度; 根据分层情况,用加权平均代表水柱的浓度.TP、TN浓度按国家水质监测标准方法进行测定,Chl.a浓度采用反复冻融-浸提法测定[15].水库流域降雨量、水位、出库流量、库容数据由大沙河水库管理处提供.用Origin软件作图,用SPSS 13.0统计分析软件对数据进行相关性分析与单因子方差分析.辛普森多样性指数用1/D表示; 水力滞留时间(WRT)近似等于当月的库容除以排出水量,忽略水面蒸发的影响.
采用R语言平台和软件(MASS、vegan和packfor)进行浮游动物群落的多样性计算和结构比较等多元统计分析.根据我国南亚带气候特点,将每年12个月划为3个季节:春季(1-4月)、夏季(5-9月)和秋季(10-12月),其中夏季为丰水期,其它季节为枯水期.不同季节内群落距离的比较采用Bray-Curtis距离公式计算,采样时间的分组采用非参数多维尺度(nMDS)分析.在浮游群落的PCA和RDA分析中,群落丰度数量经过lg(x+1)转换后,群落距离为Hellinger距离; 环境变量进行标准化,去除量纲不一致和降低方差非齐性的影响.排除环境变量数对RDA结果的影响计算环境变量的解释率,并前向选择或模型的ANOVA分析选择贡献率所解释的变量.
2 结果与分析 2.1 理化指标大沙河水库2012、2013年的月平均降雨量范围分别为60.9~474.6、7.0~438.0 mm.降雨量具有明显的季节性,2012年4-7月、2013年5-9月降雨量较高; 水位季节波动性与降雨量相似,5-9月水位较高,1-3月水位较低,呈现丰水期与枯水期的季节性变化. 2012、2013年大沙河水库水力滞留时间呈现季节性,枯水期的水力滞留时间高于丰水期,这一季节性差异在2013年表现的更为明显(图 1).
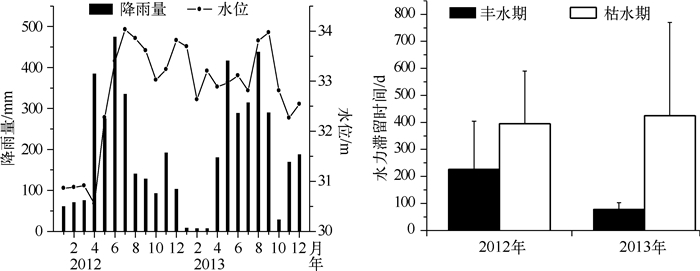
|
图 1 大沙河水库降雨量、水位变化和水力滞留时间的季节变化 Fig.1 Seasonal variation of precipitation, water level and water residence time in Dashahe Reservoir |
采样期间,大沙河水库水体表层水温季节变化明显,波动范围在14.7~31.6℃之间,平均值为24.08℃,最高水温都出现在8月,最低水温都出现在1月,水体垂直方向上水温在每年的4-5月至10月期间出现分层现象,其它月份水体垂直方向水温变化不大. 2012、2013年Chl.a浓度的年际变化范围分别为13.49~24.81、13.13~50.90 μg/L,2013年期间Chl.a浓度变化较大,2012年同期的Chl.a浓度相对稳定(图 2).
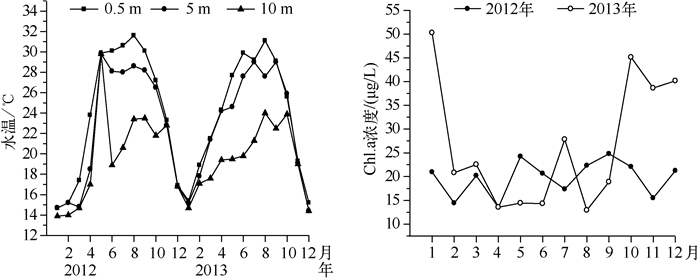
|
图 2 大沙河水库水温和Chl.a浓度的季节变化 Fig.2 Seasonal variation of water temperature and chlorophyll-a concentration in Dashahe Reservoir |
2012、2013年大沙河水库TN浓度的年际变化范围分别为0.84~1.26、0.90~1.72 mg/L,TN浓度的年际变化基本一致,高浓度值多出现在枯水期的3-4月和10-11月,低值多出现在丰水期的8-9月; 2012、2013年大沙河水库TN浓度的标准差在枯水期分别为0.23、0.16 mg/L,在丰水期分别为0.07、0.01 mg/L. 2012、2013年TP浓度的年际变化范围分别为0.018~0.069、0.015~0.050 mg/L; 2012、2013年TP浓度的标准差在枯水期分别为0.24、0.08mg/L,在丰水期分别为0.22、0.07 mg/L.大沙河水库2012、2013年的TN浓度(P=0.035)、TP浓度(P=0.01)在枯水期与丰水期存在显著差异,TN、TP浓度在枯水期都高于丰水期(图 3).
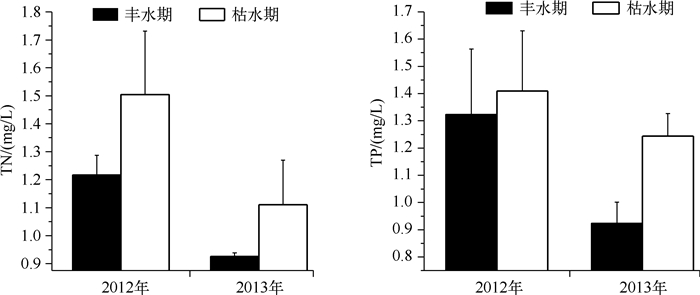
|
图 3 大沙河水库枯水期和丰水期的TN和TP浓度的比较 Fig.3 Comparison of TN and TP concentrations between dry and wet seasons in Dashahe Reservoir |
调查期间样品共检出后生浮游动物44种,其中桡足类5种、枝角类9种、轮虫30种.枝角类以微型裸腹溞、角突网纹溞和象鼻溞为主要优势种,桡足类以温中剑水蚤、博平近剑水蚤为主要优势种,轮虫以螺形龟甲轮虫、螺形龟甲轮虫变种、独角聚花轮虫、裂痕龟纹轮虫、圆筒异尾轮虫为主要优势种.对浮游动物(枝角类、桡足类、轮虫)进行主成分分析,将种类和采样时间在第一和第二轴上作图.多数种类集中在2个原点附近,说明这些种类全年分布的变异度较小.采样时间分布的季节性大致分为枯水期(轴2的左侧)和丰水期(轴2的右侧),两个主轴对2012-2013年的群落变异解释率为40 % (图 4).

|
图 4 大沙河水库浮游动物群落(包括枝角类、桡足类、轮虫)(A)和轮虫(B)的主成分分析(浮游动物拉丁名缩写见表 1,用m+采样年份+月份表示采样时间,下同) Fig.4 PCA of zooplankton community (A) and only rotifer community (B) in Dashahe Reservoir |
| 表 1 调查期间大沙河水库的浮游动物种类 Tab.1 The species of zooplankton in Dashahe Reservoir during the investigating period |
桡足类和枝角类没有明显的季节变化,轮虫的种类组成略有变化.在轮虫群落的主成分分析中,多数种类也集中分布在原点附近,说明这些种类全年分布的变异度较小.采样时间分布的季节性也大致分为枯水期(轴2的左侧)和丰水期(轴2的右侧).两个主轴对2012-2013年的群落变异解释能力较强(累积特征值的47 %)(图 4).
2012、2013年的月平均物种丰富度分别为23.8、21.7,月平均Simpson多样性指数分别为5.7、4.6.丰水期月平均Simpson多样性指数分别为7.7、6.7,枯水期分别为5.2、3.7,丰水期高于枯水期(图 5).
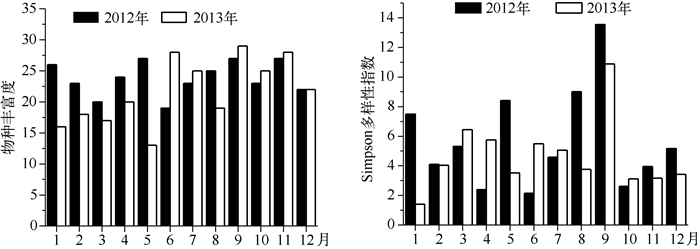
|
图 5 大沙河水库浮游动物物种丰富度和Simpson多样性指数的季节变化 Fig.5 Seasonal variation of species richness and Simpson's diversity of zooplankton in Dashahe Reservoir |
2012、2013年浮游动物总丰度的波动范围分别为211.5~1272.6、340~1669.5 ind./L; 总生物量的波动范围分别为210.1~2560.5、512.7~3145.6 μg/L.浮游动物生物量高值多出现在3月,低值都出现在6月,2012、2013年大沙河水库在枯水期和丰水期的浮游动物总丰度(P= 0.006)与总生物量(P=0.002)均存在显著差异,丰水期高于枯水期(图 6).枝角类的丰度和生物量与轮虫的丰度(r =-0.146; P =0.497)和生物量(r =-0.211; P =0.322)有较弱的负相关性,反映了它们之间的竞争强度较弱.
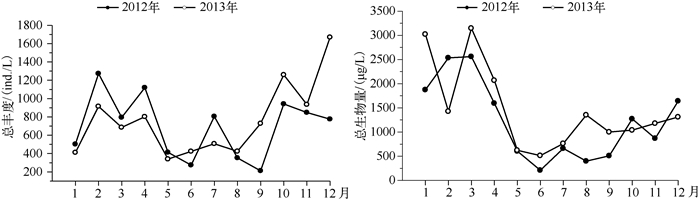
|
图 6 大沙河水库浮游动物总丰度和总生物量的季节变化 Fig.6 Seasonal variation of total abundance and biomass of zooplankton in Dashahe Reservoir |
从丰度组成上看,2012、2013年轮虫丰度占总丰度的比例分别为55.1 %、48.8 %,枝角类丰度占总丰度的比例分别为10.8 %、13.2 %,桡足类丰度占总丰度的比例分别为15.2 %、18.8 %,无节幼体丰度占总丰度的比例分别为18.8 %、19.2 %; 轮虫中占绝对优势的种类是螺形龟甲轮虫,在螺形龟甲轮虫优势度下降后,其它轮虫的优势度明显增加,优势种类数也随之增多. 2012年1月独角聚花轮虫与真翅多肢轮虫为主要优势种,2月份真翅多肢轮虫成为第一优势种,前节晶囊轮虫和螺形龟甲轮虫也同为优势种,3-4月螺形龟甲轮虫成为第一优势种,5月圆筒异尾轮虫和螺形龟甲轮虫为优势种,6-9月螺形龟甲轮虫均为优势种,但优势度呈逐月下降的趋势,7月臂三肢轮虫上升为优势种,8月对棘异尾轮虫为优势种,10-12月螺形龟甲轮虫再次成为绝对优势种.与2012年相比,2013年轮虫的群落结构也发生明显变化. 1月前节晶囊轮虫为第一优势种,2-4月独角聚花轮虫与螺形龟甲轮虫为优势种,5-7月螺形龟甲轮虫作为优势种但其优势度呈逐月下降的趋势,8月奇异六腕轮虫成为绝对优势种,9月奇异六腕轮虫与圆筒异尾轮虫为优势种,10-12月也是以螺形龟甲轮虫为优势种(图 7).
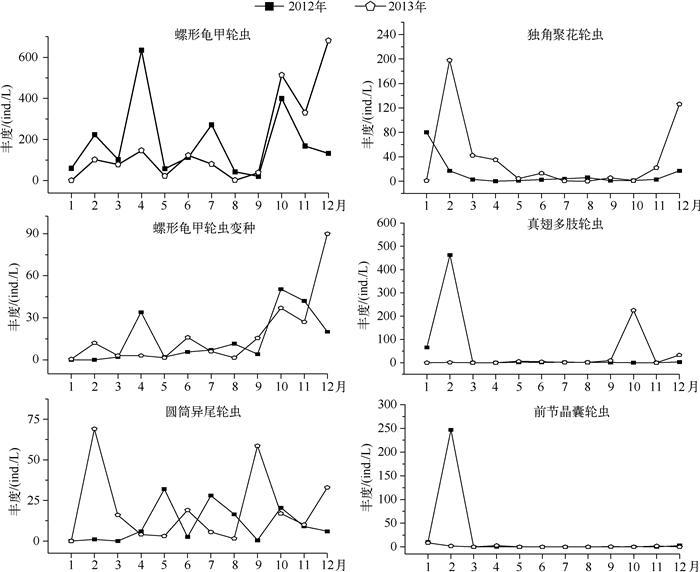
|
图 7 大沙河水库轮虫主要优势种类丰度的季节变化 Fig.7 Seasonal variation of abundance of the dominant species in Rotifera in Dashahe Reservoir |
从生物量构成上看,大沙河水库浮游动物群落结构没有明显的季节性变化,枝角类始终为优势类群,其次是桡足类,除2012年2月轮虫为优势类群,其它时期轮虫和无节幼体在群落结构中所占比例较小. 2012、2013年枝角类占总生物量的比例分别为45.5 %、51.5 %,桡足类占总生物量的比例分别为31 %、40 %,轮虫占总生物量的比例分别为19.2 %、4.6 %,无节幼体占总生物量的比例分别为4.3 %、3.9 %.枝角类中的主要种类表现出明显的更替现象. 2012年象鼻溞属的一种和角突网纹溞最大丰度均出现在3、4月,8月最低. 5月模糊秀体溞成为绝对优势类群,6、8月奥氏秀体溞为绝对优势类群.在2013年4月,颈沟基合溞与象鼻溞属的一种成为主要优势类群,5月角突网纹溞为绝对优势类群,6-7月象鼻溞属的一种与奥氏秀体溞为主要优势类群,8-9月象鼻溞属的一种与角突网纹溞为主要优势类群,11月角突网纹溞成为枝角类中的绝对优势类群(图 8).
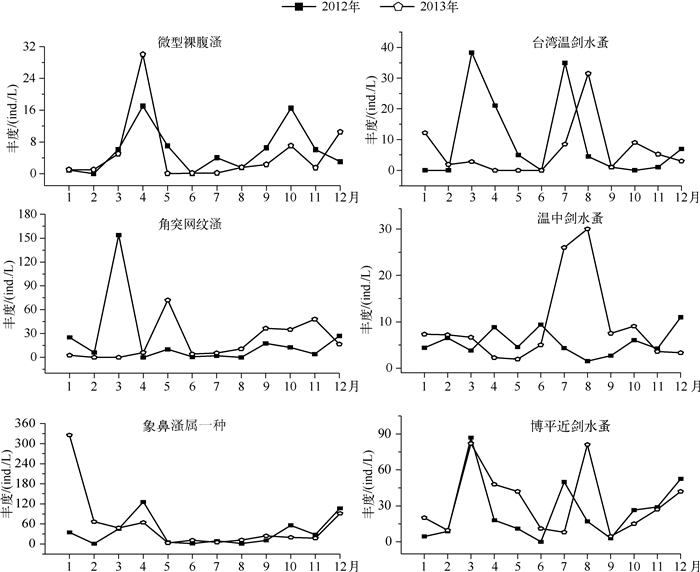
|
图 8 大沙河水库枝角类与桡足类优势种类丰度的季节变化 Fig.8 Seasonal variation of abundance of the dominant species in Copepoda and Cladocera in Dashahe Reservoir |
在非参数多维尺度(nMDS)分析中,浮游动物群落没有呈现出季节性分布特点. nMDS的压力值(Stress)较大(0.16),说明群落结构难以由少数主轴所表示.采用相同的距离公式,本文比较了春季、夏季和秋季内群落的平均距离(图 9).2012年,春季群落平均距离的变化最大(群落距离为0.75,标准差为0.07),其次是夏季(群落距离为0.62,标准差为0.09),秋季最小(群落距离为0.40,标准差为0.07).2013年,则是夏季变化最大(群落距离为0.69,标准差为0.10),其次是春季(群落距离为0.61,标准差为0.18),同样以秋季最小(群落距离为0.44,标准差为0.06).因此,在自然时间季节(春、夏、秋季)上,浮游动物群落存在季节性但不够显著. 2012年与2013年各对应月份的群落平均距离为0.61,标准差为0.18,说明2年逐月群落之间存在较大差异.
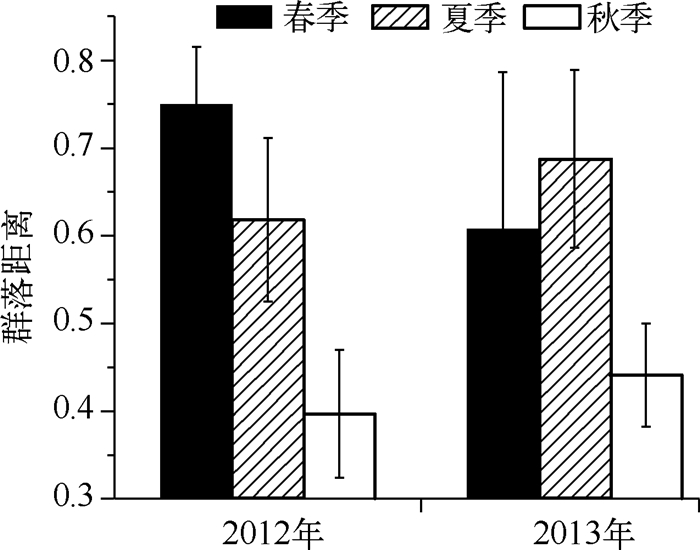
|
图 9 大沙河水库浮游动物春季、夏季和秋季内部的群落距离 Fig.9 Bray-Curtis distance between sampled communities within seasons in Dashahe Reservoir |
对浮游动物群落的RDA分析中,将种类和采样时间在第1和第2轴上作图.多数种类集中在两个轴的原点附近,说明多数种类全年分布的变异度较小.采样时间大致分为枯水期(轴2的左侧)和丰水期(轴2的右侧).浮游动物群落与环境变量有显著的相关性(P=0.017),2个主轴对2年群落变化的解释率为38 % (累积特征值),排除环境变量数的影响后,2个主轴的解释率为11 %.在所有环境变量中,Chl.a浓度对浮游动物群落变化的解释率最低,透明度(SD)、降水(Prec)和水温有强的正相关性,TN、TP浓度和水力滞留时间(WRT)之间存在正相关性,它们与SD、Prec、水温存在负相关.因此,群落的自然温度季节性变化规律较小,而水文季节较强; 结合图 9,2012和2013年之间存在较强的随机性(图 10,没有进行前向选择).
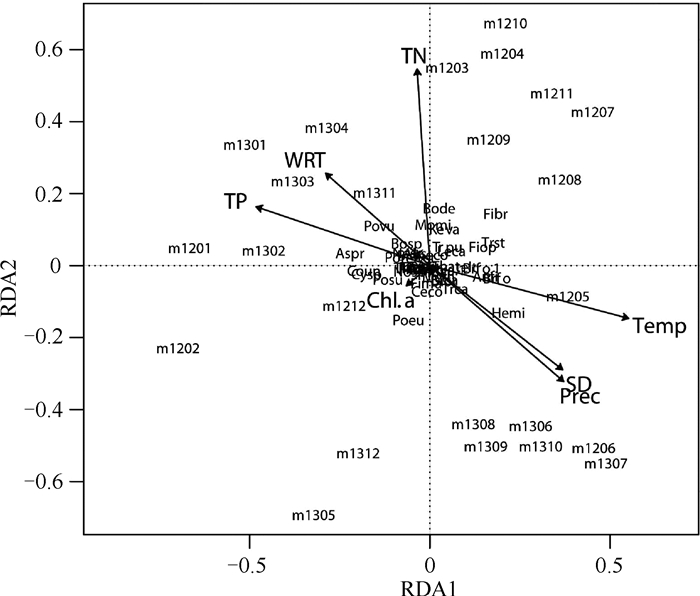
|
图 10 大沙河水库浮游动物群落与环境变量之间的RDA分析:Chl.a、SD、Prec和Temp、TN、TP和WRT Fig.10 Redundancy analysis of zooplankton community with seven environmental variables: Chl.a, secchi depth, precipitation, water temperature, total nitrogen, total phosphorus and water residence time in Dashahe Reservoir |
从浮游动物(枝角类、桡足类、轮虫)的主成分分析来看,大沙河水库浮游动物群落结构在2012-2013年调查期间自然季节性变化规律较小,水文季节变化较强,2年的浮游动物群落组成上存在较大的随机性.后生浮游动物的3个类群存在差异,轮虫的随机性最强,枝角类与桡足类较为稳定.枝角类中的象鼻溞、角突网纹溞、微型裸腹溞、颈沟基合溞与桡足类中的博平近剑水蚤、温中剑水蚤、锥肢蒙镖水蚤、右突新镖水蚤为全年种,在丰水期枝角类的全年种的丰度和生物量多出现低值,在枯水期则出现高值,桡足类的丰度和生物量没有明显的季节性,轮虫个别种类的丰度能够在短期内发生较大的变化,导致群落结构的相似性并不高(Bray-Curtis距离较大).从轮虫群落主成分分析来看,轮虫的多数种类大致分为枯水期与丰水期,累积的特征值高达47 %,表明轮虫群落结构受水文季节变化的影响更大,因此水文变化是轮虫群落结构变化的主要影响因素.大沙河水库浮游动物群落结构的变化主要体现在枯水期和丰水期的差异.在丰水期降雨量较高使水库透明度增加,加上水温高、鱼类生长快,浮游动物受到更大的鱼类捕食压力; 为防洪进行大幅度的排水增加了水库的换水率,也导致浮游动物自身数量损失增加,从而导致种群数量下降[16-17].由于种类数量的相对稳定和优势种的优势度下降,导致整个群落内部丰度的均匀度提高,Simpson生物多样性指数在丰水期较枯水期略高.丰水期与夏季相对应,将全年枯水期分为春季枯水期和秋季枯水期.每年这3个时段(季节)内部,春季浮游动物群落的Simpson生物多样性指数最大,秋季最小,但存在年际差异.
在影响浮游动物群落结构的因素中,捕食、种类竞争、食物通常被认为是最主要的.捕食强度由鱼类等捕食者的密度和种类所决定,同时受水温对代谢需要的影响.扁虫是热带水体常见的小型捕食者[18-19],虽然大沙河水库在2012年6、9、10、11月及2013年7月都检测到扁虫但丰度极低,所以扁虫对浮游动物的抑制作用相对较小.大沙河水库的鱼类养殖种类主要为滤食性的鲢、鳙,但存在大量杂食性的野杂鱼,鱼类捕食导致枝角类的优势种均为一些小型种类[20-22].个体较小的象鼻溞、螺形龟甲轮虫、博平近剑水蚤受到鱼类捕食的压力相对较小,它们是水库中的主要优势种.小型枝角类和轮虫在食物阈重叠时可以通过食物资源竞争而控制轮虫的种群增长[23-25].对轮虫与枝角类的生物量、丰度进行相关性分析,存在于轮虫和枝角类负相关性很低,说明轮虫与枝角类的竞争较弱,从侧面说明鱼类捕食降低了它们之间的竞争强度.从浮游动物丰度来看,轮虫为大沙河水库群落中的优势种群,但枝角类在生物量占绝对优势.前节晶囊轮虫在2012年2月丰度较高,可能与当时的鱼类捕食压力和食物丰富有关,晶囊轮属能以硅藻、绿藻、蓝藻、甲藻为食[26],也能够轻易地捕食螺形龟甲轮虫,也可捕食独角聚花轮虫、象鼻溞、臂尾轮虫及一些小型原生动物[27-29].由于在所有测定的环境变量中,没有变量来直接指示鱼类的数量,只能间接地分析鱼的影响.在RDA分析中,本文采用Chl.a浓度、透明度、降水、水温、TN浓度、TP浓度和水力滞留时间7个环境变量.在去除变量之间的自相关性,影响浮游动物群落的主要变量为水温、透明度和TN浓度,水温和透明度是影响捕食压力的重要间接变量.Chl.a浓度在一定程度上代表浮游动物的食物数量,但它对浮游动物群落变化的解释率最低且不显著,说明在富营养化水库食物数量不是影响浮游动物群落变化的关键因素.
综上所述,在热带富营养化水库中,食物、种类竞争不是导致群落变化的最主要因素,水文条件和鱼类捕食压力是影响浮游动物群落结构的主要原因.由于水文条件的变化,特别是由降水导致的变化具有很强的随机性,导致浮游动物群落季节和年际的随机性.
| [1] |
Cottenie K, Nuytten N, Michels E et al. Zooplankton community structure and environmental conditions in a set of interconnected ponds. Hydrobiologia, 2001, 442(1/2/3): 339-350. |
| [2] |
杨柳, 陈绵润, 林秋奇等. 一座热带高产渔业水库枯水期轮虫的群落组成与动态分析. 湖泊科学, 2008, 20(6): 780-789. DOI:10.18307/2008.0617 |
| [3] |
Lin QQ, Duan SS, Hu R et al. Zooplankton distribution in tropical reservoirs, South China. International Review of Hydrobiology, 2003, 88(6): 602-613. DOI:10.1002/(ISSN)1522-2632 |
| [4] |
王晓辉, 望甜, 林秋奇等. 华南地区典型抽水型水库后生浮游动物群落的种类组成与结构. 生态学报, 2009, 29(1): 456-465. |
| [5] |
Jr Lewis WM. Zooplankton community analysis studies on a tropical system. New York: Spring Verlag, 1979.
|
| [6] |
Iglesias C, Mazzeo N, Meerhoff M et al. High predation is of key importance for dominance of small-bodied zooplankton in warm shallow lakes: evidence from lakes, fish exclosures and surface sediments. Hydrobiologia, 2011, 667(1): 133-147. DOI:10.1007/s10750-011-0645-0 |
| [7] |
Han BP, Liu Z. Tropical and sub-tropical reservoir limnology in China-theory and practice. New York: Springer Dordrecht Heidelberg, 2012.
|
| [8] |
Dirnberger JM, Threlkeld ST. Advective effects of a reservoir flood on zooplankton abundance and dispersion. Freshwater Biology, 1986, 16(3): 387-396. DOI:10.1111/fwb.1986.16.issue-3 |
| [9] |
林秋奇, 赵帅营, 韩博平. 广东省水库轮虫分布特征. 生态学报, 2005, 25(5): 1123-1130. |
| [10] |
Velho LFM, Lansac-Tôha FA, Bonecker CC et al. The longitudinal distribution of copepods in Corumbá Reservoir, State of Goiás, Brazil. Hydrobiologia, 2001, 453(1): 385-391. |
| [11] |
Bonecker CC, Lansac-Tôha FA, Velho LFM et al. The temporal distribution pattern of copepods in Corumbá Reservoir, State of Goiás, Brazil. Hydrobiologia, 2001, 453(1): 375-384. |
| [12] |
蒋爕治, 诸南山. 中国动物志·节肢动物门·甲壳纲·淡水枝角类. 北京: 科学出版社, 1979.
|
| [13] |
Koste W. Rotatoria. Die Rädertiere Mitteleuropas, Bd. Ⅱ. Gebrüder, Berlin, 1978.
|
| [14] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [15] |
林少君, 贺立静, 黄沛生等. 浮游植物中叶绿素a提取方法的比较与改进. 生态科学, 2005, 24(1): 9-11. |
| [16] |
Nogueira MG. Zooplankton composition, dominance and abundance as indicators of environmental compartmentalization in Jurumirim Reservoir (Paranapanema River), São Paulo, Brazil. Hydrobiologia, 2001, 455(1/2/3): 1-18. |
| [17] |
Dirnberger JM, Threlkeld ST. Advective effects of a reservoir flood on zooplankton abundance and dispersion. Freshwater Biology, 1986, 16(3): 387-396. DOI:10.1111/fwb.1986.16.issue-3 |
| [18] |
Wang T, Xiao L, Lin Q et al. Pelagic flatworm predation on daphniids in a subtropical reservoir: different effects on Daphnia galeata and on Ceriodaphnia quadrangula. Hydrobiologia, 2011, 658(1): 139-146. DOI:10.1007/s10750-010-0457-7 |
| [19] |
Dumont HJ, Rietzler AC, Han BP. A review of typhloplanid flatworm ecology, with emphasis on pelagic species. Inland Waters, 2014, 4(3): 257-270. DOI:10.5268/IW |
| [20] |
Jarolím O, Kubečka J, Čech M et al. Sinusoidal swimming in fishes: the role of season, density of large zooplankton, fish length, time of the day, weather condition and solar radiation. Hydrobiologia, 2010, 654(1): 253-265. DOI:10.1007/s10750-010-0398-1 |
| [21] |
Schulze PC. Evidence that fish structure the zooplankton communities of turbid lakes and reservoirs. Freshwater Biology, 2011, 56(2): 352-365. DOI:10.1111/fwb.2010.56.issue-2 |
| [22] |
Chen F, Ye J, Shu T et al. Zooplankton response to the lake restoration in the drinking-water source in Meiliang Bay of subtropical eutrophic Lake Taihu, China. Limnologica-Ecology and Management of Inland Waters, 2012, 42(3): 189-196. DOI:10.1016/j.limno.2011.11.001 |
| [23] |
Fussmann G. The importance of crustacean zooplankton in structuring rotifer and phytoplankton communities; an enclosure study. Journal of Plankton Research, 1996, 18(10): 1897-1915. DOI:10.1093/plankt/18.10.1897 |
| [24] |
Pollard AI, Gonzalez MJ, Vanni MJ et al. Effects of turbidity and biotic factors on the rotifer community in an Ohio reservoir. Hydrobiologia, 1998, 387: 215-223. |
| [25] |
Wang S, Xie P, Geng H. The relative importance of physicochemical factors and crustacean zooplankton as determinants of rotifer density and species distribution in lakes adjacent to the Yangtze River, China. Limnologica-Ecology and Management of Inland Waters, 2010, 40(1): 1-7. DOI:10.1016/j.limno.2009.03.001 |
| [26] |
Oganjan K, Virro T, Lauringson V. Food spectrum of the omnivorous rotifer Asplanchna priodonta in two large northeastern European lakes of different trophy. Oceanological and Hydrobiological Studies, 2013, 42(3): 314-323. |
| [27] |
Gilbert JJ. Observations on the susceptibility of some protists and rotifers to predation by Asplanchna girodi. Hydrobiologia, 1980, 73(1/2/3): 87-91. |
| [28] |
Chang KH, Hideyuki DOI, Nishibe Y et al. Feeding habits of omnivorous Asplanchna: comparison of diet composition among Asplanchna herricki, A. priodonta and A. girodi in pond ecosystems. Journal of Limnology, 2010, 69(2): 209-216. DOI:10.4081/jlimnol.2010.209 |
| [29] |
Thomas SH, Housley JM, Reynolds AN et al. The ecology and phylogeny of oomycete infections in Asplanchna rotifers. Freshwater Biology, 2011, 56(2): 384-394. DOI:10.1111/fwb.2010.56.issue-2 |
 2015, Vol. 27
2015, Vol. 27 

