(2: 云南大学生命科学学院,昆明 650091)
(3: 云南大学城市建设与管理学院,昆明 650091)
(2: School of Life Science, Yunnan University, Kunming 650091, P.R.China)
(3: School of Urban Construction and Management, Yunnan University, Kunming 650091, P.R.China)
近年来,砷污染的相关研究得到世界各国政府及科学家的广泛关注,目前己成为国内外环境科学领域研究的主要热点问题之一[1-3].砷在水环境中会进行吸附/解吸、沉淀、氧化/还原等地球化学过程.这些转化过程使砷能从一种形态转化成另一种形态,由于不同形态砷的稳定性不同而导致其被固定或迁移[4-6].采用铁盐絮凝剂治理水体砷污染后,水体中的AsO43-和FeCl3结合生成FeAsO4,同时水体中形成大量Fe(OH)3胶体,这些Fe(OH)3胶体能够和AsO43-发生络合反应,形成难溶络合物FeAsO4·2H2O沉降到湖底沉积物中,沉积物成为接纳污染物砷的汇[7].然而,也有研究表明,当水体的水动力、pH值、氧化还原条件、竞争离子如PO43-浓度、有机质含量以及本土微生物等环境条件发生变化时,沉积物中砷的物理化学性质会发生改变,致使其重新被释放至水体,沉积物又可以成为水体砷污染的发生源[8-11].石荣等[12]研究表明,强酸性环境会造成金属氧化物的溶解而导致砷的释放.然而,Rubinos等[13]的研究表明,砷的迁移量会随着pH值的增大而增大;Hiller等[14]和Hering等[15]的研究表明,在过高pH值的情况下,大量增加的OH-会与砷的吸附之间产生竞争而减少砷的吸附.Rubinos等13]研究表明,水体磷浓度的升高会与砷产生竞争吸附而使砷解吸到水体中.韩沙沙等[16]和梁喜珍等[17]的研究表明,水体富营养化将导致藻类大量繁殖,藻类通过光合作用会引起水体pH值的升高.pH值的变化也会影响沉积物中砷的稳定性.本文选择湖泊含铁盐的高砷沉积物为研究对象,探索当沉积物暴露在不同pH值的上覆水以及经过不同初始pH值、不同初始总磷浓度的溶液淋洗后,沉积物-水界面砷的迁移转化条件和特征.
本研究采用静态控制实验的方法,通过设置上覆水不同pH值梯度,观察上覆水pH值稳定在某设定值时,沉积物中砷的迁移规律;同时设置淋溶土柱动态实验:配置不同pH值梯度的上覆水和不同总磷浓度的上覆水分别作为淋溶液,观察上覆水初始pH值和总磷浓度在某个设定值时,土柱中砷的迁移特性(根据淋出液的总砷浓度来判断初始pH值和总磷浓度对沉积物中砷的迁移性的影响).本文旨在通过室内实验探究含铁盐的高砷沉积物处于某个pH值或某个总磷浓度的上覆水中,沉积物中的砷的迁移特性.
1 材料与方法 1.1 样品采集和预处理高砷沉积物样品采自曾受到砷污染的一个淡水湖泊.该湖泊采用铁盐絮凝剂进行治理,使水体中的砷浓度下降并进入沉积物中.对整个湖面进行网格划分,每个网格的中心点即为采样点.全湖共设置31个样点.用抓斗沉积物采样器(型号:HAD-XDB0201D,北京)采集各样点的底泥,底泥去除杂物后装入2 L容量的自封袋,每个样点收集3袋合计约4~5 L泥样.将泥样运回实验室后混匀,风干,过20目筛后备用.
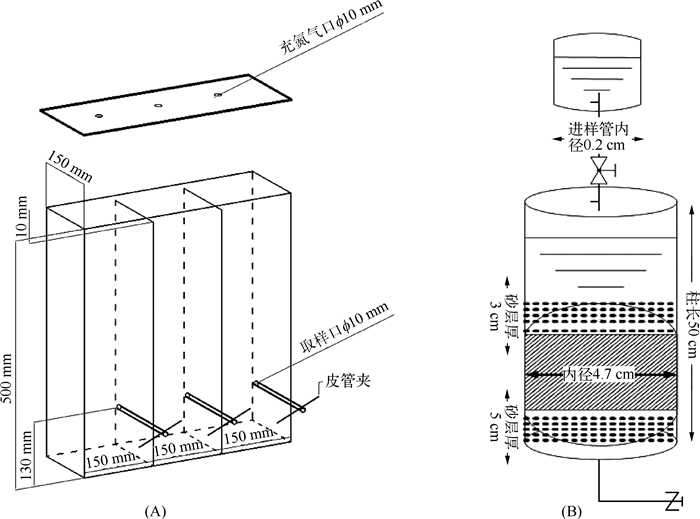
1.2 实验装置 1.2.1 静态实验所用玻璃缸静态实验使用的玻璃缸如图 1A所示,每个缸内用玻璃板分隔成等体积的3格,每个玻璃缸中的3格代表 3组重复实验.在距离每格底部13 cm的地方钻1个直径1 cm的孔,接上一段玻璃管,玻璃管外层套上皮管并附皮管夹.装置上部配玻璃盖,并在每格的正上方分别钻1个直径为1 cm的小孔,用来充氮气及添加调试剂.
|
图 1 静态试验使用的玻璃缸(A)和土柱淋溶装置(B)示意 Fig.1 Glass tank used for static experiment(A)and soil leaching column(B) |
动态实验采用内径4.7 cm、长50 cm的透明PVC管,管底部填充5 cm石英砂反滤材料(图 1B),防止土样流失,中间放土样,土柱上表覆盖3 cm石英砂,防止淋溶液冲击土样.淋溶液进样瓶用1.5 L塑料瓶.进样管用内径为0.2 cm的医用输液管.
1.3 方法步骤 1.3.1 静态玻璃缸实验在玻璃缸的每格内加入200 g风干后的泥样,然后分别加入4000 ml 1 mol/L NaNO3溶液,使水土比保持20 : 1.由于沉积物的缓冲作用,实验过程中对混合物pH值不断进行监测并校正到所设置的pH值,即:用2 mol/L的NaOH或HCl溶液调节NaNO3溶液的pH值分别到8(A组,控制pH值在7.5~8.5之间)、10(B组,控制pH值在9.5~10.5之间)、11(C组,控制pH值在10.5~11.5之间)、6(D组,控制pH值在5.5~6.5之间)、4(E组,控制pH值在3.5~4.5之间)和不调节pH值的F组(pH=7.0).
每次调节好pH值后,盖上玻璃盖,然后用透明胶带将各玻璃缸和盖子的边缘处封住,然后通过充氮口(图 1A)充入N2.取样时,从取样口收集水样,然后放入4℃冰箱冷藏待测.取完水样后立即用试管夹夹住取样出水口,打开充氮口充入N2,最后还原密封状态.在实验开始后的第2、4、6、11、14、20、25和30 d分别取上覆水水样,测定砷浓度.
1.3.2 淋溶土柱实验pH值淋溶实验:用去离子水配置4000 ml 0.1 mol/L NaNO3溶液,再用HCl或NaOH溶液分别将其pH值调节至4、7、8、11,作为淋溶液待用.磷酸盐淋溶实验:用去离子水和NaH2PO4溶液分别配置4000 ml含有总磷(TP)浓度为0、0.05、0.5和5 mg/L的淋溶液.
采用200 g风干泥样,放入淋溶柱中层.缓慢滴加上述淋溶液,每次淋溶200 ml,然后对淋溶管中的淋溶液充氮气,最后用胶布密封淋溶管进水口.控制每组实验淋溶次数为20次,每次收集100 ml淋溶液样品.
1.4 样品分析样品溶液总砷浓度的测定参照《水质砷的测定原子荧光光度法》(SL 327.1-2005);TP浓度的测定根据GB/T 11893-1989;采用Origin 8.0软件进行绘图;采用SPSS 19.0软件进行方差分析.
2 结果与讨论 2.1 不同pH值上覆水条件下沉积物中砷的迁移规律实验所用的沉积物砷平均含量为31.15 mg/kg.实验过程中每天测定pH值,发现各梯度pH值都呈现向7.5~8.0范围靠近的趋势,说明所用的沉积物有很强的pH值缓冲能力.通过每天对各实验组进行pH值调节,使之校正到设定的目标pH值,以了解上覆水酸碱度超过沉积物缓冲能力后,暴露在某一稳定pH值的上覆水中时,沉积物中砷的迁移规律.
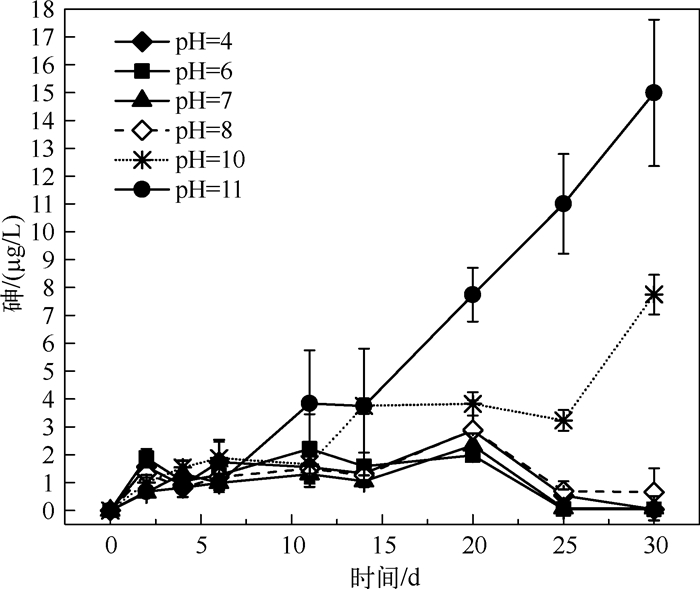
当pH值稳定在4、6、7和8的上覆水环境中,在实验开始的第1、2 d,水体砷浓度有上升趋势;第3~20 d水体砷浓度在0.5~2.5 μg/L范围内波动;从第21 d开始,水体砷浓度逐渐下降,几乎趋近于0(图 2).这说明沉积物中的砷在少量解吸释放一段时间后,砷又重新被沉积物吸附.
|
图 2 不同pH值上覆水中砷浓度的变化 Fig.2 The changes of arsenic concentration under different pH values in overlying water |
在pH=10的上覆水环境中,实验前11 d,沉积物中的砷溶出较缓慢,第11 d后,沉积物中的砷迅速溶出,但是第14~25 d,砷的溶出速度放缓,经过这个阶段后,沉积物中的砷又开始迅速溶出.在pH=11的上覆水环境中,第6 d时砷溶出速度突然增大(图 2).与pH=10相比,pH=11时沉积物中砷的迅速溶出阶段出现的时间更早,这说明沉积物处于强碱性上覆水环境中,碱性越强,砷的溶出速度越快.
2.2 不同pH值上覆水条件下沉积物中砷溶出量的比较上覆水呈强碱性时,沉积物中砷溶出量显著高于酸性、中性和弱碱性.在pH=10、11时,沉积物中砷的溶出量显著高于其他pH值梯度(P<0.05),且在碱性范围内(pH≥8),随着pH值的增大,沉积物的砷溶出量明显增大,这与Ganne等[18]和Tokunaga等[19]的研究结论相似,随着pH值从8开始增大,砷的溶出量也逐渐增大.这是因为随着pH值的增大,沉积物所携带的负电荷增多,使其与AsO43-之间的排斥力逐渐增大,促进砷的解吸[20].同时,溶液pH值的增大会导致OH-逐渐增多,与AsO43-竞争吸附位点的现象更加强烈,致使砷从底泥的迁移量增多[21].因此,从室内控制实验的角度来看,水体的碱化有可能会增加湖底沉积物中砷溶出的风险.
而在酸性、中性和弱碱性范围内(pH值为4~8),沉积物中砷的溶出量较少(1.05~1.31 μg/L),且砷溶出量差异不显著(P>0.05),说明上覆水pH值在4~8之间时,不会造成砷的大量溶出.前人的研究表明,酸性条件下,沉积物中的砷容易溶出并释放[22-23],原因是酸性条件能够加快含砷的铁氧化物的溶解,从而释放出大量砷[22].本研究结果与其不同,这可能是因为,本研究采用经FeCl3治理后的沉积物,此时,主导沉积物砷溶出的机制不是铁(氢)氧化物还原性溶解作用,可能与硫化物参与的砷的吸附沉淀有关[24-25].
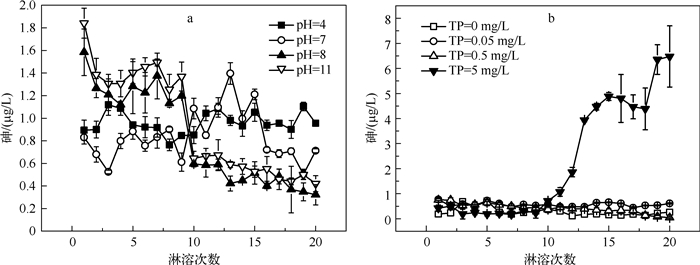
2.3 淋溶液初始pH值对沉积物中砷迁移的影响当淋溶液的初始pH值分别为4、7、8、11时,随着淋溶次数的增加,解吸淋溶出的砷浓度逐渐降低(图 3a),但解吸出来的砷都较少,浓度约为1 μg/L,不同初始pH值的淋溶液条件下砷浓度没有显著差异(P>0.05).这与郑景华等[26]的淋溶实验结果不同,其认为砷的溶出量随淋溶液pH值的增加呈降低趋势,即pH值越低,砷溶出量越高.这可能是由于:(1)该湖沉积物具有缓冲能力使开始设置的不同pH值梯度都被缓冲到弱碱性,导致pH值梯度拉不开,最终使各pH值梯度下的砷溶出量差异不大;(2)泥水比的差异也可能引起结果的不同.本文每次淋溶的泥水比是200 ml/200 g,而郑景华等[26]每次采用的泥水比是200 ml/250 g.经过测定分析,无论淋溶液的初始pH值是4还是11,淋出液的pH值都在7.5~8.0之间,说明所用沉积物具有较强的缓冲能力,有利于沉积物中砷的稳定.这种缓冲能力可能是受周边喀斯特地貌的石灰岩溶岩的影响.
|
图 3 随淋溶次数的增加,不同初始pH值(a)和TP浓度(b)的淋溶液对砷溶出的影响 Fig.3 Effect of different initial pH(a) and total phosphorus concentrations(b) of leaching solution on arsenic leaching with increasing number of leaching times |
当淋溶液TP浓度分别为0、0.05、0.5 mg/L时,随淋溶次数的增加,淋出液的砷浓度没有差异(图 3b,P>0.05),各梯度砷溶出量之间的差异不显著(P>0.05),且砷的溶出量均较低(0.5~1.0 μg/L).这说明湖泊TP浓度≤0.5 mg/L时,磷的竞争吸附对砷的迁移影响较小.Mohan等[27]的研究表明,较低的TP浓度不会影响砷的吸附,这与本文的结论一致.当水体TP浓度较低(≤0.5 mg/L)时,对沉积物中的砷迁移影响较小.
当淋溶液的TP浓度高达5.00 mg/L时,随淋溶次数的增加,淋出液的砷浓度在第10次后就显著增加(图 3b,P<0.05),沉积物的砷溶出总量显著增加(P<0.05).磷和砷在元素周期表中都属于第五主族元素,它们的化学性质相似,并且砷在土壤中形成的化合物与磷的化合物也相似.前人的研究[13, 28]发现:PO43-与AsO43-竞争沉积物上吸附位点,发生交换吸附而解吸出大量的砷.由于天然水体中的TP浓度远低于5.00 mg/L,因此,磷的竞争吸附对促进沉积物中砷溶出的影响不大.
3 结论本研究以含铁盐的高砷沉积物为研究对象,通过静态控制实验研究沉积物暴露在不同pH值上覆水中时,砷随着时间变化的迁移规律,并同步开展土柱淋溶动态模拟实验以研究不同初始pH值、不同TP浓度的淋溶液对沉积物中砷溶出的影响.主要结论为:(1)当沉积物暴露在pH=10和11的上覆水中时,分别在第11 d和第6 d后,沉积物中的砷溶出速度增大.这说明,沉积物处于强碱性上覆水环境中,碱性越强,砷的溶出越快,且砷的溶出量也越大.从室内控制实验的角度来看,上覆水的碱化有可能增加湖底沉积物中砷溶出的风险.(2)相比于强碱性环境,当沉积物暴露在酸性、中性和弱碱性(pH值为4~8)环境中,上覆水的酸碱度对沉积物砷迁移的影响较小.(3)上覆水TP浓度低于0.5 mg/L时,磷的竞争吸附对砷的迁移影响较小.
| [1] |
Meliker JR, Wahl RL, Cameron LL et al. Arsenic in drinking water and cerebrovascular disease, diabetes mellitus, and kidney disease in Michigan: a standardized mortality ratio analysis. Environmental Health, 2007, 6(4): 1-11. |
| [2] |
Marabottini R, Stazi S, Papp R et al. Mobility and distribution of arsenic in contaminated mine soils and its effects on the microbial pool. Ecotoxicology and Environmental Safety, 2013, 96: 147-153. DOI:10.1016/j.ecoenv.2013.06.016 |
| [3] |
张玉宝, 徐颖, 储昭升等. 洞庭湖平原中小型湖群沉积物中砷污染特征与评价. 湖泊科学, 2011, 23(5): 695-700. DOI:10.18307/2011.0505 |
| [4] |
Smedley P, Kinniburgh D. A review of the source, behaviour and distribution of arsenic in natural waters. Applied Geochemistry, 2002, 17(5): 517-568. DOI:10.1016/S0883-2927(02)00018-5 |
| [5] |
Xu L, Zhao Z, Wang S et al. Transformation of arsenic in offshore sediment under the impact of anaerobic microbial activities. Water Research, 2011, 45(20): 6781-6788. DOI:10.1016/j.watres.2011.10.041 |
| [6] |
Burton ED, Johnston SG, Bush RT. Microbial sulfidogenesis in ferrihydrite-rich environments: effects on iron mineralogy and arsenic mobility. Geochimica et Cosmochimica Acta, 2011, 75(11): 3072-3087. DOI:10.1016/j.gca.2011.03.001 |
| [7] |
张玉玺, 向小平, 张英等. 云南阳宗海砷的分布与来源. 环境科学, 2012, 33(11): 3768-3777. |
| [8] |
李功振, 许爱芹. 京杭大运河(徐州段)砷的形态的分步特征研究. 环境科学与技术, 2008(1): 69-71. |
| [9] |
Bhattacharya P, Welch AH, Stollenwerk KG et al. Arsenic in the environment: biology and chemistry. Science of the Total Environment, 2007, 379(2): 109-120. |
| [10] |
李雪, 王颖, 张笛. 河口沉积物对砷的吸附性能及影响因素. 环境科学与技术, 2012, 34(12): 1-6. DOI:10.3969/j.issn.1003-6504.2012.12.001 |
| [11] |
Liu R, Yang C, Li S et al. Arsenic mobility in the arsenic-contaminated Yangzonghai Lake in China. Ecotoxicology and Environmental Safety, 2014, 107: 321-327. DOI:10.1016/j.ecoenv.2014.06.020 |
| [12] |
石荣, 贾永锋, 王承智. 土壤矿物质吸附砷的研究进展. 土壤通报, 2007, 38(3): 584-589. |
| [13] |
Rubinos DA, Iglesias L, Diaz-Fierros F et al. Interacting effect of pH, phosphate and time on the release of arsenic from polluted river sediments (Anllns River, Spain). Aquatic Geochemistry, 2011, 17(3): 281-306. DOI:10.1007/s10498-011-9135-2 |
| [14] |
Hiller E, Kordík J, Slaninka I et al. Arsenic mobility from anthropogenic impoundment sediments-Consequences of contamination to biota, water and sediments, Poša, Eastern Slovakia. Applied Geochemistry, 2009, 24(11): 2175-2185. DOI:10.1016/j.apgeochem.2009.09.021 |
| [15] |
Hering J, Kneebone P. Biogeochemical controls on arsenic occurrence and mobility in water supplies. New York: Marcel Dekker, 2002: 155-181.
|
| [16] |
韩沙沙, 温琰茂. 富营养化水体沉积物中磷的释放及其影响因素. 生态学杂志, 2004, 23(2): 98-101. |
| [17] |
梁喜珍, 李畅游, 李兴等. 乌梁素海富营养化水体pH值与其他指标的相关性初探. 中国农村水利水电, 2009(12): 1-3. |
| [18] |
Ganne P, Cappuyns V, Vervoort A et al. Leachability of heavy metals and arsenic from slags of metal extraction industry at Angleur (eastern Belgium). Science of the Total Environment, 2006, 356(1): 69-85. |
| [19] |
Tokunaga S, Hakuta T. Acid washing and stabilization of an artificial arsenic-contaminated soil. Chemosphere, 2002, 46(1): 31-38. DOI:10.1016/S0045-6535(01)00094-7 |
| [20] |
Park J, Lee J, Lee JU et al. Microbial effects on geochemical behavior of arsenic in As-contaminated sediments. Journal of Geochemical Exploration, 2006, 88(1): 134-138. |
| [21] |
Masscheleyn PH, Delaune RD, Jr Patrick WH. Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil. Environmental Science & Technology, 1991, 25(8): 1414-1419. |
| [22] |
Al-Abed SR, Jegadeesan G, Purandare J et al. Arsenic release from iron rich mineral processing waste: Influence of pH and redox potential. Chemosphere, 2007, 66(4): 775-782. DOI:10.1016/j.chemosphere.2006.07.045 |
| [23] |
徐圣友, 叶琳琳, 朱燕等. 巢湖沉积物中重金属的BCR形态分析. 环境科学与技术, 2008, 31(9): 20-23. |
| [24] |
Tufano KJ, Fendorf S. Confounding impacts of iron reduction on arsenic retention. Environmental Science and Technology, 2008, 42(13): 4777-4783. DOI:10.1021/es702625e |
| [25] |
Kocar BD, Herbel MJ, Tufano KJ et al. Contrasting effects of dissimilatory iron (Ⅲ) and arsenic (Ⅴ) reduction on arsenic retention and transport. Environmental Science and Technology, 2006, 40(21): 6715-6721. DOI:10.1021/es061540k |
| [26] |
郑景华, 苏华美, 范荣桂等. 煤矸石土壤砷污染相关性分析. 水土保持通报, 2014, 34(2): 168-171. |
| [27] |
Mohan D, Jr Pittman CU. Arsenic removal from water/wastewater using adsorbents-a critical review. Journal of Hazardous Materials, 2007, 142(1): 1-53. |
| [28] |
雷梅, 陈同斌, 范稚连等. 磷对土壤中砷吸附的影响. 应用生态学报, 2004, 14(11): 1989-1992. DOI:10.3321/j.issn:1001-9332.2004.11.001 |
 2015, Vol. 27
2015, Vol. 27 


