(2: 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
(3: 国环宏博(北京)节能环保科技有限责任公司, 北京 100006)
(4: 无锡市农林局水产技术指导站, 无锡 214023)
(2: Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, P. R. China)
(3: Guo-huan-hong-bo(Beijing) Environmental Technology CO. LTD., Beijing 100006, P. R. China)
(4: Fisheries Technical Guidance Station of Wuxi Municipal Bureau of Agriculture, Forestry, Wuxi 214023, P. R. China)
近年来因污水(生活污水、畜禽养殖污水、工业污水等)的排放、农业径流及点源污染等多重因素影响,导致湖泊、水库等交换周期长、流动性差的水体中过量累积营养盐,水体呈现富营养化[1].其外在表现之一就是蓝藻水华的周期性、大规模暴发,尤其是蓝藻聚集死亡引起的藻源性黑水团等水污染事件[2-3],使得其对水质污染产生了质的变化;而2007年太湖蓝藻引发的饮用水危机,更是对当地居民的生产、生活和国民经济发展都造成了极大的影响.因此,如何快速、有效地修复污染水体,已经成为当前水环境保护需要迫切解决的问题和经济可持续发展的重要保障.针对这种情况,目前已采取了多种治理方式,如底泥疏浚[4-5]、“引江济太”工程[6]、种植水生植物修复水体[7]等,在一定范围内取得了相应的效果.其中,种植生长和扩繁能力快、适应性强、生物量大、易于机械化打捞的凤眼莲成为当前水体治理的热点[8-9],实际治理效果也显现出其具有明显的水质净化功能[10].然而,即使采用水生植物进行污染水体生态治理,在没有完全控制住水体及内源氮、磷负荷的情况下,蓝藻水华仍然周期性、规模性发生,而且藻华发生期间正值温度高(气温>25℃)、光照强烈的夏季.该季节正是水生植物生长的旺季,藻华的大量聚集将可能对植物生长产生不良影响;在江苏太湖地区持续推进的以漂浮植物水葫芦为主的太湖水污染治理专项工程中,蓝藻大量发生、聚集后对水葫芦生长产生哪些影响,需要进行系统深入的研究.因此,针对这种现象,本研究通过模拟实验研究在藻华的不同堆积程度下,在较高的温度条件下(气温>25℃)藻华聚集后对植物关键抗氧化酶活性的影响及其响应;探讨漂浮植物乃至水生植物在蓝藻水华聚集后的生长受限原因,以及为减轻蓝藻水华聚集的危害、强化利用以水葫芦为代表的水生植物修复污染水体和水质净化效果提供理论依据.
1 实验设置与样品分析 1.1 实验设置本实验在温室大棚内400L大塑料周转箱内开展,其编号为1#~9#,其中1#~3#为低浓度处理(简称处理1),4#~6#为高浓度处理(简称处理2),7#~9#为对照.实验水体采集于江苏省农科院的2#池塘,该池塘的上游来水主要是生活污水(实验区水体TN浓度为3.90mg/L,TP浓度为0.15mg/L,水温不低于25℃).然后盛放在周转箱内,周转箱底部预先放入过筛的10cm厚、采自2号塘中的底泥.待水体注入周转箱10d后,开始放入规格一致、生长健壮的水葫芦中等苗.水葫芦为单株、带有8片新鲜叶片、白色须根的绿色健壮植株.静置10d后,待水葫芦适应水体、开始正常生长后,放入从太湖梅梁湾采集的藻华聚集时的新鲜藻体.放入前预先用浮游植物生物网过滤掉流动的水分,然后用天平称量后,处理1中蓝藻加入量为60g/L[12-13],处理2中蓝藻加入量为120g/L(处理1中所添加蓝藻浓度相当于2007年无锡水厂发生藻华黑水团时的浓度),以模拟蓝藻水华不同聚集程度以及发生藻源性黑水团时其对水葫芦的影响;对照组不添加蓝藻,每个处理设置3个平行.在蓝藻大量死亡、水体发黑后,水葫芦不再生长、植株叶片和根系无明显变化时视为植物受到的损伤为不可逆的,结束实验.
1.2 样品采集与分析 1.2.1 基本指标测定实验开始后,在前3d每天用便携式水质监测仪YSI测定水体的基本指标(水温、溶解氧(DO)、pH值、氧化还原电位(Eh)及电导率(Cond);第4d后,因水体基本指标较为稳定,每2d测定1次.水体样品每3d采集1次,然后带回实验室测定铵态氮(NH4+-N)浓度.
1.2.2 植物样品采集每3d采集1次植物样品,然后带回实验室,立即用自来水冲洗干净.采集完好植物顶生叶片4片和新鲜须根(实验后期,因加藻处理中老根均腐烂、脱落,选取新长出的嫩根作为实验材料),无折叠地放入自封袋中用细线缠好,立即置于液氮罐中,留作测定关键酶活性指标.
1.3 酶液提取测定时把植物叶片、须根从液氮罐中取出,取0.5g叶片加3ml pH值为7.8、50mmol/L磷酸缓冲液(含1 % PVP, 0.2mmol/L EDTA)及少量石英砂,于冰浴中用匀浆机研磨、提取,匀浆液于15000转/min下4℃离心20min,取上清液用于相关指标测定.
1.3.1 抗氧化酶活性测定超氧化物歧化酶(SOD)活性测定参照Giannopolitis等[14]的方法,依据SOD抑制氮蓝四唑(NBT)在光下的还原作用来测定,以抑制NBT光化还原50 %为一个酶活单位;过氧化物酶(POD)活性测定参照Cakmak[15]的方法,在25℃下直接测定波长470nm处由于愈创木酚氧化而引起吸光值的上升速率,以每毫克蛋白每分钟氧化1μmol愈创木酚为一个酶活单位;过氧化氢酶(CAT)活性测定参照文献[16-17],在25℃下直接测定波长240nm处由于H2O2分解而引起的吸光值的下降速率,以每毫克蛋白每分钟分解1μmol H2O2为一个酶活单位.
1.3.2 膜脂过氧化程度测定叶片及根系的膜脂过氧化程度用丙二醛(MDA)含量来表示,参照Hodges等[18]的方法测定单位鲜重的植物组织中MDA的含量.MDA浓度(μmol/L)计算公式为:
| $ {A_{532}} - {A_{600}} = 155000C \cdot L $ | (1) |
式中,A532和A600分别表示532和600nm波长处的吸光度值,L表示比色杯的厚度(cm).植物组织中MDA含量的计算:MDA含量(μmol/g)=MDA浓度(μmol/L)×提取液体积(ml)/植物组织鲜重(g).
1.4 分析方法及数据处理采用Excel 2007进行数据分析和作图,采用SPSS 18软件进行相关统计分析.
2 结果与分析 2.1 藻华聚集对水体基本理化参数的影响藻华细胞聚集后,藻细胞会在2h内消耗掉植物根区周围水体中的DO(由firestingII(德国)微电极测定,数据未显示).根区水体中DO浓度低于0.2mg/L,从而形成缺氧环境(图 1a).在高温(气温>25℃)作用下藻细胞易腐解,致使根区水体Eh在藻细胞加入后1d内就下降为-135.2mV(图 1b),表现为厌氧、还原环境;实验进行5d后,处理1、2中植物根系就出现发黑、发臭,且老根开始大量脱落,表现出对植物根系产生毒害;在实验结束(共持续14d)时,处理2中水体DO浓度和Eh分别低至0.10mg/L和-199.9mV,呈现厌氧、强还原的环境;此时老根基本脱落或已死亡,植物叶片呈现焦黄、干枯现象,植物出现大量死亡,植物生物量不断下降,而处理1和对照组中植物生物量不断增加,处理1、2中藻体量不断下降(数据未显示),表明在120g/L的蓝藻严重聚集状态下,将会对植物产生不可逆的毒害作用,造成植物死亡.
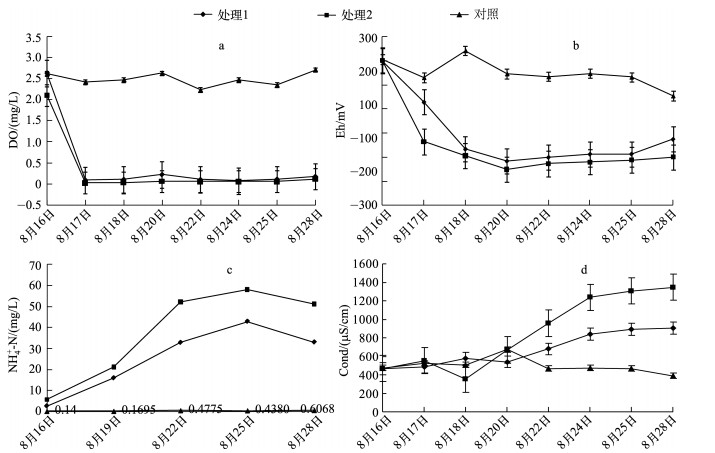
|
图 1 藻细胞聚集后水体基本理化指标和NH4+-N浓度变化 Fig.1 Changes of NH4+-N concentration and basic physical and chemical parametersin overlying water after algae cells gathered |
藻细胞死亡后大量细胞内含物会释放到水体中,造成水体NH4+-N浓度快速升高(图 1c).在本实验中,处理1、2中根区NH4+-N浓度在实验进行3d后分别高达15.90和21.18mg/L;实验结束时处理1、2中NH4+-N浓度分别高达32.99和51.22mg/L,分别为对照组根区水体的54和84倍.快速死亡、腐解的藻细胞导致水体呈现强还原、缺氧环境,藻细胞死亡后释放大量的NH4+-N于水体中,对植物根系产生毒害作用,导致植物生长的生态环境恶化,植物受外界恶劣的环境胁迫而死亡.
藻华聚集、死亡后,在初始阶段(实验的前5d)大量细胞内含物会释放到水体中,这种细胞内含物含有大量的颗粒态、胶体态等氮、磷营养盐成分,导致水体中颗粒态及可溶性的氮、磷浓度升高,从而导致水体电导率升高(图 1d)[19-20].相关研究表明,藻华细胞释放的微囊藻毒素(Microcystin, MC)能够抑制沉水植物的光合作用及其幼苗的发育[21-22];在本实验中蓝藻处理组中可能有藻毒素释放从而对水葫芦根系、嫩根生长等产生抑制作用[23].何虎等[24]的研究也表明,水华蓝藻在湖泊沿岸带的堆积会严重影响水体光强、DO浓度等,从而胁迫沉水植物的生长.
2.2 藻华聚集后对植株膜脂过氧化的影响植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度.藻细胞聚集后,植物叶片中MDA含量呈现快速升高的趋势,处理1中叶片MDA含量在实验进行3d后开始增加,处理2中叶片则在实验开始后就快速增加,至第6d达到最高值,为2.22μmol/g(FW),同期对照组和处理1中叶片的MDA含量分别为1.57和1.81μmol/g(FW).随后处理2中MDA含量开始下降,这可能是因为持续的逆境胁迫超过了植物的自我调控能力.而处理1中MDA含量持续增加,至实验结束时,处理1、2中叶片MDA含量为2.34和2.17μmol/g(FW),分别为对照组的1.5和1.4倍(图 2a).

|
图 2 藻细胞聚集后植株叶片和根系MDA和SOD含量变化 Fig.2 Changes of MDA and SOD contents in leaf and root of aquatic plant after algae cells gathered |
植物根系中MDA含量则呈现不同的变化趋势,处理1表现为先增加、后降低、再增加的变化趋势,这可能是初始阶段根系受损死亡,在后期长出部分新根受逆境胁迫导致MDA含量较高.在实验进行3d后增加为0.86μmol/g(FW),在第6d降低为0.69μmol/g(FW),随后开始快速增加,至实验结束时高达1.02μmol/g(FW),这种现象可能是植物根系对藻华细胞刚聚集时的逆境产生的一种自我应答响应;随后大量的藻细胞开始腐烂,产生严重的胁迫,植物根系死亡,导致MDA含量下降;在度过了适应期后,植物新根系长出后,虽然环境胁迫仍然存在,但植物根系能够继续生长,因此表现为根系中MDA含量很高.处理2中藻华细胞聚集最为严重,其造成的环境胁迫作用也最为强烈,其根系中MDA含量表现为实验开始后就下降的变化趋势,至实验结束时其含量降为0.57μmol/g(FW)(图 2b).植株根系中MDA含量的持续降低表明在藻细胞聚集后产生的厌氧、强还原环境和高NH4+-N含量等环境对植物根系产生了不可逆的胁迫作用.丙二醛含量是植物细胞膜质过氧化程度的体现,丙二醛含量高,说明植物细胞膜质过氧化程度高,细胞膜受到的伤害严重,同时也会告诉机体需要进行更激烈的胁迫应答反应来保护机体[24],其积累是活性氧毒害作用的表现[25],也是判断植物衰老与膜脂过氧化的一种指标.本研究表明,在蓝藻严重聚集后产生的厌氧、强还原和高盐度等环境胁迫下,植物叶片和根系内膜脂过氧化产物-丙二醛的含量在实验后期快速升高.由于根系最先和最直接受到逆境胁迫影响,因此在藻细胞聚集后水葫芦根系中SOD含量就出现了快速升高(图 2);随后受逆境条件影响,水葫芦根系中SOD含量呈现稳中有升的变化趋势.植物叶片中SOD含量变化具有滞后性,但在外界逆境胁迫积累到一定程度后叶片功能受到影响,从而导致叶片中SOD含量出现快速增加现象.丙二醛含量的增加常被看作衡量活性氧对植物体防御系统破坏程度的一个准确的衡量指标[26].因此,藻细胞聚集后,植物根系内MDA含量立即增高,且随着藻细胞聚集程度而增加,其叶片、根系内MDA含量比对照组分别增加了115 %和112 %,说明藻细胞聚集后形成的恶劣环境不但引起了植物根系内严重的膜脂过氧化现象,而且对植物叶片也产生了显著影响.
2.3 藻华聚集后对植株SOD的影响SOD是一类广泛存在于生物体内的金属酶,能够催化超阳阴离子自由基发生歧化反应,平衡机体内的氧自由基.植物正常代谢过程和在各种环境胁迫下均能产生活性氧和自由基,活性氧和自由基的积累引起细胞结构和功能的破坏.SOD作为膜脂过氧化防御系统的主要保护酶,能催化活性氧发生歧化反应产生无毒分子氧和过氧化氢,从而避免植物遭受伤害,较高的SOD活性是植物抵抗逆境胁迫的生理基础.在本实验中,藻细胞聚集后,植物叶片中的SOD含量呈现缓慢增加趋势,至实验结束时,处理1、2叶片的SOD含量分别升至274.430和266.497U/g,分别为同期对照组的1.94和1.88倍(图 2c).根系中SOD含量具有类似变化趋势,也表现为持续增加,但在实验结束时,处理1中叶片SOD含量要低于处理2(图 2d).植株体内SOD含量的持续增加,表明在藻华细胞聚集、引起环境变化后,对植物产生了胁迫;植物为了抵抗逆境压力,通过增加SOD含量以消除植株体内产生的自由基,以保护蛋白质、细胞膜免受活性氧毒害[27].活性氧代谢失调是植物在逆境胁迫下遭受伤害和衰老的机理之一,因此植物体内SOD等内源清除剂可以在逆境胁迫过程中清除活性氧,维持活性氧代谢平衡、保护膜结构,从而使植物能在一定程度上忍耐、减缓或抵抗逆境胁迫.这表明水葫芦在环境胁迫时通过增加体内SOD含量能较好地保护自身免遭活性氧自由基的伤害.如Massacci等[28]的研究也表明,植物通过SOD活性增加可以减少环境胁迫下活性氧自由基的累积.
2.4 藻华聚集后对植株POD的影响植物在逆境条件下,体内活性氧代谢和膜脂过氧化作用加剧.保护酶系统的POD与SOD可有效地清除活性氧、自由基,保持体内活性氧的平衡.在加入藻细胞后,植物叶片和根系内POD含量呈现不同的变化趋势(图 3a、b).藻细胞聚集后,处理1、2中植物叶片POD含量立即增加,且处理2中增加幅度要大于处理1,实验进行3d后,处理1、2叶片中POD含量分别为523.76和1370.41U/(g·min),实验结束时,处理1、2中POD含量高达1163.10、1988.60U/(g·min),分别为对照组的1.5和2.6倍.根系中POD含量呈现相反的变化趋势,表现为先增加、后降低的趋势(由于测定的为实验开始后含量,因此图中未显示出藻细胞添加前的变化趋势图),这可能是由于在藻华细胞聚集后,产生的环境条件变化立即对植物体、尤其是水葫芦的根系产生胁迫,因根系直接接触到水环境且能够迅速产生反应,因此,其中POD含量出现了快速增加.在实验开始后,可以看出处理1、2根系中POD含量要远高于对照组,其含量分别2643.07、3175.74U/(g·min),为对照组的2.5和3.0倍.随后其含量就开始急剧下降,处理1中POD含量与对照组持平,而处理2中POD含量则低于对照组,至实验结束时,其含量分别为841.730和525.161U/(g·min),为同期对照组的1.07和0.67倍.实验中还发现,处理1中植物已经长出大量新根,开始正常生长,处理2中大部分植物叶皮发黄、枯焦死亡.这也表明藻华聚集后产生的严重环境胁迫会对植物根系产生不可逆的伤害,导致植物POD根系快速下降而无法恢复.Rivero等[29]研究高温对黄瓜叶片的胁迫时也发现POD活性增加,但在低温下其活性下降.在环境胁迫下,不同植物有上升、下降或不变等响应[30-32].
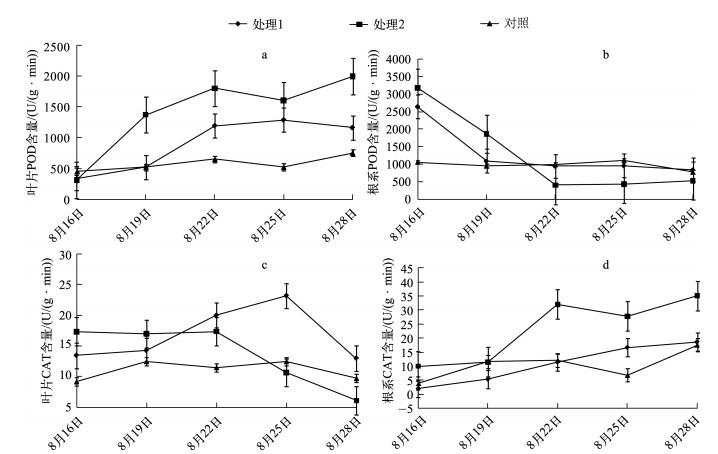
|
图 3 藻细胞聚集后植株叶片和根系POD和CAT含量变化 Fig.3 Changes of POD and CAT contents in leaf and root of aquatic plant after algae cells gathered |
CAT也是一种酶类清除剂,又称为触酶,是以铁卟啉为辅基的结合酶.它可促使H2O2分解为分子氧和水,清除体内的H2O2,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一.在本模拟实验中,植物叶片中CAT含量表现为前期增加、后期降低的变化趋势,藻细胞聚集后,叶片中CAT含量立即升高,处理1中CAT持续增加,到实验进行到9d时其含量达到最高(23.21U/(g·min)),随后快速降低,至实验结束时为12.96U/(g·min),为同期对照组的1.34倍.处理2中叶片在实验前期维持较高含量,在实验进行到6d后达到最高值(17.35U/(g·min)),随后就急剧下降,到实验结束时其含量仅为6.09U/(g·min),为同期对照组中的0.63倍(图 3c).植物体中CAT对不同胁迫做出不同的响应已经通过拟南芥进行了研究[33],研究表明植物体内H2O2浓度越高,分解速度越快.在实验中处理组2的根系中保持较高的自由基清除酶活性,从而保证其较强的自由基清除能力,减轻自由基对植物细胞生物大分子如DNA、蛋白质、脂肪酸的伤害,维持细胞正常的生命活动,这是植物抵抗逆境胁迫、保持再生长的基础[34].然而,处理2中植物叶片中CAT含量在经过逆境胁迫7d后出现快速下降,表明植物叶片中CAT因较强的逆境胁迫压力超过了植物的自我调节能力,导致植物叶片失去部分生理功能,如植物叶片光合作用下降(数据未显示,另文说明),也表明在植物受到逆境胁迫后,因根部受到伤害,导致水分、营养等物质的传递受阻[35],反而出现植物叶片抗逆能力低于植物根部的现象,这也是本实验出现根部CAT含量高于叶片的原因之一(图 3c、d).
3 讨论蓝藻水华的频繁暴发不但对当地水体的景观、旅游、饮用水水源等产生不良影响,而且对水生植被产生重要影响[36],以太湖为例,2004-2007年,太湖水华蓝藻的最大聚集面积从196.8km2上升到979.1km2.而与此同时,全湖水生植被的覆盖面积从482.2km2下降到364.1km2,总生物量下降23 % [37].而且受风向、湖流等影响,蓝藻水华常在下风向水域发生堆积,这种堆积常具有时间短、浓度高的特征,在高温作用下常出现短期内大量死亡,造成水体缺氧甚至形成藻源性“黑水团”现象,对水体污染产生质的变化[38],从而导致下风向水域中水生植被生物量显著降低[39].相关研究表明,蓝藻聚集对水生植被的生存、发展产生了重要影响,而在当前多地开展的以水葫芦为代表的水生植物的生态治理中,也发现藻华聚集、快速死亡后对水葫芦的生长、扩繁产生了严重影响,甚至出现死亡的现象.通过本研究发现,藻华细胞快速死亡后形成的缺氧、还原和高NH4+-N环境对水葫芦根系产生了不可逆的毒害作用,从而导致植物体内POD、SOD、CAT、MDA含量快速变化(图 2、3).随着藻细胞腐解、环境持续恶化和对植物毒害的持续影响,导致在处理2中植物无法抵消这种逆境胁迫而死亡.通过对植物体内几种关键酶和藻华聚集后引起的主要环境因子变化之间的Pearson相关性分析(表 1)表明,植物体内酶活性变化与根区水体DO浓度、Eh呈负相关(P<0.05),与水体中NH4+-N浓度呈显著正相关.表明在水体产生缺氧、还原环境中,几种关键的抗氧化酶含量增加;而水体中NH4+-N浓度增加将会对植物产生毒害作用,植物为了抵消该种逆境的不利影响,通过调节体内抗氧化酶的活性,以抵消不良环境胁迫对植物产生的毒害作用.其中植物体内POD含量与水体中DO浓度和Eh均呈极显著负相关(P<0.01),由于植物正常代谢过程和在各种环境胁迫下均能产生活性氧和自由基,活性氧和自由基的积累引起细胞结构和功能的破坏,而超氧化物歧化酶是活性氧清除系统中第一个发挥作用的抗氧化酶[40],表明植物体POD酶活性对水体DO浓度和Eh变化的反应更为灵敏,从而有助于植物消除外界不良影响.但在藻华细胞严重聚集环境下,植物在无法抵消逆境影响时,根系将会受到毒害而逐渐死亡[41].这也表明在藻华暴发堆积严重的水域中,植物生长环境的严重恶化是水生植被包括漂浮植物死亡的主要原因.
| 表 1 植物体内关键酶活性和环境指标的Pearson相关性分析 Tab.1 Pearson correlation of the key enzymatic activity and environmental factors |
1) 藻华细胞聚集后,受较高水体温度(>25℃)的协同作用,水体DO在2h内就消耗殆尽(DO<0.2mg/L);植物根区Eh快速下降,到实验结束时降低到-199.9mV,处理1、2根区水体NH4+-N浓度分别高达32.99和51.22mg/L,呈厌氧、强还原、高NH4+-N的严重不良环境条件,植物在该种逆境胁迫下受到毒害作用.
2) 藻华细胞聚集后,首先对水葫芦根系直接产生胁迫影响,植物根系内关键抗氧化酶活性出现剧烈的应答响应.至实验结束时,处理1、2根系内SOD含量分别为对照组的1.7和1.9倍;POD含量为对照组的2.5和3.0倍;根系内CAT含量为对照组的1.0和2.0倍.根系在藻细胞开始聚集时立即出现强烈的膜脂过氧化作用,随后受环境的持续毒害作用根系死亡,表明在较长时间段(>5d)的环境胁迫下、超过植物的自我调节能力后,植物将开始死亡.
3) 水葫芦受到逆境胁迫影响后,植物体内的SOD、POD、CAT等抗氧化酶活性出现即时应答变化,到实验结束时处理1、2的叶片内SOD含量分别为对照组的1.94和1.88倍,POD含量分别为对照组的1.5和2.6倍,CAT含量分别为对照组的1.34和0.63倍;植物叶片内膜脂过氧化程度加剧,处理1、2叶片内的MDA含量分别为对照组的1.5和1.4倍.叶片内抗氧化酶活性的变化,反映出植物叶片内部发生了强烈的生理生化反应.
| [1] |
Smith HV, Schindler WD. Eutrophication science:where do we go from here?. Trends in Ecology and Evolution, 2009, 24(4): 201-207. DOI:10.1016/j.tree.2008.11.009 |
| [2] |
中国科学院南京地理与湖泊研究所. 太湖梅梁湾2007年蓝藻水华形成及取水口污水团成因分析与应急措施建议. 湖泊科学, 2007, 19(4): 357-358. DOI:10.18307/2007.0401 |
| [3] |
Lucie G. Doing battle with the green monster of Taihu Lake. Science, 2007, 317: 1166. DOI:10.1126/science.317.5842.1166 |
| [4] |
钟继承, 刘国锋, 范成新等. 湖泊底泥疏浚环境效应:Ⅰ.内源磷释放控制作用. 湖泊科学, 2009, 21(1): 84-93. |
| [5] |
陈超, 钟继承, 范成新等. 疏浚对湖泛的影响:以太湖八房港和闾江口水域为例. 中国环境科学, 2014, 34(8): 2071-2077. |
| [6] |
贾锁宝, 尤迎华, 王嵘. 引江济太对不同水域氮磷浓度的影响. 水资源保护, 2008, 24(3): 53-56. |
| [7] |
叶春, 金相灿, 王临清等. 洱海湖滨带生态修复设计原则与工程模式. 中国环境科学, 2004, 24(6): 717-721. |
| [8] |
Tsutomu I, Teranishi S. Rates of nutrient uptake and growth of the water hyacinth[Eichhornia crassipes(mart.) Solms]. Water Research, 1988, 22(8): 943-951. DOI:10.1016/0043-1354(88)90140-6 |
| [9] |
严少华, 王岩, 王智. 水葫芦治污试验性工程对滇池草海水体修复的效果. 江苏农业学报, 2012, 28(5): 1025-1030. |
| [10] |
刘国锋, 张志勇, 严少华等. 大水面放养水葫芦对太湖竺山湖水环境净化效果的影响. 环境科学, 2011, 32(5): 1299-1305. |
| [11] |
吴婷婷, 刘国锋, 韩士群等. 蓝藻水华聚集对漂浮植物水葫芦生理生态的影响. 环境科学, 2015, 36(1): 114-120. |
| [12] |
何浪, 商兆堂, 秦铭荣等. 太湖蓝藻密度消长的规律分析. 苏农业科学, 2012, 40(6): 333-335. |
| [13] |
刘国锋, 何俊, 范成新等. 藻源性黑水团环境效应:对水沉积物界面处Fe、Mn、S循环影响. 环境科学, 2010, 31(11): 2652-2660. |
| [14] |
Giannopolitis CN, Ries SK. Superoxide dismutases:Ⅰ. occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314. DOI:10.1104/pp.59.2.309 |
| [15] |
Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves. Plant Physiology, 1992, 98(4): 1222-1227. DOI:10.1104/pp.98.4.1222 |
| [16] |
Patra HK, Kar M, Mishra D. Catalase activity in leaves and during plant development and senescence. Biochemie und Physiologie der Pfanzen, 1978, 172: 385-390. DOI:10.1016/S0015-3796(17)30412-2 |
| [17] |
李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
|
| [18] |
Hodges DM, Delong JM, Forney CF et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta, 1999, 207(4): 604-611. DOI:10.1007/s004250050524 |
| [19] |
孙小静, 秦伯强, 朱广伟. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放. 中国环境科学, 2007, 27(3): 341-345. |
| [20] |
李秋华, 林秋奇, 韩博平. 广东大中型水库电导率分布特征及其受N、P营养盐的影响. 生态环境, 2005, 14(1): 16-20. |
| [21] |
Pflugmacher S. Possible allelopathic effects of cyanotoxins, with reference to microcystin-LR, in aquatic ecosystems. Environmental Toxicology, 2002, 17(4): 407-413. DOI:10.1002/(ISSN)1522-7278 |
| [22] |
Yin LY, Huang JQ, Li DH et al. Microcystin-RR uptake and its effects on the growth of submerged macrophyte Vallisneria natans(lour.) hara. Environmental Toxicology, 2005, 20(3): 308-313. DOI:10.1002/(ISSN)1522-7278 |
| [23] |
周庆, 韩士群, 严少华等. 凤眼莲对铜绿微囊藻生长及藻毒素与营养盐释放的影响. 环境科学, 2014, 35(2): 597-604. |
| [24] |
何虎, 何宇虹, 李宽意等. 蓝藻堆积和螺类牧食对苦草生长的影响. 生态学报, 2012, 32(17): 5562-5567. |
| [25] |
Pérez-Harguindeguy N, Díaz S, Garnier E et al. New handbook for standardised measurement of plant functional traits worldwide. Australian Journal of Botany, 2013, 61(3): 1-68. |
| [26] |
鲁萍, 桑卫国, 马克平. 外来入侵种飞机草在不同环境胁迫下抗氧化酶系统的变化. 生态学报, 2006, 26(11): 3578-3585. DOI:10.3321/j.issn:1000-0933.2006.11.008 |
| [27] |
任安芝, 高玉葆, 陈悦. 干旱胁迫下内生真菌感染对黑麦草叶内几种同工酶的影响. 生态学报, 2004, 24(7): 1323-1329. |
| [28] |
Massacci A, Iannelli MA, Pietrini F et al. The effect of growth at low temperature on photosynthetic characteristics and mechanisms of photoprotection of maize leaves. Journal of Experimental Botany, 1995, 46: 119-127. DOI:10.1093/jxb/46.1.119 |
| [29] |
Rivero RM, Ruiz JM, Garca PC et al. Resistance to cold and heat stress:accumulation of phenolic compounds in tomato and watermelon plants. Plant Science, 2001, 157: 315-321. |
| [30] |
Zhang J, Cui S, Li J et al. Protoplasmic factors, antioxidant responses, and chilling resistance in maize. Plant Physiology and Biochemistry, 1995, 33: 567-575. |
| [31] |
Zhang J, Kirkham MB. Antioxidant responses to drought in sunflower and sorghum seedlings. New Phytologist, 1996, 132: 361-373. DOI:10.1111/j.1469-8137.1996.tb01856.x |
| [32] |
Fangmeier A, Brunschon S, Jager HJ. Time course of oxidant stress biomarkers in flag leaves of wheat exposed to ozone and drought stress. New Phytologist, 1994, 126: 63-69. DOI:10.1111/j.1469-8137.1994.tb07530.x |
| [33] |
Kubo A, Aono M, Nakajima N et al. Differential responses in activity of antioxidant enzymes to different environmental stresses in Arabidopsis thaliana. Journal of Plant Research, 1999, 112(3): 279-290. DOI:10.1007/PL00013884 |
| [34] |
邓旭, 王娟, 谭济才. 外来入侵种豚草对不同环境胁迫的生理响应. 植物生理学通讯, 2010, 46(10): 1013-1019. |
| [35] |
董合忠, 唐薇, 李振怀等. 棉花缺钾引起的形态和生理异常. 西北植物学报, 2005, 25(3): 615-624. |
| [36] |
陈开宁, 李文朝, 吴庆龙等. 滇池蓝藻对沉水植物生长的影响. 湖泊科学, 2003, 15(4): 364-368. DOI:10.18307/2003.0411 |
| [37] |
Ma RH, Duan HT, Gu XH et al. Detecting aquatic vegetation changes in Taihu Lake, China using multi-temporal satellite imagery. Sensors, 2008, 8(6): 3988-4005. DOI:10.3390/s8063988 |
| [38] |
刘国锋, 范成新, 钟继承等. 风浪作用下太湖改性沉积物对藻体絮凝去除效果研究. 环境科学, 2009, 30(1): 52-57. |
| [39] |
刘伟龙, 胡维平, 陈永根等. 西太湖水生植物时空变化. 生态学报, 2007, 27(1): 159-170. |
| [40] |
Fester T, Schuster W. Potato mitochondrial manganese superoxide dismutase is an RNA-binding protein. Biochemistry & Molecular Biology International, 1995, 36(1): 67-75. |
| [41] |
Tang D, Shi S, Li D et al. Physiological and biochemical responses of Scytonema javanicum(cyanobacterium) to salt stress. Journal of Arid Environments, 2007, 71: 312-320. DOI:10.1016/j.jaridenv.2007.05.004 |
 2016, Vol. 28
2016, Vol. 28 


