在水环境氮素的循环中,沉积物-水界面硝态氮(NO3--N)和铵态氮(NH4+-N)的扩散通量起非常重要的作用[1-2],在溶解氧充足的条件下,沉积物中的有机氮化物经矿化作用,生成NH4+和NO3-等离子扩散进入上覆水体中,增加水体氮浓度;同时水体中NH4+和NO3-等无机离子也会逆向扩散至沉积物中,吸附在沉积物颗粒物上.即表层沉积物对氮素的吸附和解吸过程是双向可逆过程,并且在整个循环交换过程中氮素主要以NH4+-N形式存在[3-4].
滇池是我国西南地区面积最大的内陆浅水湖泊,被列为13个重点保护水系之一[5],随着经济快速发展,滇池水环境污染日趋严重,其中草海异常富营养化,局部沼泽化,外海严重富营养化[6],导致滇池污染加重的原因除了与外源氮、磷等营养元素的大量排入有关外,底泥中沉积的营养元素也起到非常关键的作用,特别是在外源污染得到有效控制后,内源污染的潜在危害开始逐渐显现,因此,研究滇池表层沉积物对NH4+-N的吸附/解吸特征对了解沉积物-水界面氮素的交换过程,明确滇池富营养化的进程是十分必要的.
1 材料与方法 1.1 研究区概况滇池(24°28′~25°28′N, 102°30′~103°0′E)位于昆明市南的西山脚下,是我国第6大淡水湖泊[7],呈南北向分布,东北部有一长4km的天然沙堤,将滇池分为南北两部分,分别称为外海和草海;草海面积7.52km2,湖容0.188×108m3,外海面积为287.10km2,湖容约13.60×108m3,最大水深10.24m,平均水深4.40m[8].
1.2 研究点位及采样方法2013年在滇池全湖布设36个点位,包含常规监测点位、入滇河流入湖口监测点位和疏浚区监测点位,然后利用GPS定位进行采样,研究位点分布如图 1所示.
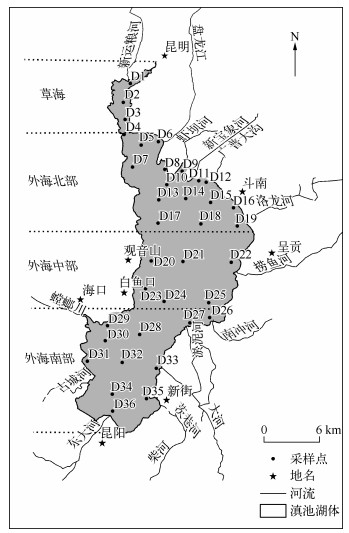
|
图 1 滇池沉积物与水样监测点位 Fig.1 Sediment and water monitoring sites of Lake Dianchi |
利用彼得森采泥器采集滇池表层10cm沉积物样品,样品装入塑料密封袋排出空气密封,及时送回实验室冷冻干燥,然后研磨过200目筛备用.
1.3 测定方法沉积物中NH4+-N含量采用浸提后靛酚蓝比色法测定; NO3--N含量采用浸提后紫外分光光度法测定;NO2--N含量采用浸提后重氮偶氮分光光度法测定[9].
沉积物NH4+-N的吸附动力学实验[4]:称取沉积物干样0.5000g若干份,置于100ml聚乙烯离心管中,分别加入10mg/L的NH4Cl溶液50ml,在室温(25±1)℃下振荡(200转/min).每隔一定时间(5、10、30、60、90、120、150和180min)取出离心管,在5000转/min条件下离心10min,过滤,采用标准方法取上清液测定NH4+-N浓度(平衡浓度).根据起始浓度与平衡浓度之差扣除空白,计算沉积物吸附NH4+-N的量.以上实验在相同的条件下作3个平行,相对误差<5 %.
沉积物NH4+-N的吸附热力学实验[4]:称取沉积物干样0.5000g若干份,置于100ml聚乙烯离心管中,分别加入50ml不同浓度的NH4Cl溶液,其浓度范围分别设置低浓度(0、0.4、0.8、1.2、2、5mg/L)和高浓度(20、60、80、120、150、200mg/L)2组系列,在室温(25±1)℃下振荡(200转/min)2h后,取出离心管,在5000转/min条件下离心5min,过滤,采用标准方法取上清液测定NH4+-N浓度(平衡浓度).根据起始浓度与平衡浓度之差扣除空白,计算沉积物吸附NH4+-N的量.以上实验在相同的条件下作3个平行,相对误差<5 %.
实验数据分别采用Excel2007、SPSS16.0以及ArcGIS软件进行统计检验、多元回归和作图.
2 结果与分析 2.1 滇池表层沉积物中不同形态氮含量的分布特征滇池表层沉积物总氮(TN)含量介于1596.25~5558.50mg/kg之间,平均值为3307.26mg/kg.长江中下游湖泊沉积物中TN含量在770.00~2630.00mg/kg之间[10],洱海沉积物中TN含量在2084.40~6515.30mg/kg之间[11],滇池沉积物TN含量与高原湖泊洱海相当,是长江中下游湖泊的2.5倍左右,表明其TN含量处于较高水平.
与TN相比,不同形态氮更能有效表征氮在湖泊富营养化中的作用.滇池沉积物中NH4+-N含量最高,NO3--N含量次之,亚硝态氮(NO2--N)含量最低(表 1).
| 表 1 2013年滇池沉积物中不同形态氮含量(mg/kg) Tab.1 Content of different forms of nitrogen in the sediment samples in Lake Dianchi |
滇池表层沉积物中TN含量相对较高的区域分别分布在草海、外海北岸、湖心、海口及外海南岸,NH4+-N、NO3--N和NO2--N含量分布与TN具有相似性,即在靠近昆明主城区域、湖心区域以及海口区域含量相对较高(图 2).草海和外海北岸接近昆明主城,外源输入累积是其主要影响因素;湖心区域水深较深,扰动较小,有利于不同形态氮素的沉降蓄积;海口区域的螳螂川是滇池唯一出口,水体中的氮素随着湖水流出,大量汇集于此,沉降进入底泥;靠近晋宁县的外海南部区域为农业相对密集区域,大量氮肥随雨水径流、水土流失等是影响沉积物氮素水平的重要因素.
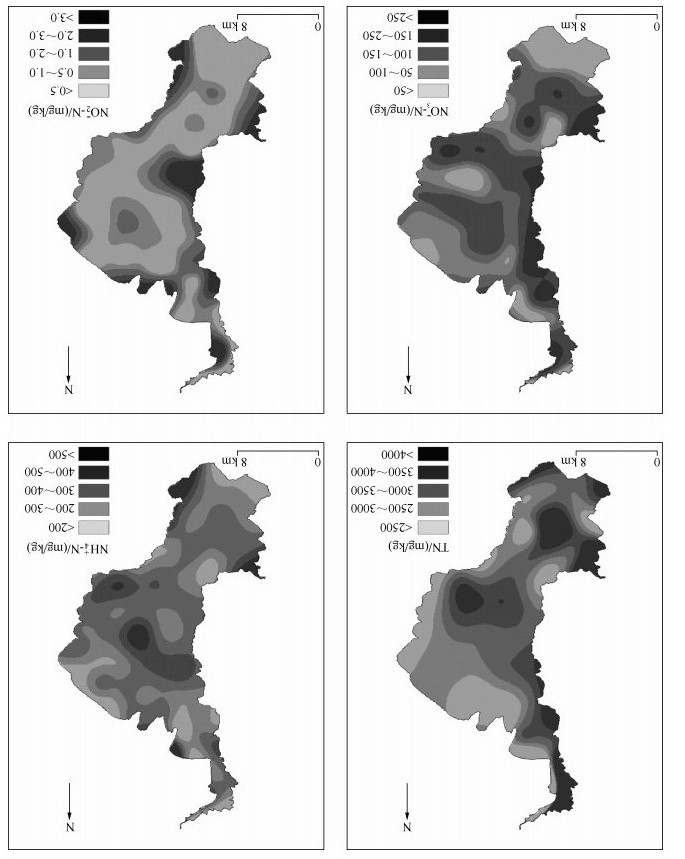
|
图 2 滇池表层沉积物不同形态氮含量的空间分布 Fig.2 The spatial distribution of different forms of nitrogen content in the surface sediments of Lake Dianchi |
沉积物NH4+-N的吸附是一个复杂的动力学过程,通常包括快吸附和慢吸附两个过程.滇池不同区域表层沉积物对NH4+-N的吸附基本上都是在前2h之内随着时间的推移,吸附量呈增长趋势,且吸附速率较大;之后吸附量不再随时间变化而变化,达到吸附平衡(图 3).这与前人的研究结果一致[12-14].
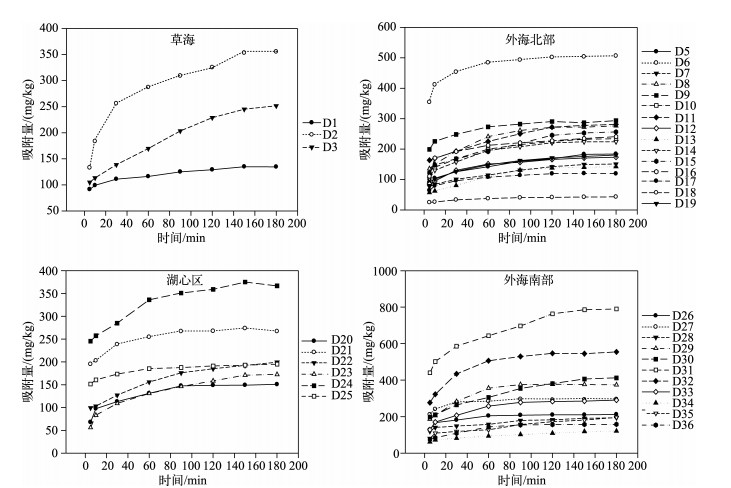
|
图 3 滇池表层沉积物NH4+-N吸附动力学曲线 Fig.3 Adsorption kinetic curves of NH4+-N in the surface sediments of Lake Dianchi |
滇池表层沉积物对NH4+-N的最大吸附速率均发生在0~5min内.所有采样点表层沉积物对NH4+-N的吸附速率在5min之后逐渐降低,与5min之内的吸附速率相差几倍至几十倍.而不同采样点表层沉积物对NH4+-N的吸附速率的差异主要显示在前5min之内(表 2).
| 表 2 不同时间段滇池表层沉积物对NH4+-N的吸附速率(mg/(kg·min)) Tab.2 Adsorption rate of NH4+-N in the surface sediments of Lake Dianchi in different intervals |
滇池不同区域表层沉积物对NH4+-N的平均最大吸附速率表现为:外海南部(34.62mg/(kg·min))>湖心区(27.15mg/(kg·min))>外海北部(23.44mg/(kg·min))>草海(21.22mg/(kg·min))(图 4).不同区域表层沉积物对NH4+-N的最大吸附速率差异较大,滇池外海大部分区域均高于草海,这是由于有机质含量较草海低,使得有机质对沉积物中NH4+-N交换的吸附点位干扰较少,因此整个外海沉积物对NH4+-N的吸附速率较高[15-16].
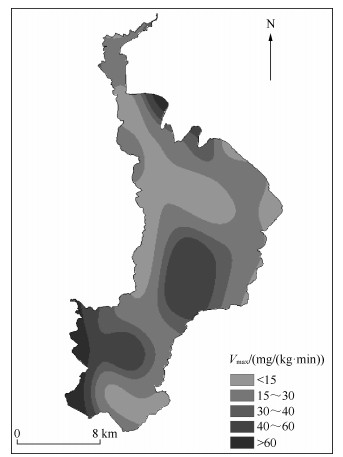
|
图 4 滇池表层沉积物对NH4+-N的最大吸附速率 Fig.4 The maximum adsorption rate of NH4+-N in the surface sediments of Lake Dianchi |
本研究利用修正的Elovich模型[17-18]对NH4+-N吸附动力学过程进行拟合,从而进一步明确滇池沉积物对NH4+-N的吸附特征:
| $ q=a+b\cdot \rm{ln}t $ | (1) |
式中,q为沉积物吸附NH4+-N的量(mg/kg);t为时间(min);a、b为常数,a为初始吸附率,b为吸附系数,其大小标志着沉积物吸附NH4+-N的强度.
拟合结果(表 3)表明,滇池表层沉积物对NH4+-N的吸附动力学行为很好地符合修正的Elovich模型,拟合曲线R2值高于0.90,均达到极显著水平(P<0.01).同时,不同污染水平沉积物的NH4+-N吸附参数间差别较大,说明滇池表层沉积物吸附NH4+-N的过程十分复杂,受到多种因素的影响.
| 表 3 滇池表层沉积物吸附NH4+-N的Elovich模型拟合参数 Tab.3 The fitting parameters of the Elovich Model of NH4+-N adsorption in the surface sediments of Lake Dianchi |
在一系列低浓度范围内(溶液NH4+-N初始浓度<5mg/L),滇池表层沉积物对NH4+-N的吸附量与平衡溶液中NH4+-N浓度呈良好的线性关系,通过改变溶液中氮的浓度,对沉积物NH4+-N的吸附量和初始溶液浓度进行线性回归,表明滇池不同采样点表层沉积物对NH4+-N均存在不同程度的解吸现象,即在NH4+-N初始浓度较低的情况下,沉积物中NH4+-N处于释放状态,而后随着NH4+-N浓度的增加,沉积物开始吸附NH4+-N,并且NH4+-N吸附量随液相NH4+-N平衡浓度的增大而增大,滇池表层沉积物对NH4+-N的吸附量与NH4+-N的初始浓度大致呈线性关系,并且在低浓度下表现出很好的吸附/解吸特征(图 5),这同前人的研究成果一致[19].
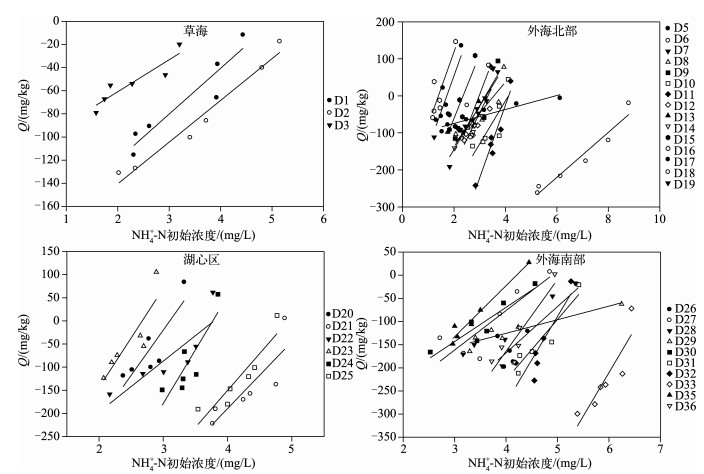
|
图 5 滇池表层沉积物对NH4+-N的吸附-解吸特征曲线 Fig.5 The adsorption-desorption characteristic curves of NH4+-N in the surface sediments of Lake Dianchi |
沉积物对NH4+-N吸附量与NH4+-N吸附平衡浓度呈良好的线性关系,可用Henry方程[20]很好地拟合:
| $ Q=NAN+{{K}_{\rm{d}}}\cdot EN{{C}_{0}} $ | (2) |
式中,Q为NH4+-N的吸附-释放量;NAN为本底吸附NH4+-N量;Kd为线性分配系数,代表了沉积物与NH4+的亲和力及沉积物的缓冲强度;ENC0为吸附平衡时溶液浓度;这些曲线与吸附量为0的直线的交点X0表示沉积物与水体达到吸附-解吸平衡时溶液中NH4+离子的浓度为ENC0,即Q=0mg/kg时为吸附-解吸平衡零点浓度,ENC0=NAN/Kd.
滇池表层沉积物NH4+-N的吸附-解吸平衡浓度ENC0最大值为9.62mg/L,最小值为1.40mg/L(表 4),上覆水中NH4+-N的均值为1.56mg/L.根据历史研究[21-22],当上覆水中NH4+离子浓度低于沉积物中NH4+离子浓度时,沉积物就会起到“源”的作用,反之就会起到“汇”的作用.相关研究表明[23],当湖泊上覆水中氮浓度大于0.2mg/L时,就可以认为该湖泊水体达到富营养化水平,而滇池表层沉积物NH4+-N的ENC0最小值为1.40mg/L,远超过0.2mg/L,表明当滇池水体处于富营养化水平时,沉积物中NH4+-N仍可能向上覆水中释放,从而加重滇池水体污染.
| 表 4 滇池表层沉积物对NH4+-N的吸附-释放特征参数 Tab.4 The adsorption-desorption characteristic parameters of NH4+-N in the surface sediments of Lake Dianchi |
沉积物NH4+-N吸附实验测得的NH4+-N吸附量实际上仅是表观吸附量,即吸附量应包括本底结合在沉积物上可以解吸的NH4+-N量和真正在吸附实验中被吸附的NH4+-N.当沉积物对NH4+-N的释放量等于吸附实验中被吸附的NH4+-N量时,沉积物对NH4+-N的表观吸附量为0,此时溶液的NH4+-N浓度即为沉积物的吸附/解吸平衡浓度.结合相关性研究,根据表 4得到滇池表层沉积物的NAN值介于116.28~1340.32mg/kg,变幅较大,平均值为500.13 mg/kg.不同区域表层沉积物NAN平均值表现为:湖心区(670.99mg/kg)>外海南岸(638.50mg/kg)>外海北岸(404.52mg/kg)>草海(175.92mg/kg).
长江中下游浅水湖泊沉积物对NH4+-N的吸附研究[4]表明,本底态吸附量与湖泊的污染程度密切相关, 即湖泊污染越严重, 其沉积物对NH4+-N本底态吸附量越大.滇池表层沉积物NAN远远大于其他湖泊(表 5),说明滇池湖体污染较其他湖泊严重,并且滇池表层沉积物的ENC0是其他湖泊的2~3倍,沉积物中NH4+-N的释放风险同样很高.
| 表 5 不同湖泊沉积物对NH4+-N的吸附/解吸特征参数[24] Tab.5 The adsorption-desorption characteristic parameters of NH4+-N in the surface sediments of different lakes |
当模拟实验中溶液NH4+-N的初始浓度在5~200mg/kg范围内时,滇池不同区域表层沉积物对NH4+-N的吸附量都是随液相NH4+-N平衡浓度的增大而增大.在低浓度区,各样点沉积物对NH4+-N的吸附量与NH4+-N的初始浓度基本呈线性关系,但NH4+-N吸附量差异较小;在高浓度区,各样点沉积物对NH4+-N的吸附都变得缓慢,但NH4+-N差异较为明显(图 6).
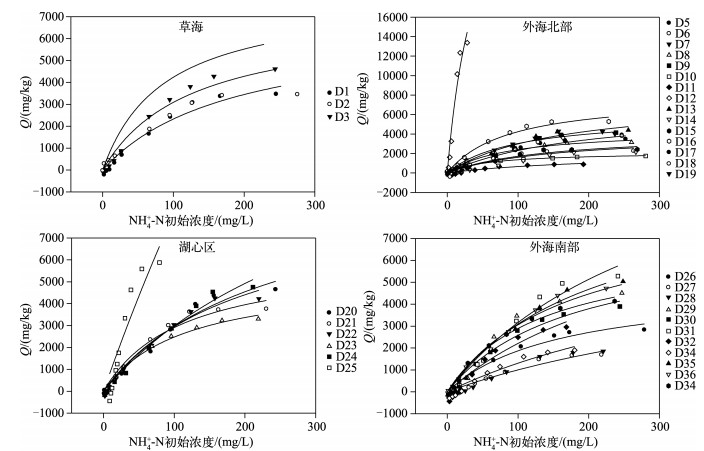
|
图 6 滇池表层沉积物对NH4+-N的吸附等温线 Fig.6 The adsorption isotherm of NH4+-N in the surface sediments of Lake Dianchi |
利用扩展的Langmuir吸附等温方程对滇池表层沉积物进行拟合[25-26],计算得到NH4+-N的最大吸附量及吸附效率,拟合结果较好,均达到显著水平(P<0.0001).
| $ Q={{Q}_{\rm{max}}}\cdot K\cdot C/(1+K\cdot C) $ | (3) |
式中,Q为沉积物对NH4+的吸附容量;Qmax为最大吸附容量,是反映沉积物吸附NH4+-N的容量因子,是沉积物对NH4+-N吸附的数量指标;C为吸附平衡浓度;K为平衡吸附系数,表示沉积物胶体与氮的亲和能力,是反映沉积物对NH4+-N吸附能力的重要参数.从拟合结果可以看出,对NH4+-N的最大吸附量Qmax变化范围较大,在2135.59~66253.21mg/kg之间,平均值为10155.46mg/kg(表 6).
| 表 6 滇池表层沉积物对NH4+-N的吸附等温线特征参数 Tab.6 Adsorption isotherm characteristic parameters of NH4+-N in the surface sediments of Lake Dianchi |
从不同区域的Qmax分布(图 7)可以看出,滇池不同区域表层沉积物对NH4+-N的吸附量差异较大,其中湖心区域最大吸附量最高,这可能是由于该区域水深较深,沉积物受外界干扰低,经过多年的汇集形成厚度较深的淤泥层,且水生植物和藻类含量较低[27],因缺少初级生产者的消耗利用,导致NH4+-N更易于被沉积物吸附固定[28].
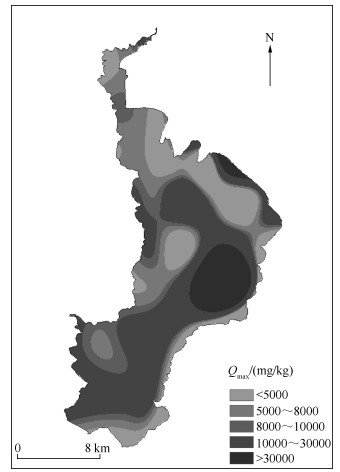
|
图 7 滇池表层沉积物对NH4+-N的最大吸附量的分布 Fig.7 The distribution of the maximum adsorption quantity of NH4+-N in the surface sediments of Lake Dianchi |
滇池表层沉积物对NH4+-N的吸附效率K值介于0.0007~0.0241L/mg之间,平均值为0.0062L/mg,不同区域平均K值表现为:外海北部(0.0082L/mg)>草海(0.0072L/mg)>湖心区(0.0052L/mg)>外海南部(0.0040L/mg).其中,以滇池草海及外海北部湖区表层沉积物对NH4+-N的吸附效率较高.滇池草海及外海北部湖区是滇池疏浚工程的重点区域,疏浚工程设计疏浚沉积物的厚度为15~50cm,而草海和外海北部沉积物的污染层平均为26.40cm,过渡层平均为70.20cm,疏浚工程基本已将污染层的沉积物转移出湖体,新产生的沉积物-水界面NH4+-N含量大幅度降低,打破了原有界面氮素的平衡浓度,浓度梯度使得沉积物对水体中NH4+-N吸附能力有所增强.
2.3 滇池表层沉积物吸附NH4+-N的特征与其理化性质的相关关系湖泊沉积物的理化性质对其NH4+-N的释放有着极为重要的影响[29],为了深入探讨滇池表层沉积物对NH4+-N吸附-解吸特征的影响因素,对其吸附特征参数与其主要的理化性质进行相关分析(表 7),结果表明,ENC0与沉积物中TN、NH4+-N含量均呈显著正相关(P<0.05),这是因为沉积物中活跃氮素含量的增加会促进NH4+-N的释放,从而降低沉积物的吸附效率[30];NAN与有机质总量呈显著负相关关系(P<0.05),与其他指标相关性未达到显著水平(P>0.05),这是因为有机质会占据和阻塞沉积物中NH4+-N交换的吸附点,从而导致沉积物对NH4+-N的吸附能力降低[15-16, 31].
| 表 7 滇池表层沉积物NH4+-N的吸附特征参数与其理化指标的相关系数 Tab.7 Correlation between the adsorption characteristic parameters and the physical and chemical properties of NH4+-N in the surface sediments of Lake Dianchi |
1) 滇池表层沉积物对NH4+-N的吸附量在前2h之内呈增长趋势,吸附速率较大;2h之后沉积物吸附NH4+-N量不随时间变化而变化,基本达到平衡.表层沉积物对NH4+-N的最大吸附速率均发生在0~5min内;不同区域样点之间的表层沉积物对NH4+-N吸附的最大速率差异较大,主要表现为:外海南部>湖心区>外海北部>草海.
2) 滇池表层沉积物对NH4+-N的ENC0为1.40~9.62mg/L,远高于上覆水中NH4+-N浓度,表明沉积物中NH4+-N具有向上覆水中释放的风险,沉积物在很长一段时间内起到水体污染“源”的作用.滇池表层沉积物的ENC0是其他湖泊的2~3倍,沉积物中氮的释放风险非常大.滇池表层沉积物的NAN远远大于其他湖泊,说明滇池湖体污染较其他湖泊严重.
3) 滇池不同区域表层沉积物对NH4+-N的最大吸附量平均值表现为:湖心区>外海南部>外海北部>草海,不同区域表层沉积物对NH4+-N的吸附量差异较大;不同区域吸附NH4+-N效率的平均值表现为:外海北部>草海>湖心区>外海南部.
4) 滇池表层沉积物ENC0与沉积物中TN、NH4+-N均呈正相关,沉积物中大量活性氮素的存在会直接促进氮素的释放,造成水质恶化;而NAN和有机质总量呈负相关(P<0.05),沉积物若含有大量有机质就会阻碍沉积物对NH4+-N的吸附,破坏沉积物对水质的改善能力.因此,在特定区域进行疏浚工程,清除沉积物中污染物含量对改善滇池水质具有积极的意义.
| [1] |
Aller RC, Mckin JE, Ullman WJ et al. Early chemical diagenesis, sediment-water solute exchange, and storage of reactive organic matter near the mouth of the Changjiang, East China Sea. Continental Shelf Research, 1985, 4(1/2): 227-251. |
| [2] |
王而力, 王雅迪, 王嗣淇. 西辽河不同粒级沉积物的氨氮吸附-解吸特征. 环境科学研究, 2012, 25(9): 1016-1023. |
| [3] |
Shen SY, Shu IT, Kemper WD. Equilibrium and kinetic study of ammonium adsorption and fixation in sodium-treated verniculite. Soil Science Society of American Journal, 1997, 61: 1611-1618. DOI:10.2136/sssaj1997.03615995006100060011x |
| [4] |
王娟, 王圣瑞, 金相灿等. 长江中下游浅水湖泊表层沉积物对氨氮的吸附特征. 农业环境科学学报, 2007, 26(4): 1224-1229. |
| [5] |
杨一光, 杨桂华. 滇池自然地理概要. 云南大学学报:自然科学版, 1985, 7(增刊): 1-8. |
| [6] |
齐素华, 艾萍, 王趁义. 滇池的富营养化现状分析及防治对策. 江苏环境科技, 2000, 13(4): 27. |
| [7] |
Liu JL, Wang RM, Hu AB et al. Distribution and bioaccumulation of steroidal and phenolic endocrine disrupting chemicals in wild fish species from Dianchi Lake, China. Environmental Pollution, 2011, 159: 2815-2822. DOI:10.1016/j.envpol.2011.05.013 |
| [8] |
Wan X, Pan XJ, Wang B et al. Distributions, historical trends, and source investigation of polychlorinated biphenyls in Dianchi Lake, China. Chemosphere, 2011, 85: 361-367. DOI:10.1016/j.chemosphere.2011.06.098 |
| [9] |
鲍士旦. 土壤农化分析. 第3版. 北京: 中国农业出版社, 2000.
|
| [10] |
王娟. 浅水湖泊中氮素分布特征与沉积物氨氮吸附释放机理研究[学位论文]. 北京: 中国矿业大学, 2007.
|
| [11] |
王圣瑞, 何宗健等. 洱海表层沉积物中总氮含量及氨氮的释放特征. 环境科学研究, 2013, 26(3): 256-261. |
| [12] |
胡智瞍, 孙红文, 潭媛. 湖泊沉积物对N和P的吸附特性及影响因素研究. 农业环境科学学报, 2004, 23(6): 1212-1216. |
| [13] |
杨龙元, 蔡启铭, 秦伯强等. 太湖梅梁湾沉积物-水界面氮迁移特征初步研究. 湖泊科学, 1998, 10(4): 41-47. DOI:10.18307/1998.0406 |
| [14] |
姜霞, 王秋娟, 王书航等. 太湖沉积物氮磷吸附/解吸特征分析. 环境科学, 2011, 32(5): 1285-1291. |
| [15] |
Swift RS. The effect of adsorbed organic materials on the cation exchange of clay minerals.In:Banin A, Kafkafi U eds. Agrochemicals in soils, 1980, 123-129. |
| [16] |
Hedges JI, Keil RG. Sedimentary organic matter preservation:an assessment and speculative synthesis. Marine Chemistry, 1995, 49: 81-115. DOI:10.1016/0304-4203(95)00008-F |
| [17] |
Padmesha TVN, Vijayaraghavana K, Sekaranb G et al. Batch and column studies on biosorption of acid dyes on fresh water macro alga Azolla filiculoides. Journal of Hazardous Materials, 2005, 125(1/2/3): 121-l29. |
| [18] |
Wang SR, Jin XC, Pang Y et al. The study on the effect of pH on phosphate sorption by different trophic Lake sediments. Journal of Colloid and Interface Science, 2005, 285: 448-457. DOI:10.1016/j.jcis.2004.08.039 |
| [19] |
王圣瑞, 金相灿, 赵海朝等. 长江中下游浅水湖泊沉积物对磷的吸附特征. 环境科学, 2005, 26(3): 38-43. |
| [20] |
Jin X, Wang S, Pang Y et al. The adsorption of phosphate on different trophic lake sediments. Colloids and Surfaces A:Physicochemical & Engineering Aspects, 2005, 254: 241-248. |
| [21] |
翟丽华, 刘鸿亮, 席北斗. 农业源头沟渠沉积物氮磷吸附特性研究. 农业环境科学学报, 2008, 27(4): 1359-1363. |
| [22] |
杨洪美. 南四湖表层沉积物中氮形态及吸附释放研究[学位论文]. 北京: 中国矿业大学, 2007.
|
| [23] |
金相灿, 刘鸿亮, 屠清瑛等. 中国湖泊富营养化. 北京: 中国环境科学出版社, 1990, 121-133.
|
| [24] |
王圣瑞. 湖泊沉积物-水界面过程. 北京: 科学出版社, 2012.
|
| [25] |
姜桂华. 铵态氮在土壤中吸附性能探讨. 长安大学学报, 2004, 21(2): 32-38. |
| [26] |
Balci S. Nature of ammonium ion adsorption by sepiolite:analysis of equilibrium data with several isotherms. Water Research, 2004, 38: 1129-1138. DOI:10.1016/j.watres.2003.12.005 |
| [27] |
陈永川, 汤利, 张德刚等. 滇池水体叶绿素a的时空变化及磷对藻类生长的影响. 农业环境科学学报, 2008, 27(4): 555-560. |
| [28] |
王雨春, 万国江, 尹澄清等. 红枫湖、百花湖沉积物全氮、可交换态氮和固定铵赋存特征. 湖泊科学, 2002, 14(4): 301-3091. DOI:10.18307/2002.0402 |
| [29] |
李震宇, 朱荫湄, 王进. 杭州西湖沉积物的若干物理和化学性状. 湖泊科学, 1998, 10(1): 79-84. DOI:10.18307/1998.0113 |
| [30] |
Raaphorst WV, Malschaert JFP. Ammonium adsorption in superficial North Sea sediments. Continental Shelf Research, 1996, 16(11): 1415-1435. DOI:10.1016/0278-4343(95)00081-X |
| [31] |
Boatman CD, Murray JW. Modeling exchangeable NH4+ adsorption in marine sediments:Process and controls of adsorption. Limnology and Oceanography, 1982, 27: 99-110. DOI:10.4319/lo.1982.27.1.0099 |
 2016, Vol. 28
2016, Vol. 28 


