(2: 上海海洋大学水产与生命学院, 上海 201306)
(3: 中国水产科学研究院淡水渔业研究中心院长江中下游渔业生态环境评价和资源养护重点实验室, 无锡 214081)
(2: College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, P. R. China)
(3: Key Laboratory of Fishery Ecological Environment Assessment and Research Conservation in Middle and Lower Reaches of the Yangtze River, Freshwater Fisheries Research Center, Chinese Academy of Fishery Science, Wuxi 214081, P. R. China)
刀鲚(Coilia nasus)属鲱形目、鳀科、鲚属.目前一般认为,长江刀鲚有溯河洄游型(即长颌鲚,C.nasus)和淡水定居型(即短颌鲚,C.brachygnathus)2类生态型[1].短颌鲚主要生活在长江中下游以及太湖、巢湖等附属湖泊[2].前者的经济价值远高于后者.与长颌鲚相比,短颌鲚上颌骨显著较短,通常用上颌骨与头长的比值是否大于1来判别两者之间的差异[1].近年来,由于水质污染、酷渔滥捕和水利工程等原因[3-4],刀鲚的资源量在逐年下降,目前难以形成渔汛[5-9].迄今为止,对于长颌鲚与短颌鲚的分类学问题学术界仍有争论[1, 10-11].最新的研究发现短颌鲚中也存在像长颌鲚那样溯河洄游的个体[12].这些都使得传统上利用上颌骨长短来判断刀鲚淡水定居或溯河洄游生境履历群体的方法显现出很大的不确定性.
江苏段是长江刀鲚的主产区,而最主要的捕捞区在靖江江段(占全省捕捞量的40 %以上)[3].调查发现,靖江江段同时分布有长颌鲚和短颌鲚[13].迄今,涉及该江段刀鲚的绝大部分研究都没有明确地指出研究对象是否为长颌鲚或短颌鲚[2-9].由于没有给出上颌骨长短的数据,无法判别其中是否混有短颌鲚个体; 再由于上述短颌鲚中也可能存在溯河洄游个体,这使得简单地从形态去区分刀鲚群体的洄游性存在偏差.此外,由于靖江江段一直以来为刀鲚重要的洄游通道,此水域不同群体或生态型组成复杂,如何了解其动态也是目前评价、保护和合理利用刀鲚资源的重要难题之一.因此,通过较为客观的手段,把握长江靖江段长颌鲚和短颌鲚各自的洄游生态学特征无疑非常重要.然而由于刀鲚个体较小,溯河洄游的生活史复杂以及出水即死的强应激特性,无法基于一些传统的调查方法(如追踪调查、标记放流等)来解决上述难题[14].
鱼类的耳石主要由碳酸钙(CaCO3)构成,一旦形成就不易被重新吸收,能够准确地记录鱼类所经历过的生境过程[15].耳石中矿质元素(特别是Sr、Ca)沉积的变化(被称为耳石微化学)常被用来作为反演不同生境条件的标记,具有客观性且与生境良好相关的特点[16-19],特别是耳石Sr/Ca常被用作微化学“指纹”来解决鱼类生境反演的难题.迄今,利用电子探针微区分析技术(EPMA)获取鱼类耳石的Sr/Ca,进而有效重建生境“履历”的研究已经取得了很大的突破[18-22].其原理是运用不同盐度水体Sr/Ca所存在的显著差异(淡水低、河口居中、海水高)来客观重建生境“履历”[23-26].Yang等[23]研究凤鲚、长江口刀鲚和太湖湖鲚的生活史后发现,长江口刀鲚耳石上对应于海、淡水生境的Sr/Ca高低差异显著,这与陆封型太湖湖鲚持续低值的现象截然不同; 同时,也确定了对应淡水、半咸水、海水不同生境“履历”的蓝色、绿黄色、红色等不同颜色的可视化、图像化标准.这也得到Dou等[26]研究长江刀鲚生境变化结果的支持.另外,Jiang等[24]通过微化学结合耳石年轮的研究,还发现了洄游性刀鲚幼鱼需要在淡水生境中发育将近一年时间才入海的情况.其通过比较我国多个河口刀鲚的耳石生境“履历”还发现,不同河口刀鲚群体各自具有相对独特的生活史类型[22].然而靖江段刀鲚的相关研究尚很少.Zhong等[17]通过耳石微化学分析,初步报道了靖江段洄游型刀鲚的生境情况.徐钢春等[12]基于长颌鲚和短颌鲚各1尾报道了靖江段短颌鲚也有洄游型个体的现象.靖江作为刀鲚的主产区和洄游通道,亟需开展更全面和更深入的研究调查; 因此,本研究拟基于长江靖江段较为多量长颌鲚和短颌鲚的耳石标本,利用耳石微化学的手段,进一步较为全面地研究两种刀鲚生态型个体间生活习性的异同; 评价其生境履历、资源组成的特征,以期为有效保护长江靖江段洄游性刀鲚的资源及江段的洄游通道功能提供理论支持.
1 材料与方法 1.1 样品采集实验所用鱼均采自长江靖江段,所用网具为流刺网.11尾的短颌鲚采样时间为2013年4月24日.长颌鲚采样时间分别为2013年4月25日和2014年5月19日,2次分别采到6尾和9尾.对鱼体进行全长、体重、上颌骨长、头长等基础数据的测量(其中上颌骨长和头长利用游标卡尺测定).其年龄的鉴定采用鱼鳞结合耳石调查读取(表 1).所有鱼体标本经测量称重后解剖并取出耳石.耳石用去离子水清洗,自然晾干后待用.
| 表 1 长颌鲚和短颌鲚耳石中锶和钙的微化学变化 Tab.1 Fluctuation of Sr and Ca microchemistry in otoliths of C.nasus and C.brachygnathus |
耳石先用丹麦Struers公司的Epofix环氧树脂包埋固定,再用相同公司的Discoplane-TS碾磨机碾磨(第1阶段用700目金刚砂轮粗磨,第2阶段用1200目砂纸细磨至核心将要暴露)后,换用相同公司的装有机织布抛光盘的RotoPol-35磨抛机,配合抛光液将其抛光至核心完全暴露.耳石再用Milli-Q水超声清洗后,晾干,真空镀膜机(JEE-420,日本电子株式会社)镀膜(36A,25s).
参考Yang等[23]的方法,使用日本电子株式会社的JXA-8100型X射线电子探针微区分析仪(EPMA)分析耳石微化学.自耳石核心沿最长径至耳石边缘的一条直线进行定量线分析.EPMA加速电压和电子束电流分别为15kV和2.0×10-8A,束斑直径为5μm,每点驻留时间为15s,以10μm为间隔连续打点测定.标准样品取用CaCO3和钛酸锶(SrTiO3).之后,再对耳石进行面分布分析.此时EPMA加速电压和电子束电流分别为15kV和5.0×10-7 A,束斑直径为5μm,像素为7μm×7μm,每点驻留时间为30ms.下文中所出现的“Sr/Ca”均按惯例使用耳石中锶元素浓度与钙浓度的比乘以103的标准化值(即“Sr/Ca×1000”).
1.3 数据分析淡水系数(FC)计算参考Jiang等[22]的定义,即FC=Lf/LT.其中Lf为基于EPMA测定结果的自耳石核心沿最长半径方向至对应淡水生境(低Sr含量或低Sr/Ca)区域结束时的径长(亦对应于耳石Sr面分布分析图像中耳石中心蓝色区域的半径); LT为定量线分析时所沿耳石从核心到边缘的最长半径.
数据使用Excel2003软件进行汇总处理.耳石不同区域Sr/Ca的趋势用平均值±标准差表示,使用SPSS19.0软件进行非参数检验(P<0.05,Mann-WhitneyU-test).淡水系数进行单因素方差分析(P<0.01,One-wayANOVA)判别不同群体.
2 结果与讨论短颌鲚(上颌骨长:16.15±3.96mm,上颌骨长/头长:0.88±0.07)的全长为120.00±2.10mm,体重为5.54±2.70g,年龄为1龄+.2013年所采长颌鲚(上颌骨长:47.69±2.91mm,上颌骨长/头长:1.11±0.02)的全长为309.80±2.23mm,体重为127.60±34.85g,年龄为2龄+.2014年所采长颌鲚(上颌骨长:45.10±3.08mm,上颌骨长/头长:1.12±0.06)的全长为271.00±2.07mm,体重为92.27±25.58g,年龄为2龄+.11尾短颌鲚耳石的微化学分析结果显示耳石从核心到边缘的Sr/Ca均较低(表 1),各测定点的比值几乎不超过3;从核心到边缘比值的平均值最大为2.32±0.93(个体jjcb17),最小为1.13±0.58(个体jjcb16)(表 1).与定量分析的结果相一致,面分布分析结果显示短颌鲚的Sr含量的面分布图均为蓝色(图 1),说明其耳石上Sr元素的分布呈稳定低值,这与Yang等[23]所记录到的陆封于太湖、全生活史淡水生活的刀鲚耳石Sr类型一致,表明本研究的短颌鲚仅生活在纯淡水环境.淡水中极低的Sr浓度会导致耳石中的Sr含量极低.本实验中短颌鲚年龄为1龄+,其耳石Sr/Ca稳定在2.00,符合淡水生活特征,不具有溯河洄游“履历”[12, 28].根据Jiang等[24]对黄海刀鲚的研究发现鲚属鱼类在淡水环境中孵化生长不足1龄时就会进行入海洄游,可以认为本研究中所采短颌鲚均为纯淡水生活个体.沈林宏等[13]发现,当幼鱼全长达到8cm时,长颌鲚与短颌鲚的上颌骨已经形成,前者上颌骨达到或超过胸鳍基部(即上颌骨/头长大于1),后者上颌骨则不到.本研究中短颌鲚全长范围为8.6~14.9cm,上颌骨已经发育,可以区分判定为典型的短颌鲚个体.值得注意的是,徐钢春等[12]对2013年4月同样在靖江段采集到的长颌鲚和短颌鲚进行耳石微化学分析时发现,所采1尾典型短颌鲚耳石Sr/Ca可以分为低值区(平均1.59±0.80)和高值区(平均4.38±1.33)2个阶段,与Yang等[23]所记录到长江溯河洄游刀鲚耳石的Sr类型一致,表明短颌鲚中的一些个体也可以像长颌鲚一样参与溯河洄游.本研究中的短颌鲚未发现有洄游型,这可能反映出:(1)洄游型短颌鲚并不常见,(2)短颌鲚的洄游和定居生态型资源情况只能由耳石微化学等手段来区分,传统的形态学方法容易导致误判.沈林宏等[13]在研究长江刀鲚幼鱼的采集时发现,在靖江段采集的渔获物中有不少短颌鲚,且在不同时间段刀鲚和短颌鲚的幼鱼捕捞所占比例不同,这表明靖江段短颌鲚的资源量亦不能忽视.如果不加以区分,很难做到合理地评价长江靖江段短颌鲚中较高价值的洄游型和较低价值的定居性资源量现状.鉴于目前刀鲚研究论文很少有上颌骨长数据以及刀鲚中长颌鲚、短颌鲚复杂生态型的现状,建议在今后相关论文中将提供上颌骨长等数据作为规范,以便更有效地把握所研究个体的生态型并提高结果的可比性.
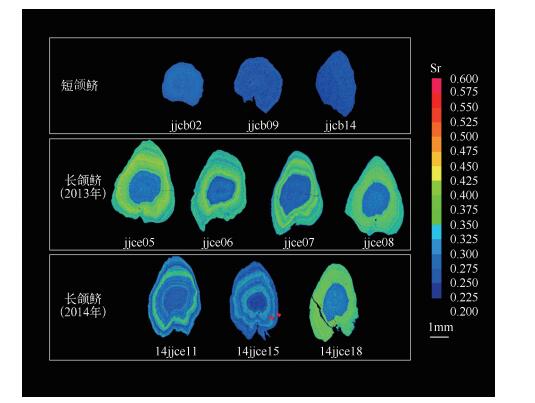
|
图 1 本研究中长颌鲚和短颌鲚耳石矢状面二维Sr含量的面分布 Fig.1 Two-dimensional imaging using mapping analysis of the Sr in otoliths of C.nasus and C.Brachygnathus in the present study (样品14jjce15面分布结果上所标红色箭头对应年轮) (the red arrowheads on 14jjce15 showed the annuli) |
与短颌鲚耳石的Sr/Ca结果不同,靖江段所采长颌鲚耳石的Sr/Ca大致可分为2~3个阶段(P<0.05, Mann-WhitneyU-test)(表 1).个体jjce02、jjce04、jjce06、jjce07、jjce08与14jjce12、14jjce13、14jjce16、14jjce17、14jjce18、14jjce20从耳石核心到边缘的Sr/Ca可以分为第1阶段(Sr/Ca<3,蓝色同心环区域,对应于低Sr淡水生境)和第2阶段(3<Sr/Ca<7,黄绿色同心环区域,对应于Sr较高的河口半咸水生境)(图 1).所有这些个体应该均为首次参加溯河洄游的刀鲚个体.虽然报道称刀鲚在1龄时即可参与溯河洄游[2],但是本研究中这些个体在淡水孵化发育后入海,>2龄才进行溯河生殖洄游.进长江前,它们主要在河口附近盐度较高的水环境中栖息,且捕获前刚回到淡水环境.个体jjce05、14jjce11和14jjce19的生境“履历”较复杂,从耳石核心到边缘可以分为3个阶段,即Sr/Ca从低到高又降低,各部分的Sr/Ca平均值分别为1.50±0.68(对应蓝色同心环区域)、3.92±5.02(对应蓝绿同心环区域)和2.42±1.74(对应蓝色同心环区域)(图 1),这显示其亦在淡水孵化并生长后入海,被采到前已溯河回淡水生活了一段时间.个体14jjce15的生境履历最为复杂,其从核心到边缘甚至可以分为5个Sr/Ca阶段,平均值依次为1.61±0.51、3.51±0.54、2.27±0.63、3.39±0.60和2.41±0.85,对应的Sr面分布图中亦可明显看出蓝色、蓝绿色、蓝色、蓝绿色及蓝色5个变化阶段(图 1).虽然导致这种现象的原因尚不清楚,但可能原因为该个体在被捕获前已经经历了1次溯河生殖洄游,且在第2次上溯过程中被捕获.袁传宓等[2]对长江中下游刀鲚研究发现,有些刀鲚性成熟较早,1龄鱼即参加溯河生殖洄游.由此可见,14jjce15个体为2龄+并已依次相间地经历了淡水、河口、淡水、河口、淡水生境“履历”.结合其年轮情况,分别对应于第1年轮前早期生活史阶段幼鱼的降海过程、第1年轮和第2年轮间成鱼的溯河洄游和降海过程以及第2年轮外的上溯过程.
虽然2013年和2014年所捕获的标本都有长颌鲚,但这两批鱼耳石微化学也存在差异.2013年刀鲚耳石的Sr含量区可分为两部分:中心蓝区对应的Sr/Ca为2.12±0.83,其它部分对应值为4.24±1.32;而2014年耳石的情况更复杂,中心蓝区对应的Sr/Ca为1.71±0.93,其它部分对应值为4.37±3.36.两者耳石其它部分Sr/Ca差异明显(P<0.05)(图 1).这显示出2014年长颌鲚以及2013年长颌鲚有可能来自于两个生活史背景(即洄游生境“履历”)不同的资源群体.
为进一步探讨这个观点的合理性及讨论该水域不同刀鲚群体的洄游模式、早期淡水生境履历特征,笔者引入了淡水系数法来进行分析.Jiang等[22]基于对中国沿海刀鲚生活史的研究,提出了刀鲚耳石淡水系数(FC)的概念,对应于受精卵孵化到幼鱼入海过程淡水栖息时间的长短或早期生活史阶段中淡水生活史在整个生活史过程中所占的比例.本研究结果显示(图 2), 2014年长颌鲚(0.50±0.11)与2013年长颌鲚(0.36±0.06)的FC间存在极显著差异(P<0.01),这反映出前者相关过程的持续时间要长于后者,可能与长江中前者所起源的出生地(亦对应于其亲鱼的产卵场)距长江口的距离要远于后者有关.短颌鲚的FC均为1.00,这与其全生活史都在淡水环境中完成相符.本研究中长颌鲚与短颌鲚间FC的差异极显著(P<0.01),这可充分对应于两者自然选择的溯河洄游、淡水定居的不同生活习性.
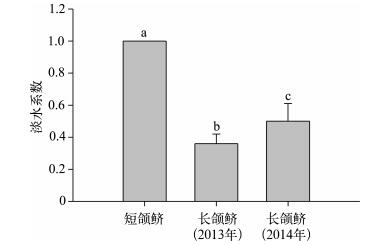
|
图 2 短颌鲚与长颌鲚的淡水系数 Fig.2 The freshwater coefficient of C.nasus and C.brachygnathus (不同字母代表差异极显著,P<0.01,One-way ANOVA) (those with different alphabet letters are significantly differentat P < 0.01, One-way ANOVA) |
长颌鲚具有溯河洄游的习性,每年2-5月从海洋溯河洄游到长江[2],有的甚至会洄游到距长江口约800km[27]的鄱阳湖.本研究结果中Sr/Ca的显著变化正是这种溯河洄游的反映.然而,近年来靖江段长颌鲚的资源却在不断衰退,小型化和低龄化明显,繁殖群体中补充群体和低龄剩余群体比例增加[28],再加上环境污染、水利工程等原因,上游的产卵场遭到破坏,洄游通道的功能也在丧失[4].由此可见,加大保护靖江段作为刀鲚(长颌鲚)洄游通道的功能对整个长江刀鲚资源量将具有十分重要的意义.同时,由于刀鲚的长颌鲚、短颌鲚两种生态类型的经济价值截然不同,加强该江段刀鲚资源群中溯河洄游型、淡水定居型个体组成演替的监测,客观评价前者的可捕捞量,也将对有效管理和可持续利用江苏靖江江段宝贵的刀鲚资源起到极大的促进作用.
3 结论1) 基于耳石微化学手段证实长江靖江段同时存在有淡水定居和溯河洄游的刀鲚个体.
2) 靖江段所研究刀鲚的长颌鲚个体表现为溯河洄游型,而短颌鲚个体表现为淡水定居型.此外,前者资源可能存在来自长江中不同产卵场个体起源的可能性.
3) 基于耳石微化学技术能够突破传统上利用上颌骨长短来判断淡水定居或溯河洄游刀鲚的局限,对采自靖江江段的长颌鲚和短颌鲚客观地进行生境履历重建.其结果对准确把握该江段淡水定居和溯河洄游刀鲚的资源组成,更好地保护靖江水域作为刀鲚的重要洄游通道的生态功能提供很好的理论支撑.
| [1] |
程万秀, 唐文乔. 长江刀鲚不同生态型间的某些形态差异. 动物学杂志, 2011, 46(5): 33-40. |
| [2] |
袁传宓, 秦安舲, 刘仁华等. 关于长江中下游及东南沿海各省的鲚属鱼类种下分类的探讨. 南京大学学报:自然科学版, 1980, 3: 67-77. |
| [3] |
陈卫境, 顾树信. 长江靖江段刀鲚资源调查报告. 水产养殖, 2012, 33(7): 10-13. |
| [4] |
施炜纲, 张敏莹, 刘凯等. 水工工程对长江下游渔业的胁迫与补偿. 湖泊科学, 2009, 21(1): 10-20. DOI:10.18307/2009.0102 |
| [5] |
戴玉红, 顾树信, 郭弘艺等. 长江靖江段鱼类资源调查与开发. 水产养殖, 2013, 34(7): 28-33. |
| [6] |
陈校辉, 边文冀, 赵钦等. 长江江苏段鱼类种类组成和优势种研究. 长江流域资源与环境, 2007, 16(5): 571-577. |
| [7] |
孙莎莎. 最近10年长江靖江沿岸鱼类群聚特征的时间格局研究[学位论文]. 上海: 上海海洋大学, 2013.
|
| [8] |
刘凯, 段金荣, 徐东坡等. 长江口刀鲚渔汛特征及捕捞量现状. 生态学杂志, 2012, 31(12): 3138-3143. |
| [9] |
张敏莹, 徐东坡, 刘凯等. 长江下游刀鲚生物学鲚最大持续产量研究. 长江流域资源与环境, 2005, 14(6): 694-699. |
| [10] |
周宗汉, 林金榜. 刀鲚和短颌鲚血清蛋白聚丙烯酰胺凝胶电泳的比较研究. 南京大学学报, 1985, 21(1): 107-110. |
| [11] |
程起群. 中国鲚鱼的形态变异、遗传多样性及系统发育研究[学位论文]. 上海: 复旦大学, 2005.
|
| [12] |
徐钢春, 顾若波, 刘洪波等. 长江短颌鲚耳石Sr/Ca值变化特征及其江海洄游履历. 水产学报, 2014, 38(7): 37-41. |
| [13] |
沈林宏, 戴玉红, 顾树信等. 长江刀鲚幼鱼的采集与运输技术研究. 水产养殖, 2011, 32(5): 4-6. |
| [14] |
陈锦淘, 戴小杰. 鱼类标记放流技术的研究现状. 上海水产大学学报, 2005, 14(4): 451-456. |
| [15] |
Campana S, Thorrold S. Otoliths, increments and elements:keys to a comprehensive understanding of fish populations?. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58: 30-38. DOI:10.1139/f00-177 |
| [16] |
姜涛, 周昕期, 刘洪波等. 鄱阳湖刀鲚耳石的两种微化学特征. 水产学报, 2013, 37(2): 239-244. |
| [17] |
Zhong L, Guo H, Shen H et al. Preliminary results of Sr:Ca ratios of Coilia nasus in otoliths by micro-PIXE. Nuclear Instruments and Methods in Physics Research, 2007, 260: 349-352. DOI:10.1016/j.nimb.2007.02.045 |
| [18] |
Liu H, Jiang T, Huang H et al. Estuatine dependency in Collichthys lucidus of the Yangtze River estuary as revealed by the environmental signature of otolith strontium and calcium. Environment Biology of Fishes, 2014, 98(1): 165-172. |
| [19] |
Katsumi T, Shun W, Mari K et al. Freshwater habitat use by a moray eel species, Gymnothorax polyuranodon, in Fiji shown by otolith microchemistry. Environment Biology of Fishes, 2014, 97(12): 1377-1385. DOI:10.1007/s10641-014-0228-9 |
| [20] |
熊瑛, 刘洪波, 刘培廷等. 基于耳石微化学的江苏吕泗近岸小黄鱼生境履历重建. 应用生态学报, 2014, 25(3): 836-842. |
| [21] |
Tsukamoto K, Nakai I, Tesch W. Do all freshwater eels migrate?. Nature, 1998, 12: 635-636. |
| [22] |
Jiang T, Liu H, Shen X et al. Life history variations among different population of Coilia nasus along the Chinese coast inferred from otolith microchemistry. Journal of the Faculty of Agriculture Kyushu University, 2014, 59(2): 383-389. |
| [23] |
Yang J, Arai T, Liu H et al. Reconstructing habitat use of Coilia mystus and Coilia nasus of the Yangtza River estuary, and of Coilia nasus of Taihu Lake, based on otolith strontium and calcium. Journal of Fish Biology, 2006, 69(4): 1120-1135. DOI:10.1111/jfb.2006.69.issue-4 |
| [24] |
Jiang T, Yang J, Liu H et al. Life history of Coilia nasus from the Yellow Sea inferred from otolith Sr:Ca ration. Environment Biology of Fishes, 2012, 95: 503-508. DOI:10.1007/s10641-012-0066-6 |
| [25] |
Yang J, Jiang T, Liu H. Are there habitat salinity markers of Sr:Ca ratio in otolith of wild diadromous fishes? A literature survey. Ichthyological Research, 2011, 58(3): 291-294. DOI:10.1007/s10228-011-0220-8 |
| [26] |
Dou S, Yokouchi K, Yu X et al. The migratory history of anadromous and non-anadromous tapertail anchovy Coilia nasus in the Yangtze River Estuary revealed by the otolith Sr:Ca ratio. Environmental Biology of Fishes, 2012, 95(4): 481-490. DOI:10.1007/s10641-012-0042-1 |
| [27] |
朱栋良. 长江刀鱼的天然繁殖胚胎发育观察. 水产科技情报, 1992, 19(2): 49-51. |
| [28] |
董文霞, 唐文乔, 王磊. 长江刀鲚繁殖群体的生长特性. 上海海洋大学学报, 2014, 9(5): 669-675. |
 2016, Vol. 28
2016, Vol. 28 

