(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
pH值是表征水环境地球化学性质的重要参数,在控制有机质的矿化、内源污染物的释放[1]、营养盐的循环[2]等过程中具有重要作用.湖泊沉积物具有非常显著的空间异质性,在沉积物界面发生的各种生物、物理、化学反应会导致pH值在微尺度呈现强烈的梯度变化[2-3], 因此高分辨获取pH值的分布信息及动力学变化是深入了解沉积物生物地球化学循环的关键.
传统的pH值测定方法包括试纸法和clark玻璃电极法[4],这两种方法简便易行,适用于溶液pH值测定,很难应用于沉积物-水界面微环境的测定.近年来,微电极法在沉积物-水界面pH值实验中的应用变得比较广泛[5],拥有较高的准确度和精密度,但是其测量体系复杂、造价过高、电极过于脆弱的缺点限制了其大规模的推广应用.随后出现了光纤感应器,其主要原理是基于荧光或磷光分析原理,将对分析物敏感指示剂固定在玻璃电极尖端,通过分析物对尖端指示剂的光学性质的改变来测定分析物的浓度.光纤传感器可以媲美微电极,而且成本较低、操作程序快捷、稳定性好[6].尽管如此,无论是微电极还是光纤感应器,均采用单点测试,获取批量数据或者剖面pH值数据,需要通过探头上下移动,因此耗时且操作繁琐.在光纤传感器基础上,平面光电极法测量pH值是应用于生物学和医学的一种平面测量方法,由于其具有良好的操作性以及可以测量二维平面的pH值变化被引入环境科学领域[7-9].
生物扰动是底栖动物影响沉积物-水界面物质与能量交换的主要过程之一,不仅可以改变沉积物的粒径、容重、渗透率等物理指标,也可以改变沉积物原有的生物分布、化学反应速率等生化指标[10].例如Pischedda等研究表明沙蚕扰动可以增加沉积物溶解氧(DO)浓度并显著改变沉积物中DO的分布特征[11].目前对于生物扰动影响沉积物-水界面pH值的研究较少,且多集中于海洋沉积物方面,淡水沉积物方面的研究有限.沈万斌等研究了颤蚓扰动对沉积物-水界面pH值的影响[12],指出颤蚓扰动对沉积物中pH值时空变化的影响较小而对上覆水的影响较大,但是作者未能明确地给出颤蚓对沉积物-水界面pH值影响能力、影响范围的大小.霍甫水丝蚓(Limnodrilus hoffmeisteri)是富营养化湖泊中大量出现的底栖动物,缺氧条件下依然能够存活[10].霍甫水丝蚓在太湖分布广泛,在重污染区域沉积物中的密度可达25120 ind./m2[13].本研究拟利用平面光电极技术,二维、高分辨地探讨霍甫水丝蚓扰动对沉积物-水界面的pH值分布特征的影响,研究结果为阐明湖泊的内源污染和有机物的矿化等过程提供重要科学参考.
1 材料与方法 1.1 平面光电极原理平面光电极的基本原理是基于特定荧光染料与不同浓度的待测物质发生反应,荧光物质的强度或者寿命发生改变,利用荧光强度或者寿命改变的量来定量反映待测物质的浓度[14].将荧光染料制成平面传感膜后,通过采集和处理平面传感膜的图片,可以得到待测物质在二维尺度上的浓度变化图像.激发光源是发出特定波长的光来激发平面传感膜,平面传感膜受激发光照射后产生发射光,利用照相机作为图像采集器采集发射光的二维数据并以图片形式保存,最后利用软件将图片处理成为待测物质浓度的二维图像.
1.2 平面光电极材料选取8-羟基芘-1, 3, 6-三磺酸三钠盐(HPTS)染料作为pH值的响应染料,HPTS是一种常用的pH值荧光指示染料[15],具有高量子产率、较大的stocks位移、良好的水溶性、较快的响应时间(<120 s)[2]以及对生物无毒害作用等优良特点.该染料对pH值的灵敏响应范围在5.5~8.5之间[2],淡水湖泊水体和沉积物的pH值与该染料的pH值响应范围契合,因此选择HPTS作为本实验的pH值荧光染料.平面传感膜的制作参考Zhu等的方法[2],简述如下:HPTS染料经过与五氯化磷的加成反应,其分子中被加入磺酰基团,形成分子团A.将碳碳双键负载至平面基材(聚酯薄膜)表面.在过硫酸铵(APS)和TEMED的催化作用下,染料分子团A与碳碳双键加成,被固定在平面基材表面,制成荧光染料均匀分布、总厚度约150 μm(含聚酯薄膜130 μm)的平面感应薄膜.
1.3 平面光电极系统及图像处理方法平面光电极系统由激发光源、平面感应膜、图片获取装置以及图片处理装置构成(图 1).本研究采用中心波长为400和450nm的LED灯(20W,深圳天耀)作为激发光源.图片获取装置采用佳能600D相机,配置Sigma 50 mm F2.8 EX DG微距镜头,镜头前加装540nm长波通滤光片(深圳激埃特光学).pH值感应薄膜经激发光照射后,释放560nm波长的光,经过滤光片过滤后被相机获取.目前平面光电极技术采用的定量方法主要有3种:荧光强度定量、强度比率定量和荧光寿命定量.荧光强度定量方法简单易行,但缺点也很明显,容易受到背景光的干扰[16];荧光寿命定量方法虽然精确,但是其设备体系复杂、造价过高、操作不便[17].本实验采用的是基于荧光强度比率定量的RGB三色参比法进行图形数据处理方法.该方法主要是通过获取RAW图像,利用图像处理软件将拍摄图像的G通道的荧光强度值提取出来.将两个不同波长激发光源(400和450 nm)照射后产生的释放光图片G通道荧光强度做比率值,得到的比率值与pH值相对应作标准曲线,以上操作通过计算机使用ImageJ软件进行.本实验中相机的有效像素分辨率为5184×3456,成像传感器尺寸为22.3mm×14.9mm,拍照时放大倍数为5倍,因此可以获得图片分辨率为21.5μm×21.5μm的pH值二维分布图.与传统的pH值测定方法如微电极相比,本方法可以获取二维pH值分布特征图像并提供更高的分辨率,有利于检测微尺度内pH值的变化.

|
图 1 平面光电极系统装置示意 Fig.1 Schematic of the optical set-up in this study |
研究样点位于太湖梅梁湾(31°30′31″N, 120°10′31″E),于2014年10月12日用彼得森采泥器抓取表层沉积物,并利用重力采水器采集深度1.2 m处的水样.采样后立即运回实验室,将沉积物和水样一起放入聚乙烯材质的整理箱中, 将湿沉积物过300目的筛网以去除水丝蚓,对上覆水进行曝气培养,光照比为12h:12h,白天开启日光灯强度约为100lx,晚上测试室用遮光布遮挡住外部光线.室温控制在20±2℃.
霍甫水丝蚓和沉积物一同从太湖中采集,带回实验室对上覆水进行曝气培养以保证上覆水中的溶解氧充足,培养一周后连同沉积物取出放入300目的筛网中,将沉积物洗净,筛网中的剩余物(主要为植物残体和底栖动物)倒入托盘中,挑取其中体长约3~4cm、生长程度相对均一、活性较强的霍甫水丝蚓成虫装入5ml离心管中,20℃保温待用.
装有沉积物的有机玻璃盒子尺寸为10cm(长)×8cm(宽)×10cm(高),盒子的前端挡板材质为透紫外光石英玻璃(10cm×10cm×2mm).实验开始时将HPTS平面感应膜贴在石英玻璃上,排除所有气泡,并在膜边缘处用防水胶带密封.将充分混匀的沉积物缓慢放入有机玻璃盒子中以保证沉积物中没有气泡,填充后沉积物的深度约为5cm.通过虹吸方法缓慢加入湖水,然后将黑色有机玻璃挡板(10cm×10cm)在石英玻璃后2mm处缓慢插入沉积物,以这2mm宽度空间作为霍甫水丝蚓活动区域.将挑选好的霍甫水丝蚓个体(共5条)加入沉积物中,定期观察其扰动对沉积物界面二维pH值变化的影响.分别在不同的时间通过光学系统(图 1)获取沉积物-水界面平面感应膜荧光图片.荧光图片经计算机处理后得到沉积物-水界面二维pH值图像.
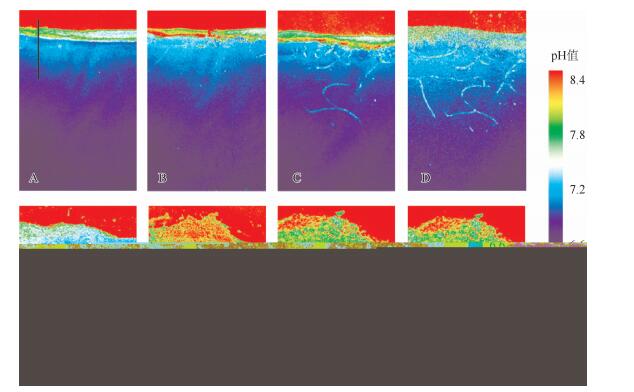
3 结果与讨论 3.1 霍甫水丝蚓扰动对沉积物-水界面pH值二维分布的影响霍甫水丝蚓投加前,沉积物和上覆水有明显分层,形成稳定的沉积物-水界面.霍甫水丝蚓放入后,第2d在石英玻璃板面开始有水丝蚓洞穴结构出现(图 2),经过霍甫水丝蚓扰动2d后的沉积物-水界面开始模糊,最大扰动深度约为3cm.相对于传统研究方法[18],本实验采用的方法能够更直观、清楚地观察到水丝蚓洞穴结构以及扰动轨迹.

|
图 2 霍甫水丝蚓扰动前后荧光照片对比 Fig.2 Fluorescent images before and after the bioturbation of Limnodrilus hoffmeisteri |
霍甫水丝蚓扰动后对沉积物-水界面的二维pH值影响如图 3所示.总体而言,上覆水的pH值较高,最高值达到8.4,而沉积物底部的pH值较低,只有6.6,在2~3cm深度内pH值降低了约1.8个单位.未加霍甫水丝蚓时,沉积物-水界面上下的pH值分布特征非常明显,呈现上覆水高、沉积物低的趋势(图 3A),pH值变化梯度十分剧烈,在界面处约0.5 cm深度内降低约1.2个pH值单位.加入霍甫水丝蚓后(图 3B),由于霍甫水丝蚓短时间内需要适应新环境,所以沉积物pH值并没有明显变化,但是沉积物-水界面已经开始变得模糊,这是由于霍甫水丝蚓的扰动增大了沉积物-水界面面积[19],为沉积物和上覆水中物质交换提供了场地条件.第2d开始,霍甫水丝蚓的生命活动强度明显增加,石英玻璃板壁出现明显的水丝蚓洞穴轨迹,上覆水进入沉积物中并引起了部分沉积物pH值的升高,之后的5d内,由于霍甫水丝蚓生命活动的不断进行,沉积物-水界面的pH值分布特征已经有明显改变,最终在表层沉积物中形成了1cm深的pH值缓冲区域.沉积物-水界面的pH值呈现以上变化主要有两个原因:一方面是随着霍甫水丝蚓适应环境后不断地进行造穴活动,在已形成的和遗弃的洞穴中必然会被引灌入上覆水[19],导致洞穴中的pH值明显高于周边沉积物的pH值,随着洞穴数量的不断增加,沉积物-水界面处就形成了1cm的pH值缓冲区域;另一方面是在实验过程中可以观察到相对均匀尺寸的颗粒逐渐在上覆水底部形成,这可能是由于霍甫水丝蚓的排泄物和搬运作用产生沉积物颗粒,这样的混合作用可以使得上覆水与沉积物的pH值趋向均一[19].本研究发现水丝蚓洞穴能在沉积物表层引起约0.6个pH值单位的降低,并形成约1cm深的pH值过渡区域.Lewandowski等[20]认为水丝蚓可将底层沉积物运送至表层,增加了上覆水与底层沉积物的接触,这也会使水丝蚓改造后的沉积物在表层出现一个pH值缓冲区域.Zhu等[21]研究了沙蚕对海水沉积物-水界面二维pH值的改变,表明沙蚕通过掘穴行为将上覆海水引入到洞穴中,使得沉积物-水界面面积变大,并使表层沉积物在2.5mm深度内的pH值产生了约0.4个pH单位的升高.
|
图 3 霍甫水丝蚓扰动作用对沉积物-水界面二维pH值分布变化,图 3A到图 3H分别为第0d(即未投放霍甫水丝蚓)至第7d的二维pH值图像 Fig.3 2D pH distribution pattern of sediment and water interface before (A) and after (B-H) bioturbation of Limnodrilus hoffmeistteri, from A to H were day 0 to day 7 |
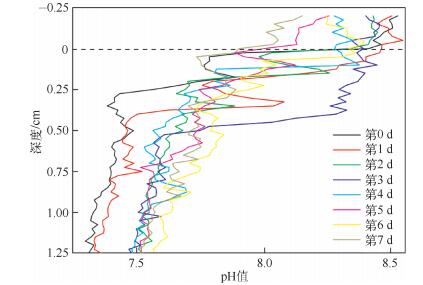
霍甫水丝蚓扰动会对沉积物-水界面pH值产生显著影响(图 4).未加霍甫水丝蚓时,沉积物-水界面pH值具有强烈的梯度变化,界面上2.5mm水体中pH值呈碱性,较稳定,约为8.4,界面下2.5mm深度内降低至7.5.加入霍甫水丝蚓后,上覆水pH值逐渐下降,至第7d时稳定在约8.1,界面下2.5mm内沉积物的pH值由未加霍甫水丝蚓时的7.5上升至霍甫水丝蚓扰动6d后的7.8.经过水丝蚓扰动6d后,在沉积物-水界面处5mm深度(界面上、下各2.5mm)内,pH值的变化梯度得到显著缓和.这很有可能是由于霍甫水丝蚓扰动增大表层沉积物的含水率,即部分上覆水进入到表层沉积物中,使表层沉积物中的氢离子与上覆水中的氢离子发生交换,从而缓和上覆水与表层沉积物的pH值变化梯度[22].生物扰动带来的沉积物交换还可能导致沉积物中腐植酸等成分发生上下移动,这也会影响沉积物中的pH值分布.Rao等[23]用微电极研究了沙蚕扰动前后沉积物-水界面处的pH值变化特征,发现沙蚕扰动后,沉积物-水界面下1~5mm深度处pH值变化梯度由每1mm降低0.4个pH单位减缓至每1mm降低0.25个pH值单位.
|
图 4 霍甫水丝蚓扰动作用对沉积物-水界面处pH值的影响 Fig.4 The pH values of the extract edvertical profiles across the sedimet-water interface during the incubation (由图 3A黑色竖线位置平面光电极数据每25个数值取1个平均值绘成) |
霍甫水丝蚓掘穴行为可以在微观尺度上改变沉积物的pH值(图 5),有水丝蚓洞穴的位置,pH值比洞穴周边未被扰动的沉积物高出0.2~0.6个pH单位,这说明霍甫水丝蚓洞穴对沉积物pH值的分布有重大影响.霍甫水丝蚓在进行掘穴活动时能将蚓体周围的表层沉积物附带输送至沉积物底层[24],而表层沉积物的pH值明显高于底层沉积物,再考虑到上覆水被引灌入洞穴中,这两个因素都导致洞穴内壁的pH值明显高于周边的底层沉积物.生物扰动可使各层沉积物发生交换,进而改变其物理化学性质,其对沉积物扰动能力的大小可能与生物体积有关[25].沈万斌等[12]采用平面光电极方法研究发现颤蚓扰动对沉积物的pH值改变并不明显,可能是由于图像采集技术分辨率不高导致的.本实验采用的荧光强度比率值成像技术拥有较高的分辨率(21.5μm×21.5μm),霍甫水丝蚓掘穴之后,遗弃的洞穴内pH值明显高于周边沉积物的pH值.

|
图 5 霍甫水丝蚓洞穴周边二维pH值分布 Fig.5 The 2D pH value nearby the burrow of Limnodrilus hoffmeisteri |
相比于传统方法而言,本研究采用的基于RGB荧光比率值法测定沉积物-水界面二维pH值的方法拥有高分辨率、良好的均匀性、更快的响应时间、合理的造价、简单方便的仪器操作等优点,这些优点使本方法能满足微尺度二维pH值检测要求,例如植物根际、底栖生物扰动、微生物群落等实验环境.本方法在生物地球化学领域具有广阔的应用前景.
4 结论1) 霍甫水丝蚓扰动对沉积物-水界面的二维pH值产生了明显的变化,主要表现在缓和了垂直方向上pH值的变化梯度,在沉积物-水界面处产生了pH值变化的缓冲区域.未扰动时,沉积物-水界面的pH值在2.5mm深度内由8.4下降至7.0,霍甫水丝蚓扰动6d后,在沉积物-水界面处1cm深度范围内pH值由8.2变为7.6.
2) 霍甫水丝蚓产生的洞穴可将上覆水引灌入洞穴中,使得pH值较高(8.4)的上覆水与界面下的低pH值(6.8)的沉积物直接接触,扩大了沉积物-水界面面积,沉积物内部的pH值分布特征也随着洞穴的产生而改变,洞穴边缘pH值可在1mm范围内由7.4降至6.9.
致谢: 感谢范兴旺、周永强在实验中提供的热情帮助.| [1] |
乔冬梅, 齐学斌, 庞鸿宾等. 不同pH值条件下重金属Pb2+的吸附解吸研究. 土壤通报, 2011(1): 38-41. |
| [2] |
Zhu QZ, Aller RC, Fan Y. High-performance planar pH fluorosensor for two-dimensional pH measurements in marine sediment and water. Environmental Science and Technology, 2005, 39(22): 8906-8911. DOI:10.1021/es051023m |
| [3] |
Hulth S, Aller RC, Engstrom P et al. A pH plate fluorosensor (optode) for early diagenetic studies of marine sediments. Limnology and Oceanography, 2002, 47(1): 212-220. DOI:10.4319/lo.2002.47.1.0212 |
| [4] |
赖心, 丰达明. pH及其测量:从20世纪到21世纪. 化学传感器, 2000(3): 1-5. |
| [5] |
Chauvet F, Amari A, Martinez A. Stability of silicon nitride/silicon dioxide/silicon electrodes used in pH microelectronic sensors. Sensors and Actuators, 1984, 6(4): 255-267. DOI:10.1016/0250-6874(84)85021-0 |
| [6] |
Klimant I, Wolfbeis OS. Oxygen-sensitive luminescent materials based on silicone-soluble ruthenium diimine complexes. Analytical Chemistry, 1995, 67(18): 3160-3166. DOI:10.1021/ac00114a010 |
| [7] |
Baumann WH, Lehmann M, Schwinde A et al. Microelectronic sensor system for microphysiological application on living cells. Sensors and Actuators B:Chemical, 1999, 55(1): 77-89. DOI:10.1016/S0925-4005(99)00116-1 |
| [8] |
Neethirajan S, Jayas DS, Sadistap S. Carbon dioxide (CO2) sensors for the agri-food industry-a review. Food and Bioprocess Technology, 2009, 2(2): 115-121. DOI:10.1007/s11947-008-0154-y |
| [9] |
Lantto V, Mizsei J. H2S monitoring as an air pollutant with silver-doped SnO2 thin-film sensors. Sensors and Actuators B:Chemical, 1991, 5(1): 21-25. |
| [10] |
孙刚, 房岩, 韩德复等. 水丝蚓对水田沉积物颗粒垂直分布的生物扰动作用. 长春师范学院学报:自然科学版, 2008(8): 59-61. |
| [11] |
Pischedda L, Poggiale JC, Cuny P et al. Imaging oxygen distribution in marine sediments. The importance of bioturbation and sediment heterogeneity. Acta Biotheoretica. |
| [12] |
沈万斌, 周楠楠, 李一楠等. pH平面光极在生物扰动存在下水/沉积物体系中的应用. 吉林大学学报:地球科学版, 2013(3): 931-938. |
| [13] |
李艳, 蔡永久, 秦伯强等. 太湖霍甫水丝蚓(Limnodrilus hoffmeisteri Claparède)的时空格局. 湖泊科学, 2012, 24(3): 450-459. DOI:10.18307/2012.0318 |
| [14] |
Vance DH, Czarnik AW. Real-time assay of inorganic pyrophosphatase using a high-affinity chelation-enhanced fluorescence chemosensor. Journal of the American Chemical Society, 1994, 116(20): 9397-9398. DOI:10.1021/ja00099a094 |
| [15] |
Borisov SM, Herrod DL, Klimant I. Fluorescent poly (styrene-block-vinylpyrrolidone) nanobeads for optical sensing of pH. Sensors and Actuators B:Chemical, 2009, 139(1): 52-58. DOI:10.1016/j.snb.2008.08.028 |
| [16] |
Glud RN, Ramsing NB, Gundersen JK et al. Planar optrodes, a new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities. Marine Ecology Progress Series, 1996, 140:217-226.
|
| [17] |
Borisov SM, Klimant I. Ultrabright oxygen optodes based on cyclometalated iridium (Ⅲ) coumarin complexes. Analytical Chemistry, 2007, 79(19): 7501-7509. DOI:10.1021/ac0710836 |
| [18] |
吴方同, 闫艳红, 孙士权等. 水丝蚓生物扰动对沉积物磷释放的影响. 环境工程学报, 2011(5): 1071-1076. |
| [19] |
周楠楠. 颤蚓生物扰动对水体沉积物中pH和DO分布的影响[学位论文]. 长春: 吉林大学, 2013.
|
| [20] |
Lewandowski J, Hupfer M. Effect of macrozoobenthos on two-dimensional small-scale heterogeneity of pore water phosphorus concentrations in lake sediments:A laboratory study. Limnology and Oceanography, 2005, 50(4): 1106-1118. DOI:10.4319/lo.2005.50.4.1106 |
| [21] |
Zhu Q, Aller RC, Fan Y. Two-dimensional pH distributions and dynamics in bioturbated marine sediments. Geochimica et Cosmochimica Acta, 2006, 70(19): 4933-4949. DOI:10.1016/j.gca.2006.07.033 |
| [22] |
张雷, 古小治, 王兆德等. 水丝蚓(Tubificid worms)扰动对磷在湖泊沉积物-水界面迁移的影响. 湖泊科学, 2010, 22(5): 666-674. DOI:10.18307/2010.0507 |
| [23] |
Rao AMF, Malkin SY, Montserrat F et al. Alkalinity production in intertidal sands intensified by lugworm bioirrigation. Estuarine, Coastal and Shelf Science, 2014, 148: 36-47. DOI:10.1016/j.ecss.2014.06.006 |
| [24] |
Gérino M, Stora G, François-Carcaillet F et al. Macro-invertebrate functional groups in freshwater and marine sediments:a common mechanistic classification. Vie et Milieu, 2003, 53(4): 221-231. |
| [25] |
覃雪波, 孙红文, 吴济舟等. 大型底栖动物对河口沉积物的扰动作用. 应用生态学报, 2010(2): 458-463. |
 2016, Vol. 28
2016, Vol. 28 

