(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
超微型浮游植物(autotrophic picophytoplankton, APP),简称超微藻,是指粒径为0.2~3 μm、能够光合自养的微型浮游生物,根据细胞结构及生理特性,可分为超微蓝藻(picocyanobacteria, PCY)和超微真核藻(photosynthetic picoeukaryotes, PPE)[1].由于个体较小、比表面积较大,超微藻具有较高的营养吸收率以及高生长速率[2-3],其对全球水生生态系统的初级生产、物质循环和能量流动有着十分重要的作用[4-7],同时超微藻在湖泊生态系统的微食物环(microbial food loop)中也扮演着重要的角色[8-9].影响超微藻的因子较多,包括营养盐、温度、光照条件、pH值等非生物因子[1, 10-12]以及异养鞭毛虫(heterotrophic nanoflagellates, HNF)、纤毛虫等生物因子[7, 13-14].目前国际上有关超微型浮游植物的研究主要集中在海洋生态系统中,针对淡水生境的研究相对较少,而国内关于湖泊超微藻的研究也才刚刚起步,目前仅有对武汉东湖[15]、太湖[16]和长江中下游湖泊[17]超微藻的一些初步研究.
鄱阳湖(28°20′~29°50′N, 115°51′~116°45′E)位于长江中下游交界处南岸,是长江流域最大的单口通江湖泊,也是中国最大的淡水湖泊[18],丰水期和枯水期水位差较大[19-20].鄱阳湖具有南高北低的湖盆形态,流向呈现出整体向北,湖区流场变化复杂,水动力条件也非常复杂[21];此外湖泊采砂活动及水动力因素引起底泥再悬浮,导致鄱阳湖透明度空间差异明显.已有研究表明透明度是影响浮游植物时空分布的重要因素,而营养条件的影响相对较小[22].迄今为止,有关鄱阳湖超微型浮游植物的研究还基本属于空白.本研究在丰水期对鄱阳湖进行大规模的采样调查,以期明晰鄱阳湖超微型浮游植物细胞丰度、生物量以及初级生产力的空间分布规律,揭示各生物、非生物环境因子对超微型浮游植物空间分布的影响.
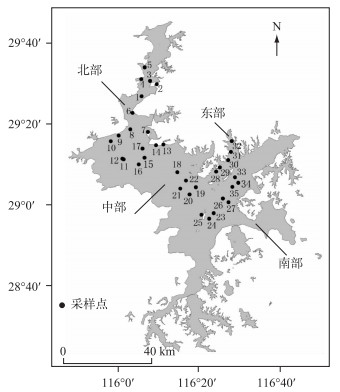
1 材料与方法 1.1 样品采集及前处理2014年7月,全湖设置了35个采样点(图 1),现场使用Hydrolab Datasond 5型多参数水质监测仪,测定水体表层水温(T)、pH值和溶解氧浓度(DO).采用塞氏透明度盘测定水体透明度(SD).采用有机玻璃采水器采集表层(水面以下0.5 m)、中层和底层(离湖底0.5 m)水样,将3层水样混合,使用5 L经酸泡处理的塑料桶储存水样,并冷冻保存,直至带回实验室;部分水样现场使用戊二醛固定(最终浓度为1 %),液氮速冻后保存于-80℃冰箱中,用于后续的流式细胞分析.
|
图 1 鄱阳湖采样点位分布 Fig.1 Distribution of the sampling sites in Lake Poyang |
总氮(TN)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、铵态氮(NH4+-N)、总磷(TP)、正磷酸盐(PO4--P)、高锰酸盐指数(CODMn)和总悬浮颗粒物(SS)浓度的测定方法参照《水和废水监测分析方法》[23].
将水样分别用3 μm和0.2 μm的Millipore聚碳酸酯膜进行逐级过滤,分别得到粒径>3 μm和粒径 < 3 μm的浮游植物,用90 %的丙酮溶液进行叶绿素a(Chl.a)的萃取,采用荧光计测定叶绿素a浓度.
净初级生产力(NPP)采用黑白瓶法测定[23].将原水样以及经3 μm的Millipore聚碳酸酯膜抽滤过的水样倒入22 ml顶空瓶中,直至完全排除空气,随船进行光照培养2~3 h,采用DO浓度的变化速率代表初级生产力的大小[24].水样中DO浓度采用检测限极低的溶氧微电极(PreSens Microx TX3,德国)测定.
超微藻、异养鞭毛虫丰度使用流式细胞仪(BD FACSJazz Cytometer,美国)进行分析测定.样品解冻后,先经过300目筛绢过滤,滤去较大的颗粒以免堵塞机器.湖泊中的超微藻主要包括超微蓝藻和超微真核藻,由于具有不同的色素组成:超微真核藻富含叶绿素a,超微蓝藻富含藻胆蛋白[25],这两种不同类群的超微藻各自的自发荧光不同,结合前向散射光(FSC)和侧向散射光(SSC)鉴定大小,通过流式细胞检测就可将它们分别计数.异养鞭毛虫(Heterotrophic Nanoflagellate, HNF)先要经过SYBR Green Ⅰ染料染色[26],再通过流式细胞仪进行计数.
1.3 数据处理采用Excel、SPSS Statistics 17.0软件包进行相关统计分析,采用Origin 8.5和ArcGIS 9.3软件完成绘图.
2 结果 2.1 丰水期鄱阳湖主要环境因子状况丰水期鄱阳湖水体平均温度在30℃左右,水体pH值基本在7~8之间,东部湖区水体pH值稍高(7.8),但是与其它区域差异不显著(P>0.2).总体上,北部和中部湖区水体透明度要比东部和南部湖区低,但总悬浮颗粒物浓度要稍高,表明北部和中部湖区的水下光照条件要比东、南部湖区差,尤其是北部通江湖区,水体透明度平均只有0.44 m,显著低于其它湖区(P < 0.05).水体TN和TP浓度较高,均值分别为1.58和0.06 mg/L,已经达到了发生富营养化的条件;除了东部湖区TP浓度显著高于其它区域外(P < 0.05),其它湖区TN、TP浓度无显著性差异.丰水期鄱阳湖异养鞭毛虫丰度在中部湖区最高,均值达到1.33×105 cells/L,显著高于其它湖区(P < 0.05),在北部通江湖区最低,平均只有4.5×104 cells/L(表 1).
| 表 1 丰水期鄱阳湖各湖区主要环境因子比较 Tab.1 Comparison of key environmental factors among different regions of Lake Poyang during the wet season |
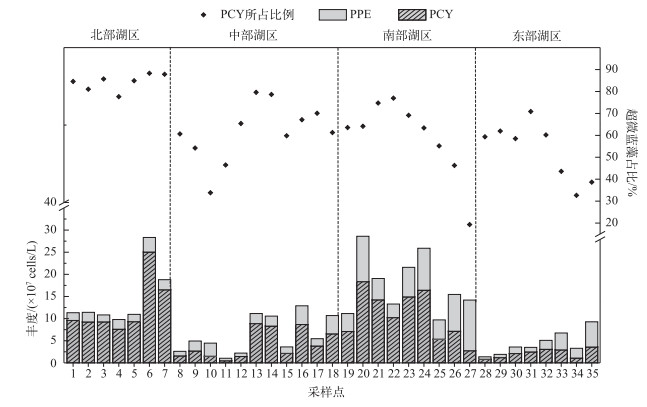
丰水期鄱阳湖水体中超微藻细胞丰度的平均值为1.04×108 cells/L,全湖超微藻细胞丰度最大值为2.86× 108 cells/L,出现在南部湖区,最小值为1.05×107 cells/L,出现在中部湖区.在空间分布上,南部和北部通江湖区超微藻丰度要显著高于全湖其它水域(P < 0.001),均值达到1.63×108 cells/L;其次是中部靠近湖心处水域,超微藻丰度均值达到6.39×107 cells/L,东部湖区和中部靠近北部水域最低,普遍不超过5×107 cells/L(图 2).
|
图 2 总超微藻、超微蓝藻和超微真核藻丰度的分布 Fig.2 Distribution of the cell abundance of total picophytoplankton, picocyanobacteria and photosynthetic picoeukaryotes |
除南部湖区小部分水域外,丰水期鄱阳湖超微蓝藻丰度基本要比超微真核藻高(图 2),超微蓝藻占超微藻丰度比例平均达到68 %,尤其是在北部通江湖区,基本都在80 % ~90 %之间,显著高于其它区域(P < 0.001).超微蓝藻丰度均值为7.04×107 cells/L,最大值出现在北部湖区,为2.50×108 cells/L,最小值出现在中部湖区,为4.88×106 cells/L.与总超微藻丰度相似,超微蓝藻在南部湖区和北部湖区的丰度显著高于其它区域(P < 0.01).丰水期鄱阳湖超微真核藻丰度相对较低,均值只有3.38×107 cells/L,南部湖区超微真核藻丰度要显著高于其它区域(P < 0.01).
相关分析(表 2)表明,超微蓝藻丰度和总超微藻丰度都与温度呈极显著正相关(P < 0.01),与异养鞭毛虫丰度呈极显著负相关(P < 0.01),与其它环境因子无显著相关性;超微真核藻丰度与pH值呈显著负相关(P < 0.05),与其它环境因子无显著相关性.
| 表 2 超微藻丰度、叶绿素a浓度和净初级生产力及其对总浮游植物的贡献率与环境因子的相关分析 Tab.2 Correlation analysis of picophytoplankton cell abundance, Chl.a concentration, NPP and its contribution ratio to total phytoplankton with environmental factors |
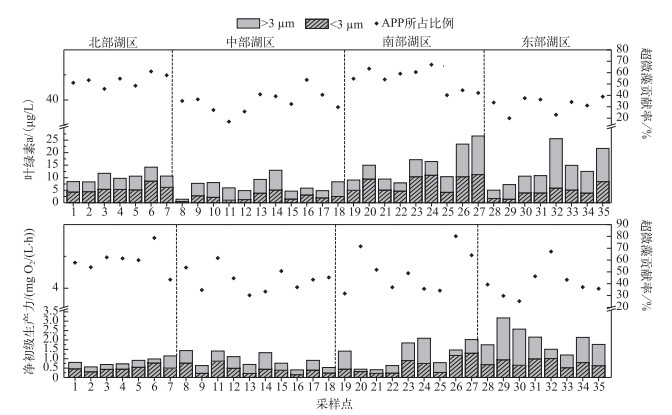
鄱阳湖丰水期水体中超微藻叶绿素a的平均浓度为4.89 μg/L,与超微藻丰度相类似,超微藻叶绿素a浓度最大值出现在南部湖区,为11.42 μg/L,最小值出现在中部湖区,为0.49 μg/L.从空间分布来看,南部湖区超微藻叶绿素a浓度显著高于其它水域(P < 0.01),其次是北部湖区和东部湖区,超微藻叶绿素a浓度约为4~5 μg/L;中部湖区超微藻叶绿素a浓度在全湖最低(P < 0.001),普遍低于3 μg/L(图 3).
|
图 3 超微藻叶绿素a浓度、净初级生产力及其对总浮游植物贡献率的分布 Fig.3 Distribution of picophytoplankton Chl.a concentration, net primary production and its contribution ratio to total phytoplankton |
超微藻净初级生产力均值为0.57 mg O2/(L·h),最大值出现在南部湖区,最小值出现在中部湖区,最大值为1.3 mg O2/(L·h),最小值为0.15 mg O2/(L·h).从空间分布上看,南部湖区和东部湖区大部分区域超微藻净初级生产力都超过0.6 mg O2/(L·h),显著高于全湖其它区域(P < 0.05);北部和中部相对较低,基本不超过0.5 mg O2/(L·h)(图 3).
相关分析表明(表 2),超微藻叶绿素a浓度与pH值、异养鞭毛虫丰度呈显著负相关(P < 0.05),与其它环境因子无显著相关性;超微藻净初级生产力与温度呈极显著负相关(P < 0.01),与其它环境因子无显著相关性.
2.4 超微藻叶绿素a浓度、净初级生产力对总浮游植物的贡献率及其与环境因子的关系总体上,全湖超微藻对总浮游植物叶绿素a浓度和净初级生产力贡献率均值分别为46 %和44 %.超微藻对总浮游植物叶绿素a浓度的贡献率在北部和南部湖区最高(P < 0.001),基本上都超过50 %,中部、东部湖区相对较低,绝大多数区域都在30 % ~40 %之间.而超微藻对总浮游植物净初级生产力的贡献率在北部通江湖区达到60 %左右,显著高于全湖其它区域(P < 0.05);其次是南部湖区,平均达到50 %;中部和东部较低,大部分区域都在40 %左右(图 3).
相关分析(表 2)表明,超微藻对总浮游植物叶绿素a浓度的贡献率与温度呈极显著正相关(P < 0.01),与异养鞭毛虫丰度呈显著负相关(P < 0.05),与其它环境因子无显著相关性;超微藻对总浮游植物净初级生产力贡献率与透明度呈极显著负相关(P < 0.01),与其它环境因子无显著相关性(P>0.05).
3 讨论 3.1 营养盐和光照对超微型浮游植物的影响一般认为,超微型浮游植物在较为浑浊的浅水富营养化湖泊丰度会很高.丰水期鄱阳湖水体中超微藻细胞丰度较高,均值能达到1.04×108 cells/L,这与Vörös等[27]的研究结果一致.研究表明,在富营养化较为严重的水体中超微藻对整个浮游植物群落的初级生产力仍具有重要贡献[27-28],丰水期鄱阳湖超微藻对总浮游植物生物量(以叶绿素a浓度表示)和净初级生产力的平均贡献率分别能达到46 %和44 %,这可能是由于鄱阳湖作为通江湖泊独特水文条件(如水体交换时间较短、水体流速相对较大)所造成的.鄱阳湖水体中氮、磷浓度已经达到发生富营养化的条件[29-30],但丰水期水体总浮游植物叶绿素a浓度偏低,平均仅为11.19 μg/L;相关分析结果也表明,水体营养盐浓度与超微藻生物量、初级生产力均无显著相关性,显示在鄱阳湖丰水期,营养盐对超微型浮游植物生长的作用表现不明显.
在温带湖泊中,光对浮游植物的影响尤为重要,甚至超过了营养盐的作用[31].超微藻(尤其超微蓝藻)对高强度的光照和辐射非常敏感,适合在低光环境下生长[1],在光照条件较差的水体中,超微藻很容易成为浮游植物群落的竞争优势种群[1, 31-32].鄱阳湖水体流速较快,采砂活动频繁,水体较为浑浊,造成其水下光照条件较差[30].在鄱阳湖水下光照条件最差的北部通江区域,超微藻对总浮游植物净初级生产力和生物量的贡献率分别达到60 %和50 %,而在水下光照条件相对较好的东部和南部湖区,其对总浮游植物的贡献率却较低;同时超微蓝藻丰度及其对总超微型浮游植物的贡献率在北部湖区最高,表明低光条件对超微蓝藻的生长较为有利.相关分析也显示,超微藻对总浮游植物净初级生产力的贡献率与水体透明度呈显著负相关(P < 0.05),表明水下光照不足会对大型浮游植物的生长和光合作用有较大的限制[30],而超微藻在这种环境条件下更能体现其竞争优势.
3.2 水温和pH值对超微型浮游植物的影响本次夏季鄱阳湖采样持续时间较长(约8 d),造成水体温度在空间上差异较大,但是绝大部分区域水温都在26~32℃之间.夏季鄱阳湖超微型浮游植物的优势种群为超微蓝藻,其占总超微藻丰度的比例能达到68 %,尤其是在北部湖区,超微蓝藻占总超微藻丰度的比例超过80 %,这可能是由于北部湖区平均温度稍高.相关分析结果表明,夏季鄱阳湖水体中超微蓝藻丰度与水温呈极显著正相关(P < 0.01),超微藻对总浮游植物叶绿素a浓度的贡献率与温度呈极显著正相关(P < 0.01),显示水温较高有利于超微蓝藻的生长,在较高的水温条件下超微蓝藻相对于超微真核藻要占有生长优势[33],超微型浮游植物对水温的变化比大型浮游植物更加敏感[34].超微真核藻丰度与pH值呈显著负相关(P < 0.05),表明在pH值较低的湖泊中超微真核藻在超微型浮游植物群落中占主导地位,而较高的pH值有利于原核超微藻生长,当pH值低于6时,超微蓝藻对总超微藻的贡献就可以忽略[12, 35].
3.3 异养鞭毛虫对超微型浮游植物的影响目前对超微型浮游植物的“下行控制”主要是捕食,无论是在淡水生境还是海洋生态系统中,异养鞭毛虫以及一些小型纤毛虫都是超微型浮游藻类的主要捕食者[36-37],其中异养鞭毛虫对超微藻和细菌的捕食量达到所有原生动物捕食量的90 % [14].丰水期鄱阳湖中部湖区水体异养鞭毛虫丰度显著高于其它湖区(P < 0.05),表明在中部湖区异养鞭毛虫对超微型浮游植物的捕食压力要明显大于全湖其它区域,这可能是导致超微藻丰度、生物量和净初级生产力及其对总浮游植物贡献率在中部湖区较低、在北部湖区较高的原因之一.相关分析结果表明,鄱阳湖超微蓝藻丰度与异养鞭毛虫丰度呈极显著负相关(P < 0.01),表明异养鞭毛虫对超微蓝藻表现出明显的捕食效应.一般认为,对于浮游藻类捕食者来说,硅藻、隐藻和绿藻的食物质量较高,而蓝藻的食物质量则较低[38-39],但水体营养盐浓度的升高可能会改变蓝藻的食物质量[40],因此鄱阳湖营养盐条件可能改变了超微蓝藻的可食性.
4 结论丰水期鄱阳湖超微型浮游植物丰度较高,由于超微蓝藻对低光、高温环境的适应力强,在水下光照条件最差、温度稍高的北部湖区,超微蓝藻是超微型浮游植物的优势种群,其占总超微藻丰度的比例超过80 %,且超微藻对总浮游植物净初级生产力以及生物量的贡献在该湖区最高,分别达到60 %和50 %.异养鞭毛虫对超微蓝藻的捕食作用是影响超微蓝藻丰度的重要原因;pH值对超微真核藻的影响较大,营养盐对超微型浮游植物生长的作用表现不明显.
致谢: 感谢中国科学院鄱阳湖湖泊湿地观测研究站工作人员在样品采集中的热心帮助;同时对吴召仕、陈超、王丹、余丽、王银平等在论文撰写和修改过程中给予的指导和帮助表示感谢.| [1] |
Callieri C. Picophytoplanktonin freshwater ecosystems:the importance of small-sized phototrophs. Freshwater Reviews, 2008, 1(1): 1-28. DOI:10.1608/FRJ-1.1.1 |
| [2] |
Raven J. Physiological consequences of extremely small size for autotrophic organisms in the sea. Photosynthetic Picoplankton, 1986, 214: 1-70. |
| [3] |
Zevenboom W. Ecophysiology of nutrient uptake, photosynthesis and growth, in photosynthetic picoplankton. Dept of Fisheries and Oceans, 1986, 391-422. |
| [4] |
Craig S. Distribution of algal picoplankton in some European freshwaters. Abstract 2nd International Phycology Congress, 1985, 31. |
| [5] |
Platt T, Rao DS, Irwin B. Photosynthesis of picoplankton in the oligotrophic ocean. Nature, 1983, 301(5902): 702-704. DOI:10.1038/301702a0 |
| [6] |
Stockner JG. Phototrophic picoplankton:an overview from marine and freshwater ecosystems. Limnology and Oceanography, 1988, 33(4): 765-775. |
| [7] |
Stockner JG, Antia NJ. Algal picoplankton from marine and freshwater ecosystems:a multidisciplinary perspective. Canadian Journal of Fisheries and Aquatic Sciences, 1986, 43(12): 2472-2503. DOI:10.1139/f86-307 |
| [8] |
Porter KG, Sherr EB, Sherr BF et al. Protozoa in planktonic food webs. The Journal of Protozoology, 1985, 32(3): 409-415. DOI:10.1111/jeu.1985.32.issue-3 |
| [9] |
Šimek K, Bobkova J, Macek M et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum:A study at the species and community level. Limnology and Oceanography, 1995, 40(6): 1077-1090. DOI:10.4319/lo.1995.40.6.1077 |
| [10] |
Mills MM, Ridame C, Davey M et al. Iron and phosphorus co-limit nitrogen fixation in the eastern tropical North Atlantic. Nature, 2004, 429(6989): 292-294. DOI:10.1038/nature02550 |
| [11] |
Mózes A, Présing M, Vörös L. Seasonal dynamics of picocyanobacteria and picoeukaryotes in a large shallow lake(Lake Balaton, Hungary). International Review of Hydrobiology, 2006, 91(1): 38-50. DOI:10.1002/(ISSN)1522-2632 |
| [12] |
Stockner JG, Shortreed KS. Autotrophic picoplankton:community composition, abundance and distribution across a gradient of oligotrophic British Columbia and Yukon Territory lakes. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 1991, 76(4): 581-601. DOI:10.1002/(ISSN)1522-2632 |
| [13] |
Liu HB, Imai K, Suzuki K et al. Seasonal variability of picophytoplankton and bacteria in the western subarctic Pacific Ocean at station KNOT. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2002, 49(24): 5409-5420. |
| [14] |
Pernthaler J, Šimek K, Sattler B et al. Short-term changes of protozoan control on autotrophic picoplankton in an oligo-mesotrophic lake. Journal of Plankton Research, 1996, 18(3): 443-462. DOI:10.1093/plankt/18.3.443 |
| [15] |
王建, 林婉莲. 武汉东湖超微藻生态学的初步研究. 湖泊科学, 1998, 10(4): 71-76. DOI:10.18307/1998.0411 |
| [16] |
谢薇薇, 王志伟, 孔繁翔等. 太湖光合自养真核超微藻遗传多样性初探. 湖泊科学, 2012, 24(1): 123-128. DOI:10.18307/2012.0117 |
| [17] |
李胜男, 史小丽, 谢薇薇等. 长江中下游湖泊超微型真核藻类遗传多样性研究. 环境科学, 2013, 34(9): 3416-3422. |
| [18] |
吴建东, 李凤山, James B. 鄱阳湖沙湖越冬白鹤的数量分布及其与食物和水深的关系. 湿地科学, 2013, 11(3): 305-312. |
| [19] |
Shankman D, Keim BD, Song J. Flood frequency in China's Poyang Lake region:trends and teleconnections. International Journal of Climatology, 2006, 26(9): 1255-1266. DOI:10.1002/(ISSN)1097-0088 |
| [20] |
刘健, 张奇, 许崇育等. 近50年鄱阳湖流域径流变化特征研究. 热带地理, 2009, 29(3): 213-218, 224. |
| [21] |
张琍, 陈晓玲, 张媛等. 水文地貌分区下鄱阳湖丰水期水质空间差异及影响机制. 中国环境科学, 2014, 34(10): 2637-2645. |
| [22] |
Wu ZS, Cai YJ, Liu X et al. Temporal and spatial variability of phytoplankton in Lake Poyang:The largest freshwater lake in China. Journal of Great Lakes Research, 2013, 39(3): 476-483. DOI:10.1016/j.jglr.2013.06.008 |
| [23] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002, 243-248.
|
| [24] |
Nimer NA, Iglesias-Rodriguez MD, Merrett MJ. Bicarbonate utilization by marine phytoplankton species. Journal of Phycology, 1997, 33(4): 625-631. DOI:10.1111/j.0022-3646.1997.00625.x |
| [25] |
焦念志. 海洋微型生物生态学. 北京: 科学出版社, 2006.
|
| [26] |
Zubkov MV, Zöllner E, Jürgens K. Digestion of bacterial macromolecules by a mixotrophic flagellate, Ochromonas sp., compared with that by two heterotrophic flagellates, Spumella pudica and Bodo saltans. European Journal of Protistology, 2001, 37(2): 155-166. DOI:10.1078/0932-4739-00815 |
| [27] |
Vörös L, Gulyás P, Németh J. Occurrence, dynamics and production of picoplankton in Hungarian shallow lakes. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 1991, 76(4): 617-629. DOI:10.1002/(ISSN)1522-2632 |
| [28] |
Binder BJ, Chisholm SW, Olson RJ et al. Dynamics of picophytoplankton, ultraphytoplankton and bacteria in the central equatorial Pacific. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 1996, 43(4): 907-931. |
| [29] |
陈晓玲, 张媛, 张琍等. 丰水期鄱阳湖水体中氮、磷含量分布特征. 湖泊科学, 2013, 25(5): 643-648. DOI:10.18307/2013.0504 |
| [30] |
吴召仕, 张路, 刘宝贵等. 鄱阳湖丰水期水体中叶绿素a含量空间分布及其与环境因子的关系. 湿地科学, 2014, 3(12): 286-292. |
| [31] |
Lewis WM. Tropical limnology. Annual Review of Ecology and Systematics, 2003, 18(4): 159-184. |
| [32] |
Wehr JD. Experimental tests of nutrient limitation in freshwater picoplankton. Applied and Environmental Microbiology, 1989, 55(6): 1605-1611. |
| [33] |
Hepperle D, Krienitz L. Systematics and ecology of chlorophyte picoplankton in German inland waters along a nutrient gradient. International Review of Hydrobiology, 2001, 86(3): 269-284. DOI:10.1002/(ISSN)1522-2632 |
| [34] |
Li WK. Annual average abundance of heterotrophic bacteria and Synechococcus in surface ocean waters. Limnology and Oceanography, 1998, 43(7): 1746-1753. DOI:10.4319/lo.1998.43.7.1746 |
| [35] |
Søndergaard M. Phototrophic picoplankton in temperate lakes:seasonal abundance and importance along a trophic gradient. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 1991, 76(4): 505-522. DOI:10.1002/(ISSN)1522-2632 |
| [36] |
Christoffersen K. Variations of feeding activities of heterotrophic nanoflagellates on picoplankton. Marine Microbial Food Webs, 1994, 8(1/2): 111-123. |
| [37] |
Weisse T, Miiller H, Pinto-Coelho R et al. Response of the microbial loop to the phytoplankton spring bloom in a large prealpine lake. Limnology and Oceanography, 1990, 35(4): 781-794. DOI:10.4319/lo.1990.35.4.0781 |
| [38] |
Brett MT, Müller-Navarra DC, Sang-Kyu P. Empirical analysis of the effect of phosphorus limitation on algal food quality for freshwater zooplankton. Limnology and Oceanography, 2000, 45(7): 1564-1575. DOI:10.4319/lo.2000.45.7.1564 |
| [39] |
Hessen DO, Ågren GI, Anderson TR et al. Carbon sequestration in ecosystems:the role of stoichiometry. Ecology, 2004, 85(5): 1179-1192. DOI:10.1890/02-0251 |
| [40] |
Worden AZ, Binder BJ. Application of dilution experiments for measuring growth and mortality rates among Prochlorococcus and Synechococcus populations in oligotrophic environments. Aquatic Microbial Ecology, 2003, 30(2): 159-174. |
 2016, Vol. 28
2016, Vol. 28 


