(2: 南京林业大学生物与环境学院, 南京 210037)
(2: College of Biology and Environment, Nanjing Forestry University, Nanjing 210037, P. R. China)
在湖泊、河流等水生环境中,沿岸带湿地植物常常会因水位波动或洪水侵蚀而部分或完全遭受泥沙等沉积物的淹埋[1-2].基质淹埋能改变湿地植物周边生物和非生物环境条件,如降低光照强度、改变周围温度、溶解氧和土壤微生物活动来影响植物的生理、形态特征以及生长和存活[3-7].基质淹埋作为对湿地植物的一种环境胁迫,关于植物对其耐受性和适应性机制的研究并不多见[8].
当湿地克隆植物部分分株遭受基质淹埋时,未淹埋的分株能通过与其相连的淹埋分株进行物质(碳水化合物、水分和养分等)的传输(即克隆整合)给予受胁迫分株资源或者信息的支持[9-10].国内外众多研究表明,克隆整合能使许多生境中遭受局部环境胁迫的分株受益,如光照胁迫、营养胁迫、水分胁迫、盐分胁迫、病原体侵染以及采食干扰等[11-17].在胁迫条件下,植物细胞新陈代谢平衡受到干扰,活性氧大量产生和积累,导致氧化胁迫,进而影响植物的生存和生长[18-19].尽管国内外有诸多研究探讨克隆整合对植物抵御和耐受环境胁迫的影响,但关注克隆整合影响湿地植物抵御基质淹埋的研究较少,特别是鲜有从氧化胁迫角度分析克隆植物抗逆的生物学机理研究[19].
植物入侵对生物多样性和全球生态系统构成了巨大的威胁[20].有相当一部分恶性外来入侵植物具有非常强的克隆繁殖能力[21-23].例如,两种入侵性水生植物喜旱莲子草和凤眼莲能在水中形成致密的毡层,排挤水生生态系统中其他几乎所有的物种[24-25].已有部分研究表明外来植物的入侵性和克隆植物的克隆特性例如克隆整合密切相关[23, 26-28].然而,目前多数针对入侵克隆植物的研究常常忽视其克隆整合特性的潜在影响,这可能会对这些入侵植物缺乏全面的了解[28].
粉绿狐尾藻(Myriophyllum aquaticum)原产南美,其作为观赏植物被引入世界各地,但是在引入地逸为野生,特别是在欧洲、北美和我国台湾地区已成为难以控制的恶性水生杂草,对当地水生生态环境造成了严重的损害[29-30].因其在富营养化水体中快速生长、在生长发育过程中可大量吸收污染物并且具有良好的景观效果等特点,近来在我国被广泛应用于水体的生态修复.并且已在我国云南、江浙等地野外出现或形成当地优势群落[15, 30].粉绿狐尾藻作为一种典型的水生克隆植物,关于其克隆整合属性的研究报道却非常少[15].本实验以外来水生植物粉绿狐尾藻克隆片段为研究材料,用室内控制实验的手段,研究克隆整合(相连匍匐茎切断与否)和基质淹埋对粉绿狐尾藻植株抗氧化酶活性、生长和生物量分配的影响.考虑到未淹埋分株能通过连接的匍匐茎输送资源给受基质淹埋分株,从而可能增强其氧化胁迫下细胞的新陈代谢水平,因此,我们提出如下假设:(1) 克隆整合将影响受基质淹埋分株的抗氧化酶(超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT))的活性,从而有利于其细胞内活性氧浓度平衡的维持;(2) 克隆整合将显著增强受淹埋分株的生长能力,从而提高其对基质淹埋的耐受性;(3) 克隆整合将显著影响受淹埋分株的生物量分配.基于劳动分工理论(division of labor theory)[13],我们预测:由于基质淹埋降低了地上资源的可获得性,克隆整合将显著增加受淹埋分株的地下生物量投入(冠根比增加).
1 材料和方法 1.1 实验材料粉绿狐尾藻为小二仙草科(Haloragidaceae)狐尾藻属(Myriophyllum)植物.多年生挺水或沉水草本植物,原产于南美洲.茎半直立,能匍匐于湿地生长.上部为挺水叶,匍匐在水面上,下半部为水中茎.挺水叶轮生,羽状排列;沉水叶丝状,朱红色,冬天落叶为红色.穗状花序顶生,花单性,雌雄异株,花序上半部为雄花,下半部为雌花,花期在每年的4-9月[31-32].粉绿狐尾藻在引入地能耐受秋、冬季低温甚至霜冻[33],能在湿润且没有水体覆盖的情况下,例如潮湿的河岸和退水后裸露的基质上正常生长,甚至在相对干燥的土壤中也能存活.在中国只有雌株,仅靠断枝和片段进行克隆繁殖和扩散[15, 30].
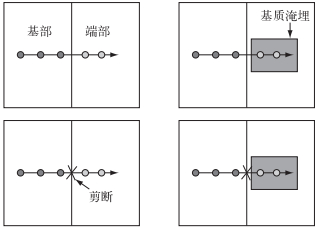
2013年6月上旬,在太湖贡湖湾区域自然分布的粉绿狐尾藻种群中采集大小一致的100株顶枝(长度约15 cm)移植于温室内进行培养.野外采集的顶枝均匍匐种植在湿润的泥沙基质上.一周后,待断枝生根后,挑选大小均一且长势良好的24株(均含5个分株,见图 1;株高16±0.31 cm)作为实验材料用于实验.每个克隆片段(实验培养的顶枝)中2个靠近顶端的生根分株(长约6 cm)作为先端部分(即子株),其余含有3个分株的茎断作为基端部分(即母株).
1.2 实验设计本实验在南京林业大学温室中进行,温室内为自然光照和温度.实验从2013年6月20日开始,2013年8月2日收获,周期为6周.实验采用两因素两水平的析因设计(two-way factorial design).实验因素为匍匐茎切断或者保持连接,先端分株被基质淹埋或者不淹埋.因而4个处理分别为:匍匐茎连接先端不淹埋、匍匐茎连接先端淹埋、匍匐茎切断先端不淹埋、匍匐茎切断先端淹埋(图 1).实验重复6次.实验容器为24个塑料白框(长×宽×高=50 cm×40 cm×15 cm),并将每个容器也分为先端和基端部分(体积比为1 :1).通过不透水的塑料布包裹使容器两部分的养分、水分和根系隔离.实验基质为体积比为1 :1的纯净的沙子和湖泥(总氮(TN)含量为2.45 mg/g; 总磷(TP)含量为0.30 mg/g)的混合物以及5 g缓释肥(Osmocote, N-P-K :16-8-12),厚度约10 cm,基质总重约20 kg.实验开始前,将挑选的24个粉绿狐尾藻的生根克隆片段匍匐放置于实验容器基质上(穿过塑料布),每个容器一颗植株,植株的先端分株放置在容器先端部分中间,相对应的基端分株放置于容器的基端部分.经过1周的适应性培养,待植株在新环境重新扎根后开始实验处理:将12个容器中的粉绿狐尾藻先端分株和基端分株的匍匐茎用剪刀切断,另外12个容器的植株匍匐茎保持连接;然后用3 cm厚的实验基质覆盖在其中的6个切断处理和6个连接处理的先端分株上来模拟湖滨沿岸带沉积物淹埋.实验期间每天浇水,保持各处理的基质上覆盖2 cm高的水以模拟湿地环境. 6周以后,待植株生长到占满了整个容器时进行收获.实验处理期间,在晴好天气温室的光照强度为1000~1200 μmol/(m2·s),平均气温为25~28℃.
|
图 1 实验设计示意图(每个容器中均为一个粉绿狐尾藻的克隆片段,容器左侧是3个基端分株,右侧为2个先端分株;基端和先端保持连接(上)或切断(下),先端分株不淹埋或受3 cm厚基质淹埋(阴影)) Fig.1 Schematic representation of the experimental design (There was one clonal fragment of M. aquaticum in each container, consisting three basal ramets grown in the left side and two apical ramets in the right side; Stolon connection between basal and apical ramets were connected (upside) or disconnected (underside); Apical ramets were buried by 3 cm sediment (shade) or not) |
实验收获前,取0.2 g先端分株顶枝部分新鲜样品置于预冷的研钵中, 加入5 ml预冷的50 mmol/L磷酸缓冲液(pH值为7.8) 冰浴研磨,然后用磷酸缓冲液定容至10 ml, 并于4℃下15000转/min离心15 min, 取上清液(粗酶液) 4℃保存, 用于测定样品SOD、POD和CAT活性.其中SOD活性用氮蓝四唑(NBT)光化还原法测定;POD活性用愈创木酚氧化法测定;CAT活性用紫外吸收法测定[34].
实验待收获时,记录各个处理先端部分分株的分枝数,并测量总的匍匐茎长.然后将所有处理分株小心收获洗净并分成叶、匍匐茎和根3个部分,并将各部分放入70℃的烘箱中72 h,烘干至恒重测量干重.
1.4 数据分析所有实验数据均为均值±标准误.在进行数据分析前,数据都经过相应的转换以确保数据满足正态分布和方差的齐次性.利用双因素方差分析(two-way ANOVA)检验克隆整合(匍匐茎连接)和基质淹埋对先端部分分株的生长(生物量、匍匐茎总长和分枝数)、冠根比(shoot/root ratio)和抗氧化酶活性(SOD、POD和CAT活性)的影响.倘若处理的影响显著,再利用Studentized Tukey's HSD的方法对因素内不同水平间的影响进行多重比较.数据分析采用SPSS 18.0统计分析软件,显著度水平为0.05.
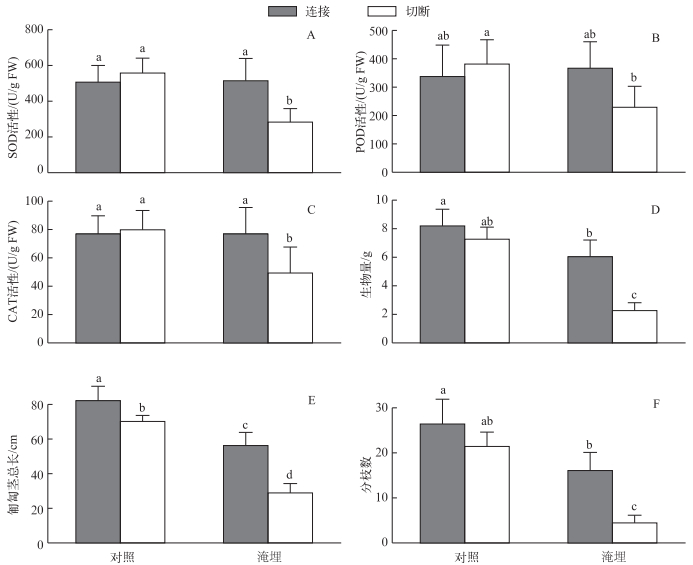
2 结果 2.1 粉绿狐尾藻先端分株的抗氧化酶活性变化克隆整合(匍匐茎连接)、基质淹埋及其交互作用显著影响了粉绿狐尾藻先端分株的SOD和CAT酶活性;而POD活性只受两个因素交互作用的影响(表 1).先端分株未被基质淹埋时,克隆整合对粉绿狐尾藻的抗氧化酶活性无显著影响(图 2A、B、C);而当先端分株被基质淹埋时,克隆整合显著增强了粉绿狐尾藻的SOD和CAT活性(图 2A、C),并有增强其POD活性的趋势(图 2B).
| 表 1 克隆整合(连接)、基质淹埋(淹埋)及两者的交互作用对粉绿狐尾藻先端分株的抗氧化酶活性的双因素方差分析结果 Tab.1 Two-way ANOVA results of effects of clonal integration, sediment burial and their interaction on the antioxidase activities of the apical ramets of Myriophyllum aquaticum |
|
图 2 匍匐茎连接或切断的粉绿狐尾藻先端分株在基质淹埋或不淹埋条件下的SOD活性(A),POD活性(B)、CAT活性(C)、生物量(D)、匍匐茎总长(E)和分枝数(F)(不同小写字母表示各处理间差异显著(P < 0.05),下同) Fig.2 Activities of superoxide (A), peroxidase (B), catalase (C), biomss (D), stolon length (E) and branch number (F) of apical ramets of M. aquaticum, with stolon connections either connected to or severed from the basal ramets and subjected to sediment burial or not |
克隆整合(匍匐茎连接)、基质淹埋及其交互作用显著影响了粉绿狐尾藻先端分株的生长(生物量、匍匐茎总长和分枝数)(表 2).基质淹埋显著降低了先端分株的各生长指标(表 2和图 2D、E、F).
| 表 2 克隆整合(连接)、基质淹埋(淹埋)及两者的交互作用对粉绿狐尾藻先端分株的生物量、匍匐茎总长和分枝数影响的双因素方差分析结果 Tab.2 Two-way ANOVA results of effects of clonal integration, sediment burial and their interaction on the biomass, stolon length and branch number of the apical ramets of Myriophyllum aquaticum |
先端分株未被基质淹埋时,克隆整合只显著增加其匍匐茎总长(图 2E),并且有增加其生物量和分枝数的趋势,但不显著(图 2D、F).而当先端分株被基质淹埋时,克隆整合显著提升了粉绿狐尾藻的所有生长指标(图 2D、E、F).此外,先端分株在基质淹埋胁迫下,匍匐茎连接处理组生物量只下降了11.2%,而切断处理组生物量下降了79.3%,表明克隆整合明显缓解了粉绿狐尾藻的生长胁迫.
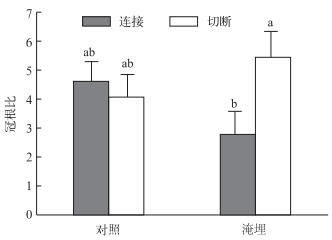
2.3 粉绿狐尾藻先端分株的生物量分配粉绿狐尾藻先端分株冠根比受基质淹埋(F1, 20 =11.68;P =0.02) 和两处理因素交互作用(F1, 20 =25.89;P < 0.001) 的显著影响.先端分株未被基质淹埋时,匍匐茎连接对粉绿狐尾藻冠根比无显著影响;而当先端分株被基质淹埋时,克隆整合显著降低了粉绿狐尾藻先端分株的冠根比(图 3).
|
图 3 匍匐茎连接或切断的粉绿狐尾藻先端分株在基质淹埋或不淹埋下的冠根比 Fig.3 Shoot/root ratio of apical ramets of Myriophyllum aquaticum, with stolon connections either connected to or severed from the basal ramets and subjected to sediment burial or not |
大量研究表明,克隆整合有助于环境胁迫下的克隆分株缓解胁迫作用对其生长的不利影响[5, 12-17].本实验中,无论匍匐茎连接与否,基质淹埋都显著降低了粉绿狐尾藻先端分株的生物量、总匍匐茎长和分枝数,表明基质淹埋对植物的生长产生了胁迫.这可能是由于基质淹埋极大地减少了先端分株的光照和溶解氧等所必需的生长资源,进而抑制其正常生长[1-3].然而,当先端分株遭受基质淹没胁迫时,匍匐茎连接处理组生长下降幅度远低于匍匐茎切断组,这表明克隆整合有利于基质淹埋环境下受胁迫分株的生长和存活,这与已有的研究结果相吻合[3, 5-7].以上结果很好地支持了我们的假设2,即克隆整合显著增强受淹埋分株的生长能力,从而提高其对基质淹埋胁迫的耐受性.与前人研究结果不同的是,本实验中所有先端分株全部存活,并无因淹埋胁迫而死亡的分株.这可能和实验处理中基质淹埋厚度较小(3 cm)以及实验前充分的生根适应性培养有关.此外,与先端分株连接的基端分株生长并未受基质淹埋胁迫的显著影响(数据未列出),表明资源输出并没有影响供体分株的生长,这与先前的一些研究结果一致[5, 7, 19, 35].其可能的原因有以下两点:1) 由于基端分株的生长条件较好,作为供体输出的富余资源对其生长影响不显著;2) 受胁迫先端分株对同化物的大量需求使之成为巨大的汇,刺激了基端分株光合效率的增强和补偿性生长[5, 19].在不损耗供体分株生长的条件下,粉绿狐尾藻的这种克隆整合策略能提升其在异质性胁迫环境下的整体表现和适合度,从而有利于其开拓各种不利生境,增强其在湖滨沿岸带的存活、生长能力和入侵性[15].
相比于切断处理的对照,长期(6周)基质淹埋胁迫下切断处理先端分株的SOD、POD和CAT酶活性都显著下降(图 2A、B、C).这与一些研究胁迫环境下植株的响应结果相类似[19, 36-37],表明长期的基质淹埋胁迫造成粉绿狐尾藻分株的活性氧清除能力减弱,产生氧化胁迫,进而抑制分株的生长(与上述生长响应趋势一致).进一步分析其原因,分株抗氧化酶活性的降低可能与H2O2的积累有关,而环境胁迫导致H2O2积累是一个较为普遍的现象,且高浓度的H2O2能直接抑制一些抗氧化酶活性[19, 38].当受基质淹埋胁迫的分株连接未受胁迫的基端分株时,其分株的抗氧化酶活性显著上升到未受基质淹埋的水平(图 2A、B、C),表明克隆整合显著提高了受淹埋胁迫分株的清除氧自由基的能力,从而有利于其细胞内活性氧浓度平衡的维持,进而促进分株的生长,缓解基质淹埋下的生长胁迫[19, 36].这一结果较好地支持了笔者的假设1.究其原因,可能在于:得益于克隆整合作用,受胁迫分株可能得到基端分株的碳同化物及其他资源的支持,与抗氧化酶的合成和有关的物质(如NAD(P)H)再生能力增强,从而导致抗氧化酶的合成再生能力提高,清除氧自由基的能力增强,进而缓解因淹埋胁迫造成的氧化胁迫,分株的生长和克隆繁殖能力得到增强[19].
克隆整合会显著影响克隆植物在异质性环境中的生物量分配,这一点在以往众多研究中得到证实[13, 15-16, 23, 39].本实验中,当先端分株遭受基质淹没胁迫时,匍匐茎连接处理的先端分株冠根比显著低于切断处理,即连接处理的分株将更多的生物量投资到地下部分,而切断处理的分株则将更多的生物量投资到地上部分,这一结果支持笔者的假设3.这可能是因为:受淹埋胁迫的切断处理分株表现得像非克隆植物一样,将更多的生物量投入到地上部分以获取更多因淹埋而极度缺乏的光照和溶解氧等资源而维持其正常生长;而受淹埋胁迫的连接处理分株则体现了克隆植物劳动分工现象,即其地下资源相对于因淹埋而造成地上资源的缺乏来说更为丰富,因而分株将更多的生物量投入到地下部分以获取更丰富的地下土壤养分等资源并与相连的分株共享,从而提高整个克隆分株系的表现[15-16, 23].因此,当粉绿狐尾藻部分分株遭受基质淹埋胁迫时,克隆整合能改变受胁迫分株的生物量分配,从而通过更有效地获取资源来提高整个克隆系的适合度.以上结果表明,克隆整合有助于提高粉绿狐尾藻在异质性胁迫环境下的资源获取能力,进而有利于提高其入侵性[15].
综上所述,在分株部分遭受基质淹埋的环境下,粉绿狐尾藻未受胁迫的分株能通过克隆整合作用给予受胁迫分株的必要资源支持,显著增强其组织的抗氧化酶活性,提升其活性氧清除能力,进而有利于分株生长;能显著提高受胁迫分株的生长和克隆繁殖能力,并且不以显著损耗基端未受胁迫的分株性能为代价,从而有助于整个克隆系的生长和适合度的提升.此外,克隆整合能改变受胁迫分株的生物量分配,使其更有效地获取相对丰富的资源,进一步提高克隆片段的适合度.以上结果支持了笔者所提出的假设,表明在异质性胁迫环境下,粉绿狐尾藻的入侵性与其克隆整合属性密切相关[15, 26].在湖滨沿岸带,因洪水的冲刷作用所带来的泥沙沉积物常常将湿地植物部分淹埋.在这种异质性环境胁迫条件下,粉绿狐尾藻的克隆分株能通过克隆整合以低成本策略(low-cost strategy)支持分株在胁迫环境的存活、生长和克隆扩散,而这种克隆属整合性可能会增强其对非克隆植物或者克隆整合能力弱的克隆植物的竞争力,进而有利于提高其入侵性[5, 15].因此,在引入外来水生植物前,植物的克隆整合属性应当作为一个重要的评价指标纳入风险评估体系中以确保引入生物的安全性[15, 40-41].
| [1] |
Lowe BJ, Watts RJ, Roberts J et al. The effect of experimental inundation and sediment deposition on the survival and growth of two herbaceous riverbank plant species. Plant Ecology, 2010, 209: 57-69. DOI:10.1007/s11258-010-9721-1 |
| [2] |
Pan Y, Xie YH, Chen XS et al. Effects of flooding and sedimentation on the growth and physiology of two emergent macrophytes from Dongting Lake wetlands. Aquatic Botany, 2012, 100: 35-40. DOI:10.1016/j.aquabot.2012.03.008 |
| [3] |
Brown JF. Effects of experimental burial on survival, growth, and resource allocation of three species of dune plants. Journal of Ecology, 1997, 85: 151-158. DOI:10.2307/2960647 |
| [4] |
van der Putten WH, van Dijk C, Peters BAM. Plant-specific soil-borne diseases contribute to succession in foredune vegetation. Nature, 1993, 362: 53-56. DOI:10.1038/362053a0 |
| [5] |
Yu F, Chen Y, Dong M. Clonal integration enhances survival and performance of Potentilla anserina, suffering from partial sand burial on Ordos plateau, China. Evolutionary Ecology, 2002, 15: 303-318. |
| [6] |
Zhang J, Maun MA. Effects of sand burial on seed germination, seedling emergence, survival, and growth of Agropyron psammophilum. Canadian Journal of Botany, 1990, 68: 304-310. DOI:10.1139/b90-041 |
| [7] |
杨慧玲, 曹志平, 朱选伟等. 克隆整合对无芒雀麦(Bromus inermis)忍受沙埋能力的影响. 生态学报, 2007, 27(5): 1723-1730. |
| [8] |
You WH, Yu D, Xie D et al. Overwintering survival and regrowth of the invasive plant Eichhornia crassipes are enhanced by experimental warming in winter. Aquatic Biology, 2013, 19: 45-53. |
| [9] |
Alpert P, Holzapfel C, Slonimski C. Differences in performance between genotypes of Fragaria chiloensis with different degrees of resource sharing. Journal of Ecology, 2003, 91: 27-35. DOI:10.1046/j.1365-2745.2003.00737.x |
| [10] |
董鸣, 于飞海, 安树青等. 植物克隆性的生态学意义. 植物生态学报, 2007, 31(4): 549-551. |
| [11] |
Dong M, Alaten B. Clonal plasticity in response to rhizome severing and heterogeneous resource supply in the rhizomatous grass Psammochloa villosa in an Inner Mongolian dune, China. Plant Ecology, 1999, 141: 53-58. DOI:10.1023/A:1009875000149 |
| [12] |
D'Hertefeldt T, vander Putten WH. Physiological integration of the clonal plant Carex arenaria and its response to soil-borne pathogens. Oikos, 1998, 81: 229-237. DOI:10.2307/3547044 |
| [13] |
Stuefer JF, Kroon HD, During HJ. Exploitation of environmental heterogeneity by spatial division of labor in a clonal plant. Functional Ecology, 1996, 10: 328-334. |
| [14] |
Xu CY, Schooler SS, van Klinken RD. Effects of clonal integration and light availability on the growth and physiology of two invasive herbs. Journal of Ecology, 2010, 98: 833-844. DOI:10.1111/j.1365-2745.2010.01668.x |
| [15] |
You WH, Yu D, Liu CH et al. Clonal integration facilitates invasiveness of the alien aquatic plant Myriophyllum aquaticum L. under heterogeneous water availability. Hydrobiologia, 2013, 718: 27-39. DOI:10.1007/s10750-013-1596-4 |
| [16] |
You WH, Yu D, Xie D et al. The invasive plant Alternanthera philoxeroides benefits from clonal integration in response to defoliation. Flora, 2014, 209: 666-673. DOI:10.1016/j.flora.2014.09.008 |
| [17] |
张想英, 樊大勇, 谢宗强等. 克隆整合有助于狗牙根抵御水淹. 植物生态学报, 2010, 34: 1075-1083. DOI:10.3773/j.issn.1005-264x.2010.09.008 |
| [18] |
Polle A. Dissecting the superoxide dismutase-ascorbate-glutathione-pathway in chloroplasts by metabolic modeling. Computer simulations as a step towards flux analysis. Plant Physiology, 2001, 126(1): 445-462. DOI:10.1104/pp.126.1.445 |
| [19] |
李兆佳, 喻杰, 樊大勇等. 克隆整合提高淹水胁迫下狗牙根根部的活性氧清除能力. 生态学报, 2011, 31(17): 4992-4999. |
| [20] |
Mack RN, Simberloff D, Lonsdale WM et al. Biotic invasions:causes, epidemiology, global consequences, and control. Ecological Applications, 2000, 10: 689-710. DOI:10.1890/1051-0761(2000)010[0689:BICEGC]2.0.CO;2 |
| [21] |
Kolar CS, Lodge DM. Progress in invasion biology:predicting invaders. Trends in Ecology & Evolution, 2001, 16: 199-204. |
| [22] |
Liu J, Dong M, Miao S et al. Invasive alien plants in China:role of clonality and geographical origin. Biological Invasions, 2006, 8: 1461-1470. DOI:10.1007/s10530-005-5838-x |
| [23] |
Wang N, Yu FH, Li PX et al. Clonal integration affects growth, photosynthetic efficiency and biomass allocation, but not the competitive ability, of the alien invasive Alternanthera philoxeroides under severe stress. Annals of Botany, 2008, 101: 671-678. DOI:10.1093/aob/mcn005 |
| [24] |
Schooler SS. Alternanthera philoxeroides(Martius) Grisebach. In:Francis RA ed. A handbook of global freshwater invasive species. London and New York:Earthscan, 2012:25-35.
|
| [25] |
Villamagna AM, Murphy BR. Ecological and socio-economic impacts of invasive water hyacinth(Eichhornia crassipes):a review. Freshwater Biology, 2010, 55: 282-298. DOI:10.1111/fwb.2010.55.issue-2 |
| [26] |
Song YB, Yu FH, Keser LH et al. United we stand, divided we fall:a meta-analysis of experiments on clonal integration and its relationship to invasiveness. Oecologia, 2013, 171: 317-327. DOI:10.1007/s00442-012-2430-9 |
| [27] |
You WH, Fan SF, Yu D et al. An invasive clonal plant benefits from clonal integration more than a co-occurring native plant in nutrient-patchy and competitive environments. PLoS ONE, 2014, 9(5): e97246. DOI:10.1371/journal.pone.0097246 |
| [28] |
王宁. 克隆整合提高了入侵植物空心莲子草对北美车前的竞争力. 生态环境学报, 2010, 19(10): 2302-2306. DOI:10.3969/j.issn.1674-5906.2010.10.007 |
| [29] |
Sytsma MD, Anderson LWJ. Biomass, nitrogen, and phosphorus allocation in parrot feather(Myriophyllum aquaticum). Journal of Aquatic Plant Management, 1993, 31: 244-248. |
| [30] |
Xie D, Yu D, You WH et al. The propagule supply, litter layers and canopy shade in the littoral community influence the establishment and growth of Myriophyllum aquaticum. Biological Invasions, 2013, 15: 113-123. DOI:10.1007/s10530-012-0272-3 |
| [31] |
Aiken SG. A conspectus of Myriophyllum(Haloragaceae) in North America. Brittonia, 1981, 33: 57-69. DOI:10.2307/2806578 |
| [32] |
Orchard AE. Myriophyllum(Haloragaceae) in Australasia. 1. New Zealand:A revision of the genus and a synopsis of the family. Brittonia, 1979, 2: 247-287. |
| [33] |
Sutton DL. Biology and ecology of Myriophyllum aquaticum.. Vancouver:Proceeding, 1st International Symposium on watermilfoil(Myriophyllum spicatum) and Related Haloragaceae Species, 1985:59-71.
|
| [34] |
李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
|
| [35] |
Xiao KY, Yu D, Xu XW et al. Benefits of clonal integration between interconnected ramets of Vallisneria spiralis in heterogeneous light environments. Aquatic Botany, 2007, 86(1): 76-82. DOI:10.1016/j.aquabot.2006.08.001 |
| [36] |
钱永强. 异质性水分胁迫下野牛草克隆分株间生理整合及其调控机理[学位论文]. 北京: 中国林业科学研究院, 2008.
|
| [37] |
胡俊靖, 陈双林, 郭子武等. 美丽箬竹水分生理整合的分株比例效应—基于叶片抗氧化系统与光合色素. 植物生态学报, 2015, 39(7): 762-772. DOI:10.17521/cjpe.2015.0073 |
| [38] |
Yordanova RY, Christov KN, Popova LP. Antioxidative enzymes in barley plants subjected to soil flooding. Environmental and Experimental Botany, 2004, 51(2): 93-101. DOI:10.1016/S0098-8472(03)00063-7 |
| [39] |
Roiloa SR, Retuerto R. Responses of the clonal Fragaria vesca to microtopographic heterogeneity under different water and light conditions. Environmental and Experimental Botany, 2007, 61: 1-9. DOI:10.1016/j.envexpbot.2007.02.006 |
| [40] |
Champion PD, Clayton JS. Border control for potential aquatic weeds. Wellington: Department of Conservation, 2000.
|
| [41] |
Gordon DR, Gantz CA, Jerde CL et al. Weed risk assessment for aquatic plants:Modification of a New Zealand system for the United States. PloS ONE, 2013, 7(7): e40031. |
 2016, Vol. 28
2016, Vol. 28 

