(2: 中国科学院藻类生物学重点实验室, 武汉 430072)
(2: Key Laboratory of Algal Biology of Chinese Academy of Sciences, Wuhan 430072, P.R.China)
铁(Fe)是地壳中丰度最高的氧化还原敏感性金属元素,约占5.1 %,对湖泊沉积物的氧化还原作用具有重要的指示意义[1].沉积物中铁氧化物具有吸附、解吸、氧化还原、催化等功能,能够直接影响各种生物地球化学反应过程[2-3],如能够有效地吸附沉积物或水体中氮和磷等营养元素[4].在湖泊沉积物中Fe(Ⅱ)和Fe(Ⅲ)可通过氧化还原反应实现相互转化. Fe(Ⅱ)和Fe(Ⅲ)之间的氧化还原作用对湖泊沉积物的地球化学研究有重要意义[3].
轮叶黑藻(Hydrilla verticillata,以下简称黑藻)是一种多年生沉水植物,因其具有生存范围广、适应性强、繁殖能力强等特点而广泛用于恢复富营养化水体的先锋物种.黑藻通过根系泌氧作用将O2由根系向外分泌到根际环境中,这样在保证植物根系生长对O2需求的同时,也维持了环境的局部氧化状态.根系泌氧不断使根际沉积物中存在的Fe(Ⅱ)被氧化,生成铁氧化物或铁氢氧化物,这些物质可以在植物的根表面沉积,这种通过连续的氧化作用使植物根表的周围紧附一层由结晶态或无定形态铁的氧化物或氢氧化物沉淀,称之为铁膜[5],其反应过程可表示为:
| $ {\rm{4F}}{{\rm{e}}^{2 + }} + {{\rm{O}}_2} + 10{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{4Fe}}{\left( {{\rm{OH}}} \right)_3} + 8{{\rm{H}}^{\rm{ + }}} $ |
有研究表明,铁膜具带正负电荷的基团和较大的表面积,可以通过吸附或共沉淀等作用,影响沉积物中其他元素的迁移转化和生物有效性,从而减少根系对有毒离子的吸收,维持植物正常生长[6-7].
微生物活性控制着湖泊沉积物中的氧化还原反应,微生物可利用有机物作为电子供体进行呼吸代谢,当O2存在时,O2是首选的电子受体[2].根系泌氧使根系周围与根际之间形成氧化还原电位差以及反相的铁氧浓度梯度,成为微氧型铁氧化菌的良好生存场所[8-11].其中,嘉利翁氏菌(Gallionella)是一种典型的微氧型铁氧化菌,属于亚硝化单胞菌目(Nitrosomonadales),能以Fe(Ⅱ)为能源进行化能自养,或利用有机碳源进行混合营养代谢.细菌铁氧化过程不仅能合成有机物,还能产生大量的无定形羟基氧化铁,为异化铁还原菌提供了理想的基质,因而有利于促进水生植物根际铁的生物地球化学循环[12-14].地杆菌(Geobacter)是厌氧环境中分布最广泛的铁还原菌,属于δ-变形菌门[15].有研究表明以铁氧化物为末端电子受体的Fe(Ⅲ)的异化还原有可能是最早的微生物代谢形式,广泛存在于土壤、沉积物等环境中[16].微生物异化Fe(Ⅲ)还原是兼性厌氧菌和严格厌氧菌将Fe(Ⅲ)作为末端电子受体的厌氧呼吸过程.在这一过程中,铁还原微生物以一些有机和无机组分作为碳源和能源[17].
微生物是湖泊沉积物铁循环的核心参与者,铁氧化菌和铁还原菌在营养元素循环及微量元素的迁移转化等方面的重要作用,使二者成为目前研究的热点.本研究选取黑藻为研究对象,研究其根系泌氧作用对沉积物中铁形态及其对根际沉积物中嘉利翁氏菌和地杆菌的影响,旨在探讨植物根系泌氧作用对沉积物中铁循环的影响.
1 材料与方法 1.1 实验材料本研究主要选取浙江省东钱湖(29°52′N, 121°34′E)沉积物为研究对象.用彼得森采泥器采集湖中心0~10 cm表层新鲜沉积物,置于便携式冰箱快速带回实验室,鲜泥直接过80目筛(避免沉积物中大颗粒物损坏电极),过筛后混匀,待其自然沉降1 d后备用,实验开始时沉积物总氮(TN)含量为2.59±0.14 mg/g,总磷(TP)含量为0.12±0.03 mg/g,有机质(OM)含量为13.41 % ±1.66 %,总铁(TFe)含量为13.46±0.44 mg/g,亚铁(Fe(Ⅱ))含量为6.74±0.17 mg/g,pH值为7.04±0.05.
实验用黑藻采自云南滇池草海,采集后立即带回实验室,用自来水冲洗数次并去除里面混杂的水草及其他藻类,然后于实验室内驯化培养,备用.
1.2 实验设计将50 ml注射器顶端截掉,用注射器自带的活塞塞住底部(图 1),加入7 cm左右厚的沉积物,静置一夜.取性状一致、长度均为5 cm的黑藻扦插于注射器内,用锡箔纸包裹注射器,保证不透光.对照组不扦插黑藻,其余同实验组,对照组和实验组各设置18个重复.放入整理箱(70 cm×50 cm×50 cm)中,小心注入自来水,使水深保持在40 cm左右.放入恒温室内培养,温度为25℃培养,12 h/12 h光照/遮光(1500 lx/0 lx).实验中每天用蒸馏水补足蒸发减少的水分,培养周期为60 d,每10 d取1次样,取样方法为对照组和实验组各随机取出3支注射器用于后续测定.

|
图 1 注射器模拟实验 Fig.1 Model of syringe experiment |
取样时,小心取出注射器,先用微电极测定植物周围2 mm处溶解氧的微观剖面,然后进行破坏性取样,并将粘附在植物根上的沉积物定义为根际沉积物[18],对照组去除表层的沉积物(1 cm)后定义为非根际沉积物,小心收集后,-20℃保存用于理化性质的测定和DNA的提取.
1.3 分析测定沉积物总铁(TFe)和亚铁(Fe(Ⅱ))用3 mol/L HCl提取16 h后,5000转/min离心5 min,上清液用2, 2-联吡啶分光光度法测定[19].为研究沉积物中铁氧化物的结晶度以及生物可利用性,采用5步连续提取的方法[11]获得沉积物中不同形态的铁.具体做法为:先用1.0 mol/L MgCl2(pH=5)提取可交换态铁,再用0.1 mol/L焦磷酸钠提取有机结晶态铁,然后用0.2 mol/L草酸/草酸铵(pH=3)提取贫结晶态铁,再用DCB溶液(含0.03 mol/L Na3C6H5O7· 2H2O, 0.125 mol/L NaHCO3和0.06 mol/L Na2S2O4)提取强结晶态铁,最后用浓硝酸提取剩余铁.所有的提取液用2, 2-联吡啶分光光度法测定其中的铁[19].
沉积物-水界面的微观剖面利用微电极进行测量(图 1).实验用穿刺型氧电极(OXY25, ϕ=25 μm, Unisense,丹麦)研究沉积物-水界面几毫米至几厘米内的变化.具体做法是:先将微电极连接在四通道主机(Unisense,丹麦)上进行极化和校正.在穿刺样品时将微电极安装在1个马达控制器(MC-232, Unisense,丹麦)上,用显微操纵器控制(MM 33, Unisense,丹麦)将电极和电脑相连.通过调节相应的参数(响应时间为3 s,步距均为500 μm)来研究沉积物-水界面剖面微尺度上的变化.实验时在黑藻根系周围2 mm以内进行穿刺(图 1).
DNA的提取按照E.Z.N.A. soil kit土壤DNA提取试剂盒(Omega,美国)的说明书进行. DNA提取后,先用1 %琼脂糖凝胶电泳检测DNA.然后对目标DNA进行普通PCR扩增,扩增条件见表 1.
| 表 1 荧光定量PCR引物和条件 Tab.1 Primers and conditions for real time qPCR |
荧光定量PCR标准品的制备是将纯化的PCR产物与pMD18-T载体(Takara,日本)连接,制备总细菌、嘉利翁氏菌和地杆菌标准品.具体方法为:将普通PCR产物通过凝胶电泳检测后用Axygen胶回收试剂盒(Axygen,美国)进行纯化,然后根据pMD18-T载体说明书进行连接反应,再将连接产物导入到大肠杆菌内(DH 5α,Takara,日本). DNA片段成功插入到pMD18-T载体中后,重组克隆体在含有AMP的琼脂培养基上将显示白色菌落.挑选单个的白色菌落用于扩大培养,同时通过普通PCR检测,检查有无目标条带;检测完成后,去除没有条带的,委托武汉天一辉远生物科技有限公司进行测序,测序完成后将所得序列与NCBI数据库比对,并通过Bankit提交至Genbank数据库,获得序列号.按Axygen质粒回收试剂盒(Axygen,美国)上的说明书进行质粒提取.利用限制性内切酶Aat Ⅱ(TaKaRa,日本)进行酶切反应.酶切后的质粒用微量分光光度计测定质粒OD260,计算质粒浓度,并以此作为荧光定量PCR的标准品.
荧光定量PCR按表 1中的引物对总细菌、嘉利翁氏菌和地杆菌进行扩增,反应体系如下:总体积为10.0 μl,其中iTaq Universal SYBR Green Supermix(Bio-Rad,美国)5 μl,引物各0.5 μl,模板DNA 0.5 μl,无菌水3.5 μl.扩增条件见表 1.用上述已插入目标基因的质粒10倍梯度稀释后用做标准曲线,为确保实验数据的有效性,实验时设置3个阴性对照和6个不同梯度的标准品,每个样品和标准品各设3个平行,以基线(背景)荧光信号标准差的10倍作为阈值,溶解曲线均为单一峰.实验时扩增效率和标准曲线相关性(r2)见表 1.
获得的总细菌序列在Genbank中的登录号为KP714253,嘉利翁氏菌基因序列在Genbank中的登录号为KP714251;地杆菌基因序列在Genbank中的登录号为KP714257.
1.4 数据处理及分析数据处理利用SPSS 19.0软件进行.利用单因素方差分析或t-检验进行显著性水平检验,显著性水平为P < 0.05.图表采用Origin 8.0作图.
2 结果 2.1 根系生长特征黑藻各项生长指标均随培养时间的增长而显著增加,其中,叶片是黑藻进行光合作用的主要场所,随着培养时间的增加,黑藻生长迅速,生物量不断增加.黑藻根系随着培养时间的延长而迅速生长,尤其表现在根系生物量的增加(表 2).
| 表 2 不同时间黑藻生长状况* Tab.2 The growth of H. verticillata in different times |
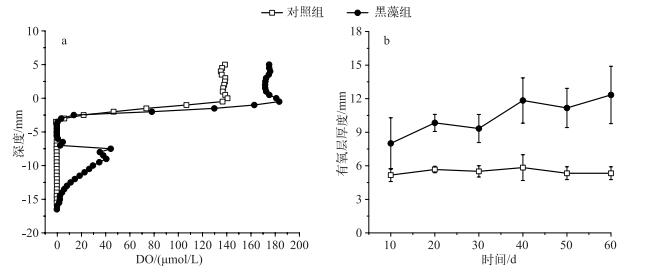
为了研究种植黑藻后对沉积物-水界面微观剖面的影响,利用微电极原位研究溶解氧(DO)浓度垂直剖面的变化,结果显示,黑藻组水体DO浓度为174 μmol/L,而对照组仅为137 μmol/L(图 2a),这说明黑藻的存在使水体DO浓度增加.当微电极进入泥水界面后,DO浓度迅速下降,至界面下3 mm左右处降为0.当微电极继续向下到7 mm左右,出现1个明显的峰值,峰值大小为40 μmol/L,峰宽为8 mm,显著大于黑藻根茎(约1 mm),这进一步说明黑藻根系泌氧的存在.
|
图 2 沉积物-水界面DO垂直剖面变化(培养40 d)(a)和有氧层厚度变化(b) Fig.2 In situ measurement of oxygen profile(cultured 40 d)(a)and oxic layer thickness (b)of the water-sediment interface |
从有氧层厚度来看,对照组有氧层厚度为5.5 mm左右(图 2b),且随时间变化不明显.种植黑藻后有氧层厚度显著增加(P < 0.05),均大于8 mm,且随培养时间呈增加的趋势,说明黑藻能使沉积物中DO浓度增加.
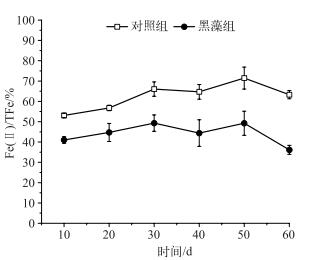
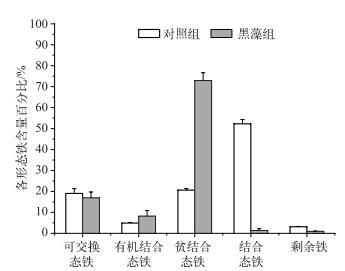
2.3 黑藻对沉积物中铁形态的影响种植黑藻后,根际沉积物中Fe(Ⅱ)含量占总铁含量的45 %左右(图 3),且显著低于对照组(62.53 % ±6.60 %).从铁的形态来看(图 4),沉积物中可交换态铁和有机结合态铁含量相对较少,不同处理组沉积物中铁主要以贫结合态铁和结合态铁的形式存在.黑藻组贫结合态铁的含量显著高于对照组,而结合态铁含量显著低于对照组,这主要是因为根系泌氧作用促进根际沉积物中Fe(Ⅱ)的氧化.实验结束时沉积物中总铁含量为13.15±0.17 mg/g,与实验开始时沉积物中总铁含量并没有显著差异,说明植物对铁的吸收作用很小,主要是铁形态发生变化.
|
图 3 沉积物中Fe(Ⅱ)占总铁含量百分比的变化 Fig.3 The percentage changes of Fe(Ⅱ) of the total Fe in sediments |
|
图 4 实验结束时沉积物中各形态铁含量百分比的变化 Fig.4 The percentage changes of different Fe fractions in sediments at the end of experiment |
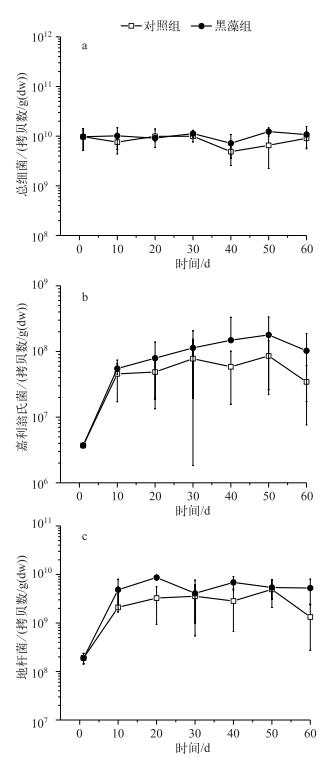
从总细菌的拷贝数来看,除第50 d外,黑藻组和对照组并无显著差异(图 5).嘉利翁氏菌的拷贝数随着培养时间呈增加的趋势,在第60 d略有下降.从数量上来看,除第40 d外,黑藻组嘉利翁氏菌拷贝数均高于对照组,从平均值来看,黑藻组嘉利翁氏菌拷贝数是对照组的1.92倍.地杆菌拷贝数在培养10 d后,随着培养时间的增加基本呈持平状态.从数量上来看,黑藻组地杆菌数均高于对照组,从平均值来看,黑藻组地杆菌拷贝数是对照组的1.94倍.
|
图 5 沉积物中总细菌、嘉利翁氏菌和地杆菌拷贝数的变化 Fig.5 Changes in gene copies of total Bacteria, Gallionella and Geobacter in different sediments |
沉积物-水界面的溶解氧浓度主要受植物根系泌氧和沉积物自身耗氧等因素的影响.本研究利用微电极技术,原位确定了根系泌氧的存在(图 2a).水生植物根系泌氧是植物在长期淹水缺氧环境中自然选择的结果,通过植物组织内部强大的通气组织来实现[22].黑藻通过叶片进行光合作用产生O2,通过茎、根等通气组织输送到植物根系,供根系呼吸.通气组织是具有巨大空间的海绵组织,它能够在植物组织内部为气体存储和交换提供一个方便的内部通道,使其传送的氧气被邻近组织细胞消耗或扩散到根尖和根际沉积物中[23],并使沉积物-水界面有氧层厚度增加(图 2b).
3.2 根系泌氧对根际铁循环的影响根系泌氧可以诱导根表铁膜的形成[24],普遍的观点认为根际Fe(Ⅱ)通过化学氧化转化为Fe(Ⅲ)而形成铁膜[1, 25],从而影响植物对养分的吸收、还原性物质的毒害作用和其它一些重金属元素的存在形态等[25].因而,植物根表铁膜的形成必须具备两个条件,一是植物根际处于局部氧化状态,二是生长介质中存在大量的Fe(Ⅱ).
O2将根际Fe(Ⅱ)氧化成Fe(Ⅲ)(图 3),由于该过程是可自发的反应[26],所以对于在此过程中是否有微生物驱动的Fe(Ⅱ)氧化存在很大争议.但是已有报道称铁氧化菌可大大加快铁的氧化反应速度,铁氧化菌存在时氧化铁的能力比纯化学作用氧化铁的能力要高出数倍[27].有研究表明在此过程中微生物的氧化占20 % ~75 %[24, 28-29],表明细菌铁氧化在根际铁循环过程中起到至关重要的作用.已有的研究表明,嘉利翁氏菌易于在高Fe(Ⅱ)(5~25 mg/L)、低O2浓度( < 50 μmol/L)和偏中性pH(6.0~7.6)条件下生存[28],这与本研究的条件相似.种植黑藻的沉积物中,随着根系的生长,植物根系生物量不断增加,O2通过根系径向泌氧扩散到根际缺氧环境中,可以为嘉利翁氏菌提供适宜的环境条件[25].从实验结果来看,根际沉积物中嘉利翁氏菌的数量虽略有增加,但是统计分析发现,根际和非根际沉积物中嘉利翁氏菌的数量并无显著差异(图 5b),这主要是因为沉积物中铁氧化菌和非生物铁氧化过程共同存在.有研究表明,铁氧化菌和非生物铁氧化过程竞争,通过微好氧或厌氧呼吸作用进行铁氧化作用,并获得微生物生长所需要的能量[27].细菌铁氧化过程不仅能合成有机物,还能产生大量的贫结合态铁(图 4),促进沉积物中铁形态的转化,并为异化铁还原菌提供理想的基质[12, 30-31],根际地杆菌数量也显著高于对照组(图 5c).因此,植物根系泌氧有利于增加铁氧化菌和铁还原菌的数量,促进沉积物中微生物铁循环[32].
沉积物中同时检测到嘉利翁氏菌和地杆菌表明Fe(Ⅱ)氧化和Fe(Ⅲ)还原是同时存在的.而根际沉积物中大量贫结合态铁氧化物表明Fe(Ⅱ)氧化速率高于Fe(Ⅲ)还原速率[31]. Weiss等[11]通过室内模拟实验发现根际铁还原速率是非根际的2倍,也说明根际铁还原的重要性.另外一个影响铁还原菌的重要因素是沉积物中有机质含量[31],这主要是由于有机质可以为异化铁还原提供电子供体[33].因而,根际沉积物中高丰度的贫结合态铁、嘉利翁氏菌和地杆菌(图 4和图 5)表明根系泌氧作用有利于促进根际微生物铁循环.
4 结论1) 黑藻的根系泌氧能使沉积物-水界面的溶解氧浓度增加,表层有氧层厚度增加.
2) 黑藻通过根系泌氧作用将根际环境中Fe(Ⅱ)氧化,并改变沉积物中铁的形态,是根际铁循环的重要参数.
3) 黑藻根系泌氧对根际耗氧微区微生物有一定的影响:根系泌氧使根际嘉利翁氏菌和地杆菌数量增加,进一步影响根际微生物铁循环.
| [1] |
Melton ED, Swanner ED, Behrens S et al. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle. Nature Reviews Microbiology, 2014, 12(12): 797-808. DOI:10.1038/nrmicro3347 |
| [2] |
Proefschrift. Cycling of iron and manganese in freshwater, estuarine and deep sea sediments[Dissertation]. Groningen: Groningen University, 2003. https://www.ncbi.nlm.nih.gov/pubmed/18754044
|
| [3] |
Weber KA, Achenbach LA, Coates JD. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490 |
| [4] |
Martins G, Terada A, Ribeiro DC et al. Structure and activity of lacustrine sediment bacteria involved in nutrient and iron cycles. FEMS Microbiology Ecology, 2011, 77(3): 666-679. DOI:10.1111/j.1574-6941.2011.01145.x |
| [5] |
Emerson D, Fleming EJ, McBeth JM. Iron-oxidizing bacteria: an environmental and genomic perspective. Annual Review of Microbiology, 2010, 64: 561-583. DOI:10.1146/annurev.micro.112408.134208 |
| [6] |
Yang J, Tam NFY, Ye Z. Root porosity, radial oxygen loss and iron plaque on roots of wetland plants in relation to zinc tolerance and accumulation. Plant and Soil, 2014, 374(1/2): 815-828. |
| [7] |
Minett DA, Cook PLM, Kessler AJ et al. Root effects on the spatial and temporal dynamics of oxygen in sand-based laboratory-scale constructed biofilters. Ecological Engineering, 2013, 58: 414-422. DOI:10.1016/j.ecoleng.2013.06.028 |
| [8] |
Emerson D. Iron-oxidizing bacteria are associated with ferric hydroxide precipitates(Fe-plaque)on the roots of wetland plants. Applied and Environmental Microbiology, 1999, 65(6): 2758-2761. |
| [9] |
Lin C, Larsen EI, Nothdurft LD et al. Neutrophilic, microaerophilic Fe(Ⅱ)-oxidizing bacteria are ubiquitous in aquatic habitats of a subtropical Australian coastal catchment. Geomicrobiology Journal, 2012, 29(1): 76-87. DOI:10.1080/01490451.2010.523446 |
| [10] |
Wang J, Vollrath S, Behrends T et al. Distribution and diversity of Gallionella-like neutrophilic iron oxidizers in a tidal freshwater marsh. Applied and Environmental Microbiology, 2011, 77(7): 2337-2344. DOI:10.1128/AEM.02448-10 |
| [11] |
Weiss JV, Emerson D, Megonigal JP. Geochemical control of microbial Fe(Ⅲ) reduction potential in wetlands: comparison of the rhizosphere to non-rhizosphere soil. FEMS Microbiology Ecology, 2004, 48(1): 89-100. DOI:10.1016/j.femsec.2003.12.014 |
| [12] |
Emerson D. Potential for iron-reduction and iron-cycling in iron oxyhydroxide-rich microbial mats at Loihi Seamount. Geomicrobiology Journal, 2009, 26(8): 639-647. DOI:10.1080/01490450903269985 |
| [13] |
Himmelheber DW, Thomas SH, Löffler F et al. Microbial colonization of an in situ sediment cap and correlation to stratified redox zones. Environmental Science & Technology, 2009, 43: 66-74. |
| [14] |
Nevin K, Lovley D. Mechanisms for Fe(Ⅲ) oxide reduction in sedimentary environment. Geomicrobiology Journal, 2002, 19(2): 141-159. DOI:10.1080/01490450252864253 |
| [15] |
Cummings DE, Snoeyenbos-West, Newby DT et al. Diversity of Geobacteraceae species inhabiting metal-polluted freshwater lake sediments ascertained by 16S rDNA analyses. Microbial Ecology, 2003, 46(2): 257-269. DOI:10.1007/s00248-005-8002-3 |
| [16] |
Lovley DR. Dissimilatory Fe(Ⅲ)-and Mn(Ⅳ)-reducing prokaryotes. Prokaryotes, 2006, 2: 635-658. |
| [17] |
Lovley DR, Holmes DE, Nevin KP. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction, in advances in microbial physiology. Academic Press, 2004, 219-286. |
| [18] |
Li Y, Wang X. Root-induced changes in radial oxygen loss, rhizosphere oxygen profile, and nitrification of two rice cultivars in Chinese red soil regions. Plant and Soil, 2013, 365: 115-126. DOI:10.1007/s11104-012-1378-1 |
| [19] |
Moss ML, Mellon MG. Colorimetric determination of iron with 2, 2-bipyridyl and with 2, 2, 2-terpyridyl. Industrial and Engineering Chemistry-Analytical Edition, 1942, 14(11): 862-865. DOI:10.1021/i560111a014 |
| [20] |
Hegler F, Lösekann Behrens T, Hanselmann K et al. Influence of seasonal and geochemical changes on the geomicrobiology of an iron carbonate mineral water spring. Applied and Environmental Microbiology, 2012, 78(20): 7185-7196. DOI:10.1128/AEM.01440-12 |
| [21] |
Wang J, Muyzer G, Bodelier PL et al. Diversity of iron oxidizers in wetland soils revealed by novel 16S rRNA primers targeting Gallionella-related bacteria. ISME Journal, 2009, 3(6): 715-725. DOI:10.1038/ismej.2009.7 |
| [22] |
Visser EJW, Colmer TD, Blom CWPM. Changes in growth, porosity, and radial oxygen loss from adventitious roots of selected mono-and dicotyledonous wetland species with contrasting types of aerenchyma. Plant Cell and Environment, 2000, 23: 1237-1245. DOI:10.1046/j.1365-3040.2000.00628.x |
| [23] |
Liu Zhikuan, Ma Qinglan, Niu Kuaikuai. Prospect on radial oxygen loss of wetland plants in the wetland. Journal of Hainan Normal University, 2010, 23(1): 84-92. [刘志宽, 马青兰, 牛快快. 湿地植物根系泌氧及其在湿地处理中的应用. 海南师范大学学报, 2010, 23(1): 84-92.] |
| [24] |
Neubauer SC, Toledo-Durán GE, Emerson D et al. Returning to their roots: iron-oxidizing bacteria enhance short-term plaque formation in the wetland-plant rhizosphere. Geomicrobiology Journal, 2007, 24(1): 65-73. DOI:10.1080/01490450601134309 |
| [25] |
Wang J. Ecology of neutrophilic iron-oxidizing bacteria in wetland soils [Dissertation]. Netherlands: Utrecht University, Science Faculty, 2011.
|
| [26] |
Sobolev D, Roden EE. Evidence for rapid microscale bacterial redox cycling of iron in circumneutral environments. Antonie van Leeuwenhoek, 2002, 81: 587-597. DOI:10.1023/A:1020569908536 |
| [27] |
Franzmann PD, Haddad CM, Hawkes RB et al. Effects of temperature on the rates of iron and sulfur oxidation by selected bioleaching Bacteria and Archaea: Application of the Ratkowsky equation. Minerals Engineering, 2005, 18(13/14): 1304-1314. |
| [28] |
Druschel GK, Emerson D, Sutka R et al. Low-oxygen and chemical kinetic constraints on the geochemical niche of neutrophilic iron(Ⅱ) oxidizing microorganisms. Geochimica et Cosmochimica Acta, 2008, 72(14): 3358-3370. DOI:10.1016/j.gca.2008.04.035 |
| [29] |
Neubauer SC, Emerson D, Megonigal JP. Life at the energetic edge: Kinetics of circumneutral iron oxidation by lithotrophic iron-oxidizing bacteria isolated from the wetland-plant rhizosphere. Applied and Environmental Microbiology, 2002, 68(8): 3988-3995. DOI:10.1128/AEM.68.8.3988-3995.2002 |
| [30] |
Thamdrup B. Bacterial manganese and iron reduction in aquatic sediments. New York: Kluwer Academic/Plenum Publishers, 2000, 41-84.
|
| [31] |
Weiss JV, Emerson D, Backer SM et al. Enumeration of Fe(Ⅱ)-oxidizing and Fe(Ⅲ)-reducing bacteria in the root zone of wetland plants: Implications for a rhizosphere iron cycle. Biogeochemistry, 2003, 64: 77-96. DOI:10.1023/A:1024953027726 |
| [32] |
Sobolev D, Roden EE. Evidence for rapid microscale bacterial redox cycling of iron in circumneutral environments. Antonie van Leeuwenhoek, 2002, 81(1/2/3/4): 587-597. |
| [33] |
Lovley DR, Phillips EJP. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Applied and Environment Microbiology, 1988, 54(6): 1472-1480. |
 2016, Vol. 28
2016, Vol. 28 

