(2: 深圳市深港产学研环保工程技术股份有限公司, 深圳 518055)
(2: Engineering Research Center of the Ministry of Education for Tropical and Subtropical Aquatic Ecological Engineering, Shenzhen 518055, P. R. China)
近年来,随着人们对农村水体污染危害认识的逐渐提高,农村诸多源头控制及过程排水的处理技术[1]等逐渐开展起来,并收到一定的治理效果.目前,农村污水处理设施普遍排放标准不高,水体中仍含有较高的氮、磷等营养盐物质,导致地表水体的富营养化.因此,需要一种近自然的深度处理技术,以进一步降低尾水营养物质,达到改善水体的要求.
沉水植物是一种根、茎、叶全部位于水层下面营固着生活的大型水生植物,是水生生态系统重要组成部分,作为水生生态系统的生产者,在生长过程中可通过直接吸收或间接作用显著降低水体中的氮、磷营养盐浓度,并释放出氧气,同时分泌化感物质抑制藻类的生长,对水体环境起到净化作用[2-3].目前,利用沉水植物净化水体氮、磷具有高效、低消耗且环境安全等优点,越来越受到该领域的广泛重视和研究[4-5].雷泽湘等[6]运用苦草等大型沉水植物围隔实验可显著降低太湖梅梁湾的湖水营养盐浓度,吴娟等[7]利用静态模拟实验研究表明,轮叶黑藻的生长能显著降低水体的氮、磷水平.国内外开展沉水植物净化水体水质实验多为静态小试或围隔实验[8-9],但自然状态下水体是不断流动.目前,对沉水植物修复动态水研究报道较少[10],尤其是对水体中沉水植物植物区和无植物区动态流动中的研究更是鲜有报道[11].
本文以尾水的氮、磷营养盐为净化对象,设计沉水植物有植物单元和无植物单元串联净化系统,了解沉水植物系统不同单元的净化效果,并探讨系统中有无植物单元串联设计对水体氮、磷营养盐去除的影响,以期为沉水植物系统净化农村水体提供参考.
1 材料与方法 1.1 实验材料实验所用的沉水植物轮叶黑藻(Hydrilla verticillata)和苦草(Vallisneria natans)均采集于广州野外采集.植物经实验条件下驯养适应15 d后,选择叶芽根茎齐全、性状统一且含15~18 cm健壮顶枝的轮叶黑藻和高度为15~20 cm的苦草幼苗进行实验,2种植物均采用扦插法栽种,栽种配置见表 1.
| 表 1 各净水单元沉水植物的生长特性 Tab.1 The growth of submerged macrophytes in units |
实验于2013年3月10日至7月10日在广州暨南大学温室内的水槽中进行.实验水槽共计2组,每组水槽面积约为3.4 m2,由6个尺寸为75 cm×75 cm×65 cm的单元构成,分为轮叶黑藻组(H1~H6) 和苦草组(V1~V6)(图 1),其中轮叶黑藻组无植物单元为H1、H3、H5,有植物单元为H2、H4、H6;苦草组相同.每组水槽通过水体在无植物单元上端进水,下端出水,在有植物单元下端进水,上端出水垂直方向呈对角的连续流动方式,使6个单元形成了无植物区和有植物区循环串联的水槽装置.
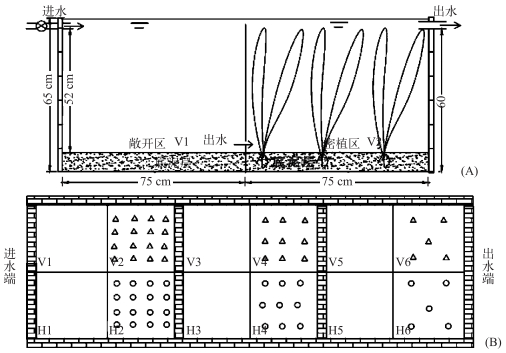
|
图 1 布水和装置设计流程图 Fig.1 Water distribution design flow chart |
实验水槽底部放置厚度为8~12 cm的土壤(采自氮、磷营养盐含量相对较低的广州火炉山山体土壤),其中土壤背景值总氮(TN)含量为0.35±0.04 g/kg,总磷(TP)含量为0.14±0.01 g/kg.实验用水参考Wienβer等[12]污水配置方法,选择适宜稀释梯度液用于模拟农村池塘污水水体TN浓度为4.5±1.4 mg/L,TP浓度为0.4±0.1 mg/L(进水氮、磷离子浓度见表 2).实验每天进水100 L,进水流量为10 L/h,每天10 h.
| 表 2 实验水槽进水与出水水质比较* Tab.2 The inflow and outflow water quality comparison experiment |
实验期间水体温度范围为20.9~28.3℃,各单元水温差异小于2℃;温室阴天和晴天光照范围为3470~98690 lx.
1.3 取样与分析方法 1.3.1 水质分析实验开始时测定水质初始值,之后每隔5 d采集进水和12个单元出水口附近水样,现场测定水温、pH值、溶解氧(DO)浓度(YSI-Plus,US),实验室测定总氮(TN)、硝态氮(NO3--N)、铵态氮(NH4+-N)、叶绿素a(Chl.a)和磷酸盐(PO43--P)浓度等指标,共采集水样24次.采样及水质分析方法参照文献[13].
1.3.2 植物测定沉水植物生长情况于实验初期和实验末期时分别测定,每次现场测定6个有植物单元内植物鲜重、株高及分蘖数.且在每个植物单元里选择3兜代表性植株用纯水冲洗干净称量鲜重,60℃烘干至恒重,计算含水率,并将植物磨碎过100目筛,测定植物体内的全氮和全磷含量[14].
1.3.3 微生物测定实验采用最大可能计数(Most Probable Number, MPN)法测定水体、底泥及植物表面硝化细菌与反硝化细菌总数.水样采集利用无菌100 ml白色广口塑料瓶在每个单元中水体中层(约水下0.3 m)处取得12个样品;底泥采集完装入盛有100 ml无菌水的三角瓶中,置于摇床上振荡30 min,制成均匀悬浊液12个样品;植物单元内取植物样鲜重(各个部位)20 g,用100 ml无菌水洗脱植物根、茎、叶表面微生物6个样品.
1.4 数据及统计分析 1.4.1 相对生长速率选用相对生长速率(RGR)比较不同植物的生长速率,公式为:
| $ RGR = (ln{{W}_2} - \ln {{W}_1})/{t} $ | (1) |
式中,W2为第2次测定的植物干重(g);W1为第1次测定的植物干重(g);t为2次测定的时间间隔(d).
1.4.2 细菌总数查MPN表,计算水样、底泥附着和植物附着微生物的细菌总数[15].底泥与植物附着微生物单位为kg-1;比较水样细菌总数时,视1 L为1 kg,单位为L-1.
1.4.3 数据处理数据处理使用Excel 2007软件,统计分析使用SPSS 17.0软件,其中P < 0.05为差异显著,P < 0.01为差异极显著,实验数据采用平均值±标准差表示.
2 实验与分析 2.1 轮叶黑藻和苦草生长特性轮叶黑藻和苦草栽种初期,生长状况良好.轮叶黑藻为枝条分蘖,分蘖数由初始1条变为6.5~12.3条,无分株现象,逐步形成一个顶冠蓬散、底部稀少(株数不变)的植物群落;苦草分蘖数由5.6~7.3条增至8.3~10.3条,分株由20~28棵增至52~69棵,平均增加株数133.1 %,形成底部覆盖较多的“草坪型”生长模块(表 1).从生长特性上看,轮叶黑藻对光照竞争压力更大,过量的顶端枝叶使植物中、下层难以透过光照,造成植物光合作用受阻,影响其生长.
实验结束时,各个单元沉水植物生物量均显著大于实验初期(P < 0.01),轮叶黑藻组H2、H4和H6单元生物量增长倍数分别为16.9、22.9和38.3倍,苦草组V2、V4和V6单元生物量增长倍数分别为3.2、8.7和7.6倍.通过对比各单元内沉水植物的相对生长速率(RGR),轮叶黑藻组H6单元生长最快(0.030 d-1),显著高于H2和H4单元(P < 0.05);苦草组V4单元生长最快(0.019 d-1),显著高于其他单元(P < 0.05),原因可能是H2、H4和V2单元植物生长的限制因子为植物过密,导致植物生长空间和光照受限,而过密的植物生物量会影响植物生长.结果显示,本实验中轮叶黑藻选择20 g/m2,苦草选择40 g/m2可作为适种密度,结合植物生长特性和相对生长速率等因素,适时收割才能保证植物持续旺盛生长.
2.2 进、出水水质特征随着实验的运行,沉水植物系统对水体中的TN、NO3--N、NH4+-N和PO43--P浓度有明显的去除效果(P < 0.01),轮叶黑藻组单元各水质参数的平均去除率分别为52.1 %、38.7 %、87.5 %和66.9 %,苦草组分别为48.9 %、45.1 %、81.3 %和62.3 %.其中2组沉水植物对水体中各参数净化效果略有不同,轮叶黑藻组对TN、NH4+-N、PO43--P的处理效果高于苦草组,对NO3--N的处理效果低于苦草组,但2组出水水质参数并无显著性差异,且2组各水质参数间表现出相似的去除趋势.
2.3 水体N、P的延程变化沉水植物系统对水体中的TN去除效果显示(图 2a),TN浓度随水流沿程方向呈逐级降低的趋势.统计分析发现,轮叶黑藻组有植物单元TN的平均净化效率为14.8 %,苦草组为12.3 %,而2组无植物单元平均净化效率不到3.7 %,有植物单元处理水体TN效率极显著高于无植物单元(P < 0.01),但轮叶黑藻组和苦草组之间并无显著差异(P>0.05).
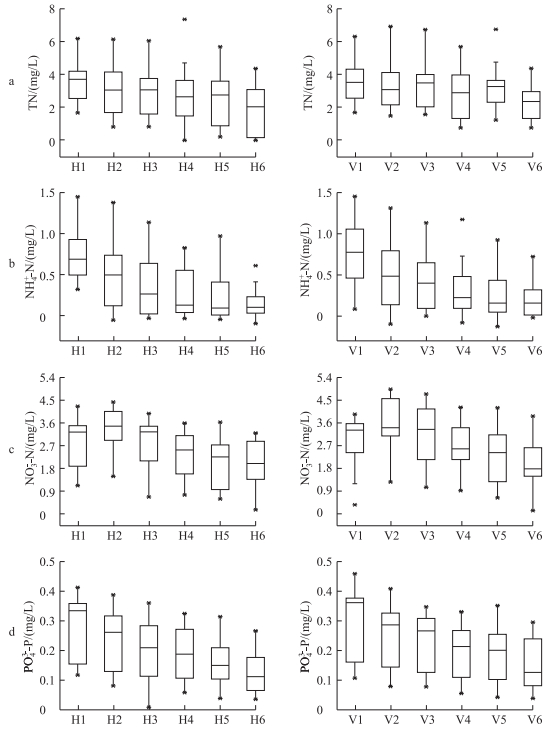
|
图 2 轮叶黑藻组和苦草组各净水单元氮、磷浓度变化 Fig.2 Changes of water quality in water purification unit of Hydrilla verticillata and Vallisneria natans |
沉水植物系统对水体中的NH4+-N去除效果显示(图 2b),随水流沿程方向NH4+-N浓度先迅速降低,后稳定在0~0.5 mg/L较低的波动范围内.轮叶黑藻组有植物单元NH4+-N平均去除率为27.4 %,无植物单元平均去除率为31.4 %;苦草组有植物单元NH4+-N平均去除率为26.3 %,无植物单元为38.7 %.统计分析可知,2组实验中NH4+-N去除效率在无植物单元显著高于有植物单元(P < 0.05).
实验期间,沉水植物系统NO3--N浓度随着水流沿程方向呈现先升高后逐渐降低的趋势(图 2c).这可能是因为在前几个单元内水体中硝化作用的增量高于被沉水植物直接吸收利用及反硝化过程去除量而引起的NO3--N积累,当单元内NH4+-N浓度降低之后,NO3--N浓度开始呈现降低的趋势.轮叶黑藻组有植物单元NO3--N浓度平均去除率为12.1 %,无植物单元平均去除率为2.4 %;苦草组有植物单元NO3--N平均去除率为14.8 %,无植物单元为1.3 %.统计分析可知,NO3--N去除效率在有植物单元内极显著高于无植物单元(P < 0.01).
沉水植物系统对水体中的PO43--P去除效果显示(图 2d),随水流沿程方向NH4+-N浓度呈现逐级降低的趋势.统计分析发现,当污水流经实验有植物单元内PO43--P轮叶黑藻组平均去除率为13.3 %,苦草组平均去除率为15.7 %,而在无植物单元PO43--P平均去除率只有8 %左右,极显著小于有植物单元(P < 0.01).
2.4 水体DO和pH值的空间变化实验初期2组沉水植物单元水体DO浓度均较低,随着实验的进行,DO浓度逐渐升高.整个实验期间,轮叶黑藻组水体DO浓度变化范围分别为1.4~8.9 mg/L,苦草组为0.6~12.6 mg/L.其中轮叶黑藻组有植物单元和无植物单元DO浓度平均值分别为5.5和6.8 mg/L,苦草组分别为5.1和7.4 mg/L.统计发现,沉水植物有植物单元DO浓度显著小于无植物单元(P < 0.05).实验前期各单元水槽中水体pH值无明显变化,均在6.5~7.5之间,到实验中后期,pH值逐渐升高(图 3).
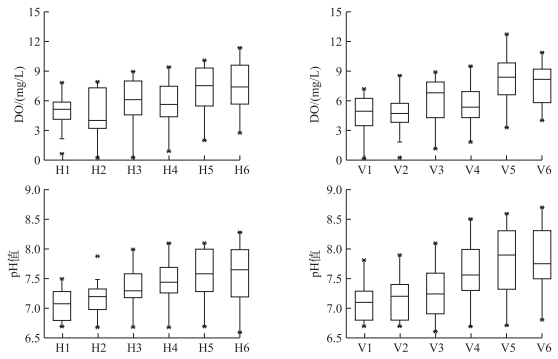
|
图 3 轮叶黑藻组和苦草组各净水单元pH值和DO浓度变化 Fig.3 Changes of pH and DO concentrations in water purification unit of Hydrilla verticillata and Vallisneria natans |
对比2组实验组的水体和底泥微生物含量分析,底泥表面硝化细菌和反硝化细菌总数均显著高于水体(P < 0.01)(表 3),表明底泥表面为微生物生长提供了必要的营养与能量,是系统硝化与反硝化作用的主要位点.轮叶黑藻组和苦草组底泥表面的硝化细菌和反硝化细菌总数无显著差异(P>0.05).
| 表 3 轮叶黑藻组和苦草组有无植物单元硝化与反硝化细菌总数lg[n(MPN)]的差异性分析* Tab.3 The nitrification and denitrification bacteria lg[n(MPN)] in plant and open cells of Hydrilla verticillata and Vallisneria natans |
对比2组实验组有无植物单元微生物含量分析,植物单元与无植物单元水体硝化细菌与反硝化细菌总数无显著差异(P>0.05),硝化细菌总数在无植物单元略大于植物单元.而底泥中植物单元硝化细菌总数显著小于无植物区域(P < 0.03),反硝化细菌总数植物单元显著小于无植物单元(P < 0.02).结果表明,在无植物单元水体和底泥发生硝化作用较为显著,而在有植物单元内底泥发生反硝化作用较为显著,水体中的反硝化强度也有所增强.
生物降解是系统中N去除的重要途径,硝化细菌是以NH4+-N为降解底物的微生物,NH4+-N在硝化细菌的作用下转变为NO3--N,而NO3--N在反硝化细菌的作用下转变为NO2--N,最后变为N2或NO2从水体中去除[16].硝化细菌总数与TN浓度(P < 0.016) 和NH4+-N浓度(P < 0.021) 均存在显著正相关,与NO3--N浓度无显著相关性(P < 0.067);而反硝化细菌与TN浓度(P < 0.001) 和NO3--N浓度(P < 0.001) 均存在极显著正相关,与NH4+-N浓度存在极显著负相关(P < 0.002).结果表明,N的去除与微生物反硝化作用存在显著相关性,无植物区硝化作用与有植物区的反硝化作用,对系统中N的彻底去除提供良好条件,也在一定程度上验证有植物单元和无植物单元串联设计的优越性.
3 讨论通过6个月的连续监测数据,分析实验水槽中DO浓度、pH值、叶绿素a浓度、植物生物量、植物面积与水质氮、磷去除负荷的关系,对找出水体营养盐去除机制,评价沉水植物在池塘水体中的生态修复作用及其与无植物区域串联之间的关系非常重要.
沉水植物生物量与水体中的TN、NO3--N、NH4+-N、PO43--P去除负荷均存在显著正相关(P < 0.05),表明水体中营养盐浓度的降低与沉水植物的吸收存在直接关系(表 4),植物在生长过程中,可通过根系和茎叶直接吸收水体中的氮、磷营养盐合成植物蛋白所需的有机氮和有机磷[17].本实验条件下,轮叶黑藻组生物量显著高于苦草组,表明轮叶黑藻体内能富集更多的TN、PO43--P,也许是导致轮叶黑藻组出水效率高于苦草的一个重要原因[18].另一方面,植物在生长过程中可以通过光合作用和呼吸作用影响水体环境,从而调节了原有的环境因子(DO、pH值等),且水体中氮、磷去除受到水环境条件的影响[19].水体中氮的去除机制主要有3个方面,即硝化与反硝化、沉降吸附和生物吸收作用,其中硝化和反硝化作用最重要[20].硝化细菌将NH4+-N在有氧环境下转化为NO3--N,反硝化细菌在缺氧环境下,利用有机碳源为电子供体,NO3--N为电子接受者而还原成NO、NO2及N2排出. DO浓度与TN、NO3--N、PO43--P去除负荷呈现负相关、与NH4+-N去除负荷呈正相关(表 4),表明当污水从上端位孔流经无植物区域时较高的DO和NH4+浓度增加了水体的硝化强度,这可能是实验水槽NH4+迅速减少的主要原因[21],而下端孔流经有植物区域内,充足的NO3-和相对缺氧的环境提供反硝化的条件,从而增大水体中TN、NO3--N的去除.
| 表 4 沉水植物各环境影响因子之间的相关性 Tab.4 Correlations between environmental impact factors of submerged plants |
轮叶黑藻组和苦草组植物分别设置高、中、低3个栽种覆盖度,结果显示,除H2、H4区域沉水植物在生长过程中因空间受限存在轻微的发黄以外,其他均迅速生长且很快高于原来设置的最大密度,从DO、pH值和微生物含量看出,植物存在营造出有别于无植物单元的降解N、P过程环境.沉水植物栽种面积是一个可以调控改变水体中N、P浓度去除的影响因素[22].分析沉水植物面积与水质参数的相关性可知,其与TN、NO3--N、PO43--P浓度呈显著正相关,与NH4+-N浓度呈负相关.表明沉水植物生物量在一定范围内,沉水植物面积的持续增加虽然可以显著降低水体中的NO3--N、PO43--P浓度,但对NH4+-N的去除不明显,这对于处理高NH4+-N浓度的农村生活废水不太适宜,且水体大面积的水生植物收割不合理很容易使得植物残体淤积于池底,造成更多的污染物质甚至造成生物累积而引发毒害等问题[23].本实验地处华南热带亚热带地区广州,温度较高,植物生长迅速,实验中植物盖度为25 %的水槽生长情况和处理能力均比较理想,与Reed[25]建议水生植物占水体全部面积的25 %~35 %基本一致.
4 结论1) 2种沉水植物在本实验污水浓度和植物密度下,均可旺盛生长,通过收割轮叶黑藻可带走水体中的氮为1.6~3.3 g/m2,磷为0.27~0.57 g/m2; 苦草带走的氮为0.3~0.5 g/m2,磷为0.08~0.12 g/m2.轮叶黑藻和苦草适种植密度分别为20和40 g/m2.
2) 轮叶黑藻组TN、NO3--N、NH4+-N和PO43--P平均去除率分别达到52.1 %、38.7 %、87.5 %和66.9 %,苦草组平均去除率分别为48.9 %、45.1 %、81.3 %和62.3 %.
3) 有植物单元对NO3--N的去除率高于无植物单元,对NH4+-N去除率低于无植物区,表明适当的无植物水域可促进NH4+-N的硝化作用,且有无植物单元串联更有利于水体中氮的去除.
| [1] |
Sun Qingye, Ma Xiuling, Yang Guide et al. Studies on nitrogen, phosphorus and organic matter in ponds around Chaohu Lake. Environmental Science, 2010, 31(7): 110-1515. [孙庆业, 马秀玲, 阳贵德等. 巢湖周围池塘氮、磷和有机质研究. 环境科学, 2010, 31(7): 1510-1515. DOI:10.13227/j.hjkx.2010.07.015] |
| [2] |
Hough RA, Fornwall MD, Negele BJ et al. Plant community dynamics in a chain of lakes-principal factors in the decline of rooted macrophytes with eutrophication. Hydrobiologia, 1989, 173(3): 199-217. DOI:10.1007/BF00008968 |
| [3] |
Gao Yunni, Liu Biyun, Wang Jing et al. Allelopathic effects of phenolic compounds released by Vallisneria spiralis on Microcystis aeruginosa. J Lake Sci, 2011, 23(5): 761-766. [高云霓, 刘碧云, 王静等. 苦草(Vallisneria spiralis)释放的酚酸类物质对铜绿微囊藻(Microcystis aeruginosa)的化感作用. 湖泊科学, 2011, 23(5): 761-766. DOI:10.18307/2011.0514] |
| [4] |
Melzer A. Aquatic macrophytes as tools for lake management. Hydrobiologia, 1999, 395/396: 181-190. DOI:10.1023/A:1017001703033 |
| [5] |
Wang Liqing, Li Yan, Zhang Ruilei. The purification of Lake Dianshan water quality with six species of submerged macrophyte systems. Journal of Agro-Environment Science, 2008, 27(3): 1134-1139. [王丽卿, 李燕, 张瑞雷. 6种沉水植物系统对淀山湖水质净化效果的研究. 农业环境科学学报, 2008, 27(3): 1134-1139.] |
| [6] |
Lei Zexiang, Xie YF, Liu ZW et al. Study on the purification of eutrophicated water with aquatic macrophytes. Journal of Anhui Agricultural Sciences, 2006, 34(3): 553-554. [雷泽湘, 谢贻发, 刘正文等. 大型水生植物对富营养化湖水净化效果的试验研究. 安徽农业科学, 2006, 34(3): 553-554.] |
| [7] |
Wu Juan, Wu Zhenbin, Cheng Shuiping. Effect of Hydrilla verticillata on characteristics of water and sediment and removals of nutrition. Acta Hydrobiologica Sinica, 2009, 33(4): 589-595. [吴娟, 吴振斌, 成水平. 轮叶黑藻对水体和沉积物理化性质的改善和营养元素的去除作用. 水生生物学报, 2009, 33(4): 589-595. DOI:10.3724/SP.J0000.2009.40589] |
| [8] |
Jukka H, Leena N. Effects of submerged macrophytes on sediment resuspension and internal phosphorus loading in Lake Hiidenvesi(southern Finland). Water Research, 2003, 37: 4468-4474. DOI:10.1016/S0043-1354(03)00405-6 |
| [9] |
Wu Zhenbin, Qiu Dongru, He Feng et al. Effects of rehabilitation of submerged macrophytes on nutrient level of a eutrophic lake. Chinese Jouranl of Applied Ecology, 2003, 14(8): 1351-1353. [吴振斌, 邱东茹, 贺锋等. 沉水植物重建对富营养水体氮磷营养水平的影响. 应用生态学报, 2003, 14(8): 1351-1353. DOI:10.13287/j.1001-9332.2003.0301] |
| [10] |
Wang Weihong, Ji Min. The restoration of submerged macrophytes for improving water quality in a reclaimed wastewater river in Tianjin Binhai new area, China. Journal of Agro-Environment Science, 2007, 26(6): 2292-2298. [王卫红, 季民. 滨海再生水河道中沉水植物的恢复对水质的改善. 农业环境科学学报, 2007, 26(6): 2292-2298.] |
| [11] |
Qin Boqiang. Principles and approach for lake ecological restoration. Acta Ecologica Sinica, 2007, 27(11): 4848-4858. [秦伯强. 湖泊生态恢复的基本原理与实现. 生态学报, 2007, 27(11): 4848-4858. DOI:10.3321/j.issn:1000-0933.2007.11.055] |
| [12] |
Wienβer A, Kappelmeyer U, Kuschk P et al. Influence of the redox condition dynamics on the removal efficiency of a laboratory-scale constructed wetland. Water Research, 2005, 39: 248-256. DOI:10.1016/j.watres.2004.08.032 |
| [13] |
State Environmental Protection Administration ed. Water and wastewater monitoring and analysis methods. 4th edition. Beijing: China Environmental Science Press, 2002, 88-285. [国家环境保护总局. 水和废水监测分析方法. 第4版. 北京: 中国环境科学出版社, 2002, 88-285.]
|
| [14] |
Wu Jianzhi, Ge Ying, Wang Xiaoyue. UV absorptio photo metric determin ation of total nitrogen in plant after K2S2O8 oxidation. Physical Testing:Chemical Analysis, 2000, 36(4): 166-167. [吴建之, 葛滢, 王晓月. 过硫酸钾氧化吸光光度法测定植物总氮. 理化检验:化学分册, 2000, 36(4): 166-167.] |
| [15] |
Xu Guanghui, Zheng Hongyuan eds. Agricultural microbiology experimental technology. Beijing: Beijing Agriculture Press, 1986. [徐光辉, 郑洪元. 农业微生物学实验技术. 北京: 农业出版社, 1986.]
|
| [16] |
Sundberg C, Tonderski K, Lindgren PE. Potential nitrification and denitrification and the corresponding composition of the bacterial communities in a compact constructed wetland treating landfill leachates. Water Science and Technology, 2007, 56: 159-166. |
| [17] |
Peterson SB, Teal JM. The role of plants in ecologically engineered wastewater treatment systems. Ecological Engineering, 1996, 6(2): 137-148. |
| [18] |
Xie Yifa, Hu Yaohui, Liu Zhengwen et al. Effects of sediment resuspension on the growth of submerged plants. Acta Scientiae Circumstantiae, 2007, 27(1): 18-22. [谢贻发, 胡耀辉, 刘正文等. 沉积物再悬浮对沉水植物生长的影响研究. 环境科学学报, 2007, 27(1): 18-22.] |
| [19] |
Hu Lian, Wang Chengyan, Shen Zhenfeng. In situ enclosure experiment for purification ability of the submerged plants in Yunlonghu Reservoir. Journal of Hydroecology, 2008, 29(2): 17-21. [胡莲, 万成炎, 沈振锋. 云龙湖水库沉水植物净化水质的原位围隔试验. 水生态学杂志, 2008, 29(2): 17-21. DOI:10.15928/j.1674-3075.2008.06.003] |
| [20] |
Saunders DL, Kalff J. Nitrogen retention in wetlands, lakes and rivers. Hydrobiologia, 2001, 443: 205-212. DOI:10.1023/A:1017506914063 |
| [21] |
Peder GE, Weisner SEB. An experimental study on effects of submersed macrophytes on nitrification and denitrification in ammonium-rich aquatic system. Limnology and Oceanography, 1999, 44(8): 1993-1999. DOI:10.4319/lo.1999.44.8.1993 |
| [22] |
Dai YR, Jia CR, Liang W et al. Effects of the submerged macrophyte Ceratophyllum demersum L. on restoration of a eutrophic waterbody and its optimal coverage. Ecological Engineering, 2012, 40: 113-116. DOI:10.1016/j.ecoleng.2011.12.023 |
| [23] |
Zhu Qingshun. On the dynamics of the aquatic vegetation in Changdang Hu Lake with reference to fishery effect. Journal of Fisheries of China, 1988, 13(1): 24-35. [朱清顺. 长荡湖水生植被动态及其渔业效应. 水产学报, 1988, 13(1): 24-35.] |
| [24] |
Chen Qichun, Li Zhengkui, Wang Yichao et al. Applied study of the submerged macrophytes bed-immobilized bacteria in drinking water restoration. Environmental Science, 2012, 33(1): 83-87. [陈祈春, 李正魁, 王易超等. 沉水植物床-固定化微生物技术在水源地修复中的应用研究. 环境科学, 2012, 33(1): 83-87. DOI:10.13227/j.hjkx.2012.01.027] |
| [25] |
Reed SC, Brown D. Subsurface flow wetlands:A performance evaluation. Water Environment Research, 1995, 67: 244-248. DOI:10.2175/106143095X131420 |
 2016, Vol. 28
2016, Vol. 28 


