磷是生物生长所必需的大量元素之一,多数淡水水体中的藻类生长主要受磷的限制[1-2],水体中磷浓度的变化对浮游植物总量和群落结构有重要的影响[3-4].当水体中溶解性磷浓度低于0.01 mg/L时,部分浮游植物种类生长受到限制,浓度越低受到限制的种类越多[5],因此对水体中磷的监测是浮游植物群落生态、水质管理和水生态学研究的基础内容.目前对磷的测定方法有很多,包括分光光度法、原子光谱法和色谱法等[6],其中钼酸铵分光光度法是测定水体中磷浓度最常见的方法,该方法因其操作简单、准确性高而被广泛应用[7],其原理是在中性条件下,用过硫酸钾消解水样,将其中所含的多种含磷化合物全部氧化成正磷酸盐,在酸性条件下正磷酸盐和钼酸铵、酒石酸锑钾反应形成磷钼杂多酸后,立即被抗坏血酸还原生成蓝色的络合物,可用比色法测定这种蓝色络合物的浓度[8].钼酸铵分光光度法(GB 11893-1989)的检测下限为0.01 mg/L[9],但在水体中,尤其是在我国南亚热带地区淡水水体中,部分水体的总磷以及多数水体的溶解态磷浓度均低于0.01 mg/L[10-12].鉴于目前大多数监测部门或研究机构多采用该方法检测水体中的磷浓度,因此,明确该方法在监测低磷浓度水体可能出现的问题很有必要,同时迫切需要对该方法进行合理有效的改进,提高对低磷浓度( < 0.01 mg/L)水体检测的灵敏度和准确性.
从钼酸铵分光光度法的原理上分析,可以从3个方面进行改进:①改变显色剂的配制方法[13],减少显色剂干扰;②改变测定波长,提高灵敏度;③增加水样体积,消解后不对水样进行稀释定容,而是按消解前体积定容.通过对标准试样和野外水样的测定,分析比较方法改进前后的灵敏度和准确性,得到更适合检测淡水水体尤其是南亚热带地区低磷浓度水体中磷的测定方法.
1 材料与方法 1.1 仪器和设备自动蒸汽灭菌锅(D-1型)用于总磷的氧化消解;分光光度计(Hitachi U-3900)用于测定吸光度. 50、100 ml磨口比色管和3 cm比色皿.
1.2 实验试剂实验过程中试剂用水为超纯水.使用的化学药品包括:抗坏血酸、钼酸铵、酒石酸锑钾和过硫酸钾,均为分析纯;硫酸为优级纯.
实验试剂的配置:1)抗坏血酸溶液(10%):将10 g抗坏血酸溶于水并稀释至100 ml;2)抗坏血酸溶液(0.1 mol/L):将1.76 g抗坏血酸溶于水并稀释至100 ml;3)钼酸盐溶液:溶解13 g钼酸铵于100 ml蒸馏水中,溶解0.35 g酒石酸锑钾于100 ml蒸馏水中,在不断搅拌下把钼酸铵溶液徐徐加到300 ml硫酸(1:1)中,加酒石酸锑钾溶液并且混合均匀;4)酒石酸锑钾溶液:将0.2743 g酒石酸锑钾溶于水并稀释至100 ml;5)钼酸铵溶液(4%):将4 g钼酸铵溶于水并稀释至100 ml;6)硫酸(14%):将14 ml浓硫酸稀释至100 ml;7)新显色剂:将50 ml硫酸溶液(14%)、5 ml酒石酸锑钾溶液、15 ml钼酸铵溶液(4%)和30 ml抗坏血酸溶液(0.1 mol/L)混合而成,现用现配;8)过硫酸钾溶液(5%):将5 g过硫酸钾溶于水并稀释至100 ml;9)磷标准溶液:浓度为500 mg/L,由水利部水环境监测评价研究中心提供.
1.3 实验方法1) 全波段扫描.准确移取不同体积的磷标准溶液于一系列比色管中,分别加入国标显色剂和新显色剂后放置15 min使其形成稳定的磷钼蓝络合物,于波长450~1000 nm间进行扫描,寻找磷钼蓝的最大吸收峰.
2) 根据显色剂和测定波长的区别设置交叉实验,得到以下4种比色法. a:依次向50 ml水样中加入1 ml抗坏血酸溶液(10%)和2 ml钼酸盐溶液,上下倒转摇匀,放置15 min后于波长700 nm处用3 cm比色皿测定吸光度,即国标法;b:向50 ml水样中加入4 ml新显色剂,上下倒转摇匀,放置15 min后于波长880 nm处用3 cm比色皿测定吸光度;c:依次向50 ml水样中加入1 ml抗坏血酸溶液(10%)和2 ml钼酸盐溶液,上下倒转摇匀,放置15 min后于波长880 nm处用3 cm比色皿测定吸光度;d:向50 ml水样中加入4 ml新显色剂,上下倒转摇匀,放置15 min后于波长700 nm处用3 cm比色皿测定吸光度.
对比在4种比色法下溶解态磷浓度的测定结果,筛选最佳比色法,测定水样中的总磷浓度.
3) 根据消解方式的不同,以及上述筛选出的最佳比色法,设置2种总磷测定流程与方法.
M1:水样的消解处理参考国标法(GB 11893-1989),即准确移取水样25 ml于50 ml比色管中,向水样中加入4 ml过硫酸钾溶液进行消解后,定容至50 ml标线,以下操作同上述的最佳比色法.
M2:增加消解水样体积,即准确移取水样50 ml于100 ml比色管中,向水样中加入8 ml过硫酸钾溶液进行消解后,定容至58 ml,再从经消解过的水样中另取出25 ml,加入2 ml新显色剂,以下操作同上述的最佳比色法.
4) 标准曲线的绘制.参照南亚热带湖库的实际磷浓度范围[12],准确移取不同体积的磷标准溶液于一系列比色管中,以下操作同上述2)和3),以磷浓度对其吸光度分别绘制溶解态磷和总磷标准曲线.
5) 加标回收实验.设置3个梯度的低浓度磷标准试样:0.0030±0.00016、0.0053±0.00027和0.0083±0.00042 mg/L,分别用上述4种比色法及M1、M2法测定样品中的磷浓度,每个样品做6个平行.
6) 水样总磷浓度的测定.采集3份来自贫营养水库的水样,另通过稀释得到2份更低浓度的水样,以超纯水代替水样作空白,分别采用M1、M2法测定总磷浓度,每个样品做6个平行.
7) 数据分析.结果以平均值表示,每组所得数据用ANOVA进行分析,统计软件为SPSS 18.0,作图软件为Origin 8.0.
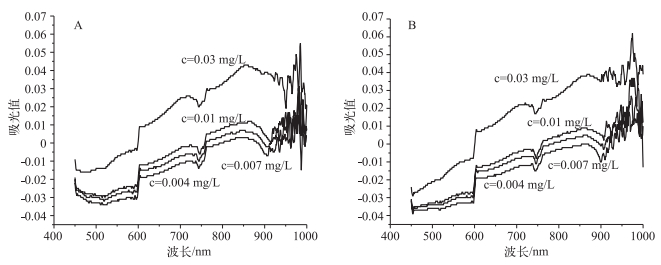
2 结果与讨论 2.1 吸收波长和显色剂对磷测定的影响对磷钼蓝络合物进行全波段(450~1000 nm)扫描(图 1),结果表明磷钼蓝有2个吸收峰,分别为720 nm和880 nm波长位置,880 nm处的吸收峰要显著高于720 nm处.国标法中磷的测定波长为700 nm,考虑到我国水质总磷浓度的测定标准是在1989年制定并开始实施的,当时我国使用具有此波段范围分光光度计的实验室不是很多,如采用880 nm作为测定标准在国内难以推广,因此选择700 nm测定波长的实用性更强[14].近20年来,随着技术的发展,分光光度计的稳定性和精确性更高,分光光度计已能准确测定880 nm处的吸光值.在这种情况下,选择880 nm作为磷的测定波长更具优势,尤其是对低磷浓度水体的磷测定,其灵敏度要比使用700 nm作为测定波长更高.
|
图 1 磷钼蓝全波段扫描图:A)添加国标显色剂;B)添加新显色剂 Fig.1 Consecutive wavelength scanning of phosphorus molybdenum blue: A)adding standard chromogenic agent; B)adding new chromogenic agent |
对比相同磷浓度下添加2种显色剂试样的吸光值(图 1),结果表明国标显色剂的吸光值要高于新显色剂.添加国标显色剂的样品中钼酸铵浓度为0.98 g/L,抗坏血酸浓度为1.89 g/L;添加新显色剂的样品中钼酸铵浓度为0.44 g/L,抗坏血酸浓度为0.39 g/L.在磷浓度测定中钼酸铵和抗坏血酸是显色剂的主要成分,这两者在配制和添加过程中会产生一定的色度,已有文献表明过多的钼酸根会形成其他不参与显色反应的钼盐从而影响测定结果[15].当样品中磷浓度较少时显色不明显[16],显色剂本身的颜色会对测定造成一定干扰.新显色剂中各组分的浓度均低于国标显色剂,因此对吸光值的干扰要小于国标法.
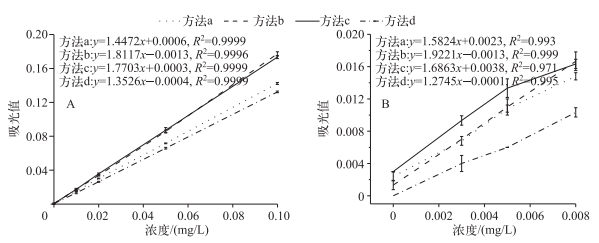
2.2 4种方法对溶解态磷测定的差异 2.2.1 4种方法标准曲线的比较对比4种方法在高磷浓度(>0.01 mg/L)下的标准曲线(图 2A),4种方法的R2值均可达到0.999以上,浓度和吸光值之间线性关系非常好,均适用于高磷浓度水样的测定.绘制4种方法在低磷浓度( < 0.01 mg/L)下的标准曲线(图 2B),结果表明方法b的R2值为0.999,其线性关系相比于其他3种方法更好.
|
图 2 4种方法的标准曲线和回归方程:A)高磷浓度;B)低磷浓度 Fig.2 The standard curve and regression equation of four methods: A)high phosphorus concentration; B)low phosphorus concentration |
方法b、c所得标准曲线的斜率比方法a、d所得标准曲线的斜率明显更大(图 2),表明b、c灵敏度更高,方法的灵敏度和检出限有关,灵敏度越高,检出限越低[17],因此方法b、c的检出限要低于方法a、d.方法b、c测定波长为880 nm,方法a、d的测定波长为700 nm,根据全波段扫描的结果,880 nm波长的峰值要高于700 nm的峰值,因此方法b、c灵敏度的提高是由于880 nm处吸收值更高导致的.相对于700 nm,880 nm作为测定波长时吸光值更高,对不同浓度的区分更灵敏,更适用于对低磷浓度水样的测定.
比较4种方法对空白样品的测定(图 2B),方法a、c测定的吸光值明显大于方法b、d.空白值越大,将导致最小分析信号升高[18],而随着被测组分浓度的下降,空白值对测定结果准确性的影响也越来越大[19].方法a、c添加的是国标显色剂,方法b、d添加的是新显色剂,这与全波段扫描所得结果一致,可见新显色剂可以减少对低磷浓度样品测定时的干扰,更适用于对低磷浓度水样的测定.
综合以上分析,方法b的灵敏度更高和空白值更小,相对其他3种方法,更适用于对低磷浓度水样的测定.
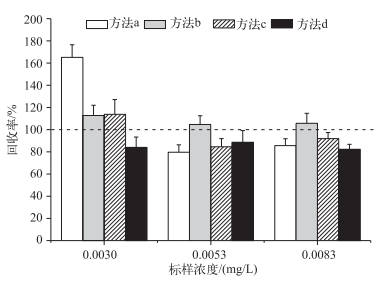
2.2.2 4种方法对低浓度溶解态磷标样测定结果的比较加标回收实验是化学分析中重要的质控手段,回收率是判定结果准确度的量化指标[20].实验结果表明(图 3),方法b的回收率与其它3种方法差异极显著(F=17.86,P < 0.01),且平均值最趋近于100%,故相对于其他3种方法,方法b具有较高的准确性,更适用于对低磷浓度水样的测定.
|
图 3 4种比色法测定低磷浓度标样的回收率 Fig.3 The recovery ratio of low phosphorus concentration standard sample determined by four methods |
加标回收结果表明,方法b能够准确测定0.003 mg/L以上的浓度,因此本实验确定方法b的最低检测限可达到0.003 mg/L.鉴于0.01 mg/L只对于部分浮游植物是磷限制性磷浓度,而0.003 mg/L对于绝大多数浮游植物是磷限制性磷浓度[5],因此溶解态磷的检测下限扩展到0.003 mg/L,对于浮游植物群落生态学的研究有重要意义.
在夏季,广东省多数大型水库出现稳定水体分层,上层水体的溶解态磷浓度远低于0.01 mg/L,例如流溪河水库、新丰江水库、高州水库夏季的溶解态磷浓度均在0.005 mg/L以下[21],在这种情况下,使用方法b进行磷浓度测定更好.
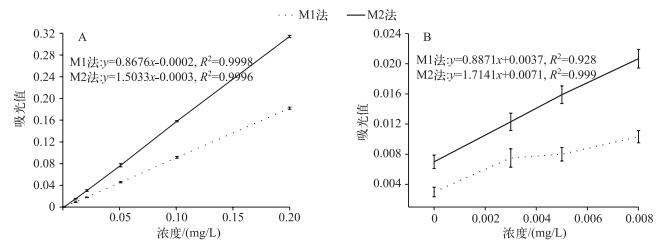
2.3 M1、M2法对总磷浓度测定的差异 2.3.1 M1、M2法标准曲线的比较对比M1、M2法在高磷浓度(>0.01 mg/L)下的标准曲线(图 4A),其R2值均可达到0.999以上,适用于高磷浓度水样的测定.比较M1、M2法在低磷浓度( < 0.01 mg/L)下的标准曲线(图 4B),M2法的R2值为0.999,浓度和吸光值之间线性关系较好;M1法的R2值为0.928,其线性关系较差.
|
图 4 总磷标准曲线和回归方程:A)高磷浓度;B)低磷浓度 Fig.4 The standard curve and regression equation of total phosphorus: A)high phosphorus concentration; B)low phosphorus concentration |
M1法消解后需对水样进行二次稀释定容,即将25 ml水样定容到50 ml后再进行比色分析,而M2法消解后不对水样进行稀释定容,而是按消解前体积定容后比色,因此M1法的检测下限相对M2法要高.按照方法b的检测下限,M2法的检测下限仍然为0.003 mg/L,但M1法的检测下限提高到0.006 mg/L,对低于该限值的水样,将无法保证结果的准确性.实验结果也表明,M1法在浓度为0.003和0.005 mg/L处吸光值无明显差异.
2.3.2 M1、M2法对低浓度总磷标样和野外水样测定结果的比较低浓度总磷标样的加标回收实验结果表明(图 5A),相对于M1法,M2法测定的回收率变化较小,且更趋近于100%,因此M2法的准确性和稳定性更高.
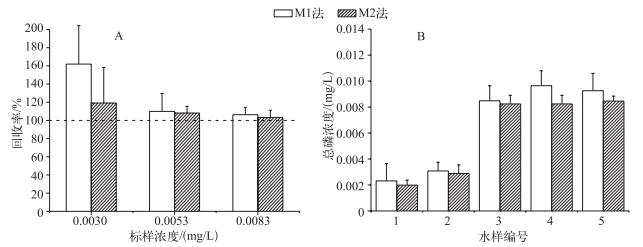
|
图 5 M1和M2法测定低浓度总磷标样的回收率(A)和野外水样中的总磷浓度(B) Fig.5 The recovery ratio of low total phosphorus concentration standard sample(A) and total phosphorus concentration of field sample(B) determined by M1 and M2 |
用M1、M2法分别测定5份野外水样中的总磷浓度(图 5B),表明2种方法测定的水样总磷浓度差异不显著(P>0.05),但M1法测得的总磷浓度总体上均高于M2法. M1法测定低磷浓度水样时,磷浓度和吸光值间线性相关性较差,会导致绘制的标准曲线斜率出现偏差,本实验中表现为标准曲线斜率偏小(图 4B),因此用该标准曲线计算出来的浓度会比实际浓度偏大,这也是M1法测得的浓度高于M2法的原因.反之,若绘制的标准曲线斜率偏大,则计算出来的浓度则会偏低.可见M1法由于消解后需要稀释定容,进一步降低了低磷浓度样品中的磷浓度而使分光光度计对浓度差异的响应不灵敏,导致浓度和吸光值间的线性关系较差和标准曲线绘制出现偏差,使最终测得的结果无法真实反映水样的实际浓度.
综上以上分析,M2法相对于M1法更适用于对低磷浓度水样的测定.
3 结论对于低磷浓度水体(总磷浓度低于0.01 mg/L),现行的国标磷测定法(GB 11893-1989)准确性和灵敏度均较差.可从3个方面进行改进提高测定的准确性:1)增加消解水样体积至50 ml,消解后不再进行二次稀释定容(即M2法);2)改变显色剂的配制(即14%硫酸溶液50 ml、酒石酸锑钾溶液5 ml、4%钼酸铵溶液15 ml和0.1 mol/L的抗坏血酸溶液30 ml混合而成,现配现用),减少显色剂干扰;3)将测定波长设置为880 nm,提高灵敏度.通过改进后,新方法能准确有效测定磷浓度在0.003~0.01 mg/L范围内的水样.
| [1] |
Conley DJ, Paerl HW, Howarth RW et al. Controlling eutrophication:nitrogen and phosphorus. Science, 2009, 323(5917): 1014-1015. DOI:10.1126/science.1167755 |
| [2] |
Kalff J. Limnology:inland water ecosystems. New Jersey: Prentice Hall, 2002.
|
| [3] |
Abell JM, Özkundakci D, Hamilton DP. Nitrogen and phosphorus limitation of phytoplankton growth in New Zealand lakes:implications for eutrophication control. Ecosystems, 2010, 13(7): 966-977. DOI:10.1007/s10021-010-9367-9 |
| [4] |
Elser JJ, Bracken MES, Cleland EE et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems. Ecology Letters, 2007, 10(12): 1135-1142. DOI:10.1111/j.1461-0248.2007.01113.x |
| [5] |
Reynolds CS. The ecology of phytoplankton. Cambridge: Cambridge University Press, 2006.
|
| [6] |
Sun Jianmin, Cui Meng, Gao Zheng. Study and proceeding on the determination of trace phosphorus. Studies of Trace Elements and Health, 2005, 22(2): 55-58. [孙建民, 崔萌, 高峥. 痕量磷测定方法的研究及新进展. 微量元素与健康研究, 2005, 22(2): 55-58.] |
| [7] |
Peng Ganghua, Kang Changan, Zhong Hongyan et al. Quality control index of total phosphorus test in water sample using ammonium molybdate spectrophotometric method. Environment and Ecology in the Three Gorges, 2011, 33(2): 31-34. [彭刚华, 康长安, 钟鸿雁等. 钼酸铵分光光度法测定水中总磷质量控制指标研究. 三峡环境与生态, 2011, 33(2): 31-34.] |
| [8] |
China Environmental Protection Administration, Editorial Board of Water and Wastewater Monitoring and Analysis Method. Water and wastewater monitoring and analysis method. The fourth edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法. 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [9] |
GB 11893-1989. Water quality-determination of total phosphorus-ammonium molybdate spectrophotometric method. Beijing: China Standard Press, 1989. [GB 11893-1989. 水质总磷的测定——钼酸铵分光光度法. 北京: 中国标准出版社, 1989.]
|
| [10] |
Xu Ning, Duan Shunshan, Lin Qiuqi et al. Analysis on phosphorus pollution and eutrophication of the large reservoirs for water supply in Guangdong Province. Ecologic Science, 2003, 22(4): 341-345. [徐宁, 段舜山, 林秋奇等. 广东大中型供水水库的磷污染与富营养化分析. 生态科学, 2003, 22(4): 341-345.] |
| [11] |
Lin Qiuqi, Hu Ren, Duan Shunshan et al. Reservoir trophic states and the response of plankton in Guangdong Province. Acta Ecologica Sinica, 2003, 23(6): 1101-1108. [林秋奇, 胡韧, 段舜山等. 广东省大中型供水水库营养现状及浮游生物的响应. 生态学报, 2003, 23(6): 1101-1108.] |
| [12] |
Jiang Tao, Liu Zufa, Chen Xiaohong et al. Assessment of reservoir eutrophication in Guangdong Province. J Lake Sci, 2005, 17(4): 378-382. [江涛, 刘祖发, 陈晓宏等. 广东省水库富营养化评价. 湖泊科学, 2005, 17(4): 378-382. DOI:10.18307/2005.0417] |
| [13] |
U.S. Environmental Protection Agency. Methods of chemical analysis of water and wastes. USEPA Rep. 600/4-79-020. USEPA, Cincinnati, OH. 1979.
|
| [14] |
Zhang Hui. Study on colorimetry wavelength choice of phosphorus molybdenum blue. Agro-environmental Protection, 1991, 10(6): 274, 277. [张辉. 磷的钼蓝比色波长选择的研究. 农业环境保护, 1991, 10(6): 274, 277.] |
| [15] |
Tsoulfanidis IA, Tsogas GZ, Giokas DL et al. Design of a field flow system for the on-line spectrophotometric determination of phosphate, nitrite and nitrate in natural water and wastewater. Microchimica Acta, 2008, 160(4): 461-469. DOI:10.1007/s00604-007-0789-9 |
| [16] |
Huang Cheng, Zhou Yan, Zeng Ganning et al. Determination of phosphorus in seaweed by molybdenum blue spectrophotometry with ascorbic acid reducing agent. Marine Environmental Science, 2009, 28(A01): 76-78. [黄城, 周燕, 曾淦宁等. 抗坏血酸-钼蓝分光光度法测定海藻中磷的研究探讨. 海洋环境科学, 2009, 28(z1): 76-78. DOI:10.3969/j.issn.1007-6336.2009.z1.022] |
| [17] |
Cha Dongmei. The elementary discussion of sensitivity, detection limit and determination limit. University Chemistry, 2011, 26(4): 84-86. [察冬梅. 浅议灵敏度, 检出限和测定限. 大学化学, 2011, 26(4): 84-86. DOI:10.3969/j.issn.1000-8438.2011.04.023] |
| [18] |
Jiang Zigang. The analysis margin in trace analysis. Shanghai Environmental Sciences, 1987(1): 8. [蒋子刚. 痕量分析中的分析空白. 上海环境科学, 1987(1): 8.] |
| [19] |
Xu Jirong. The discussion on the blank value of the sample in marine environmental monitoring. Marine Environmental Science, 1996, 15(2): 12-16. [徐继荣. 海洋环境监测中有关分析空白值的探讨. 海洋环境科学, 1996, 15(2): 12-16.] |
| [20] |
Ren Chengzhong, Mao Lifen. Study on the practice of standard recovery test and calculation of recovery rate. Industrial Safety and Environmental Protection, 2006, 32(2): 9-11. [任成忠, 毛丽芬. 加标回收实验的实施及回收率计算的研究. 工业安全与环保, 2006, 32(2): 9-11.] |
| [21] |
Xie Difei. Eutrophication evaluation of large and medium reservoirs in Guangdong Province and design of water quality management information system[Dissertation]. Guangzhou:Jinan University, 2002(in Chinese with English abstract). [谢涤非. 广东省大中型水库富营养化评价及水质管理信息系统研制[学位论文]. 广州: 暨南大学, 2002. http://cdmd.cnki.com.cn/Article/CDMD-10559-2002114058.htm ]
|
 2016, Vol. 28
2016, Vol. 28 

