过量营养物质的汇入使得大量水体出现富营养化现象.有研究表明营养物质氮(N)和磷(P)浓度增加是导致水体藻类暴发的主导因子,但大多数学者普遍认为相较于N,P是控制藻类暴发更为重要的限制因素[1].因此,水体富营养化控制措施往往通过减少磷的输入来实现.但在实际应用中,单纯控制外源磷的输入远远不够,因为内源磷的释放是上覆水中磷的另一重要来源[2].且藻类具有分泌胞外碱性磷酸酶分解有机磷来补充水体中的PO43-供自身吸收的能力[3].此外,研究显示某些细菌可以将不能直接利用的有机磷分解为溶解态无机磷(DIP),进而促进藻类生长引起水华[4].
沉水植物能够较好地控制藻类的增长并在维持水体澄清方面具有重要作用[5].沉水植物可以通过与藻类竞争营养物质、光照和分泌化感物质等来抑制藻类的生长[6],同时沉水植物还能影响底质中各形态磷含量及存在形式、抑制底质的再悬浮,从而抑制内源磷的释放[7].尽管有关沉水植物在水体中所起作用的报道已有很多,但对沉水植物控制藻类大量生长的机理认识仍相对缺乏,尤其是对其如何调控藻类吸收水体磷的过程缺乏深入的研究.
因此,本研究选择沉水植物金鱼藻(Ceratophyllum demersum)为实验对象,通过在室内构建浅水湖泊中宇宙模拟系统,对上覆水中不同形态磷浓度、不同粒径组分碱性磷酸酶活性、藻密度、光量子产量、有机/无机磷细菌数量等进行高频率监测,运用结构方程模型解析水体藻密度与其他各变量之间的关系,探究沉水植物对藻类生长的抑制作用及相应机制.
1 材料和方法 1.1 实验系统建立与设置中宇宙模拟系统为0.6 m×0.5 m×0.8 m PVC水箱,沉积物深度约20 cm,水深约60 cm;实验系统沉积物和上覆水均取自流经同济大学校园的景观河道,沉积物总磷(TP)、有机磷(OP)、无机磷(IP)、总氮(TN)、有机质(OM)初始含量分别为1.15±0.04、0.91±0.02、0.24±0.03、1.50±0.06、55.6±2.07 g/kg(dw),上覆水TP、总溶解态磷(TDP)、可溶性活性磷(SRP)、TN、铵态氮(NH4+-N)、化学需氧量(COD)初始浓度分别为0.49±0.001、0.041±0.003、0.38±0.001、4.92±0.19、4.14±0.06、14.4±0.90 mg/L.实验装置位于同济大学敞开式温室.
实验设置两组:种植金鱼藻的实验组和未种植植物的空白对照组,每组设3个平行.金鱼藻于2014年6月初采自武汉严西湖,预培养4周后,选取长度一致的健壮植株按照实际工程中常用种植参数(0.5 kg/m2),移栽至各实验装置.实验过程中定期以自然曝气3 d的自来水补充因蒸发、蒸腾作用所损耗的水量.
1.2 采样和分析实验周期为2014年7月7日-2014年10月4日,期间依照先密后疏的规律(周期为2~8 d)采集各实验系统内表层水10 cm以下样品进行各指标分析.
1.2.1 理化指标分析水样氮、磷浓度按照国家环境保护总局标准分析方法进行测定[8],颗粒态磷(PP)浓度为TP浓度与TDP浓度之差;溶解态有机磷(DOP)浓度为TDP浓度与SRP浓度之差.
1.2.2 浮游植物密度与光量子产量的测定用于浮游植物鉴定的水样用酸化的鲁哥试剂进行现场固定[9],静置沉淀48 h,移去上清液,将样品浓缩至10 ml进行充分摇匀之后,取0.1 ml放置于计数框进行显微镜(奥林巴斯BX53)鉴定和计数.浮游植物种类鉴定参照《中国淡水藻类》[10].水样暗适应15 min后用叶绿素荧光仪(Water-PAM,Walz)测定有效光量子产量(Fv/Fm).
1.2.3 微生物数量测定采用5倍或10倍稀释法对水样中有机磷与无机磷细菌进行平板计数,所用培养基均为美国进口分装混合培养基.有机磷细菌培养基(1 L水):葡萄糖,10 g;氯化钠,0.3 g;硫酸铵,0.5 g;酵母膏,0.5 g;碳酸镁,0.3 g;氯化钾,0.3 g;硫酸锰,0.03 g;硫酸铁,0.03 g;琼脂,15 g;卵磷脂,0.2 g.无机磷细菌培养基(1 L水):葡萄糖,10 g;氯化钠,0.3 g;硫酸铵,0.5 g;碳酸钙,5 g;酵母膏,0.5 g;碳酸镁,0.3 g;氯化钾,0.3 g;硫酸锰,0.03 g;硫酸铁,0.03 g;琼脂,15 g.培养条件为28℃恒温培养48 h.
1.2.4 胞外碱性磷酸酶活性的测定碱性磷酸酶活性(APA)的测定及分级采用Gage等[11]所改良的方法.取水样5 ml,每个样品3个平行,分别加入对硝基苯磷酸二钠盐(最终浓度为0.3 mmol/L)、Tris-HCl缓冲液(pH=8.5,最终浓度为13 mmol/L)和Na3N(最终浓度5 mmol/L),定容至10 ml,恒温37℃反应4 h后,分光光度法410 nm波长条件下测定吸光度.总碱性磷酸酶活性(TAPA)由原水样直接测得.此外,用孔径为3.0 μm和0.45 μm的滤膜分别过滤部分水样,分别测得粒径小于3.0 μm部分组分碱性磷酸酶活性(APA3.0)和溶解态碱性磷酸酶活性(SAPA).不同粒径大小颗粒APA的计算方法为:粗颗粒碱性磷酸酶活性(以藻类和附着在藻类上的细菌分泌为主):粗颗粒APA=TAPA-APA3.0,细颗粒碱性磷酸酶活性(以浮游细菌、微藻等分泌为主):细颗粒APA =APA3.0-SAPA.
1.3 统计分析曲线的拟合以及数据图的绘制采用Origin Pro 8.0,数据协方差分析采用SPSS 19.0,结构方程模型(SEM)的建立采用R包“lavaan”.
SEM是基于变量的协方差矩阵来分析变量之间关系的一种统计方法,不仅可以考察变量之间的直接影响,还可以解释变量间的间接影响.此外,SEM还允许自变量和因变量之间存在测量误差,为分析潜在变量之间的结构关系提供了可能,是唯一能同时对复杂的多变量之间关系进行全面检验的统计方法.结构方程模型属于多变量统计, 整合了因素分析与路径分析两种统计方法,检验观测变量与潜在变量之间及多个潜在变量内部的因果关系.
2 结果与分析 2.1 上覆水不同形态磷浓度变化上覆水中不同形态磷浓度在实验开始阶段(0~15 d)均出现大幅下降,这与实验添加上覆水导致水中磷被悬浮的颗粒物吸附有关;之后(15~83 d)由于沉积物磷的释放使得上覆水中磷浓度有所上升.相较于DOP与PP,TP、TDP和SRP浓度随时间变化趋势更为明显且一致,这是因为SRP为上覆水中主要形态磷(图 1).对照组上覆水TP、TDP和SRP平均浓度显著高于(约4倍)实验组(P < 0.05,图 1,表 1),但是S曲线方程对相应的实验数据均能进行较好的拟合,尤其是在实验系统稳定之后(15~83 d)(图 1).此外,实验组和对照组SRP与TP的比值(SRP/TP)均维持在较高的水平,平均值分别为0.66和0.80,协方差结果显示实验组和对照组之间SRP/TP比值差异显著(P < 0.05,表 1).
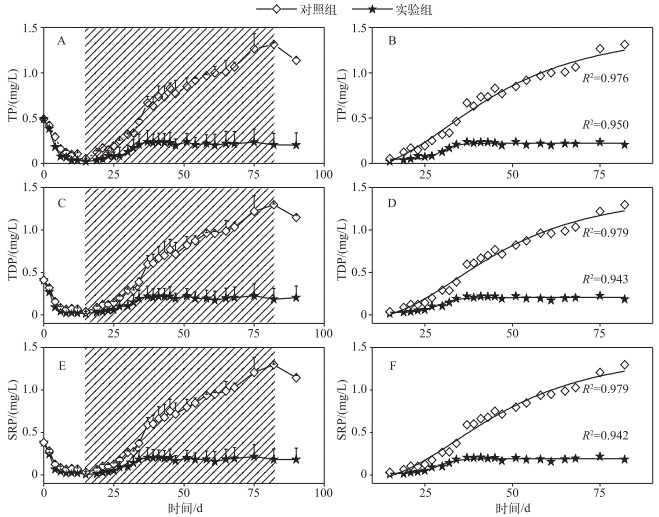
|
图 1 不同系统上覆水中TP、TDP与SRP浓度变化 Fig.1 Temporal changes of TP, TDP and SRP concentrations in overlying water in different systems (图B、D、F分别为对图A、C、E中阴影区域数据(15~83 d)进行拟合得到的曲线) |
| 表 1 各变量均值(2~90 d)及方差分析结果* Tab.1 Average values and ANOVAs for variables (LSD) between groups (from the 2th to 90th day) |
实验期间,实验组和对照组上覆水中PP和DOP浓度均呈波动变化.对照组PP浓度显著高于实验组(P < 0.05,图 2,表 1),但两组的DOP浓度无显著差异.
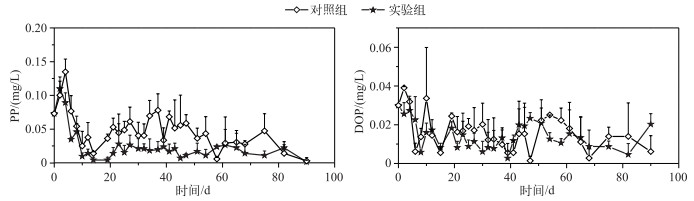
|
图 2 不同系统上覆水中PP与DOP浓度变化 Fig.2 Temporal changes of DOP and PP concentrations in overlying water in different systems |
金鱼藻的生长对藻类密度的动态变化具有明显的影响,显著降低了藻类密度(P < 0.05,表 1).尽管各系统浮游植物有效光量子产量在实验初期均出现大幅的上升(图 3),但整个实验过程中两系统之间差异显著(P < 0.05),其中对照组均值为0.30,而实验组仅为0.19.
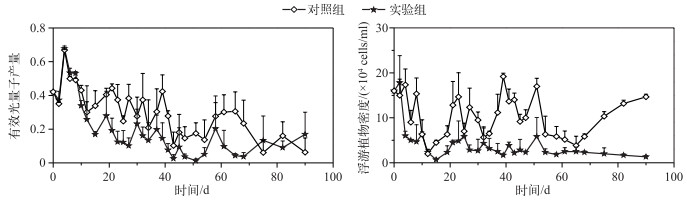
|
图 3 不同系统中浮游植物与有效光量子产量变化 Fig.3 Phytoplankton density and quantum yield in different systems |
实验起始阶段各系统上覆水中磷细菌密度均出现大幅上升现象(图 4),这是因为实验系统构建时添加上覆水导致底泥大量颗粒物悬浮至水中,但是随后两者数量都大幅下降,其中有机磷细菌数量持续降低直至第15 d,而无机磷细菌数量在第4 d有小幅上升.值得关注的是实验起始的不稳定阶段,实验组系统上覆水中两种细菌数量的波动和空白组相比均较小.这表明金鱼藻生长能够显著抑制沉积物的再悬浮.整个实验过程中,对照组有机磷细菌和无机磷细菌分别为122和158 CFU/ml,显著高于实验组(P < 0.05,表 1).

|
图 4 不同系统上覆水中磷细菌变化 Fig.4 Temporal changes of bacterial density in overlying water in different systems |
实验初期(0~15 d),两个实验系统中不同粒径组分胞外碱性磷酸酶活性随时间的变化相似,开始急剧升高之后又迅速下降(图 5).到达相对稳定阶段后,系统之间磷酸酶活性差异逐渐明显,尤其是TAPA.最小显著性检验结果显示对照组TAPA显著高于实验组(P < 0.05,表 1).细颗粒APA和粗颗粒APA也有相似的规律,且同样对照组显著高于实验组.此外,实验组和对照组中粗颗粒APA分别占TAPA的47.0 %和44.7 %.

|
图 5 不同系统上覆水中碱性磷酸酶活性变化 Fig.5 Temporal changes of total APA, soluble APA, algal APA and bacterial APA in overlying water in different systems |
基于所得数据建立结构方程模型,为了寻求最佳模型,在全因子模型的基础上筛选线性作用显著的因子变量,以提高预测数据和模型拟合优度.最终简化后模型因子包括:藻类密度、有效光量子产量、可溶性活性磷、不同粒径组分碱性磷酸酶活性和细菌密度(图 6).模型结果显示,对照组可溶性活性磷对水体中藻类和细颗粒APA具有最直接的负作用(P < 0.05),两者标准化相关系数均为-0.52;其次对有效光量子产量直接负作用也较为显著(标准化系数为-0.46).同时,水体中藻类密度对TAPA有直接的正作用,标准化相关系数为0.21(P < 0.05).此外,粗颗粒APA与细颗粒APA,以及有机磷细菌与无机磷细菌之间存在显著正协变关系(P < 0.05).
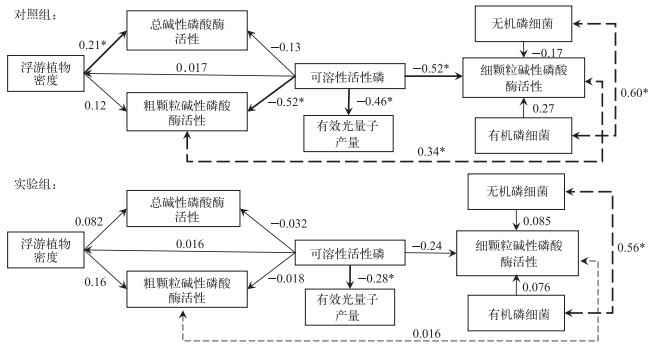
|
图 6 结构方程模型 Fig.6 SEM of the relationship between target variables |
对比两组结果(图 6),可溶性活性磷在实验组中仅对光量子产量具有显著的直接负作用(标准化相关系数为-0.28;P < 0.05).此外,实验组也仅有机磷细菌与无机磷细菌存在正协变关系,且弱于对照组.
3 讨论本研究中金鱼藻生长良好(实验结束时鲜重为0.813±0.12 kg),显著抑制了藻类生长(图 3,表 1).为了进一步解析沉水植物控制藻类生物量的机理,我们重点关注并比较了各系统上覆水中不同形态磷的浓度.尽管各系统上覆水中的TP、TDP和SRP的浓度随着时间均呈现出S曲线变化,但实验组以上3种形态磷浓度远远低于对照组.此外,实验组水体PP浓度也显著低于对照组.这些结果表明金鱼藻能够很好地维持水体中的磷处于较低浓度水平.研究发现藻类生物量与磷浓度密切相关,呈现出非线性的S曲线关系[12-13].然而,本研究SEM结果却显示即使是对照组系统,SRP也并没有强烈地影响到藻类密度.相关机理需要进一步探究.
对营养盐的竞争和化感作用是沉水植物抑制藻类生长的主要途径[14],然而不同物种侧重于不同的策略,这往往取决于它们的形态学特征.大多数水生被子植物扎根于底泥中并从中获取自身需要的大部分常量元素,而金鱼藻则只通过假根与底泥相连接,它对营养盐的吸收主要通过根以上的部位来进行[15].与对照组相比,实验组水体中的TAPA和粗颗粒APA均显著下降,这可能与系统中水体藻类密度较低和/或碱性磷酸酶活性受到抑制有关.基于藻类量子产量与藻类生物量无关以及藻类密度对TAPA并无直接作用(图 6),可以推测金鱼藻主要是通过分泌化感物质对藻类生长产生抑制,且已有研究显示从金鱼藻提取的化感物质对藻类生长具有较强的抑制作用[16].
SEM结果显示两实验系统中不同形态的磷、碱性磷酸酶、藻类密度、细菌动态和光量子产量之间的相互关系呈现出不同的格局(图 6),金鱼藻的生长减弱了这些变量之间的相互作用.其中,金鱼藻生长降低了SRP对粗颗粒APA的直接作用,进一步证实在水生植物存在的情况下SRP并非影响藻类生长的唯一因素.
| [1] |
Correll DL. The role of phosphorus in the eutrophication of receiving waters:A review. Journal of Environment Quality, 1998, 27(2): 261-266. |
| [2] |
Schindler DW, Hecky RE, Findlay DL et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input:Results of a 37-year whole-ecosystem experiment. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(32): 11254-11258. DOI:10.1073/pnas.0805108105 |
| [3] |
Young EB, Tucker RC, Pansch LA. Alkaline phosphatase in freshwater Cladophora-epiphyte assemblages:Regulation in response to phosphorus supply and location. Journal of Phycology, 2010, 46(1): 93-101. DOI:10.1111/(ISSN)1529-8817 |
| [4] |
Song Chunlei, Cao Xiuyun, Li Jianqiu et al. Contribution of phosphatase and microbial activity to internal phosphorus loading in lake and its relationship with eutrophication. Science China:Earth Sciences, 2005, 35(S2): 90-100. [宋春雷, 曹秀云, 李建秋等. 湖泊磷酸酶与微生物活性对内源磷负荷的贡献及其与富营养化的关系. 中国科学:地球科学, 2005, 35(S2): 90-100.] |
| [5] |
Yount JL. Aquatic nutrient reduction and possible methods. Rep.35th Ann.Meet., FL Anti-mosquito Assoc, 1964, 83-85. |
| [6] |
Mulderij G, Van Nes EH, Van DE. Macrophyte-phytoplankton interaction:The relative importance of allelopathy versus other factors. Ecological Modelling, 2007, 204(1/2): 85-92. |
| [7] |
Schulz M, Kozerski HP, Pluntke T et al. The influence of macrophytes on sedimentation and nutrient retention in the lower River Spree (Germany). Water Research, 2003, 37(3): 569-578. DOI:10.1016/S0043-1354(02)00276-2 |
| [8] |
"Monitoringand analysis method of water and wastewater" editorial board of State Environmental Protection Administration of China ed. Monitoring and analysis methods of water and wastewater. Fourth Edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法. 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [9] |
Parsons TR, Maita Y. A manual of chemical and biological methods for sea water analysis. Oxford:Pergamon Press, 1984, 1523. |
| [10] |
Hu Hongjun, Wei Yinxin. The freshwater algae of China. Shanghai: Shanghai Scientific&Technical Publishers, 1980. [胡鸿钧, 魏印心. 中国淡水藻类. 上海: 上海科学技术出版社, 1980.]
|
| [11] |
Gage MA, Gorham E. Alkaline phosphatases activity and cellular phosphorus as an index of the phosphorus status of phytoplankton in Minnesota lakes. Freshwater Biology, 1985, 15(2): 227-233. DOI:10.1111/fwb.1985.15.issue-2 |
| [12] |
Dai YR, Jia CR, Liang W et al. Effects of the submerged macrophyte Ceratophyllum demersum L.on restoration of a eutrophic waterbody and its optimal coverage. Ecological Engineering, 2012, 40: 113-116. DOI:10.1016/j.ecoleng.2011.12.023 |
| [13] |
Dai YR, Tang HB, Chang JJ et al. What's better, Ceratophyllum demersum L., individual or combined?. Ecological Engineering, 2014, 70: 397-401. DOI:10.1016/j.ecoleng.2014.06.009 |
| [14] |
Watson S, McCauley M, Downing JA. Sigmoid relationships between phosphorus, algal biomass, and algal community structure. Canadian Journal of Fisheries and Aquatic Sciences, 1992, 49(12): 2605-2610. DOI:10.1139/f92-288 |
| [15] |
Denny P. Mineral cycling by wetland plants-a review. Archiv für Hydrobiologie-Beiheft Ergebnisse der Limnologie, 1987, 27: 1-25. |
| [16] |
Xian QM, Chen HD, Zou HX et al. Allelopathic activity of volatile substance from submerged macrophytes on Microcystin aeruginosa. Acta Ecologica Sinica, 2006, 26(11): 3549-3554. DOI:10.1016/S1872-2032(06)60054-1 |
 2017, Vol. 29
2017, Vol. 29 


