水华暴发是水体富营养化常见特征之一,三峡水库蓄水后,水动力条件时常改变,营养盐不断积累,导致库区部分支流库湾水华现象严重[1],铜绿微囊藻是三峡库区蓝藻水华暴发常见的优势藻种之一,藻群体的形成和增长是水华暴发的前提,铜绿微囊藻在适宜环境下,大量增殖形成群体上浮于水面,并分泌微囊藻毒素,严重破坏水域生态系统,直接影响工农业生产及生活用水的供水水质,从而对人类健康产生极大危害[2-3].影响藻群体形成的非生物因子主要有营养盐、光强、温度、pH以及金属离子等[4-5],Cu2+、Fe3+、Zn2+和Pb2+等已有相关报道[4, 6-7],Sharma等[8]研究证实金属离子可显著促进藻细胞分泌胞外多糖(EPS),Wang等[9]发现一定浓度的Ca2+能促进微囊藻多糖的合成并有利于藻群体形成,从而可知金属离子在微囊藻群体形成中起着非常重要的作用,但将金属离子与其他环境因子进行对比分析少有报道.国内外学者已对铜绿微囊藻的生长及生理特性等进行了多方面研究,但单细胞状态的微囊藻怎样集结聚集形成群体尚无明确定论[10].部分研究发现微囊藻水华形成过程中,往往伴随着EPS合成,Wallace[11]发现EPS能调节微囊藻垂直移动,目前对EPS的研究主要集中在提取和结构分类上,对于环境因子如何影响其合成,其与藻群体形成的具体关系的研究甚少.
不同水域理化性质、生物背景不一,导致水华暴发的环境因素和生态机制也有差异.为进一步探究三峡水库成库后支流回水区富营养化问题,本实验以三峡库区小江流域回水区铜绿微囊藻为研究对象,在环境因子(N、P浓度,Ca2+浓度,光照强度,温度)对其生长影响分析的基础之上,与环境因子对EPS合成影响分析相结合,揭示不同环境条件下EPS对铜绿微囊藻群体形成的作用.并对前期实验培养成熟的铜绿微囊藻群体和纯培养的单细胞作为后续实验材料,在激光共聚焦显微镜和扫描电子显微镜下观察了两组实验材料中细胞的存在状态及Ca2+和EPS分布情况,以期更深入了解微囊藻水华的发生过程与Ca2+和EPS分布之间的关系,并从微观角度解释铜绿微囊藻群体的形成过程,为阐明铜绿微囊藻水华的形成机理提供相关依据.
1 材料与方法 1.1 实验材料 1.1.1 实验藻种在三峡库区小江流域回水区采集浮游藻类,现场用甲醛固定,经显微镜观察、鉴定,进行短期预培养、稀释法结合平板分离法以及灭菌等步骤[12]得到纯化的实验藻种铜绿微囊藻(M. aeruginosa),并采用BG-11培养液对藻进行驯化和扩大培养,取对数生长期的藻进行后续实验.
1.1.2 实验培养液BG-11培养液[13]:NaNO3 1.5 g/L,K2HPO4 0.04 g/L,MgSO4·7H2O 0.075 g/L,CaCl2·2H2O 0.036 g/L,C6H8O7 0.006 g/L,FeC6H5O7·NH4OH 0.006 g/L,EDTANa2 0.001 g/L,Na2CO3 0.02 g/L,H3BO3 2.86 g/L,MnCl2·4H2O 1.81 g/L,ZnSO4·7H2O 0.222 g/L,CuSO4·5H2O 0.079 g/L,Na2MoO4·2H2O 0.39 g/L,Co(NO3)2·6H2O 0.049 g/L.培养基液pH调至7.5,并经高压灭菌(121℃,105 kPa,30 min).
1.2 实验方法本实验采用单因素分析方法,在500 ml三角瓶中加入300 ml经过灭菌消毒的BG-11培养液,铜绿微囊藻的初始接种量为3.0×106 cells/ml,探讨N、P浓度;Ca2+浓度;光强;温度对铜绿微囊藻生长、EPS合成及藻群体形成的影响.以三峡库区小江流域环境背景值及相关研究[14-18]为参考,N、P浓度设置梯度:N=1 mg/L、P=0.05 mg/L(NP1组);N=5 mg/L、P=0.25 mg/L(NP2组);N=10 mg/L、P=0.5 mg/L(NP3组);N=50 mg/L、P=2.5 mg/L(NP4组);N=100 mg/L、P=5 mg/L(NP5组);其余因子光强2000 lux,光暗比12 h:12 h,温度25℃. Ca2+浓度梯度为0.13、13、65、130和260 mg/L(Ca2+1组~ Ca2+5组);其余因子光强2000 lux,光暗比12 h:12 h,温度25℃.铜绿微囊藻在光强梯度设置为1000、2000、4000、8000和12000 lux的培养箱中进行培养,光源为白炽灯,光暗比12 h:12 h,温度25℃.温度梯度设置为15、20、25、30和35℃,光强2000 lux,光暗比12 h:12 h.每项因子的每个水平分别做3个平行,自接种当日起每天定时摇动3次,分别间隔3 d在同一时间取样测定藻密度及EPS含量.
1.3 分析方法 1.3.1 藻细胞计数细胞计数采用血球计数板法,计数板规格选用25×16,根据对角线法依次对5个大格的藻细胞进行计数.藻细胞密度(106 cells/ml)=5×(N1+N2+N3+N4+N5)×10-2×B,式中:N1~ N5指5个大格中的藻细胞数,B指稀释倍数.
1.3.2 EPS测定分析EPS的提取及测定采用Del Gallo等[19]经过修改和量化的蒽酮-硫酸法.取藻液10 ml,调节pH至10,摇匀后置于恒温水浴震荡器中,45℃震荡4 h(60转/min),于10500转/min离心15 min使藻液分离,将上清液以0.45 μm膜过滤后用于测定EPS浓度.
1.3.3 铜绿微囊藻形态特征分析将纯培养的单细胞微囊藻和三峡库区小江流域回水区分离提纯并扩大培养的铜绿微囊藻群体,以BG-11培养液,光照为1000 lux,室温(25℃)条件培养成熟后,分别制成玻片,在激光共聚焦显微镜和扫描电子显微镜下观察其形态,根据文献[20-21],激光共聚焦显微镜观察需对EPS和Ca2+进行荧光标记,EPS的荧光标记方法[22]:取一小滴用蒸馏水冲洗过的藻液滴在洗净的载玻片上,并滴加适量的Calcofluor White Stain(美国Sigma多聚糖荧光染料)和1滴10%的KOH溶液,放置1 min. Ca2+的荧光标记方法:取一小滴藻液于载玻片上,并滴加适量2 μmol/L的Fluo-3, pentasodium salt稀释液(美国AAT Bioquest Inc.胞外Ca2+荧光探针),然后在37℃下恒温孵育1 h.
2 结果与讨论 2.1 环境因子对铜绿微囊藻生长的影响当N、P浓度较低(N≤5 mg/L、P≤0.25 mg/L)时,在前9 d,铜绿微囊藻保持指数增长,9 d后,铜绿微囊藻生长无显著变化(P>0.05)(图 1a);这与许海等[23]研究铜绿微囊藻对氮、磷饥饿耐受能力结果相符.当初始N、P浓度相对较高(N≥10 mg/L、P≥0.5 mg/L)时,铜绿微囊藻随着培养时间的推移逐渐增长,在前24 d,不同N、P浓度梯度间,藻细胞密度无显著性差异(P>0.05),这与罗东等[24]的研究发现当P≥0.5 mg/L时,不同P浓度条件下的藻增长速度基本相近的结果一致.培养后期,N、P逐渐被藻生长利用从而浓度降低,高浓度N、P逐渐降低到最优值进一步利于藻类生长,故当N=10 mg/L、P=0.5 mg/L时,就能使铜绿微囊藻呈优势增长.

|
图 1 不同初始N、P浓度(a)、Ca2+浓度(b)、光强(c)和温度(d)条件下铜绿微囊藻生长情况 Fig.1 The growth of M. aeruginosa under the condition of different original N and P concentrations(a), Ca2+ concentrations(b), light intensities(c) and temperatures(d) |
在5组不同的Ca2+浓度水平下,铜绿微囊藻均呈一定趋势增长,且当Ca2+=65 mg/L时,铜绿微囊藻的生长量最大且增长速率最突出,随着Ca2+浓度继续增加,铜绿微囊藻的生长量和增长速率反而减小;低浓度Ca2+(<65 mg/L)比高浓度Ca2+(>65 mg/L)条件下的藻生长量及增长速率大但差异并不显著(P>0.05)(图 1b).适宜浓度的Ca2+有利于藻生长,浓度过高(>65 mg/L)则会一定程度抑制藻细胞增殖,这与郭丽丽等[17]及Shi等[25]研究中Ca2+对微囊藻生长的影响结论相近.其可能的原因是Ca2+是藻生长所需离子,适宜浓度的Ca2+有利于藻细胞壁的构成,对藻细胞膜结构起稳定作用,从而利于藻生长;浓度过高的Ca2+可能会抑制藻体内一些保护酶的活性,从而不利于藻生长[26].
在培养期的前15 d,不同光照强度下的藻生长无显著差异(P>0.05),在高光照强度(12000 lux)下的藻生长量相对较低,表现出光抑制(图 1c).培养后期(>15 d),当光照强度为1000 lux时,铜绿微囊藻呈现最优生长,这与刘世明等[27]总结较低的光强有利于铜绿微囊藻生长结论一致.整个培养期间,不同光强下的藻生长均存在波动,光照周期一定(12 h)时,光强在一定范围(2000~4000 lux)内变化对铜绿微囊藻生长影响无明显差异(P>0.05),推测铜绿微囊藻对高光照强度的耐受能力较强.
温度分别为15、25和35℃时,对铜绿微囊藻类生长的影响差异较明显(P<0.05),当温度较低(15℃)和较高(35℃)时,铜绿微囊藻的生长趋势均较缓,且在培养后期藻生长有略微下降(图 1d).其可能原因是低温条件下微囊藻胞内酶活性较低,生长受到抑制,温度过高则出现高温胁迫现象.付保荣等[28]研究表明, 铜绿微囊藻的最佳生长温度在25℃以上,本研究表明30℃是铜绿微囊藻生长最佳温度,其生长量高达3.15×107 cells/ml;培养初期,铜绿微囊藻在饱和温度范围内呈线性增长,在培养后期(第24 d)达到生长饱和.
2.2 环境因子对铜绿微囊藻EPS合成的影响不同环境因子条件下,铜绿微囊藻EPS合成情况可知,铜绿微囊藻EPS合成随着N、P浓度的增加而增加(图 2a).低N、P浓度(N≤10 mg/L、P≤0.5 mg/L)抑制铜绿微囊藻EPS合成,N、P浓度越低EPS合成量越低; 高N、P浓度(N≥50 mg/L、P≥2.5 mg/L)促进EPS合成.一些研究表明N、P浓度缺乏能刺激蓝杆藻(Cyanothece)[29]、筒柱藻(Cylindrotheca)[30]等藻类的EPS合成,本研究表明N、P浓度对微囊藻的影响与上述藻类不同,而与雷腊梅等[31]研究营养条件对铜绿微囊藻胞外多糖产生影响的结果一致.其可能的原因是铜绿微囊藻在N、P丰富条件下的碳固定效率较高,故营养条件对不同藻类EPS合成影响不同.与图 1a对比可知,N、P浓度对铜绿微囊藻EPS的合成与藻生长的影响具有一致性,高浓度的N、P为铜绿微囊藻提供了丰富的营养盐,在一定程度上有利于微囊藻生长,并利于EPS的合成和分泌,故调节N、P浓度是控制微囊藻生物量增长的有效途径.
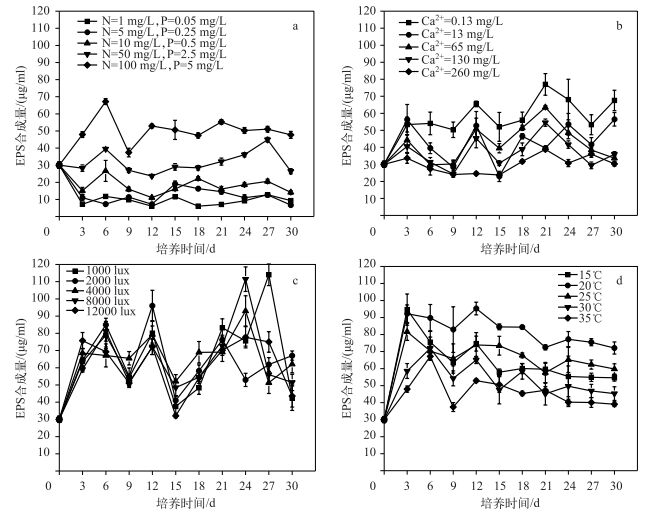
|
图 2 不同初始N、P浓度(a)、Ca2+浓度(b)、光强(c)和温度(d)条件下铜绿微囊藻EPS的合成情况 Fig.2 The EPS concentration of M. aeruginosa under the condition of different original N and P concentrations(a), Ca2+ concentrations(b), light intensities(c) and temperatures(d) |
低浓度Ca2+(0.13 mg/L)与高浓度Ca2+(260 mg/L)相比对EPS合成影响有显著差异(P<0.05),0.13 mg/L Ca2+条件下EPS合成量最大能达到77 μg/ml,而其他3组处理对EPS合成影响无显著差异(P>0.05)(图 2b).与图 1b对比可知,0.13 mg/L Ca2+不是最有利于微囊藻生长的条件,但仍对藻生长有一定促进作用,即微量的Ca2+就能同时满足微囊藻的生长及EPS合成. Ca2+浓度过高(260 mg/L),微囊藻生长受到抑制,EPS浓度同样较低,其可能的原因是Ca2+不仅会影响藻细胞膜的通透性,从而影响EPS向细胞外分泌的过程,过高浓度的Ca2+还会在刺激微囊藻细胞分泌EPS的同时会促进其溶解[17].
光强对藻类EPS合成的影响少有报道.光照对铜绿微囊藻EPS合成有一定促进作用,且其促进效果高于N、P和Ca2+的作用(R光照>RCa2+>RN、P,其中R值代表显著水平的高低)(图 2c),说明微囊藻的EPS合成和释放依赖光照.在前21 d,不同光照处理对铜绿微囊藻EPS合成影响无明显差异(P>0.05);不同光照强度下EPS合成呈先增后降再增再降的不稳定变化趋势,2000~4000 lux条件有利于EPS合成, 在第9~18 d表现最为突出,在第27 d 1000 lux条件下EPS合成量出现峰值114 μg/ml,对应图 1c, 此时的微囊藻同样处于优势生长.整个培养周期来看,在第15和30 d,EPS合成量均有回落现象,这可能是微囊藻群体形成过程中EPS被利用的结果.
适宜的温度能够促进铜绿微囊藻EPS的合成,其促进效果同样高于N、P和Ca2+的作用(R温度> RCa2+>RN、P),EPS的合成量随着温度的升高呈先增加后降低的趋势,20℃时其合成量最大,25℃次之,35℃条件下最低,与施军琼等[32]的研究结论相似(图 2d).结合图 1d,微囊藻在20℃时也能较好地增长,20℃是微囊藻生长及EPS合成相对最有利的条件.
综合图 2分析,环境因子对铜绿微囊藻EPS合成的影响大小主要表现为光照>温度> Ca2+>N、P,进一步表明季节性变化对藻群体聚集有重要影响.
2.3 环境因子对铜绿微囊藻群体形成的影响 2.3.1 N、P浓度对铜绿微囊藻群体形成的影响不同N、P浓度条件下,铜绿微囊藻藻群体形成情况可知,细胞个数为3~10的铜绿微囊藻群体比重最大,即在实验室培养的微囊藻以细胞数较小的群体形态为主(图 3).在前12 d,N=50 mg/L、P=2.5 mg/L(NP4组)条件下形成的藻群体最大;在18 d后N=100 mg/L、P=5 mg/L(NP5组)条件下形成的藻群体最大,其可能原因是随着时间的推移,初始高浓度的N、P被消耗后逐渐降低,从而利于群体形成,这与培养前期在适中浓度(NP4组)条件下群体形成最大的结果一致.即初始N、P浓度较低和较高均不利于藻群体形成,高N、P浓度比低N、P浓度条件下群体形态的藻细胞所占比例高,N=50 mg/L、P=2.5 mg/L是藻群体形成的最佳条件,此时EPS的合成量也较大,故进一步验证具有黏性的EPS有助于藻群体的进一步形成.大的微囊藻群体只在部分时间段出现,第6 d和第15 d是铜绿微囊藻群体形成的集中时间段,其中N=10 mg/L、P=0.5 mg/L(NP3组)条件对细胞数10~100的藻群体最有利,而细胞数>100的藻群体在高初始N、P浓度(NP5组)条件下较易形成,表明铜绿微囊藻藻群体大小随着营养盐浓度的升高而增大,即降低N、P浓度在一定程度上能够控制藻群体增长.

|
图 3 不同初始N、P浓度条件下铜绿微囊藻群体形成情况 Fig.3 The Microcystis aeruginosa groups under the condition of different original N and P concentrations |
不同Ca2+浓度条件下,铜绿微囊藻藻群体形成情况表明, 整个培养期间细胞数>100的藻群体只在第9 d 260 mg/L(Ca2+5组)条件下出现,且密度极小,相比N、P浓度条件下,形成的藻群体密度成倍增长,且Ca2+对藻群体形成的影响比N、P要显著(P<0.05).培养前15 d,铜绿微囊藻在130 mg/L Ca2+浓度下(Ca2+4组)形成的群体最大,其次是高浓度260 mg/L Ca2+浓度下(Ca2+5组)条件下,结合图 1b和图 2b,此条件均不是藻生长及EPS合成的最佳值.其可能的原因是,当藻形成群体时更容易适应外界恶劣的环境,以及Ca2+在微囊藻群体形成的过程中起桥架作用[9];15 d后,适中Ca2+浓度下(65 mg/L, Ca2+3组)形成的藻群体最大,此时藻生长量同样处于优势,进一步表明藻群体的形成是藻生长及聚集的一个过程.在整个培养期间,低Ca2+浓度条件下的藻群体形成密度较小且稳定;高Ca2+浓度条件下,藻群体密度在3.0×105 cells/ml范围内波动.细胞数为10~100和>100的藻群体均在培养前段时间(12 d前)集中形成,且均易在较高Ca2+浓度条件下聚集,可进一步推测Ca2+对铜绿微囊藻群体聚集的影响大于EPS对藻群体的粘结作用(图 4).
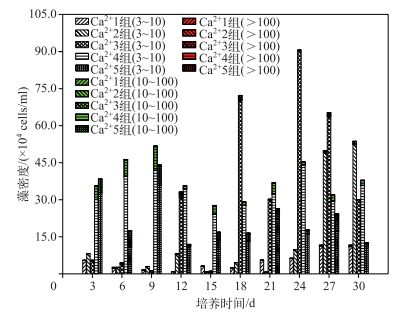
|
图 4 不同初始Ca2+浓度条件下铜绿微囊藻群体形成情况 Fig.4 The Microcystis aeruginosa groups under the condition of different original Ca2+ concentrations |
低光照强度不利于藻群体形成,在培养前期,藻群体形成密度很小,光照强度的影响并不明显(P>0.05);在培养后期,高光照强度条件下,藻群体密度急剧增加,其可能的原因是藻群体形成对光照的接收需要一定时间(图 5),这与李小龙等[33]的研究发现铜绿微囊藻能抗强光伤害结论一致.调节光强对细胞数较大的藻群体形成无明显促进作用,培养过程中细胞个数为10~100的藻群体只在培养后期的高光照强度(8000 lux)条件下检测到,其数量并不多,此条件下的EPS合成量较高,对藻群体形成有一定促进作用,而细胞个数>100的藻群体并未检测到.故高光照强度对铜绿微囊藻群体的形成相对有利,因此,适当调节光照强度能有效控制藻群体形成.对比图 3可知,不同光照条件下的藻群体密度比不同N、P浓度条件下的藻群体数大,N、P浓度下的藻群体增长主要在培养前期,而光照条件下的藻群体形成主要在培养后期,即微囊藻在只满足光照条件时需要长时间才能实现生物量的积累和增长.
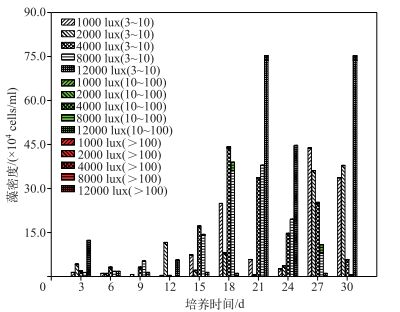
|
图 5 不同光强条件下铜绿微囊藻群体形成情况 Fig.5 The Microcystis aeruginosa groups under the condition of different light intensities |
不同温度条件下的藻群体形成大小低于控制Ca2+和光强条件下形成的藻群体大小,但在培养过程中有细胞数>100的藻群体形成(图 6).结合图 3,控制N、P浓度条件下总的藻群体形成密度也较小,但会有>100的藻群体出现,这可能是不同N、P浓度和温度条件下总的藻群体密度较低的原因之一. 25℃是能形成大群体的最佳温度,结合图 1d和图 2d,30℃最有利于单细胞藻生长,同样在培养后期有利于细胞数为3~10的藻群体形成,20℃最有利于EPS合成,但此条件并非藻群体形成的最优温度,故温度和EPS浓度对藻群体形成是独立又相互影响的因子.低温(15℃)在培养后期对小群体藻形成较有利,高温对藻群体密度的影响表现为先下降然后又回升的趋势,进一步表明铜绿微囊藻适应的温度范围宽,对高温具有良好的适应性.
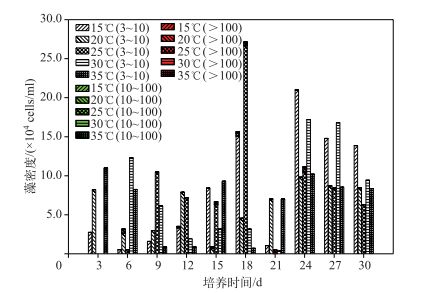
|
图 6 不同温度条件下铜绿微囊藻群体形成情况 Fig.6 The Microcystis aeruginosa groups under the condition of different temperatures |
图 7为激光共聚焦显微镜下群体微囊藻的形态,其中A表示过渡态,B表示分裂态,从A到B可看出,藻细胞逐渐变大和变多,有逐渐聚集集中的趋势,即分裂态的微囊藻群体比过渡态的微囊藻群体庞大,结合更为紧密,细胞密集区处于群体结构的中心部位.进一步证明铜绿微囊藻形成群体的方式之一是通过分裂增殖累计细胞数目形成,刘光涛[10]的研究也证实了此结论.图中蓝色指示EPS,绿色指示Ca2+,EPS在过渡态群体的中心部位相对较少,主要分布在藻群体的外边缘,起包裹作用,而Ca2+则主要分布在相对成熟的细胞中(图 7A). EPS主要分布在分裂态群体中细胞较为密集的部分,Ca2+也随着细胞的分裂聚集逐渐增多(图 7B).将A和B中的a、b、c三幅图对应来看,铜绿微囊藻群体形成过程中,EPS的合成主要是由过渡态的细胞分泌,先在即将形成群体的外周起粘结保护作用,随着细胞的分裂增殖,藻群体的密集部位EPS浓度逐渐增加,藻群体逐渐增大;Ca2+则是随着细胞的增长聚集而逐渐增加,从微观角度可以确定Ca2+在群体形成过程中起着重要作用.从A和B的复合图观察得藻群体的蓝色范围与绿色范围几乎相重合,且蓝色更为明显,说明Ca2+多集中分布在群体微囊藻的EPS内部,进一步表明Ca2+会影响藻细胞膜的通透性,从而影响EPS向细胞外分泌的过程.

|
图 7 激光共聚焦显微镜下过渡状态(A)和分裂状态(B)的微囊藻群体的形态特征 Fig.7 The morphological characteristics of Microcystis aeruginosa group at transition state(A) and division state(B) under the laser scanning confocal microscope |
扫描电子显微镜下单细胞与群体微囊藻的形态如图 8所示. a是纯培养的单细胞铜绿微囊藻,呈分散排列,大多单个存在,也有个别细胞松散地连接在一起,细胞表面有少量的多糖,进一步表明铜绿微囊藻形成群体的另一种方式是通过单细胞直接聚集形成. b是前期实验培养成熟的铜绿微囊藻群体的存在形态,群体细胞由厚厚的多糖胶鞘粘结在一起,多糖胶鞘表面有许多颗粒小晶体,根据荧光标记可知其为Ca2+晶体,进一步表明Ca2+有助于EPS合成以及铜绿微囊藻群体形成.胶鞘内部有细胞间隙,为铜绿微囊藻上浮机制创造条件,并能调节微囊藻在水体中运动,同时会影响其对光照以及营养盐的吸收. b中大部分细胞正处于分裂期,子母细胞在分裂完成后并没完全分开,而是在一个公共的EPS胶质鞘包围下紧贴在一起,并且不断进行分裂进而形成更大的细胞群体.比较单细胞和群体细胞的形态特征可知,群体细胞周围的胶质鞘更加明显和清晰,由多糖和果胶质组成的胶质层更厚,即具有粘性的EPS有助于藻群体的形成.

|
图 8 扫描电子显微镜下单细胞(a)和群体(b)铜绿微囊藻的形态特征比较 Fig.8 The comparison of the single-celled(a) and colonial(b) Microcystis aeruginosa under the scanning electron microscope |
1) 当N≤100 mg/L、P≤5 mg/L时,微囊藻生长和EPS合成随着N、P浓度增加而增加,当N≥10 mg/L、P≥0.5 mg/L时,不同N、P浓度条件下,藻生长量无显著性差异(P>0.05),即N=10 mg/L、P=0.5 mg/L就能使铜绿微囊藻呈优势增长,大的藻群体在N=100 mg/L、P=5 mg/L时较易形成.低浓度Ca2+对微囊藻生长无明显促进作用,适宜浓度的Ca2+(65 mg/L)有利于藻生长,浓度过高则会抑制藻细胞增殖;EPS合成量随着Ca2+浓度的增加反而降低,过高浓度的Ca2+在刺激微囊藻细胞分泌EPS的同时可能会促进其溶解,0.13 mg/L Ca2+条件下EPS合成量最大能达到77 μg/ml,Ca2+和EPS均对微囊藻群体形成起桥架粘结作用.光照和温度对EPS合成有一定促进作用,且其促进效果均高于N、P和Ca2+作用,EPS的合成随着温度升高先增加后降低;30℃最适宜铜绿微囊藻生长,最高细胞密度可达3.15×107 cells/ml;25℃是能形成大群体的最佳温度,20℃是同时满足微囊藻生长及EPS合成相对最有利的温度条件.
2) EPS的合成主要是由过渡态的细胞分泌,在即将形成群体的外周起粘结保护作用,随着细胞的分裂增殖,藻群体密集部位的EPS浓度逐渐增加,藻群体逐渐增大;群体细胞周围比单细胞的胶质鞘更加明显和清晰,胶质层更厚,进而表明具有粘性的EPS在藻群体形成过程中发挥着重要作用;Ca2+则是随着细胞的增长聚集而逐渐增加,多糖胶鞘表面有许多Ca2+晶体,从微观角度可以确定Ca2+在EPS合成及群体形成过程中起着重要作用.
致谢: 李哲副研究员提供了部分野外观测数据,赵彬副教授帮忙审阅和修改了有关内容,於阳帮忙收集资料,谨致谢意.| [1] |
Song Linxu, Liu Defu, Cui Yujie. Study on the distribution of non-point nitrogen and phosphorus load from Xiangxi River in the Three Gorges Reservoir. Environmental Science, 2016, 36(2): 428-434. [宋林旭, 刘德富, 崔玉洁. 三峡库区香溪河流域非点源氮磷负荷分布规律研究. 环境科学学报, 2016, 36(2): 428-434.] |
| [2] |
Yu You, Ran Kuilin, Zhang Tao. Research progress of environmental factors on the growth and physiology of Microcystis aeruginosa. Technology Rich Wizard, 2011, 24: 265-267. [余游, 冉奎林, 张涛. 环境因子对铜绿微囊藻生长、生理影响研究进展. 科技致富向导, 2011, 24: 265-267.] |
| [3] |
Anderson DM, Burkholder JM, Cochlan WP et al. Harmful algal blooms and eutrophication:Examining linkages from selected coastal regions of the United States. Harmful Algae, 2008, 8(1): 39-53. DOI:10.1016/j.hal.2008.08.017 |
| [4] |
Bi Xiangdong, Dai Wei, Zhang Shulin et al. Research progress on the competitive advantages and formation mechanism of Microcystis colony. Environmental Science & Technology, 2014, 7: 41-44. [毕相东, 戴伟, 张树林等. 微囊藻群体的竞争优势及其形成机制的研究进展. 环境科学与技术, 2014, 7: 41-44.] |
| [5] |
Xu Lina, Li Xudong, Wang Xin et al. The research progress on the effects of abiotic factors on the physiological function of Microcystis aeruginosa. Guangzhou Chemical Industry, 2014, 13: 3-7. [徐莉娜, 李旭东, 王鑫等. 非生物因子对铜绿微囊藻生理代谢影响的研究进展. 广州化工, 2014, 13: 3-7.] |
| [6] |
Wu ZX, Gan NQ, Huang Q et al. Response of Microcystis to copper stress-Do phenotypes of Microcystis make a difference in stress tolerance. Environmental Pollution, 2007, 147(2): 324-330. DOI:10.1016/j.envpol.2006.05.022 |
| [7] |
Alexova R, Fujii M, Birch D et al. Iron uptake and toxin synthesis in the bloom-forming Microcystis aeruginosa under iron limitation. Environmental Microbiology, 2011, 13(4): 1064-1077. DOI:10.1111/emi.2011.13.issue-4 |
| [8] |
Sharma M, Kaushik A, Somvir et al. Sequestration of chromium by exopolysaccharides of Nostoc and Gloeocapsa from dilute aqueous solutions. Journal of Hazardous Materials, 2008, 157(2/3): 315-318. |
| [9] |
Wang YW, Zhao J, Li JH et al. Effects of calcium levels on colonial aggregation and buoyancy of Microcystis aeruginosa. Current Microbiology, 2011, 62(2): 679-683. DOI:10.1007/s00284-010-9762-7 |
| [10] |
Liu Guangtao. Research of inducing Microcystis aeruginosa colony[Dissertation]. Nanjing:Nanjing University, 2012. [刘光涛. 铜绿微囊藻群体诱导研究[学位论文]. 南京: 南京大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10284-1012376935.htm ]
|
| [11] |
Wallace BB, Hamilton DP. The effect of variations in irradiance on buoyancy regulation in Microcystis aeruginosa. Classical Review, 2009, 22(4): 132-133. |
| [12] |
Lu Yuan, Wen Jianfan. Isolation, pure cultivation and total DNA extraction of Microcystis aeruginosa Kutz in Dianchi Lake. J Lake Sci, 2001, 13(3): 285-288. [陆源, 文建凡. 滇池铜绿微囊藻(M. areuginosa Kutz)的分离培养与总DNA提取的改进. 湖泊科学, 2001, 13(3): 285-288. DOI:10.18307/2001.0314] |
| [13] |
Zhou Jian, Yang Guijun, Qing Boqiang et al. Effects of nitrogen and phosporous on colony formation of Microcystis aeruginosa. Research of Environmental Sciences, 2014, 27(11): 1251-1257. [周健, 杨桂军, 秦伯强等. 氮磷对铜绿微囊藻群体形态的影响. 环境科学研究, 2014, 27(11): 1251-1257.] |
| [14] |
Guo Jinsong, Sheng Jinping, Li Zhe et al. Seasonal variation of phytoplankton community in Xiaojiang backwater area during the preliminary operation stage of the Three Gorges Reservoir. Environmental Science, 2010, 31(7): 1492-1497. [郭劲松, 盛金萍, 李哲等. 三峡水库运行初期小江回水区藻类群落季节变化特点. 环境科学, 2010, 31(7): 1492-1497.] |
| [15] |
Li Zhe, Guo Jinsong, Fang Fang et al. Seasonal variation of cyanobacteria and its potential relationship with key environmental factors in Xiaojiang back water area, Three Gorges Reservoir. Environmental Science, 2010, 31(2): 301-309. [李哲, 郭劲松, 方芳等. 三峡小江回水区蓝藻季节变化及其与主要环境因素的相互关系. 环境科学, 2010, 31(2): 301-309.] |
| [16] |
Wu Min, Lin Li, Huang Zhuo. Environmental factors affecting freshwater algae growth:A case study on Microcystis aeruginosa. Journal of Yangtze River Scientific Research Institute, 2012, 29(10): 41-47. [吴敏, 林莉, 黄茁. 淡水藻类生长的环境影响因子分析——以铜绿微囊藻为例. 长江科学院院报, 2012, 29(10): 41-47. DOI:10.3969/j.issn.1001-5485.2012.10.009] |
| [17] |
Guo Lili, Zhu Wei, Li Ming. Effect of major cations in water on the growth and polysaccharide contents of Microcystis aeruginosa. Ecology and Environmental Sciences, 2013, 22(8): 1358-1364. [郭丽丽, 朱伟, 李明. 水中主要阳离子对铜绿微囊藻生长及多糖的影响. 生态环境学报, 2013, 22(8): 1358-1364.] |
| [18] |
Yang Z, Geng L, Wang W et al. Combined effects of temperature, light intensity, and nitrogen concentration on the growth and polysaccharide content of Microcystis aeruginosa in batch culture. Biochemical Systematics & Ecology, 2012, 41(1): 130-135. |
| [19] |
Gallo MD, Haegi A. Characterization and quantification of exocellular polysaccharides in Azospirillum brasilense and Azospirillum lipoferum. Symbiosis, 1990.
|
| [20] |
Wang Xingdong, Lin Zhongshan, Zhang Liyong et al. The structure of scanning electron microscope and the preparation of sample. Guangzhou Chemical Industry, 2012, 40(19): 28-30. [王醒东, 林中山, 张立永等. 扫描电子显微镜的结构及对样品的制备. 广州化工, 2012, 40(19): 28-30. DOI:10.3969/j.issn.1001-9677.2012.19.013] |
| [21] |
Yu Lihou. Methods of sample preparation for laser scanning confocal microscopy(1)-Sample of cultured cells. Journal of Chinese Electron Microscopy Society, 2010, 29(2): 185-188. [余礼厚. 激光共聚焦显微镜样品制备方法(一)——细胞培养样品. 电子显微学报, 2010, 29(2): 185-188.] |
| [22] |
Patricia GC, Constanza BM, Guzmán AM et al. Calcofluor white stain. Tabers Cyclopedic Medical Dictionary, 2009.
|
| [23] |
Xu Hai, Wu Yali, Yang Guijun et al. Tolerance of Microcystis aeruginosa and Scendesmus obliquus to nitrogen and phosphorus deficiency. Ecological Science, 2014, 33(5): 879-884. [许海, 吴雅丽, 杨桂军等. 铜绿微囊藻、斜生栅藻对氮磷饥饿的耐受能力研究. 生态科学, 2014, 33(5): 879-884.] |
| [24] |
Luo Dong, Chen Rong, Cheng Qing et al. Effects of different phosphorus concentrations and ratios of N/P on the growth of Microcystis aeruginosa and the water environmental factors. Environmental Science & Technology, 2015, 7: 6-9. [罗东, 陈荣, 程青等. 不同磷浓度和N/P对铜绿微囊藻生长及水环境因子的影响. 环境科学与技术, 2015, 7: 6-9.] |
| [25] |
Shi JQ, Wu ZX, Song LR. Physiological and molecular responses to calcium supplementation in Microcystis aeruginosa (Cyanobacteria). New Zealand Journal of Marine & Freshwater Research, 2013, 47: 51-61. |
| [26] |
Blokhina O, Virolainen E, Fagerstedt KV. Antioxidants, oxidative damage and oxygen deprivation stress:A review. Annals of Botany, 2003, 91Spec(2): 179-194. |
| [27] |
Liu Shiming, Zhu Xuezhu, Zhang Min. Growth and photosynthetic capacity of Microcystis aeruginosa and Chlorella pyrenoidosa in response to the interactions of temperature and light. J Lake Sci, 2014, 26(5): 773-779. [刘世明, 朱雪竹, 张民. 铜绿微囊藻(Microcystis aeruginosa)和蛋白核小球藻(Chlorella pyrenoidosa)生长及光合活性对温度光照交互作用的响应. 湖泊科学, 2014, 26(5): 773-779. DOI:10.18307/2014.0516] |
| [28] |
Fu Baorong, Lu Nan, Miao Bin et al. Effects of environmental factors on growth and toxin production of Microcystis aeruginosa. Journal of Liaoning University:Natural Sciences Edition, 2015, 42(1): 85-90. [付保荣, 鲁男, 苗斌等. 环境因子对铜绿微囊藻生长和产毒的影响. 辽宁大学学报:自然科学版, 2015, 42(1): 85-90.] |
| [29] |
Philippis RD, Margheri MC, Pelosi E et al. Exopolysaccharide production by a unicellular cyanobacterium isolated from a hypersaline habitat. Journal of Applied Phycology, 1993, 5(5): 387-394. |
| [30] |
Magaletti E, Urbani R, Sist P et al. Abundance and chemical characterization of extracellular carbohydrates released by the marine diatom Cylindrotheca fusiformis under N-and P-limitation. European Journal of Phycology, 2004, 39(2): 133-142. DOI:10.1080/0967026042000202118 |
| [31] |
Lei Lamei, Song Lirong, Ou Danyun et al. Effects of nutrient conditions on expolysaccharide production in water-bloom forming cyanobacteria, Microcystis aeruginosa. Acta Scientaiarum Naturalium Universitatis Sunyatseni, 2007, 46(3): 84-87. [雷腊梅, 宋立荣, 欧丹云等. 营养条件对水华蓝藻铜绿微囊藻的胞外多糖产生的影响. 中山大学学报:自然科学版, 2007, 46(3): 84-87.] |
| [32] |
Shi Junqiong, Ma Jianmin, Wu Zhongxing. Effects of environmental factors on extracellular polysaccharide produced by Microcystis aeruginosa PCC7820. Journal of Henan Normal University:Natural Science, 2008, 36(5): 119-123. [施军琼, 马剑敏, 吴忠兴. 环境因子对铜绿微囊藻7820胞外多糖的影响. 河南师范大学学报:自然科学版, 2008, 36(5): 119-123.] |
| [33] |
Li Xiaolong, Geng Yahong, Li Yeguang et al. The advantages in competition based on the photosynthetic characteristics of Microcystis aeruginosa. Journal of Wuhan Botanical Research, 2006, 24(3): 225-230. [李小龙, 耿亚红, 李夜光等. 从光合作用特性看铜绿微囊藻(Microcystis aeruginosa)的竞争优势. 植物科学学报, 2006, 24(3): 225-230.] |
 2017, Vol. 29
2017, Vol. 29 
