(2: 江苏省水利厅工程管理处, 南京 210029)
(3: 国信招标集团股份有限公司河南分公司, 郑州 450000)
(2: Engineering Management Division, Water Resources Department of Jiangsu Province, Nanjing 210029, P. R. China)
(3: Guoxin Tendering Group, Henan Branch, Zhengzhou 450000, P. R. China)
底栖动物是湖泊生态系统中一个重要的组成部分,其活动在很大程度上影响着湖泊水泥界面氮、磷营养盐的循环,间接加速或者减缓湖泊水体的富营养化进程.研究表明,底泥氮、磷释放量的增加在加速浅水湖泊富营养化方面起着重要作用[1-2].水泥界面上的氮、磷交换受到多种物理、化学和生物因素的影响,底栖动物主要通过营养盐的排泄和生物扰动作用来影响水体中营养盐的动态变化过程[3-8]. Fukuhara等[6]发现摇蚊幼虫和颤蚓能够通过生物扰动作用促进底泥氮磷的释放. Conroy等[9]研究发现贻贝的氮、磷排泄能够缩短水体中氮、磷的转化周期.
太湖是中国第三大淡水湖,也是一个典型的浅水湖泊,平均水深仅为1.9 m.近年来,由于太湖周边经济的高速发展,大量氮磷等营养物质排入湖中,导致太湖水质不断恶化,富营养化趋势日趋严重[10].太湖是属于平原地区的大型浅水湖泊,外源营养物质进入湖盆后沉积至底泥中,由于内源释放的静态和动态释放,在外源加强控制的背景下,水柱中营养水平仍能保持较高水平,富营养化仍很严重[11].目前有关太湖内源释放的研究很多,且集中在沉积物中氮、磷、重金属等元素的含量、形态和分布变化,以及风浪扰动等非生物因子对沉积物营养盐释放的影响,目前有关水生动物,特别是底栖动物对太湖水体营养盐变化影响的研究较少,主要集中在生物扰动对底泥营养盐释放的影响方面,而对底栖动物直接排泄对水体氮、磷浓度的潜在影响甚少[12-15].
霍甫水丝蚓是现阶段广泛分布于太湖、具有代表性的寡毛类优势种,耐污性较强,能在低氧环境下正常生长繁殖,甚至在缺氧环境下也能短期生存,常被用来作为有机污染或富营养化的标志性指示种[1-2],目前在太湖拥有相对较高的密度和生物量,是重要的营养物潜在排泄种类.本文选取太湖霍甫水丝蚓作为研究对象,以温度和密度为模拟控制条件,通过分析霍甫水丝蚓NH4+-N、PO43--P释放速率,研究了不同温度和密度对霍甫水丝蚓NH4+-N、PO43--P释放的影响.运用上述实验获得的霍甫水丝蚓释放率与温度的模拟方程,结合对野外太湖霍甫水丝蚓实测生物量数据,得到太湖霍甫水丝蚓NH4+-N和PO43--P释放量的年际变化和季节变化,初步估算太湖霍甫水丝蚓对水体氮、磷的贡献量,研究结果为进一步研究底栖动物对太湖营养盐物质循环的影响提供基础资料.
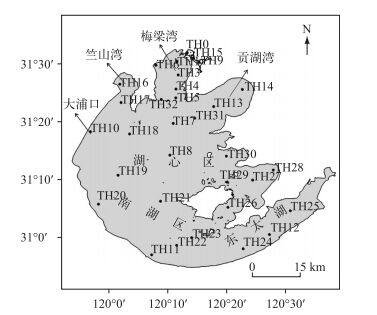
1 材料和方法 1.1 野外数据及实验生物采集根据预采样结果在太湖全湖共设32个采样点(图 1),在2007-2010年对太湖霍甫水丝蚓进行4年的野外调查.采样频率为每季度采样1次,分别为每年的2、5、8和11月.样品定量采集使用1/40 m2改良Peterson采泥器,泥样经60目尼龙网筛洗净后,在白瓷盘中将样本挑出,并置于10%福尔马林溶液中保存.实验所用霍甫水丝蚓采自太湖大浦口TH10常规监测点附近水域.霍甫水丝蚓采集后尽快带回实验室,挑出个体大小接近的用于室内模拟不同温度和密度对霍甫水丝蚓氮、磷释放率的影响.称量霍甫水丝蚓的湿重时,先用滤纸将标本体表的水分吸去,直至滤纸上没有湿的印迹为止,然后置于电子天平上称量,最终结果折算成单位面积的密度和生物量.霍甫水丝蚓的干重利用其干湿重比进行换算.
|
图 1 太湖采样点示意 Fig.1 Locations of the 32 sampling sites in Lake Taihu |
2011年6月中旬开始实验.以温度(5、10、15、20、25和30℃)和霍甫水丝蚓密度(0、5000、10000、15000、20000和25120 ind./m2)为模拟控制条件进行实验,共分为30种组合,每种实验组合设置4个重复.实验用水取自太湖大浦口TH10常规监测点附近水域,经25#浮游生物网过滤后,再用Whatman GF/C膜进行过滤后保存,为避免营养盐的背景值对实验产生影响,将滤后湖水与蒸馏水按1:4比例混合后使用.实验时从泥样中挑选出个体大小相近,体长约30 mm的霍甫水丝蚓,用蒸馏水清洗其表面,按0、10、20、30、40和50条分别放入装有50 ml混合水的烧杯(底面半径为2.5 cm,容积为100 ml)中,再将烧杯置于GSX-300BS光照培养箱中,在设定温度下黑暗中培养6 h.实验结束后,将每个烧杯中的50 ml水样过滤(Whatman GF/C)并尽快测定水样中NH4+-N和PO43--P浓度.而每个烧杯中的霍甫水丝蚓则转移至对应的锡箔纸上,放入80℃的烘箱中烘24 h后拿出称量其干重.
1.3 测定指标与方法因为霍甫水丝蚓通过新陈代谢作用释放的主要含氮排泄物是NH4+-N,主要含磷排泄物是PO43--P,用实验后各处理组水体中的NH4+-N(或PO43--P)与对照组中NH4+-N(或PO43--P)的浓度差值计算霍甫水丝蚓NH4+-N、PO43--P的释放量.用纳氏比色法测定水体NH4+-N浓度,用钼锑抗分光光度法测定水体PO43--P浓度.
1.4 数据分析与处理霍甫水丝蚓NH4+-N、PO43--P释放率计算公式为:
| ${\rm{lg}}\;{R_T} = 0.895\,{\rm{lg}}\;W + 0.022T + 0.154$ | (1) |
式中, RT为水温T条件下的释放率(μg/mg(dw)·d),W为霍甫水丝蚓个体干重(mg),T为水体温度(℃).
室内控制实验数据采用SPSS 16.0软件进行统计分析处理,通过方差分析(ANOVA)分析温度、密度对霍甫水丝蚓NH4+-N、PO43--P释放率的影响.利用Q10确定霍甫水丝蚓NH4+-N、PO43--P释放率和温度的关系[3-7]. Q10=RT1+10/RT1,RT1为温度T1时的释放率,RT1+10为温度T1+10时的释放率.
霍甫水丝蚓NH4+-N和PO43--P释放量计算公式分别为:
| ${Q_{\rm{N}}} = \left( {0.2821T - 0.4953} \right) \cdot {W_{\rm{A}}} \cdot S \cdot D \cdot {10^{ - 6}}$ | (2) |
| ${Q_{\rm{P}}} = \left( {0.0199T + 0.133} \right) \cdot {W_{\rm{A}}} \cdot S \cdot D \cdot {10^{ - 6}}$ | (3) |
式中, QN、QP分别为NH4+-N、PO43--P的释放量(kg),T为水体温度(℃),S为计算面积(m2),WA为S面积内的霍甫水丝蚓总生物量干重(g),D为天数.利用太湖各采样点所代表的面积权重和生物量计算出各采样点霍甫水丝蚓NH4+-N和PO43--P年平均释放量,从而获得太湖各区域霍甫水丝蚓NH4+-N和PO43--P年平均释放量.其中生物量数据由野外采样获得,而水温数据由中国科学院南京地理与湖泊研究所太湖湖泊生态系统研究站提供.
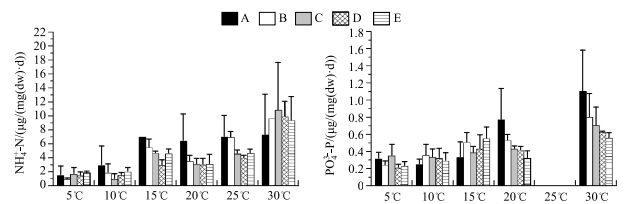
2 结果 2.1 温度和密度对霍甫水丝蚓NH4+-N、PO43--P释放率的影响太湖霍甫水丝蚓随着温度的升高NH4+-N和PO43--P的释放率均呈现逐渐升高的趋势(图 2).方差分析结果显示,温度对霍甫水丝蚓NH4+-N和PO43--P释放率均有极显著影响,而密度则均没有显著影响;温度和密度对霍甫水丝蚓的NH4+-N释放率不存在交互作用,而对PO43--P释放率则存在交互作用(表 1).
|
图 2 不同温度下霍甫水丝蚓NH4+-N和PO43--P释放率 Fig.2 NH4+-N and PO43--P excretion rates of L. hoffmeisteri at different temperatures (注:由于实验数据异常,将霍甫水丝蚓在25℃时PO43--P释放率去掉) |
| 表 1 温度、密度及其交互作用对霍甫水丝蚓NH4+-N、PO43--P释放率影响的方差分析 Tab.1 UNIANOVA of effects of temperature, density and their interaction on the NH4+-N, PO43--P excretion of L. hoffmeisteri |
多重比较发现,5、10、15和20℃时霍甫水丝蚓NH4+-N释放率不存在显著性差异(P>0.05),15、20和25℃时霍甫水丝蚓NH4+-N释放率也不存在显著性差异(P>0.05),30℃时霍甫水丝蚓NH4+-N释放率与其他温度之间存在显著差异(P<0.05).由于实验数据异常,将霍甫水丝蚓在25℃时PO43--P释放率去掉. PO43--P释放率在5℃与10℃温度之间不存在差异(P>0.05),15℃和20℃温度之间也不存在差异(P>0.05),而30℃其PO43--P释放率则与他温度存在显著差异(P<0.05).
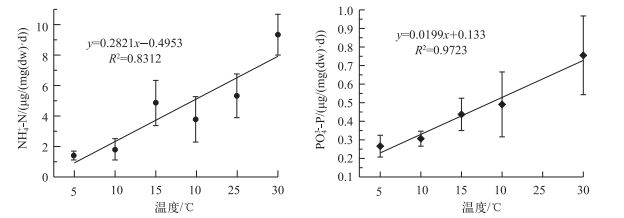
因为密度变化对霍甫水丝蚓NH4+-N和PO43--P释放率没有显著影响,故分别拟合温度与霍甫水丝蚓NH4+-N和PO43--P释放率之间的关系(图 3),进而获得温度与霍甫水丝蚓NH4+-N和PO43--P释放率之间的线性方程:RNH4+-N=0.2821T-0.4953,R2=0.8312;RPO43--P=0.0199T+0.133,R2=0.9723.NH4+-N释放率不同温度区间的Q10值存在差异,但是在10~20和20~30℃时差别不大,分别为2.11和2.47(图 2).而PO43--P释放率的Q10值在不同温度区间变化很小,且Q10值较小,仅为1.5.
|
图 3 不同温度下霍甫水丝蚓NH4+-N和PO43--P释放率 Fig.3 NH4+-N and PO43--P excretion rates of L. hoffmeisteri at different temperatures |
2007-2010年太湖霍甫水丝蚓的年际变化表明(表 2),除2010年外,太湖霍甫水丝蚓NH4+-N和PO43--P的释放量随生物量的增加而增大;2007年太湖霍甫水丝蚓的生物量是2008年的2.5倍,其NH4+-N和PO43--P释放量分别为2008年的2.8和2.7倍;2008年太湖霍甫水丝蚓的生物量是2009年的1.2倍,其NH4+-N和PO43--P释放量则均为2009年的1.1倍.另太湖霍甫水丝蚓NH4+-N和PO43--P的释放量与霍甫水丝蚓数量的变化并不一致(表 2). 2010年霍甫水丝蚓数量比2009多15%,但是2010年霍甫水丝蚓的NH4+-N和PO43--P释放量却分别比2009年减少了46%和30%;而2007-2009年太湖霍甫水丝蚓的NH4+-N和PO43--P释放量和数量则都逐年降低.
| 表 2 太湖霍甫水丝蚓NH4+-N和PO43--P释放量的年际变化 Tab.2 Annual change of NH4+-N and PO43--P excretion of L. hoffmeisteri in Lake Taihu |
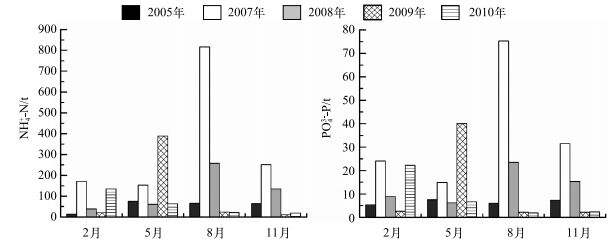
从季节变化看(图 4),各年霍甫水丝蚓NH4+-N和PO43--P释放量的季节变化有较大差异. 2009年霍甫水丝蚓NH4+-N释放量的最大值出现在春季(5月),最小值出现在秋季(11月). 2007和2008霍甫水丝蚓NH4+-N释放量的最大值均出现在夏季(8月),2007年最小值出现在春季(5月),2008年最小值出现在冬季(2月). 2010年霍甫水丝蚓NH4+-N释放量的最大值出现在冬季(2月),最小值出现在秋季(11月).各年霍甫水丝蚓PO43--P释放量的季节变化与其NH4+-N释放量的季节变化基本相一致.
|
图 4 不同季节太湖霍甫水丝蚓NH4+-N和PO43--P的释放量 Fig.4 NH4+-N and PO43--P excretion of L. hoffmeisteri in different seasons |
对颤蚓类而言,培养时间不超过24 h,有无营养基底对其释放率没有影响,即使食物缺乏,颤蚓类NH4+-N和PO43--P释放率在20 h之内随时间变化不大[8, 16-17]. Fukuhara和Yasuda发现,颤蚓类NH4+-N排泄在培养的前8 h内是连续的,而其PO43--P排泄在前10 h内也是连续的[3-4].因此本实验采用无食物供给,在黑暗培养霍甫水丝蚓6 h后测定其NH4+-N和PO43--P释放率是合理有效的.另外Fukuhara和Yasuda也发现粪便对释放率也没有显著影响[3-4].
根据文献报道,统计了不同实验条件下所测得的颤蚓类NH4+-N和PO43--P释放率(表 3)表明,不同文献报道的颤蚓类NH4+-N释放率不同,这可能由于不同文献选用的实验颤蚓种类不同、实验条件不完全相同造成,本研究所测得的霍甫水丝蚓NH4+-N释放率除在15℃时较其他研究偏高外,均与其他相同温度下的研究结果相近,这可能是实验过程中人为原因造成的. Postolache等[5]认为,其实验结果中颤蚓类在高温23℃时NH4+-N释放率的迅速升高是由于高温环境下有机体异常生理活动造成的.由于太湖夏季平均水温可达到25℃以上,因此太湖霍甫水丝蚓的生理代谢可能异于其他地区,本研究发现太湖霍甫水丝蚓NH4+-N释放率在30℃时与其他温度存在显著差异(P<0.05),霍甫水丝蚓PO43--P释放率也具有相同的特点.本研究霍甫水丝蚓NH4+-N释放率在10~20和20~30℃时的Q10值分别为2.11和2.47,与Postolache等的研究结果接近(Q10=2.52)[5].一般而言,Q10值在2~3之间是无脊椎动物的特点之一[18],说明霍甫水丝蚓NH4+-N释放率受温度的影响较大.与以前的研究结果相比,本研究测得的霍甫水丝蚓PO43--P释放率较高,但是其Q10值仅为1.5,略高于Postolache等的研究结果(Q10=1.31),低于Fukuhara和Yasuda的Q10值(Q10=2)[3, 5],说明霍甫水丝蚓PO43--P释放率对温度升高的敏感性较小.整体而言,霍甫水丝蚓NH4+-N和PO43--P释放率均随着温度的升高而增加.近年来夏季高温时太湖中很容易爆发蓝藻水华,而藻类营养盐的来源也包括内源释放的营养盐.霍甫水丝蚓在高温条件下能够释放大量的NH4+-N和PO43--P,其营养盐释放可能会对太湖蓝藻水华爆发产生促进作用.
| 表 3 不同实验条件下水丝蚓NH4+-N和PO43--P释放率 Tab.3 NH4+-N and PO43--P excretion rates reported by several authors for tubificids worms in different experimental conditions |
目前研究颤蚓类种群密度对底泥氮、磷释放的影响较多,而关于颤蚓类的种群密度对其自身释放率的影响尚没有相关方面的报道[6, 19].本研究中发现霍甫水丝蚓的种群密度对其自身的NH4+-N和PO43--P释放率均没有显著影响.这可能是因为培养时间较短,霍甫水丝蚓以自身肠胃内的原有食物作为新陈代谢的来源,且种群密度没有超过环境容量,个体之间不存在竞争关系造成的.
3.2 太湖霍甫水丝蚓NH4+-N和PO43--P释放量的时空变化霍甫水丝蚓NH4+-N和PO43--P释放量通过其NH4+-N和PO43--P释放率方程和生物量计算得来的,所以霍甫水丝蚓NH4+-N和PO43--P释放量受水温和生物量的影响很大.霍甫水丝蚓NH4+-N和PO43--P释放量随生物量的增加或温度的升高而增大,故2010年太湖霍甫水丝蚓NH4+-N和PO43--P释放量异常的原因很可能与当年温度有关(表 2).一般情况下,太湖霍甫水丝蚓在春季(3-5月)会出现一个生物量高峰,故太湖霍甫水丝蚓NH4+-N和PO43--P释放量在春季会较大.虽然太湖霍甫水丝蚓在夏季(6-8月)的生物量较小,但是由于太湖夏季水温较高,故其NH4+-N和PO43--P释放量也较大.而太湖霍甫水丝蚓NH4+-N和PO43--P释放量在秋、冬季较低主要是由于温度较低造成的. 2007年太湖霍甫水丝蚓NH4+-N和PO43--P在竺山湾释放量很大,而在2008-2010年释放量较小的原因是竺山湾在2008年进行了清淤造成霍甫水丝蚓的生物量急剧减少.
3.3 太湖霍甫水丝蚓对水体N、P贡献2007-2009年太湖霍甫水丝蚓NH4+-N和PO43--P释放量的平均值分别为1925.54和210.00 t.根据文献的报道[21-22],1980-1981和1987-1988年间太湖全湖入湖NH4+-N总量分别为4700和5362.6 t,本研究中计算得到的霍甫水丝蚓NH4+-N年平均释放量分别相当于1980-1981和1987-1988年入湖NH4+-N总量的50%和36%. 1994和1998年太湖环湖河道总氮入湖量分别为32072.5和32053.32 t,则霍甫水丝蚓NH4+-N年平均释放量分别约为1994和1998年入湖总氮的6%和6%.据1994年入湖污染物量的估算,太湖环湖河道总磷入湖量为2690.6 t,则本研究估算的霍甫水丝蚓PO43--P排泄量占太湖入湖总磷的7.8%. 2001-2002年太湖入湖TP下降到1029 t,若加入霍甫水丝蚓的PO43--P排泄量为1239 t,霍甫水丝蚓的PO43--P的贡献可达到16.9%.以1987-1988年为对象, 比较太湖霍甫水丝蚓NH4+-N和PO43--P释放量与进入太湖的各种污染源N、P浓度的差异(表 4).霍甫水丝蚓NH4+-N年均释放量明显高于大气尘降、大气降水、围网养鱼、湖面船只入湖NH4+-N量,仅次于环湖河道的NH4+-N排放量.与各种污染源排放的PO43--P相比,霍甫水丝蚓PO43--P年平均释放量仅次于环湖河道和间接入湖的PO43--P量.
太湖不同地区NH4+-N和PO43--P的霍甫水丝蚓2007-2010年平均释放量与沉积物释放量的比较[23-24]发现(表 5),霍甫水丝蚓的营养盐释放在太湖内源释放中占据较大比重,在竺山湾和西部沿岸地区霍甫水丝蚓NH4+-N释放量甚至高于沉积物的释放量,且霍甫水丝蚓PO43--P释放量在竺山湾地区也高于沉积物的释放量,在西部地区则接近沉积物的释放量.根据范成新等对全太湖内源营养物释放量的估算,NH4+-N和PO43--P的年释放量分别为9960.3和899.4 t[23-24],霍甫水丝蚓NH4+-N和PO43--P年均释放量分别达到全太湖内源释放NH4+-N和PO43--P的19.3%和23.3%.而本研究得出的太湖霍甫水丝蚓NH4+-N和PO43--P释放量并不是其释放的全部营养盐,故太湖霍甫水丝蚓对太湖水体氮、磷循环的实际贡献量可能更大.本研究表明,太湖霍甫水丝蚓虽然本身不产生新的氮和磷,但是它把氮和磷从有机态转化为无机态,能够提高水体中营养盐浓度,可为初级生产者利用,加快了湖泊中氮和磷的周转速率,在相当程度上将加剧太湖蓝藻水华的暴发,可见霍甫水丝蚓的营养盐释放对于湖泊营养盐循环过程和生态系统具有显著的影响.
| 表 5 霍甫水丝蚓与沉积物NH4+-N、PO43--P年释放量的比较 Tab.5 Release amount of NH4+-N and PO43--P released by L. hoffmeisteri comparison with sediment |
| [1] |
Lee GF. Factors affecting the transfer of materials between water and sediments. University of Wisconsin, Water Resources Center, Eutrophication Information Program, 1970.
|
| [2] |
Wildung RE, Schmidt RL. Phosphorus release from lake sediments. Vol. 73. For sale by the Supt. of Docs., US Govt. Print. Off, 1993.
|
| [3] |
Fukuhara H, Yasuda K. Phosphorus excretion by some zoobenthos in an eutrophic freshwater lake and its temperature dependency. Japanese Journal of Limnology, 1985, 46(4): 287-296. DOI:10.3739/rikusui.46.287 |
| [4] |
Fukuhara H, Yasuda K. Ammonium excretion by some freshwater zoobenthos from an eutrophic lake. Hydrobiologia, 1989, 173(1): 1-8. DOI:10.1007/BF00008595 |
| [5] |
Postolache C, Rîşnoveanu G, Vădineanu A. Nitrogen and phosphorous excretion rates by tubificids from the Prahova River (Romania). Hydrobiologia, 2006, 553(1): 121-127. DOI:10.1007/s10750-005-9896-y |
| [6] |
Fukuhara H, Sakamoto M. Enhancement of inorganic nitrogen and phosphate release from lake sediment by tubificid worms and chironomid larvae. Oikos, 1987, 48(3): 312-320. DOI:10.2307/3565519 |
| [7] |
Gardner WS, Briones EE, Kaegi EC et al. Ammonium excretion by benthic invertebrates and sediment-water nitrogen flux in the Gulf of Mexico near the Mississippi River outflow. Estuaries and Coasts, 1993, 16(4): 799-808. DOI:10.2307/1352438 |
| [8] |
Gardner WS, Nalepa TF, Slavens DR et al. Patterns and rates of nitrogen release by benthic Chironomidae and Oligochaeta. Canadian Journal of Fisheries and Aquatic Sciences, 1983, 40(3): 259-266. DOI:10.1139/f83-039 |
| [9] |
Conroy JD, Edwards WJ, Pontius RA et al. Soluble nitrogen and phosphorus excretion of exotic freshwater mussels (Dreissena spp.):Potential impacts for nutrient remineralisation in western Lake Erie. Freshwater Biology, 2005, 50(7): 1146-1162. DOI:10.1111/fwb.2005.50.issue-7 |
| [10] |
Qin Boqiang, Hu Weiping, Chen Weimin eds. Evolution and mechanism of water environment in Lake Taihu. Beijing: Science Press, 2004. [秦伯强, 胡维平, 陈伟民. 太湖水环境演化过程与机理. 北京: 科学出版社, 2004.]
|
| [11] |
Qin Boqiang ed. Lake eutrophication and water environment security in China. Impact of Science on Society, 2007(3): 17-23. [秦伯强. 我国湖泊富营养化及其水环境安全. 科学对社会的影响, 2007(3): 17-23.] |
| [12] |
Zhang Lei, Gu Xiaozhi, Wang Zhaode et al. The influence of Tubificid worms bioturbation on the exchange of phosphorus across sediment-water interface in lakes. J Lake Sci, 2010, 22(5): 666-674. [张雷, 古小治, 王兆德等. 水丝蚓(Tubificid worms)扰动对磷在湖泊沉积物-水界面迁移的影响. 湖泊科学, 2010, 22(5): 666-674. DOI:10.18307/2010.0507] |
| [13] |
Lü Jing, Zheng Zhongming, Lu Kaihong et al. Effects of bioturbation by freshwater snail, Bellamya aeruginosa, on the contents of C, N and P in sediment and pore water in blue-green algal bloom waters. Ecology Science, 2010, 29(6): 538-542. [吕敬, 郑忠明, 陆开宏等. 铜锈环棱螺生物扰动对"蓝藻水华"水体底泥及其间隙水中碳, 氮, 磷含量的影响. 生态科学, 2010, 29(6): 538-542.] |
| [14] |
Wu Fangtong, Yan Yanhong, Sun Shiquan et al. Influence of Limnodrilus hoffmeisteri bioturbation on phosphorus release from sediment. Chinese Journal of Environmental Engineering, 2011, 5(5): 1071-1076. [吴方同, 闫艳红, 孙士权等. 水丝蚓生物扰动对沉积物磷释放的影响. 环境工程学报, 2011, 5(5): 1071-1076.] |
| [15] |
Yao Sipeng, Li Ke, Zhou Deyong et al. Impact of Limnodrilus hoffmeristeri on inorganic nitrogen and phosphorus exchange at the sediment-water interface in Meiliang Bay, Lake Taihu. Environmental Science & Technology, 2011, 34(1): 100-104. [姚思鹏, 李柯, 周德勇等. 霍甫水丝蚓对太湖梅梁湾沉积物影响——水界面无机氮, 磷交换. 环境科学与技术, 2011, 34(1): 100-104.] |
| [16] |
Gardner WS, Nalepa TF, Quigley MA et al. Release of phosphorus by certain benthic invertebrates. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(8): 978-981. DOI:10.1139/f81-131 |
| [17] |
Nalepa TF, Gardner WS, Malczyk JM. Phosphorus release by three kinds of benthic invertebrates:Effects of substrate and water medium. Canadian Journal of Fisheries and Aquatic Sciences, 1983, 40(6): 810-813. DOI:10.1139/f83-105 |
| [18] |
Prosser CL. Comparative animal physiology. New York: Wiley-Liss, 1991, 578.
|
| [19] |
Ito T, Hara K. Impact of Tubificid worm on nutrient dynamics in paddy field. 2010.
|
| [20] |
Rîşnoveanu G, Postolache C, Vădineanu A. Nitrogen and phosphorous excretion rates by tubificids from the Danube River. In:Weber J ed. Biogeochemical processes and cycling of elements in the environment. Wroclaw:Poland, 2004:205-206.
|
| [21] |
Gu Dingxi. Some changes of ecological environment in Taihu in recent twenty years. Journal of Shanghai Normal University:Natural Sciences, 1983(Nature Reserve album): 50-59. [顾丁锡. 二十年来太湖生态环境状况的若干变化. 上海师范学院学报:自然科学版, 1983(环境保护专辑): 50-59.] |
| [22] |
Xu Pengzhu, Qin Boqiang. Water quantity and pollutant fluxes of the surrounding rivers of Lake Taihu during the hydrological year of 2001-2002. J Lake Sci, 2005, 17(3): 213-218. [许朋柱, 秦伯强. 2001-2002水文年环太湖河道的水量及污染物通量. 湖泊科学, 2005, 17(3): 213-218. DOI:10.18307/2005.0304] |
| [23] |
Fan Chengxin, Zhang Lu, Qin Boqiang et al. Migration mechanism of biogenic elements and their quantification on the sediment-water interface of Lake Taihu:I. Spatial variation of the ammonium release rates and its source and sink fluxes. J Lake Sci, 2004, 16(1): 10-16. [范成新, 张路, 秦伯强等. 太湖沉积物-水界面生源要素迁移机制及定量化——1. 湖泊科学, 2004, 16(1): 10-16. DOI:10.18307/2004.0102] |
| [24] |
Fan Chengxin, Zhang Lu, Bao Xianming et al. Migration mechanism of biogenic elements and their quantification on the sediment-water interface of Lake Taihu:Ⅱ. Chemical thermodynamic mechanism of phosphorus release and its source-sink transition. J Lake Sci, 2006, 18(3): 207-217. [范成新, 张路, 包先明等. 太湖沉积物-水界面生源要素迁移机制及定量化——2.磷释放的热力学机制及源-汇转换. 湖泊科学, 2006, 18(3): 207-217. DOI:10.18307/2006.0303] |
 2017, Vol. 29
2017, Vol. 29 
