轮虫具有体型小、繁殖周期短的特点,在三大后生浮游动物类群中有着较高的内禀增长率,在湖泊和水库等水域生态系统的营养盐循环和能量传递中发挥着重要作用[1-2].轮虫具有相对较短的世代周期,能够比甲壳类动物更快地对环境变化作出响应,很多种类被用作水质的敏感指示种[3-4].在自然水体中,轮虫群落组成与动态受到水温、溶氧、浊度和营养盐等环境因素以及食物资源和捕食等生物因素的影响[5-7].水库是人为在河道上筑坝形成的半人工半自然水体,沿河道方向有一定的地形坡度.从上游的河流入库口到大坝,根据水体水流速度和混合强度,通常分为河流区、过渡区和湖泊区,因此水库兼具河流和湖泊特点.水库的库形特点不仅造成了水库在水动力的分区,也形成了化学和生物分布的纵向梯度,因而水库的不同水域之间环境要素和生物群落具有明显的异质性[8-9].在季风影响下,热带亚热带地区水库降雨的季节性非常明显[10].季节性降雨直接影响水库水位、浊度等特征,同时通过流域汇水带入外源营养盐,水文过程是影响水库轮虫群落结构变化的重要环境因素[11].水库的轮虫群落受环境和生物的多因素影响,这种影响在不同水域具有不同的强度和特点.异尾轮属(Trichocerca)是轮虫中较为特殊的一个属,目前全球共有70余种,在古北区、新北区有着较高的物种丰富度,其咀嚼器及背甲可作为其分类依据[12-13].异尾轮属是在热带地区的常见类群,在热带及热带亚热带过渡区中有着较高的物种多样性,是该地区轮虫的重要组成类群,其种类与数量对轮虫群落的优势种、多样性与群落丰度有着重要影响[14-15].受采样时间和样品数量的限制,目前关于异尾轮虫的群落动态及其影响因素只有零星的报道,还缺少对其系统性的认识.
流溪河水库位于热带至亚热带过渡区,是典型的大型峡谷型水库,具有较为明显的纵向梯度[16].异尾轮虫是该水库中的优势类群,为了解典型水体中异尾轮虫作为一个群落(assemblage)的分布与动态提供可能.本文于2013-2014年对水库的河流区(吕田和玉溪)、过渡区(汇水)和湖泊区(库中和大坝)进行逐月采样并测定环境指标,对不同水域的异尾轮虫群落结构进行分析,以期了解热带亚热带过渡区典型水库中异尾轮虫群落的时空分布及其影响因素.
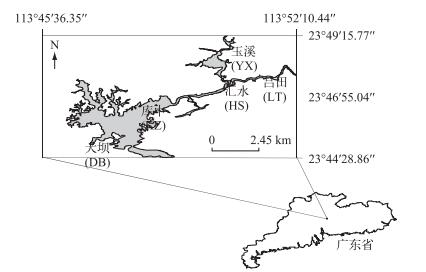
1 材料与方法流溪河水库(大坝:23°45′N, 113°46′E)是广东省广州市典型的峡谷型水库,具有两条主要的入库河流:吕田河和玉溪河,库容为0.325 km3,受亚热带季风气候影响,具有明显的丰水期(5-9月)及枯水期(10-12和1-4月).水库鱼类以放养的鳙和鲢为主,浮游植物的优势类群以甲藻和硅藻为主[10, 17].
于2013年1月至2014年12月对5个采样点进行逐月采样,河流区的采样点设置在吕田(LT)及玉溪(YX),过渡区的采样点设置在汇水(HS),湖泊区的采样点则设置在库中(KZ)和大坝(DB)(图 1).浮游动物定性样品使用孔径20 μm的浮游生物网进行斜向拖网,浮游动物定量样品根据现场水深从表层均匀取水至底部,取水体积为40~50 L,使用孔径20 μm的浮游生物网过滤浓缩并使用甲醛溶液固定保存.样品静置后进行浓缩,按照Koste分类系统在显微镜下进行定性检测及定量计数(2013年3月样品缺失).使用YSI-85型水质仪现场测定溶解氧(DO)、温度(Temp)等环境参数.使用萨氏盘现场测定水体透明度(SD).在各采样点采集水样,按照《地表水环境质量标准》(GB 3838-2002)测定水体总磷(TP)、总氮(TN),磷酸盐(PO43--P)浓度按照钼酸铵分光光度法测定,氨氮(NH3-N)浓度按照纳氏试剂分光光度法测定,硝态氮(NO3--N)浓度按照紫外分光光度法测定,亚硝态氮(NO2--N)浓度按照分光光度法测定,可溶解性无机氮(DIN)浓度通过NO3--N、NO2--N和NH3-N求得,叶绿素a(Chl.a)浓度按照反复冻融-浸提法进行测定[18].轮虫的物种多样性使用Simpson多样性指数表示.以同一年份的不同采样点作为单因子使用SPSS 16.0软件进行单因子方差分析及相关性分析,绘图及数据处理使用Excel及R语言平台.
|
图 1 流溪河水库5个采样点的位置分布 Fig.1 Locations of five sampling sites in Liuxihe Reservoir |
异尾轮虫群落结构的数据分析使用R语言平台中的vegan、packfor和MASS函数包.在轮虫群落的PCA(主成分分析)和RDA(冗余分析)分析中,轮虫的丰度数据经过lg(x+1)转换后再进行Hellinger转换. RDA分析中使用前向选择对变量进行筛选,同时将环境变量中的DO、SD、Temp作为物理环境变量,将TP、TN、DIN、PO43--P、Chl.a和晶囊轮虫丰度(Asp)作为生物+化学变量,将水库不同水域的环境变量对轮虫群落结构的变异影响进行方差解析.使用逐步回归筛选在不同水域对轮虫总丰度有显著影响的环境变量.基于Bray-Curtis距离进行样方和物种组成的NMDS(非度量多维尺度分析)排序分析.
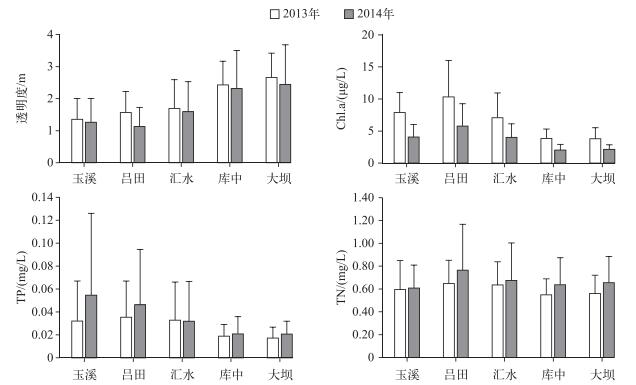
2 结果与分析 2.1 理化指标流溪河水库玉溪、吕田、汇水、库中和大坝透明度的年均值均呈从河流区向过渡区和湖泊区逐渐增加的趋势,同年透明度在不同位点间存在显著差异(ANOVA, P < 0.01). Chl.a浓度2年平均值从河流区到湖泊区逐级降低,且同样存在显著差异(ANOVA, P < 0.01).各点TP浓度的年均值表现出逐级递减趋势(ANOVA, P>0.05),TN浓度则无明显梯度变化(ANOVA, P>0.05)(图 2).
|
图 2 2013和2014年流溪河水库各样点年均透明度、Chl.a、TP和TN浓度的空间变化 Fig.2 The spatial variation of annual averaged transparency, Chl.a, TP and TN in five sampling sites in Lixihe Reservoir in 2013 and 2014 |
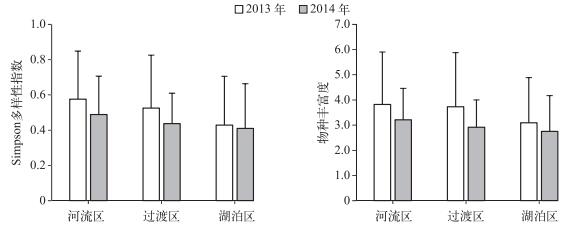
2013-2014年共采集到异尾轮虫11种,其中对棘异尾轮虫、圆筒异尾轮虫、暗小异尾轮虫和刺盖异尾轮虫为优势种(表 1).河流区、过渡区和湖泊区的年平均种类丰富度和Simpson多样性指数从水库上游到下游均呈现逐级递减的趋势(ANOVA, P>0.05)(图 3),异尾轮虫群落在物种多样性及丰富度上的纵向梯度变化体现了异尾轮虫群落对生境梯度变化的响应.
| 表 1 流溪河水库异尾轮虫种类及其统计分析中的缩写 Tab.1 Trichocerca species and abundance in Liuxihe Reservoir and their abbreviations used in data analysis |
|
图 3 2013和2014年流溪河水库3个水域异尾轮虫群落的Simpson多样性指数和物种丰富度 Fig.3 Simpson's diversity and species richness of Trichocerca assemblages in three different waters in Liuxihe Reservoir in 2013 and 2014 |
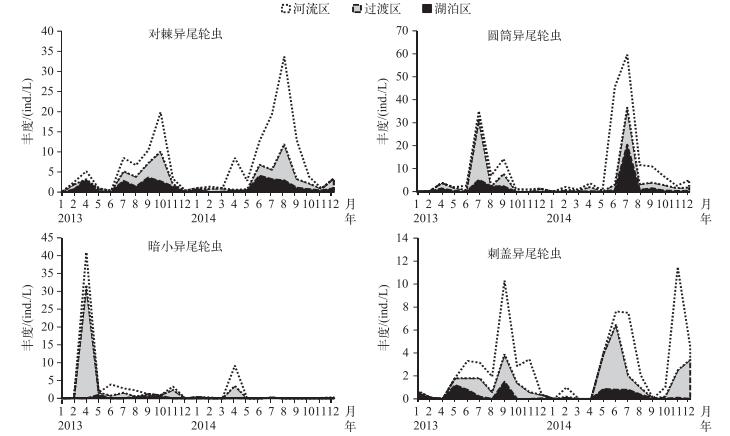
暗小异尾轮虫丰度峰值出现在过渡区,而其余优势异尾轮虫的丰度峰值均出现在河流区(图 4). 2013年1-3月各优势种丰度均较低,4月暗小异尾轮虫在过渡区和河流区成为主要优势种,随后迅速下降,5-6月无绝对优势种,到了7月圆筒异尾轮虫在各水域成为绝对优势种,8月圆筒异尾轮虫在湖泊区和河流区仍为优势种,过渡区优势种则演替为对棘异尾轮虫,9月刺盖异尾轮虫在河流区上升为主要优势种,对棘异尾轮虫和圆筒异尾轮虫则分别为湖泊区和过渡区的优势种,到了10月对棘异尾轮虫在各水域成为优势种,11-12月无绝对优势种.与2013年相比,2014年异尾轮虫优势种动态稍有变化,在1-5月没有出现明显绝对优势种,暗小异尾轮虫丰度在4月出现年内峰值,6月份圆筒异尾轮虫在河流区成为主要优势种,湖泊区和过渡区优势种则为对棘异尾轮虫,7月各水域以圆筒异尾轮虫为优势种,8月各水域优势种演替为对棘异尾轮虫,9月河流区优势种仍为对棘异尾轮虫,而圆筒异尾轮虫再次在湖泊区和过渡区成为优势种,除刺盖异尾轮虫丰度11月在河流区出现峰值外,10-12月无绝对优势种(图 4).各优势种的丰度峰值存在年间差异.
|
图 4 2013-2014年流溪河水库异尾轮虫优势种种群动态 Fig.4 Population dynamics of four dominant species in Trichocerca in Liuxihe Reservoir during 2013-2014 |
河流区、过渡区及湖泊区异尾轮虫2年平均丰度分别为142.9±70.6、102.5±39.0和53.6±9.1 ind./L. 3个水域采样点(玉溪因与吕田相似,未列入图 5)的异尾轮虫总丰度呈单峰型分布,具有明显的季节性特征,在夏季(5-9月)逐步增加,而在春、秋季(1-4、10-12月)逐渐下降保持低位,丰度峰值均出现在夏季丰水期(图 5).逐步回归分析表明,在河流区异尾轮虫的总丰度与温度、透明度、DO、DIN和晶囊轮虫丰度相关,而在过渡区则与温度、透明度、磷酸盐浓度和晶囊轮虫丰度相关,而在湖泊区则除与总氮无相关性之外,与其它环境变量均相关(表 2).
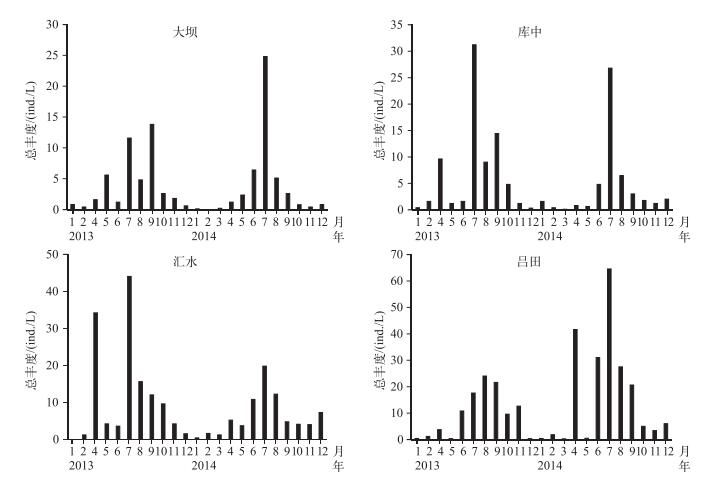
|
图 5 2013-2014年流溪河水库异尾轮虫群落的总丰度变化 Fig.5 Abundance variation of Trichocerca assemblage in Liuxihe Reservoir during 2013-2014 |
| 表 2 流溪河水库河流区、过渡区和湖泊区轮虫丰度回归分析 Tab.2 Multiple regression of total rotifer abundance in riverine zone, transition zone and lacustrine zone in Liuxihe Reservoir |
异尾轮虫群落的主成分分析表明,多数种类集中在原点,表明其全年分布差异较小,没有明显的季节分布差异,而暗小异尾轮虫(Trpu)、对棘异尾轮虫(Trsi)、刺盖异尾轮虫(Trca)、圆筒异尾轮虫(Trcy)和卡顿异尾轮虫(Trch)则在全年分布上有较大差异(图 6).第一、二主轴对河流区、过渡区及湖泊区异尾轮虫群落变异的累积解释率分别为46.8%、59.5%和59.1% (累计特征值).
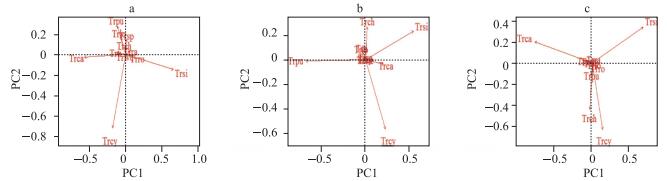
|
图 6 流溪河水库河流区(a)、过渡区(b)和湖泊区(c)异尾轮虫群落PCA分析(异尾轮虫拉丁名缩写见表 1,下同) Fig.6 PCA of Trichocerca assemblages in riverine zone (a), transition zone (b) and lacustrine zone (c) in Liuxihe Reservoir |
NMDS排序表明,在湖泊区的采样点分布较为集中,表明湖泊区的异尾轮虫群落结构较为相似.对于过渡区来说,全年采样点离散分布,表明过渡区异尾轮虫群落在全年分布上差异较大,而河流区的异尾轮虫群落变异程度则介于河流区和过渡区之间(图 7).
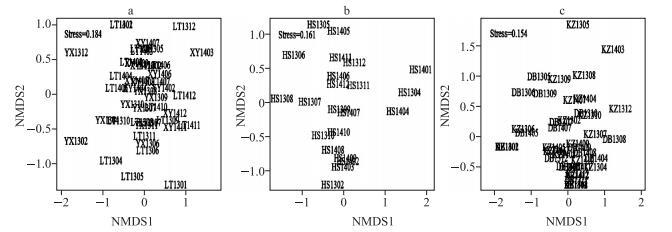
|
图 7 流溪河水库河流区(a)、过渡区(b)、湖泊区(c)异尾轮虫群落非度量多维尺度分析(用采样地点字母缩写+年份缩写+月份表示采样点,下同) Fig.7 NMDS plot of Trichocerca assemblage in riverine zone (a), transition zone (b) and lacustrine zone(c) in Liuxihe Reservoir |
在群落结构的RDA分析中,对环境变量进行前向选择去除自相关变量后,发现对河流区异尾轮虫群落结构变异有显著贡献的环境变量为Chl.a、透明度和温度,在过渡区的显著环境变量为晶囊轮虫丰度,而在湖泊区则为温度和磷酸盐浓度,前两个主轴对河流区、过渡区和湖泊区异尾轮虫群落结构变异的解释率分别为18.1%、11.5%和18.0% (图 8).
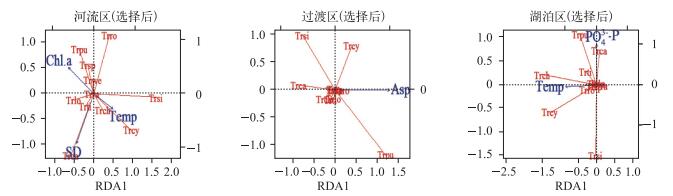
|
图 8 流溪河水库异尾轮虫群落与环境变量之间的RDA分析 Fig.8 Redundancy analysis of Trichocerca assemblages with environmental variables in Liuxihe Reservoir |
物理环境变量组(X1)和生物+化学变量组(X2)对解释轮虫群落的贡献在各个水域中有所不同.在河流区和湖泊区,物理环境变量组(X1)和生物+化学变量组(X2)的解释率较为接近,表明河流区及湖泊区轮虫群落受物理和生物+化学变量共同作用决定,在过渡区则以生物+化学变量组为主导因素(图 9),这也与进行前向选择后的RDA分析中保留的显著环境变量的属性一致.
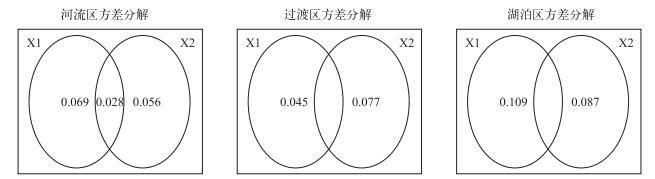
|
图 9 流溪河水库异尾轮虫群落与环境变量的方差分解分析(X1:物理环境变量,X2:生物+化学环境变量) Fig.9 Variation partitioning of Trichocerca assemblage with environmental variables in Liuxihe Reservoir (X1: physical variables, X2: biological and chemical variables) |
流溪河水库透明度、Chl.a浓度等环境变量呈现梯级变化和空间异质性,这种环境变量的纵向梯度变化是由水库本身库形所导致的水文条件变化的体现.河流区河道狭窄、流速快,上游冲刷带来的泥土颗粒尚未大量沉降,同时给浮游植物带来了丰富外源营养盐,从上游到下游形成了透明度及叶绿素等环境变量的梯度变化.
当水体环境条件发生改变时,轮虫群体的种类组成会对环境变化做出响应[19].与环境的梯度变化一致,流溪河水库异尾轮虫群落的物种多样性及物种丰富度呈现出梯度变化,大致呈现出从水库上游到下游逐级递减的趋势,河流区相比湖泊区有较高的物种多样性.根据中度干扰假说,中等程度上的环境干扰,有助于环境容纳多样化的种类共存[20].河流区和过渡区水流速度要快于湖泊区,上游的激流生境比下游湖泊区的静水环境干扰多,这意味着河流区轮虫生态位的多样化为较高的物种多样性提供了生境条件. RDA分析中经前向选择后保留的对异尾轮虫群落结构有影响的环境变量在河流区较多,而过渡区及湖泊区较少,这也从侧面体现了上游生境的相对不稳定性.物种多样性和丰富度的梯度递减体现了异尾轮虫群落对环境梯度变化的响应.
食物是影响群落的重要生物因素[21],食物在水体中在一定程度上由Chl.a浓度体现. RDA分析表明,Chl.a浓度、透明度和水温是影响河流区异尾轮虫群落结构的主要环境变量.水温可以影响浮游植物生长进而影响食物供应,河流区水流流速快且未沉降泥沙颗粒极多,不利于轮虫滤食浮游植物的同时也会影响到河流区的透明度,透明度同样会影响限制藻类的生长和对轮虫的食物供应.在过渡区,晶囊轮虫丰度是影响群落结构的重要环境因素.晶囊轮虫是水库和湖泊中常见的杂食性轮虫,它不仅以绿藻和硅藻为食,还可以捕食其它轮虫,而捕食压力是影响群落的另一重要生物因素[22-25].过渡区由于水流变缓,上游冲刷后入库的泥沙颗粒开始沉降,有利于晶囊轮虫对异尾轮虫的捕食,晶囊轮虫丰度与对数转换后的对棘异尾轮虫丰度呈显著负相关(r=-0.432,P=0.039),表明晶囊轮虫与对棘异尾轮虫之间可能存在捕食关系.在湖泊区,水体环境较为稳定,由上游冲刷而来的泥沙颗粒进一步沉降导致水体透明度最高,透明度的增加有助于鱼类捕食轮虫,而温度作为重要间接变量会影响到鱼类对异尾轮虫的捕食强度,同时作为营养盐的磷酸盐能够显著影响浮游植物的生长及其密度,浮游植物生物量(Chl.a浓度)会影响水体透明度进而间接调控鱼类对轮虫的捕食,温度除了可以作为间接变量影响轮虫群落,还可以作为重要的直接变量在驱动轮虫群落生长、繁殖和竞争优势属演替上发挥重要作用,因此水温和磷酸盐浓度成为影响湖泊区异尾轮虫群落结构的关键要素.在方差解析中,河流区及湖泊区的物理环境变量组和生物+化学变量组对群落结构变异的解释率比较接近,表明在河流区和湖泊区的轮虫群落受物理环境变量和生物+化学变量共同作用决定,而在过渡区则更多地以生物+化学变量为主导因素,这与进行前向选择后的RDA分析中保留的显著环境变量的属性一致.
在季风区,降雨引起的水文变化被认为是影响轮虫群落的关键要素[11].在对异尾轮虫群落的PCA分析中,每个水域(河流区、过渡区和湖泊区)的对棘异尾轮虫、圆筒异尾轮虫、暗小异尾轮虫和刺盖异尾轮虫在全年分布上有较大的差异,但其余多数种类的异尾轮虫在PCA图中基本集中于原点,说明其全年分布差异较小.这种全年分布的差异在种群丰度动态中表现为明显的季节分布模式,优势种主要出现在丰水期(图 4),优势种具有的丰水期分布模式与季风区丰水期明显的季节性降雨相对应,这表明丰水期分布模式可能与季节性降雨有关,即季节性降雨是影响流溪河水库异尾轮虫群落结构的潜在因素.
综上所述,在流溪河这一典型的大型峡谷型水库中,异尾轮虫群落的物种多样性和丰富度从水库上游至下游不同水域呈递减趋势.对棘异尾轮虫、圆筒异尾轮虫和刺盖异尾轮虫等优势种主要出现在丰水期.叶绿素a浓度(指示食物)、晶囊轮虫丰度、水温和磷酸盐浓度分别是影响河流区、过渡区、湖泊区异尾轮虫群落结构的关键要素,而降雨则是影响整个库区异尾轮虫群落的潜在因素.
| [1] |
Allan JD. Life history patterns in zooplankton. American Naturalist, 1976, 110(971): 165-180. DOI:10.1086/283056 |
| [2] |
Makarewicz JC, Likens GE. Structure and function of the zooplankton community of Mirror Lake, New Hampshire. Ecological Monographs, 1979, 49(1): 109-127. DOI:10.2307/1942575 |
| [3] |
Gannon JE, Stemberger RS. Zooplankton (especially crustaceans and rotifers) as indicators of water quality. Transactions of the American Microscopical Society, 1978, 97(1): 16-35. DOI:10.2307/3225681 |
| [4] |
May L, Spears BM, Dudley BJ et al. The response of the rotifer community in Loch Leven, UK, to changes associated with a 60% reduction in phosphorus inputs from the catchment. International Review of Hydrobiology, 2014, 99(1/2): 65-71. DOI:10.1002/iroh.201301705 |
| [5] |
Khaleqsefat E, Malekzadeh-Viayeh R. Effect of season and environmental variables on rotifer community structure:Evidence from two selected freshwaters in Northwest Iran. Research Journal of Animal Sciences, 2013, 7(3): 34-41. DOI:10.3923/rjnasci.2013.34.41 |
| [6] |
Du X, Feng W, Li W et al. Response of rotifer community to environmental changes in five shallow lakes in the middle reach of Changjiang River, China. Chinese Journal of Oceanology and Limnology, 2014, 32(5): 1083-1091. DOI:10.1007/s00343-014-3354-5 |
| [7] |
Devetter M. Influence of environmental factors on the rotifer assemblage in an artificial lake. Hydrobiologia, 1998, 387/388: 171-178. DOI:10.1023/A:1017050011995 |
| [8] |
Thornton KW, Kimmel BL, Payne FE. Reservoir limnology:Ecological perspectives. New York: Wiley-Interscience, 1990, 109-131.
|
| [9] |
Han Boping. Reservoir ecology and limnology in China:A retrospective comment. J Lake Sci, 2010, 22(2): 151-160. [韩博平. 中国水库生态学研究的回顾与展望. 湖泊科学, 2010, 22(2): 151-160. DOI:10.18307/2010.0201] |
| [10] |
Xiao LJ, Wang T, Hu R et al. Succession of phytoplankton functional groups regulated by monsoonal hydrology in a large canyon-shaped reservoir. Water Research, 2011, 45(16): 5099-5109. DOI:10.1016/j.watres.2011.07.012 |
| [11] |
Xi Lihong, Li Huiming, Lin Qiuqi et al. Structure and seasonality variations of zooplankton community in the pelagic zone of tropical Dashahe Reservoir, Guangdong, South China. J Lake Sci, 2015, 27(6): 1049-1058. [习丽红, 李慧明, 林秋奇等. 热带富营养水库敞水区浮游动物群落结构与季节变化:以广东大沙河水库为例. 湖泊科学, 2015, 27(6): 1049-1058. DOI:10.18307/2015.0609] |
| [12] |
Segers H. A biogeographical analysis of rotifers of the genus Trichocerca Lamarck, 1801(Trichocercidae, Monogononta, Rotifera), with notes on taxonomy. Hydrobiologia, 2003, 500(1): 103-114. DOI:10.1023/A:1024624132386 |
| [13] |
Segers H. Global diversity of rotifers (Rotifera) in freshwater. Hydrobiologia, 2008, 595(1): 49-59. DOI:10.1007/s10750-007-9003-7 |
| [14] |
Fernando CH. The freshwater zooplankton of Sri Lanka, with a discussion of tropical freshwater zooplankton composition. International Review of Hydrobiology, 1980, 65(1): 85-125. DOI:10.1002/iroh.19800650105 |
| [15] |
Lin Qiuqi, Zhao Shuaiying, Han Boping. Rotifer distribution in tropical reservoirs, Guangdong Province, China. Acta Ecologica Sinica, 2005, 25(5): 1123-1131. [林秋奇, 赵帅营, 韩博平. 广东省水库轮虫分布特征. 生态学报, 2005, 25(5): 1123-1131.] |
| [16] |
Peng L, Lin G, Wang T et al. Limnological Characteristics of Liuxihe Reservoir. In:Han BP, Liu Z eds. Tropical and sub-tropical reservoir limnology in China-Theory and practice. New York:Springer, 2012:243-257. DOI:10.1007/978-94-007-2007-7_14.
|
| [17] |
Zhao SY, Sun YP, Han BP. Top-down effects of bighead carp (Aristichthys nobilis) and Leptodora richardi (Haplopoda, Leptodoridae) in a subtropical reservoir during the winter-spring transition:A mesocosm experiment. Hydrobiologia, 2016, 765(1): 43-54. DOI:10.1007/s10750-015-2398-7 |
| [18] |
Lin Shaojun, He Lijing, Huang Peisheng et al. Comparison and improvement on the extraction method for chlorophyll a in phytoplankton. Ecologic Science, 2005, 24(1): 9-11. [林少君, 贺立静, 黄沛生等. 浮游植物中叶绿素a提取方法的比较与改进. 生态科学, 2005, 24(1): 9-11.] |
| [19] |
Manuel JD, Armengol J. Rotifer assemblages:A contribution to the typology of Spanish reservoirs. Hydrobiologia, 1993, 255/256(1): 421-428. DOI:10.1007/BF00025867 |
| [20] |
Connell JH. Diversity in tropical rain forests and coral reefs. Science, 1978, 199(4335): 1302-1310. DOI:10.1126/science.199.4335.1302 |
| [21] |
Baião C, Boavida MJ. Environmental factors determining the structure of rotifer communities in a river-shed reservoir. Aquatic Ecology, 2000, 34(4): 369-377. DOI:10.1023/A:1011406018683 |
| [22] |
Devetter M, Sedďa J. Regulation of rotifer community by predation of Cyclops vicinus (Copepoda) in the Ŕímov Reservoir in spring. International Review of Hydrobiology, 2006, 91(1): 101-112. DOI:10.1002/iroh.200510810 |
| [23] |
Oganjan K, Virro T, Lauringson V. Food spectrum of the omnivorous rotifer Asplanchna priodonta in two large northeastern European lakes of different trophy. Oceanological and Hydrobiological Studies, 2013, 42(3): 314-323. DOI:10.2478/s13545-013-0088-5 |
| [24] |
Gilbert JJ. Morphological and behavioral responses of a rotifer to the predator Asplanchna. Journal of Plankton Research, 2014, 36(6): 1576-1584. DOI:10.1093/plankt/fbu075 |
| [25] |
Wallace RL, Snell TW, Ricci C et al. Rotifera Vol. 1:Biology, ecology and systematics. In:Segers H, Dumont HJ eds. Guides to the identification of the microinvertebrates of the continental waters of the world. Leiden:Backhuys, 2006:1-299.
|
 2017, Vol. 29
2017, Vol. 29 

