水体富营养化是全球重要水质难题之一[1].氮和磷是水体富营养化的主要限制因子,控制水体氮和磷浓度能有效抑制水体富营养化[2].水源水库内源(底泥)氮、磷释放,是水库氮、磷主要来源途径之一,在外源氮和磷得到有效控制的条件下,削减底泥氮、磷释放将成为控制水源水库富营养化的有效方法之一[3].当前,削减底泥氮、磷释放的主要方法有清淤法和原位覆盖法[4],由于清淤法存在费用高、底泥再悬浮、运输和处置过程存在二次污染、破坏水底生态环境等不足[5],使得原位覆盖法成为国内外学者研究热点,并在欧美、日本等地得到广泛工程应用[4].原位覆盖法由传统物理厚层覆盖[6-7]发展到当今活性薄层覆盖[8-12],覆盖层作用机理也从物理掩蔽[6-7]发展到物理化学吸附及生物化学转化[8-15].目前研究和应用中,针对水源水库的污染底泥覆盖材料主要有改性沸石的磷钝化剂(Z2G1) [10, 16]和镧改性膨润土(锁磷剂phoslock©)[12, 17-18];实验室研究表明[16],Z2G1覆盖不仅能完全抑制底泥氮和磷释放,而且还削减了上覆水中氮和磷,但在新西兰Okaro水库实际应用中表明,投加0.35 kg/m2的Z2G1后,水库中氮、磷负荷削减不明显[10],有待进一步开发研究.锁磷剂phoslock©是澳洲工业科学研究协会于1990年研发的,于2002年商品化的,到目前为止,锁磷剂广泛应用于澳洲、欧洲、美国、加拿大、新西兰等水库和湖泊[18],大规模应用案例超过120处,但锁磷剂主要针对削减水源水库磷负荷,针对削减水源水库氮负荷的底泥原位覆盖法研究不多,对底泥不同形态氮削减效果鲜见报道.
福建泉州山美水库位于南安市码头镇山美村,是一座集防洪、供水、灌溉、发电等综合利用的大(二)型水库,总库容6.55×108 m3,是福建省水利厅管辖的库容最大的水库;惠女水库位于泉州市洛江区马甲镇彭殊村,是座集防洪、供水、灌溉、发电等综合利用的大(二)型水库,总库容1.26×108 m3,是泉州第二大水库;为了解决惠女水库的汛末库容量闲置和水量远远不能满足需求问题,由山美水库至惠女水库的引调水工程于2014年10月开始动工,预计2015年年底竣工,工程总投资5.1亿元.山美水库和惠女水库总氮(TN)严重超标,库区TN浓度高峰期达3~4 mg/L,主要以硝态氮(NO3--N)形态存在,可见,削减水库氮负荷是水库水污染防治面临的难题.
本文作者前期所在课题组自主研发了污染底泥生物活性覆盖材料(生物沸石),即从底泥分离、筛选获得高效异养硝化细菌和好氧反硝化细菌,以天然斜发沸石为载体,通过连续曝气挂膜法制备成生物沸石,通过实验室静态模拟和现场原位试验研究以及示范工程应用[13, 19-17, 22],发现生物沸石薄层覆盖不仅能有效削减上覆水体氮负荷,而且也削减了底泥中氮负荷,同时高效菌生物作用能实现沸石吸附铵态氧(NH4+-N)能力的原位再生.因此,针对山美水库和惠女水库TN严重超标问题,本文以山美水库和惠女水库上覆水和底泥为研究对象,研究了通过生物沸石薄层覆盖削减水库氮负荷的可行性,考察了生物沸石覆盖对上覆水体TN及对底泥中不同形态氮的削减效果,探讨了上覆水体溶解氧(DO)浓度对削减氮负荷效果的影响,分析了削减氮负荷作用机理.研究结果可为泉州山美水库和惠女水库氮污染防治提供理论依据和技术支撑.
1 材料与方法 1.1 试验材料试验所用的上覆水和底泥分别取自于福建泉州山美水库和惠女水库中的源水和表层底泥,由于山美水库水深30~40 m,惠女水库水深20~30 m,原位取柱状泥样较为困难,采用自制的取样器取得表层泥样,取样过程中对水库底泥有扰动,将表层泥样搅拌混匀作为试验所用的底泥.上覆水和底泥间隙水的水质指标(pH、TN、NH4+-N、亚硝态氮(NO2--N)、NO3--N、总磷(TP)、正磷酸盐(PO43--P)等)如表 1所示,底泥的物理化学性质及矿物成份如表 2所示.
| 表 1 上覆水和底泥间隙水的水质指标* Tab.1 Characteristics of the overlying and the interstitial water |
| 表 2 底泥物理化学性质及矿物成份 Tab.2 Physical and chemical properties and the mineral composition of sediments |
试验所用的沸石是天然斜发沸石,沸石粒径为1~2 mm,比表面积为42.51 m2/g,沸石对NH4+-N最大吸附量为13.5 mg N/g.其物理化学及矿物特征详见参考文献[13, 22].
试验所用的生物沸石是将天然斜发沸石浸置在由2株高效异养硝化细菌(WGX10和WGX18,均为芽孢杆菌属,Bacillus sp.)和2株高效好氧反硝化菌(HF3和HF7,均为不动杆菌属,Acinetobacter sp.)组成的混合菌液中,通过连续曝气挂膜方法制备而成;4株菌的生理生化特性及生物沸石制备过程详见参考文献[13, 22].
1.2 试验装置与方法试验在容积为10 L、直径为200 mm的广口玻璃瓶中进行;上覆水水深为20 cm,底泥厚度为5 cm,生物沸石的覆盖强度为1 kg/m2(覆盖厚度约1 mm).
试验共有16个广口玻璃瓶,分为8组,每组2个平行,编号为1#~8#,其中,1#为山美水库底泥,无覆盖,广口瓶敞开,命名为“SM-NC”;2#为山美水库底泥,生物沸石覆盖,广口瓶敞开,命名为“SM-C”;3#为山美水库底泥,无覆盖,广口瓶密封,密封前,先将加入瓶中的上覆水充N2,使其DO浓度 < 0.1 mg/L,然后加入玻璃瓶中,再充N2,使玻璃瓶中上覆水DO浓度 < 0.1 mg/L(下同),命名为“SM-NC-A”;4#为山美水库底泥,生物沸石覆盖,广口瓶密封,命名为“SM-C-A”;5#为惠女水库底泥,无覆盖,广口瓶敞开,命名为“HN-NC”;6#为惠女水库底泥,生物沸石覆盖,广口瓶敞开,命名为“HN-C”;7#为惠女水库底泥,无覆盖,广口瓶密封,命名为“HN-NC-A”;8#为惠女水库底泥,生物沸石覆盖,广口瓶密封,命名为“HN-C-A”.
试验在室温下进行,历时120 d;广口玻璃瓶口敞开(不控制上覆水体DO浓度),或广口玻璃瓶口密封(控制上覆水体DO < 1 mg/L),考察上覆水DO浓度对生物沸石覆盖削减氮负荷效果的影响;玻璃瓶四周用黑色塑料袋包裹,防止光照的影响;定期测定柱中水深10 cm处水温、DO浓度和pH(对于敞开广口瓶系统用便携式仪器直接测定,对于密封广口瓶系统则快速打开用于密封的橡胶塞,然后用便携仪器测定,若实验过程中出现密封广口瓶系统DO>1 mg/L,就先通过向广口瓶中充N2,使其系统上覆水中DO < 1 mg/L,但是本实验研究过程中,密封广口瓶中的DO浓度未出现大于1 mg/L的情况);每次取水样约40 ml,分别测定水样中的TN和NH4+-N浓度.
试验结束时,将玻璃瓶中底泥混匀,取出玻璃瓶内的底泥,风干、碾细、过100目尼龙筛后待分析;测试分析底泥中TN、NH4+-N和有机氮含量.
1.3 测定方法 1.3.1 水体相关指标测定方法水温和DO浓度:HACH HQ30d型便携式溶解氧测定仪;pH:上海精密科学仪器有限公司,雷磁PHB-4型便携式pH计;TN浓度:过硫酸钾氧化,紫外分光光度法[23];NH4+-N浓度:纳氏试剂光度法[23];NO2--N浓度:N-(1-奈基)-乙二胺光度法[23];NO3--N浓度:紫外分光光度法[23];TP、PO43--P浓度:钼锑抗分光光度法[23].
1.3.2 底泥相关指标测定方法TN含量:硒粉—硫酸铜—硫酸钾—硫酸消煮法(又称半微量开氏法)[24];TP含量:高氯酸-硫酸消化—钼锑抗分光光度法[25];有机质含量:重铬酸钾容量法-外加热法[25];NH4+-N含量:2 mol/L KCl浸提—靛酚蓝比色法[26];有机氮含量:忽略底泥中的NO3--N,有机氮含量为TN含量与NH4+-N含量的差值;主要矿物成份:采用德国Bruker-AXS公司D8 Advance X射线衍射仪(XRD)分析;真实密度:采用He置换法,在真空容量法吸附装置中测定,具体测定步骤是:在真空容量法吸附装置中,用He作介质,通过理想气体状态方程(P·V=n·R·T)计算测试腔内样品所排开的气体体积,从而精确测量样品的骨架体积(含闭孔),采用真实密度=样品质量/样品骨架体积(含闭孔)公式计算出样品真实密度.
1.4 数据处理上覆水体和底泥中不同形态氮削减率(P)的计算公式为:
| $P = \frac{{{C_{{\rm{NC}}i}} - {C_{{\rm{C}}i}}}}{{{C_{{\rm{NC}}i}}}} \times 100\% $ | (1) |
式中,CCi为取样时生物沸石覆盖系统上覆水或底泥中不同形态氮浓度(mg/L或mg/kg);CNCi为取样时未覆盖系统上覆水或底泥中不同形态氮浓度(mg/L或mg/kg);i为取样次数.
采用Excel软件对生物沸石覆盖系统与未覆盖系统之间削减氮污染物效果的差异进行方差分析.
2 结果与讨论 2.1 削减上覆水体中氮负荷的能力在试验历时120 d过程中,各系统中水温为24.4~29.7℃,SM-NC、SM-C、SM-NC-A和SM-C-A等4个系统中pH为6.80~7.22,HN-NC、HN-C、HN-NC-A和HN-C-A系统中pH为7.35~7.82,SM-NC和SM-C系统中DO浓度为4.02~7.35 mg/L,HN-NC和HN-C系统中DO浓度为2.52~6.85 mg/L,SM-NC-A、SM-C-A、HN-NC-A和HN-C-A系统中DO浓度 < 1 mg/L.各系统中上覆水NH4+-N和TN浓度变化如图 1、2所示.

|
图 1 山美水库(a)和惠女水库(b)各系统上覆水中NH4+-N浓度 Fig.1 NH4+-N concentration of overlying water in each system from Shanmei Reservoir(a) and Huinü Reservoir(b) |
由图 1可见,在上覆水DO浓度 < 1 mg/L时,山美水库和惠女水库底泥均持续向水体释放NH4+-N,惠女水库底泥释放强度明显高于山美水库,说明惠女水库底泥氮释放风险高于山美水库;在上覆水DO浓度为4.02~7.35 mg/L时,山美水库底泥开始向水体释放NH4+-N,上覆水体NH4+-N浓度达到最大值后逐渐降低;但在上覆水DO浓度为2.52~6.85 mg/L时,惠女水库底泥向水体释放NH4+-N的规律与山美水库不完全相同,上覆水体NH4+-N浓度先增加,再减小,然后又增加,再减少,这规律与沙茜等[27]研究湖泊底泥NH4+-N释放规律相同;可见,即使在好氧条件下,山美水库和惠女水库底泥仍然不断向水体释放NH4+-N.在试验进行的前6 d,生物沸石覆盖均能完全抑制底泥中NH4+-N释放,主要依靠沸石对NH4+-N快速的物理化学吸附作用,说明沸石吸附NH4+-N的量大于底泥释放NH4+-N的量;6 d后,生物沸石覆盖系统上覆水中NH4+-N浓度有上升趋势,说明沸石物理化学作用吸附NH4+-N的量与高效硝化细菌的硝化作用解吸NH4+-N的量之差小于底泥释放NH4+-N的量,但覆盖系统中NH4+-N浓度明显低于未覆盖系统,说明生物沸石覆盖能有效削减水库底泥NH4+-N释放.
本研究未关注NO3--N和NO2--N浓度的变化过程,但作者前期的试验监测了生物沸石覆盖系统上覆水中NH4+-N、NO3--N和NO2--N浓度的变化过程,得到一致的结论是[13, 19-22]:(1) 系统上覆水中NH4+-N和NO2--N浓度先增加再减少,NO3--N浓度先增加后缓慢减少,最终系统上覆水中氮主要以NO3--N形式存在,NH4+-N和NO2--N浓度都很低;(2) 系统上覆水中NO2--N浓度是在NH4+-N浓度达到最大时,才开始逐渐增加,当NH4+-N浓度不再下降时,NO2--N浓度达到最大值,此时,系统上覆水中NO3--N浓度开始上升,当NO2--N浓度不再下降时,NO3--N浓度达到最大值,再缓慢降低.
SM-C系统对TN的削减率为37.38%~80.28%,平均值为58.89%;SM-C-A系统对TN的削减率为39.03%~75.06%,平均值为62.22%;HN-C系统对TN的削减率为52.96%~88.04%,平均值为65.75%;HN-C-A系统对TN的削减率为28.33%~78.92%,平均值为62.64%(图 2).方差分析表明,SM-NC和SM-C、SM-NC-A和SM-C-A、HN-NC和HN-C、HN-NC-A和HN-C-A系统中TN浓度均存在明显差异(P < 0.01),可见,在不同实验条件下,生物沸石覆盖均能有效削减上覆水中氮负荷,说明通过生物沸石覆盖削减水源水库氮负荷是可行的.
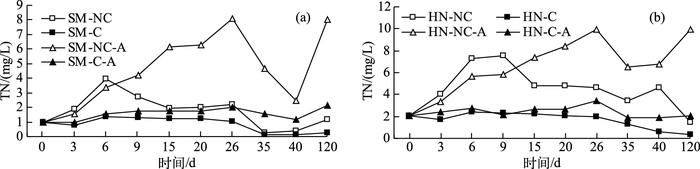
|
图 2 山美水库(a)和惠女水库(b)各系统上覆水中TN浓度 Fig.2 TN concentration of overlying water in each system from Shanmei Reservoir(a) and Huinü Reservoir(b) |
试验历时120 d,试验前后各系统底泥中不同形态氮含量如表 3所示. SM-C系统对底泥TN、NH4+-N和有机氮的削减率分别为10.39%、44.56%和8.41%;SM-C-A系统对底泥TN、NH4+-N和有机氮的削减率分别为12.09%、32.35%和10.88%;HN-C系统对底泥TN、NH4+-N和有机氮的削减率分别为12.14%、39.45%和11.04%;HN-C-A系统对底泥TN、NH4+-N和有机氮的削减率分别为13.08%、42.30%和10.97%;生物沸石覆盖对底泥中NH4+-N有较好的削减效果,对TN和有机氮也有一定的效果,说明生物沸石覆盖不仅削减了水源水库上覆水氮负荷,而且对底泥中氮负荷也有一定的削减作用,尤其是较好地削减了底泥中容易释放的NH4+-N,进一步说明通过生物沸石薄层覆盖削减水源水库氮负荷是可行的.生物沸石覆盖修复过程促进了底泥有机氮转化为NH4+-N并释放到间隙水中,生物沸石再快速吸附间隙水中NH4+-N,从而实现削减底泥中氮负荷,降低底泥释放氮污染物风险,当然,这里似乎引起争议问题,即生物沸石覆盖促进底泥将有机氮转化为NH4+-N,这个过程看起来是不利的,但是生物沸石最能快速吸附NH4+-N,使得底泥中NH4+-N和有机氮都有削减,实现底泥内源氮负荷削减.
| 表 3 试验前后各系统底泥中不同形态氮含量 Tab.3 Nitrogen content of the sediment in each system before and after the experiment |
由图 2和表 3可见,SM-C-A系统对山美水库上覆水和底泥总氮的削减效果均略好于SM-C系统,HN-C系统对惠女水库上覆水中TN的削减效果略好于HN-C-A系统,但HN-C系统对惠女水库底泥TN的削减效果略差于HN-C-A系统,总的来说,密封玻璃瓶系统对TN的削减效果优于敞开玻璃瓶系统,可见,上覆水体DO浓度越小,生物沸石覆盖系统削减TN的效果越好,这结果与前期生物沸石覆盖削减扬州古运河氮负荷的研究结果不一致(前期研究表明,在上覆水体DO < 1 mg/L时,不利于高效菌发生硝化反应将水体NH4+-N转化为NO3--N,从而影响了高效菌反硝化脱氮效果[13]),主要原因是扬州古运河与两个水库上覆水氮形态差异很大,扬州古运河水中的氮主要以NH4+-N形态存在(TN:17.52 mg/L;NH4+-N:14.54 mg/L),而山美水库和惠女水库水体中的氮主要以NO3--N形态存在(山美水库:TN:3.24 mg/L;NO3--N:2.66 mg/L;惠女水库:TN:3.95 mg/L;NO3--N:3.02 mg/L),说明山美水库和惠女水库水体自身硝化能力较强,上覆水体DO浓度较低时,更有利于高效菌反硝化脱氮.可见,针对山美水库和惠女水库水中氮主要以NO3--N形态存在以及底部水体DO浓度较低等特点,利用生物沸石薄层覆盖削减水库氮负荷更有优势,应用前景更为广阔,但是,水源水库底泥生物沸石薄层覆盖修复过程的氮迁移转化机制亟需进一步研究.
2.4 削减氮负荷的作用机理分析首先,通过生物沸石的物理吸附和化学吸附(离子交换)将底泥释放的NH4+-N储存在覆盖层中,从而控制底泥向上覆水释放NH4+-N,同时,生物沸石也吸附上覆水体中部分NH4+-N,削减了上覆水体中氮负荷,此过程持续若干天后,生物沸石层对NH4+-N的吸附达到相对饱和[13, 22].
其次,通过生物沸石上高效异养硝化细菌和好氧反硝化细菌的同步异养硝化和好氧反硝化作用以及生物同化作用将沸石中NH4+-N解吸出来并转化为NO3--N,部分NO3--N进一步转化为N2,部分无机氮转化为有机氮,从而实现去除有毒性NH4+-N,同时,原位生物再生沸石吸附NH4+-N的能力,延长生物沸石覆盖层的有效性.其具体过程是:(1) 异养硝化作用:高效异养硝化细菌将液相NH4+-N转化为N2O、或NO2--N、或NO3--N,促进沸石固相中的NH4+-N解吸到液相中,实现原位生物再生沸石吸附NH4+-N的能力[28-29];(2) 生物同化作用:高效细菌将液相中部分NH4+-N、或NO2--N、或NO3--N作为氮源转化为有机氮;(3) 好氧反硝化作用:高效好氧反硝化细菌将液相中NO2--N、NO3--N、有机氮转化为N2[29].
总之,生物沸石覆盖层有效地减少底泥向水体释放NH4+-N,将对生物有毒性的NH4+-N转化为NO3--N(实现沸石吸附NH4+-N能力原位生物再生),部分NO3--N转化为N2(实现脱氮),可见,生物沸石覆盖能有效削减水源水库氮负荷.
本文尝试通过氮平衡来分析削减氮负荷的作用机理,但是由于水体中TN浓度、沸石吸附的NH4+-N量和底泥中TN含量三者之间的氮含量差好几个数量级,再加上底泥TN测定方法本身误差较大,致使系统氮平衡分析的结果不理想,这也是个瓶颈问题,因此,需要进一步设计科学可行的试验方案,精确计算系统中氮平衡,讨论生物沸石覆盖削减氮负荷作用机理.
2.5 野外原位应用时生物沸石覆盖厚度讨论污染底泥原位生物沸石薄层覆盖技术在野外原位应用时,存在的实际问题有:1) 薄层覆盖厚度太小,实际投加时,很难均匀覆盖,会有部分底泥表面未被生物沸石覆盖,影响生物沸石覆盖削减氮负荷效果,例如Özkundakci等[11]开发了一种以沸石改性的磷钝化剂(Z2G1或Aqual-PTM),以Z2G1为活性层覆盖材料原位控制沉积物氮和磷释放,富营养化Okaro湖实际应用结果表明:投加Z2G1后,湖泊中氮、磷负荷降低不明显,归因于Z2G1覆盖不均匀(Z2G1堆积密度为2 g/cm3,覆盖强度为0.35 kg/m2,水下摄像机显示实际覆盖强度为0.115~1.52 kg/m2),且部分沉积物表层未被覆盖;2) 若水下底泥有机腐殖质较多,底泥表层较为松散,生物沸石也会容易沉入表层浮泥中,减弱生物沸石覆盖削减氮负荷的效果;3) 加上野外风浪扰动,生物沸石薄层覆盖层很难完全阻止底泥再悬浮.因此,建议通过如下措施来消除或缓解上述问题:1) 若底泥表层浮泥较多,可先通过清淤方式将表层浮泥清除掉,或先覆盖5~10 cm厚度的干净沙子,再覆盖生物沸石;2) 在经济条件允许情况下,适当增加生物沸石覆盖厚度,如2~5 mm;3) 采用多层覆盖方式,即下层覆盖沙子,中层覆盖生物沸石,上层覆盖沙子.
3 结论1) 生物沸石薄层覆盖能有效削减水源水库氮负荷,覆盖强度为1 kg/m2的生物沸石覆盖(厚度约1 mm),对上覆水中TN的削减率为58.89%~65.75%,对底泥中TN的削减率为10.39%~13.08%,对底泥中NH4+-N的削减率为32.35%~44.56%,对底泥中有机氮的削减率为8.41%~11.04%.利用生物沸石薄层覆盖技术削减水源水库氮负荷是可行的.
2) 对于以NO3--N为主要形态氮的上覆水体,DO浓度越低,越有利于高效菌脱氮,可见,针对山美水库和惠女水库水中氮主要以NO3--N形态存在以及底部水体DO浓度较低等特点,利用生物沸石薄层覆盖削减水库氮负荷更有优势.
3) 水源水库底泥生物沸石薄层覆盖修复过程中氮迁移转化机制需要进一步试验研究,可借助于微生物分子生态学技术及氮平衡原理讨论分析,同时需要考察其他因素的影响,如碳源、上覆水氮负荷等.
| [1] |
Lürling M, Mackay E, Reitzel K et al. Editorial-A critical perspective on geo-engineering for eutrophication management in lakes. Water Research, 2016, 97: 1-10. DOI:10.1016/j.watres.2016.03.035 |
| [2] |
Lewis WM, Wurtsbaugh WA, Paerl HW. Rationale of control of anthropogenic nitrogen and phosphorus to reduce eutrophication of inland waters. Environmental Science & Technology, 2011, 45: 10300-10305. |
| [3] |
Zhong Jicheng, Liu Guofeng, Fan Chengxin et al. Environmental effect of sediment dredging in lake (Ⅰ): The role of sediment dredging in reducing internal phosphorus release. J Lake Sci, 2009, 21(1): 84-93. [钟继承, 刘国锋, 范成新等. 湖泊底泥疏浚环境效应:Ⅰ.内源磷释放控制作用. 湖泊科学, 2009, 21(1): 84-93. DOI:10.18307/2009.0111] |
| [4] |
Förstner U, Apit SE. Sediment remediation: U.S. focus on capping and monitored natural recovery. Fourth international conference on remediation of contaminated sediment. Journal of Soils and Sediments, 2007, 7: 351-358. DOI:10.1065/jss2007.10.256 |
| [5] |
Perelo LW. Review: In situ and bioremediation of organic ollutants in aquatic sediments. Journal of Hazardous Materials, 2010, 177: 81-89. DOI:10.1016/j.jhazmat.2009.12.090 |
| [6] |
Kim G, Jung W. Role of sand capping in phosphorus release from sediment. Journal of Civil Engineering, 2010, 14(6): 815-821. |
| [7] |
Lampert D, Sarchet WV, Reible DD et al. Assessing the effectiveness of thin-layer sand caps for contaminated sediment management through passive sampling. Environmental Science & Technology, 2011, 45(19): 8437-8443. |
| [8] |
Jacobs PH, Förstner U. Concept of subaqueous capping of contaminated sediments with active barrier system (ABS) using natural and modified zeolite. Water Research, 1999, 33(9): 2083-2087. DOI:10.1016/S0043-1354(98)00432-1 |
| [9] |
Berg U, Neumann T, Donnert D et al. Sediment capping in eutrophic lakes-efficiency of undisturbed calcite barriers to immobilize phosphorus. Applied Geochemistry, 2004, 19(11): 1759-1771. DOI:10.1016/j.apgeochem.2004.05.004 |
| [10] |
Lin JW, Zhan YH, Zhu ZL. Evaluation of sediment capping with active barrier system (ABS) using calcite/zeolite mixtures to simultaneously manage phosphorus and ammonium release. Science of the Total Environment, 2011, 409: 638-646. DOI:10.1016/j.scitotenv.2010.10.031 |
| [11] |
Özkundakci D, Hamilton DP, Gibbs MM. Hypolimnetic phosphorus and nitrogen dynamics in a small, eutrophic lake with a seasonally anoxic hypolimnion. Hydrobiologia, 2011, 661: 5-20. DOI:10.1007/s10750-010-0358-9 |
| [12] |
Meis S, Spears BM, Maberly SC et al. Sediment amendment with phoslock® in Clatto reservoir (Dundee, UK): Investigating changes in sediment elemental composition and phosphorus fractionation. Journal of Environmental Management, 2012, 93(1): 185-193. DOI:10.1016/j.jenvman.2011.09.015 |
| [13] |
Huang TL, Zhou ZM, Xu JL et al. Biozeolite capping for reducing nitrogen load of the ancient canal in Yangzhou City. Water Science and Technology, 2012, 66(2): 336-344. DOI:10.2166/wst.2012.189 |
| [14] |
Yin HB, Kong M. Reduction of sediment internal P-loading from eutrophic lakes using thermally modified calcium-richattapulgite-based thin-layer cap. Journal of Environmental Management, 2015, 15: 178-185. |
| [15] |
Yang MJ, Lin JW, Zhan YH et al. Immobilization of phosphorus from water and sediment using zirconium-modified zeolites. Environmental Science and Pollution Research, 2015, 22(5): 3606-3619. DOI:10.1007/s11356-014-3604-2 |
| [16] |
Gibbs M, Özkundakci D. Effects of a modified zeolite on P and N processes and fluxes across the lake sediment-water interface using core incubations. Hydrobiologia, 2011, 661: 21-35. DOI:10.1007/s10750-009-0071-8 |
| [17] |
Meis S, Spears BM, Maberly SC et al. Assessing the mode of action of Phoslock® in the control of phosphorus release from the bed sediments in a shallow lake (Loch Flemington, UK). Water Research, 2013, 47(13): 4460-4473. DOI:10.1016/j.watres.2013.05.017 |
| [18] |
Dithmer L, Nielsen UG, Lürling M et al. Responses in sediment phosphorus and lanthanum concentrations and composition across 10 lakes following applications of lanthanum modified bentonite. Water Research, 2016, 97: 101-110. DOI:10.1016/j.watres.2016.02.011 |
| [19] |
Huang TL, Zhou ZM, Su JF et al. Nitrogen reduction in eutrophic landscape river using bioactive multilayer capping (BMC) with biozeolite and sand. Journal of Soils and Sediments, 2013, 13(7): 1309-1317. DOI:10.1007/s11368-013-0703-5 |
| [20] |
Zhou ZM, Huang TL, Yuan BL et al. Remediation of nitrogen-contaminated sediment using bioreactive, thin-layer capping with biozeolite. Soil & Sediment Contamination, 2016, 25(1): 89-100. |
| [21] |
Zhou ZM, Huang TL, Yuan BL. Nitrogen reduction using bioreactive thin-layer capping (BTC) with biozeolite: A field experiment in a eutrophic river. Journal of Environmental Sciences, 2016, 42: 119-125. DOI:10.1016/j.jes.2015.07.005 |
| [22] |
Zhou Zhenming. In situ remediation of contaminated sediment using combined biological and physicochemical technology in the urban rivers and lakes[Dissertation]. Xi'an: Xi'an University of Architecture & Technology, 2013. [周真明. 城市河湖污染底泥原位生物/物化组合修复技术研究[学位论文]. 西安: 西安建筑科技大学, 2013. ]
|
| [23] |
"Water and wastewater monitoring and analysis method" editorial board of State Environmental Protection Administration of China ed. Monitoring and analysis methods of water and wastewater: fourth edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002. ]
|
| [24] |
Agricultural chemical professional committee of soil science society of China ed. Soil and agricultural chemistry general analysis. Beijing: Science Press, 1983. [中国土壤学会农业化学专业委员会. 土壤农业化学常规分析方法. 北京: 科学出版社, 1983. ]
|
| [25] |
Jin Xingcan, Tu Qingying. Eutrophication investigation specification of lakes: 2th ed. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范. 第2版. 北京: 中国环境科学出版社, 1990.]
|
| [26] |
Bao Shidan ed. Soil and agricultural chemistry analysis: 3th ed. Beijing: China Agriculture Press, 2005. [鲍士旦. 土壤农化分析. 第3版. 北京: 中国农业出版社, 2005.]
|
| [27] |
Sha Qian, He Jun, Zhang Weihao et al. Nitrogen release from sediments in different types of urban lakes. Environmental Science & Technology, 2013, 36(4): 89-91. [沙茜, 何君, 张维昊等. 不同类型湖泊沉积物中氮释放规律研究. 环境科学与技术, 2013, 36(4): 89-91.] |
| [28] |
Jung JY, Chung YC, Shin HS et al. Enhanced ammonia nitrogen removal using consistent biological regeneration and ammonium exchange of zeolite in modified SBR process. Water Research, 2004, 38: 347-354. DOI:10.1016/j.watres.2003.09.025 |
| [29] |
Wei YX, Ye ZF, Wang YL et al. Enhanced ammonia nitrogen removal using consistent ammonium exchange of modified zeolite and biological regeneration in a sequencing batch reactor process. Environmental Technology, 2011, 32(12): 1337-1343. DOI:10.1080/09593330.2010.536784 |
 2017, Vol. 29
2017, Vol. 29 
