(2: 江苏省姜堰市环境监测站 姜堰 225500)
(2: Environmental Monitoring Station of Jiangyan, Jiangsu Province, Jiangyan 225500, P.R.China)
目前,湖泊湿地水体富营养化程度日益严重.亚太地区54%的湖泊水体存在各种程度的富营养化[1],而在我国的湖泊(包括水库)水体受到富营养化影响的比例达到66%以上[2].在富营养化过程中涉及的主要营养元素为植物主要生理过程必需的氮(N)和磷(P)[3].大量研究表明,水生植物,特别是湿地植物,对于水体富营养化削减具有积极意义[4].英国境内很多湖泊都是通过监测水生植物生长与群落演替过程来指示水体富营养化进程,并向管理部门提供分析结果[3].更有很多管理部门直接向湿地生态系统中引入水生植物,达到净化水体的效果[5].因为水生植物与土壤可以形成一个复合系统[4],通过根系吸收、凋落、酸性分泌物分泌等途径,使得N、P及一些重金属元素在植物-土壤系统中周转,最终达到富集的效果,降低水体中的浓度[6].水生植物与土壤形成的复合系统中,根系周围活跃的微生物作用也能有效降低总氮(TN)和总磷(TP)浓度,如硝化细菌和反硝化细菌的作用能够固持水体中大部分TN,从而降低其在水中的含量[7].蒋跃平等[8]的研究结果表明,水生植物平均TN和TP积累对去除水体中TN和TP的贡献率分别为46.8%和51.0%,而其地上部分平均TN和TP积累对去除水中TN和TP的贡献率就高达38.5%和48.5%.另外也有研究表明,土壤中发达的植物根系为微生物提供了良好的生存环境,改变了机制的通透性,增强了对N、P等的吸收和沉淀[9].
引入植物种的选择方面,欧洲范围以芦苇(Phragmites australis (Cav.) Trin. ex Steud.)为主,而在美国则更倾向于宽叶香蒲(Typha latifolia L.)[10].这两种水生植物在我国湿地生态系统中也有广泛分布.刘长娥等[11]通过对长江河口九段沙上沙湿地生态系统中3种主要植物营养元素含量进行分析发现,不同水生植物N、P元素富集过程各不相同.其中芦苇富集效率相对最高.之后,杨永兴等[12]又指出芦苇对N、P的富集主要集中在表层土壤,这主要和芦苇根系分布特征有关.对内蒙古乌梁素海湿地芦苇群落生物量分布调查发现,水体N浓度与总生物量呈正相关[13].而在水体的净化过程中,香蒲的TP净化效率要略高于TN的净化效率.香蒲通过其发达的根系还可以有效降低湿地土壤间隙水中N、P含量,从而提高湿地潜流或上覆水中营养元素的固持效率[14].针对H2PO4-、NH4+、NO3-的吸收动力学特征分析结果显示,芦苇对P具有更强的耐瘠能力,而东方香蒲(Typha orientalis Presl)对N具有更强的耐瘠能力[15].芦苇或香蒲单一植物群落类型对N、P等营养元素固持作用已有部分报道,而混合群落(如芦苇+香蒲)的净化效率与单一植物群落相比有什么样的变化,需要进一步明晰.
近年来,由于污水排放、污染事故、疏浚物倾倒等负面事件的发生,溱湖湿地水环境质量严重下降.有研究表明,溱湖湖心水体TN和TP浓度分别增加了4倍和17倍(1989-2010年)[16].明确溱湖湖体周边水生植物对于这一富营养化趋势的作用,以及不同湿地植被类型降低溱湖湿地水体富营养化水平的差异,可以为溱湖湿地管理决策过程提供重要理论支持.
因此,本研究在溱湖湿地范围内,选取2个环境情况基本一致、具有代表性的河岸湿地芦苇群落(芦苇群落、芦苇+香蒲群落)样地进行采样研究.按季节取样分析芦苇植株各器官和土壤各层TN和TP含量,并对水体N、P元素浓度进行监测.研究芦苇和芦苇+香蒲两种水生植物群落类型对于水体N、P元素净化效率的差别,为溱湖湿地水生植物管理提供理论依据,为湿地生态系统土壤-植被养分循环提供理论支撑.
1 材料与方法 1.1 实验区域概况溱湖湿地(32°37′2.70″~32°37′33.70″N,120°5′29.90″~120°6′14.70″E)地处江苏中部,属亚热带湿润气候区,四季分明,气候温和,年均气温16℃,冬季平均气温3.3℃,夏季平均气温26.2℃,年均降雨量1031.8 mm,平均相对湿度80%,无霜期220天,全年主导风向东南风.区域植物主要由芦苇群落、花叶芦竹(Arundo donax var. versicolor)群落、长苞香蒲(Typha angustata Bory et Chaub.)群落等组成.芦苇群落以及香蒲群落在湿地各区域均有分布,属于优势湿地植被类型.
1.2 实验设计与样品处理本实验在溱湖国家级湿地公园中选取发育典型、未受严重人为干扰、面积较大的湿地(其中主要植被类型为芦苇群落和芦苇+香蒲群落)作为采样分区,分区面积为5 hm2(表 1).采样分区内,划出芦苇单一群落区(样地Ⅰ)和芦苇+香蒲混合群落区(样地Ⅱ)各3个,并在每个群落区中设立20 m×20 m的样方2个,其中1个收割其地上植物作为对照,于2012年2月-2013年2月期间每个月下旬重新收割一次.总样方数12个,包括芦苇单一群落区3个,对照3个;芦苇+香蒲混合群落区3个,对照3个.于2012年2月-2013年2月共12个月期间,按照春(3-4月)、夏(5-8月)、秋(9-11月)、冬(12-2月)4个季节划分,每个小样方在各季节取两次样,每次取3个平行样,每个样品分析化验3次.采用收获法采集植物样品,在小样方内每次取样时随机选取9株长势良好的植物,并在生长季末(10月末)选取3块1 m×1 m的小样方,齐地割下所有植物地上部分,将茎、叶、穗分别整理装袋.植物地下根部采用挖掘法,去除死根后就地洗净,将所有样品用聚乙烯自封袋盛装,贴好标签后带回实验室备用.取根同时,(包括对照样地)按照土层(0~15、15~30、30~45和45~60 cm)多点混合法收集土壤样品;在采样分区水流入口和出口分别布设两个采样断面,各6个采样点,并用聚乙烯采样瓶采集河流明水面下20 cm水样,采集时间为上午10:00-12:00,密封时样品液面与瓶盖齐平,采集后装于有冰块的泡沫箱带回实验室测定.
| 表 1 采样分区群落特征 Tab.1 Community characteristics of sampling zones |
将采集的植物样品分成根、茎、叶、穗4部分,首先在105℃烘箱中烘15 min杀青,然后低温(65℃)烘24 h至恒重,计算生物量.对烘干后的植物样品进行粉碎、混合,过60目(0.25 mm)尼龙筛.用H2SO4-H2O2消化之后,TN含量用凯氏定氮法测定,TP含量用钼锑抗比色法测定.
将采集的土壤样品置于阴凉通风环境中自然风干.然后将风干后的土样研磨,过100目(0.15 mm)筛待测. TN含量用凯氏定氮法,TP含量用高氯酸消煮钼锑抗比色法测定.
水样TN浓度的测定采用过硫酸钾氧化紫外分光光度法(GB 11894-1989),TP浓度的测定采用钼酸铵分光光度法(GB/T 11893-1989).
1.3 数据处理首先对数据进行单样本Kolmogorov-Smirnov检验,证明数据符合正态分布,再进行Levene方差齐性检验(P>0.05);然后使用SPSS 19.0软件对植物各器官与土壤N、P含量数据进行单因素方差分析(one-way ANOVA,α=0.05);最后采用LSD检验(α=0.05),并用Sigmaplot 12.5软件统计和作图.
2 结果与分析 2.1 实验样地上、下游水体TN和TP浓度年均值比较湖水从上游流经被研究湿地到达下游后,TN和TP浓度都有所减小(P≤0.05,表 2),而TN的削减率(37.3%)要高于TP的削减率(27.3%).由此可以推断出,被研究湿地对于水体TN和TP浓度都存在削减作用,且对于TN的削减作用更大.
| 表 2 实验样地上、下游水体中TN和TP年均浓度比较(n=12) Tab.2 Annual average concentrations of TN and TP in the water of upstream and downstream of experimental sites |
为了验证湿地土壤对于水体中N、P削减作用的贡献,分析了各样地中各土层TN和TP含量(图 1).结果表明,两种植被类型中,土壤各土层TN含量均表现为芦苇+香蒲群落最高(P < 0.05),而芦苇群落各土层TN含量也略高于对照样地(0.05 < P < 0.08),说明水生植物对于土壤固持水体中的TN有一定的促进作用,而多样性的升高也会显著提升这种促进效果.土壤中TP含量则为单一芦苇群落最低(P < 0.01),芦苇+香蒲群落与对照样地间只有表层土壤(0~15 cm)出现了显著降低(P < 0.01),其他土层差异均不显著(P>0.05).香蒲的加入导致了这种现象的出现,这说明香蒲对土壤中P的固持有一定的促进作用,而芦苇则会消耗土壤中的P,对湿地土壤P固持的过程产生了负面影响.

|
图 1 实验样地中各土层TN和TP含量 Fig.1 Contents of TN and TP in different depths of soil in experimental sites |
结果表明,芦苇叶中的TN含量远高于根、茎、穗的TN含量(P < 0.01),不同群落之间并无差异(P>0.05).这说明芦苇植株对于N的吸收过程并未受到香蒲的干扰,叶片的N富集效率最高.芦苇+香蒲群落中香蒲各器官中的TN含量除了叶片低于芦苇之外(P < 0.05),其余器官的TN含量都与芦苇差异不显著(P>0.05) (图 2).

|
图 2 实验各样地中芦苇和香蒲各器官TN和TP含量 Fig.2 Contents of TN and TP in the organs of Phragmites australis and Typha latifolia in experimental sites |
TP含量在芦苇和香蒲各器官中的变化较大,香蒲穗中的TP含量是其他器官的1.8~3.4倍,出现明显的富集现象.单一芦苇群落中的芦苇叶片TP含量显著高于根、茎、穗(P < 0.01),这与TN含量分布一致.芦苇+香蒲群落中的芦苇穗中TP含量却显著提高,同时也是单一芦苇群落中芦苇穗TP含量的2.5倍(P < 0.01),但与叶片中含量差异不显著(P>0.05) (图 2).
从N、P储量来看,芦苇植株内N、P储量都是根>茎>叶>穗,而香蒲则是根>穗>茎>叶(表 3);芦苇根部富集的N、P储量分别占到植株总N、P储量的66.7%和71.4%,高于香蒲根部的N、P储量所占比例(61.8%和62.5%).香蒲穗中富集了相对较高的N、P(21.6%和25%),而单一芦苇群落芦苇穗中的N、P储量只占植株总储量的4.2%和2.6%.同时,芦苇+香蒲群落芦苇穗中P储量大幅度提高,占到了植株总P储量的7.2%,是单一芦苇群落芦苇穗P储量的2.8倍.另外,芦苇由于在生物量上与香蒲存在着显著的差异,因此根、茎、叶中N、P储量都远高于香蒲.但是香蒲穗中P含量较高,使得其P储量的绝对值也达到了单一芦苇群落芦苇穗P储量的2倍.
| 表 3 各实验样地中芦苇和香蒲各器官生物量及N、P储量 Tab.3 Organs biomass and N & P reserves of Phragmites australis and Typha latifolia in experimental sites |
香蒲的穗器官在秋、冬季节已消失,所以在本次实验中没有收集到数据.从芦苇各器官的季节动态来看,芦苇茎、叶器官的TN和TP含量在夏季高于其他几个季节,TN含量表现比较明显,特别是对于芦苇茎来说,夏季的TN含量高出其他几个季节70%~84%,而TP含量甚至高出其他几个季节81%~92%.芦苇根的TP含量在各个季节都没有明显变化,这可能是因为根在各季节没有明显的增长与消减,且对P的需求在各季节没有高低起伏,而芦苇茎的TP含量在夏季明显较高可能是因为它在夏季生长旺盛,植株需要较多的P以促进生长.从香蒲器官季节动态来看,香蒲茎、叶器官的TN含量在夏季和芦苇茎、叶器官一样,都比其他几个季节高.在夏季,香蒲各器官的TN含量为穗>叶>茎>根,TP含量则为穗>茎>叶>根,穗在夏季发育较快,且需要的N、P元素较多,所以含量比其他器官高(图 3).
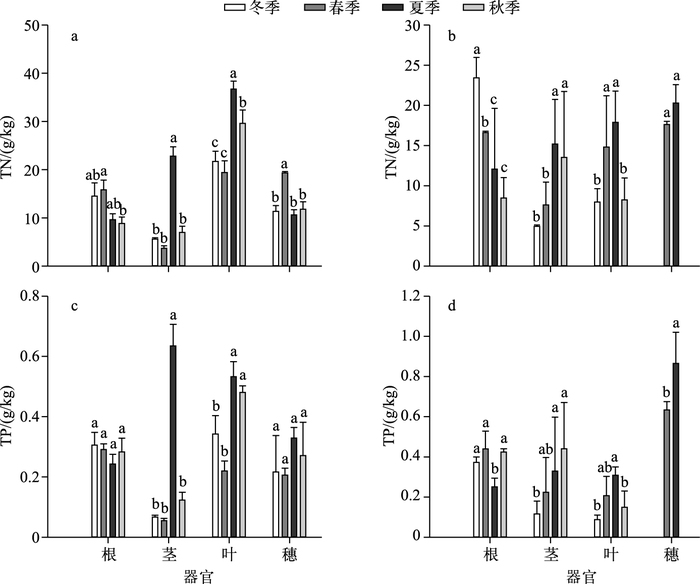
|
图 3 芦苇(a、c)和香蒲(b、d)各器官TN和TP含量的季节动态 Fig.3 Seasonal dynamic contents of TN and TP in the organs of Phragmites australis (a, c) and Typha latifolia(b, d) |
湿地土壤对于N、P元素有一定的固持作用,表现为含有大量有机质的湿地土壤中存在大量的铁、铝氧化物,这些表面带有正电荷的颗粒具有较强的吸附性以固定水体中的营养元素[17];生物因子(植物、微生物)通过吸收、代谢等生理过程富集N、P,最终大部分沉积至土壤中,达到固定营养元素的效果[18].此外,动植物残体归还、人为来源(施肥与污染等)以及大气沉降也能促使土壤N、P元素含量的变化.特别对于P元素来说,土壤P元素主要来源于成土母质,在较大尺度上来讲,土壤类型和气候条件对土壤N、P元素也有影响[19].而影响溱湖土壤N、P元素的主要是人为因素.本研究结果显示,样地所在流域(近2 hm2湿地面积)下游水体中TN和TP含量比上游显著降低(P < 0.05),TN和TP削减率分别为37.3%和27.3%.证明溱湖湿地对于N、P元素的削减作用存在,且固N效率相对P更高.
芦苇和香蒲是溱湖湿地两种最常见的高等水生植物,它们对于营养元素存在着很好的富集过程,经常被用作人工湿地净化物种来削减水体中的N、P元素[20].本研究结果显示芦苇群落土壤对于水体中的N有一定的富集作用,但是主要发生在30~45 cm土层中.这主要是由于芦苇等水生植物根系43%都分布在30 cm以下土层,而且99.1%以上都是表面积大的细根(直径小于2 mm)[21],有利于在30 cm以下土层的N被吸收利用.同时由于细根周转快的特点,也有利于土壤中N的富集.
进一步分析表明,芦苇+香蒲的群落配置会显著提高水生植物群落土壤中TN的富集现象.因为当芦苇、香蒲共存时芦苇主要通过忍耐机制,香蒲主要通过逃避机制应对种间胁迫[22],这种种间竞争适应主要会体现在根系分布深度(香蒲根系分布深度增加,芦苇不变)、茎粗(减小)、叶片数(减小)和株高(增加)上[23].对于人工湿地中芦苇、香蒲不同配置模式下土壤N、P净化效率的对比研究也发现,混交模式中香蒲会通过在种植初期增加叶片氮含量来提高与芦苇竞争过程中的光竞争劣势[24];而且对人工湿地的研究表明香蒲根系分布较芦苇来说更加密集,为微生物提供了良好的栖息场所,加强了微生物的硝化与反硝化作用,这与已有的研究香蒲根际微生物数量及活性要高于芦苇相吻合[25].换言之,芦苇+香蒲群落中相对激烈的种间竞争会通过提高生态系统中N利用效率来促进N的生物富集过程,然后通过植物-土壤系统导致土壤N含量显著提高.
3.2 溱湖湿地芦苇和香蒲各器官TN和TP含量季节动态芦苇各器官的TN和TP含量的季节动态反映了植物体各器官对N、P的需求,植物体不同器官中TN含量的季节变化主要与其对N化合物的合成能力与需求有关[26].有研究表明[27],芦苇茎、叶的TN含量在夏季较高,这与本研究的结果一样.其原因可能是夏季芦苇处于生长旺期,植物需要充足的N来调节叶片光合速率、相关酶活性及气孔导度来满足高光合效率的需求.因此,运输器官(茎)与叶片都会大量富集N;而生长期结束后,地上器官的N开始向地下器官转移,其含量开始下降.对九段沙中沙湿地中芦苇各构件(根、茎、叶等)TP含量季节动态研究表明[11],芦苇各构件TP含量的最高值均发生在生长期的5月,这与本研究中芦苇茎、叶、穗器官TP含量动态类似.在植物生长发育的关键时期,P作为植物生长发育的必要元素需求量很大.于是,植物开始大量富集P以供给整个生长旺季的需要.香蒲各器官N、P也有随季节而向上输送蓄积或向下转运回流的特点[28],即香蒲地上部分和地下部分TN和TP含量也会在生长季出现峰值.本研究中香蒲各器官季节动态与芦苇类似,说明水生植物不同季节对N、P的需求主要与环境因子相关.而且,在夏季香蒲穗中出现N、P的大量富集,Hendrickson等[29]也发现了这一现象.这主要是由于植物不同器官中TN和TP含量变化与植物自身结构和生长节律密切相关.穗只在春、夏两季生长,对营养元素的需求都集中在这两个季节,尤其作为生殖器官对P的需求很大,导致了与其他器官的显著差异.
3.3 溱湖湿地两种主要群落类型的N和P固持效果本研究中芦苇和香蒲各器官N:P与全球和中国陆地植物N:P分布有一定的差异.全球陆生植物叶片中N:P平均值为13(凋落物中为20),水生植物为12;中国陆生植物叶片N:P平均值为14[30],而在本研究中叶片N:P约为68.9.这种现象的出现是因为本研究中芦苇叶片N含量(26.87 g/kg)远高于中国陆生植物叶片N含量(18.6 g/kg);同时,芦苇和香蒲P含量(0.39 g/kg和0.19 g/kg)远低于中国陆生植物叶片P含量(1.21 g/kg).有研究表明,植物N:P < 14时,N成为植物生长的限制因子;植物N:P>16时,P成为植物生长的限制因子[31].本研究结果说明溱湖湿地富营养化主要集中在N过量对水生植物的影响上面,而水生植物群落中P仍处于一个相对缺乏的状况.这主要是因为虽然水体中P有富营养化的趋势,但是这些P并不能够满足N的大量富集导致的植物(芦苇)对P的需求.
正因为P是溱湖湿地水生植物生长的限制因子,芦苇群落的生长不仅不能提高土壤P的富集效率,反而加速了土壤中P的消耗.芦苇对于土壤P贫瘠的耐受能力较强,利用效率较高[26-27].当P为限制因子时,芦苇可以通过调整pH值富集根际土壤溶液TP,从而活化土壤中部分相对稳定的P[32].而香蒲在P贫瘠时,只能依靠提高根系生物量来提高P的获取,而不能改变土壤化学组成[26],这就导致了它会更多依靠吸收水体中的P来满足自身生理需求[14].相比之下,由于香蒲具有更为直接的P贫瘠应对策略,对人工湿地研究结果表明单一种植条件下香蒲具有更高的P富集效率[33].因此,当芦苇与香蒲共生时,香蒲通过提高根系生物量的方式达到富集土壤P的效果,抵消群落中芦苇对土壤P的消耗.另外,本研究结果中出现的芦苇+香蒲群落表层土壤(0~15 cm)TP含量的降低主要是由于香蒲在与芦苇竞争过程中的逃避机制使其根系向更深的土壤中分布[27],因此对于表层土壤P的富集过程不能完全抵消芦苇对土壤P的消耗.
4 结论1) 根据上、下游水体TN和TP浓度年均值差异可以看出溱湖湿地对水中TN和TP浓度有一定的削减作用,且对TN的削减作用更大,TP的削减率为27.3%,而TN的削减率约是TP的1.37倍.
2) 芦苇群落的湿地可以增强其土壤(30 cm以下土层)富集N的效率,并且芦苇+香蒲群落中的土壤固N效率比单一芦苇群落土壤的高;对于P来说也是一样,香蒲的加入对土壤中P的固持有一定的促进作用,从而使得芦苇+香蒲群落的土壤固P效率也比单一群落的土壤高.
3) 不同季节芦苇和香蒲器官TN和TP含量有所变化,对芦苇而言,芦苇茎、叶器官的TN和TP含量在夏季高于其他几个季节,TN含量表现比较明显,特别是对于芦苇茎来说,夏季的TN含量高出其他几个季节70%~84%,而TP的含量甚至高出其他几个季节81%~92%;对香蒲而言,香蒲茎、叶器官的TN含量在夏季和芦苇茎、叶器官一样,都比其他几个季节高.在夏季,香蒲各器官的TN含量为穗>叶>茎>根,TP含量则为穗>茎>叶>根.穗在夏季发育较快,且需要的N、P元素较多,所以含量比其他器官高.
4) 芦苇、香蒲对于P贫瘠的响应机制不同导致芦苇会消耗土壤P,而香蒲的介入可以抵消这一消耗的过程.因此,芦苇+香蒲的植物配置模式可以提高湿地土壤固持N、P的综合效率.
| [1] |
Wang Zhi, Zhang Zhiyong, Zhang Junqian et al. The fauna structure of benthic macro-invertebrates for environmental restoration in a eutrophic lake using water hyacinths. China Environmental Science, 2012, 32(1): 142-149. [王智, 张志勇, 张君倩等. 水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征. 中国环境科学, 2012, 32(1): 142-149.] |
| [2] |
Jin Xiangcan, Hu Xiaozhen. Concept and tactic of clean water runoff generation mechanism restoration in lake watershed. China Environmental Science, 2010(3): 374-379. [金相灿, 胡小贞. 湖泊流域清水产流机制修复方法及其修复策略. 中国环境科学, 2010(3): 374-379.] |
| [3] |
Bengtsson L, Herschy RW. Encyclopedia of lakes and reservoirs. Monographiae Biologicae, 2012, 53: 10-26. |
| [4] |
Huang Xiuyong. Biological cycling of nutrient elements of two plantations in southeast coastal area, China. Journal of Northwest Forestry University, 2015, 30(2): 84-89. [黄秀勇. 东南沿海沙地2种人工林营养元素生物循环. 西北林学院学报, 2015, 30(2): 84-89.] |
| [5] |
Wu S, Kuschk P, Brix H et al. Development of constructed wetlands in performance intensifications for wastewater treatment: A nitrogen and organic matter targeted review. Water Res, 2014, 57: 40-55. DOI:10.1016/j.watres.2014.03.020 |
| [6] |
Lyubenova L, Kuhn AJ, Höltkemeier A et al. Root exudation pattern of Typha latifolia L. plants after copper exposure. Plant and Soil, 2013, 370(1/2): 187-195. |
| [7] |
Tong Changhua, Yang Xiaoe, Pu Peimin. Purification of eutrophicated water by aquatic plant. Chinese Journal of Applied Ecology, 2004(8): 1447-1450. [童昌华, 杨肖娥, 濮培民. 富营养化水体的水生植物净化试验研究. 应用生态学报, 2004(8): 1447-1450.] |
| [8] |
Jiang Yueping, Ge Ying, Yue Chunlei et al. Nutrient removal role of plants in constructed wetland on sightseeing water. Acta Ecologica Sinica, 2004(8): 1720-1725. [蒋跃平, 葛滢, 岳春雷等. 人工湿地植物对观赏水中氮磷去除的贡献. 生态学报, 2004(8): 1720-1725.] |
| [9] |
Johnson S. Effects of water level and phosphorus enrichment on seedling emergence from marsh seed banks collected from northern Belize. Aquatic Botany, 2004, 79(4): 311-323. DOI:10.1016/j.aquabot.2004.05.003 |
| [10] |
Korboulewsky N, Wang R, Baldy V. Purification processes involved in sludge treatment by a vertical flow wetland system: Focus on the role of the substrate and plants on N and P removal. Bioresour Technol, 2012, 105: 9-14. DOI:10.1016/j.biortech.2011.11.037 |
| [11] |
Liu Chang'e, Yang Yongxing, Yang Yang. Distribution characteristics and seasonal dynamics of N, P and K in wetland plants in upper shoal of Jiu duan sha. Chinese Journal of Ecology, 2008, 27(11): 1876-1882. [刘长娥, 杨永兴, 杨杨. 九段沙上沙湿地植物N, P, K的分布特征与季节动态. 生态学杂志, 2008, 27(11): 1876-1882.] |
| [12] |
Yang Yongxing, Liu Chang'e, Yang Yang et al. The grey correlation analysis of nutrient elements between wetland reed and soil at Jiuduansha of The Yangtze river estuary. Resources and Environment in the Yangtze Basin, 2010, 11: 1294-1301. [杨永兴, 刘长娥, 杨杨等. 长江河口九段沙上沙湿地芦苇与土壤之间营养元素的灰色关联分析. 长江流域资源与环境, 2010, 11: 1294-1301.] |
| [13] |
Duan Xiaonan, Wang Xiaoke, Ouyang Zhiyun et al. The biomass of Phragmites australis and its influencing factors in Wu liangsuhai. Chinese Journal of Plant Ecology, 2004, 28(2): 246-251. [段晓男, 王效科, 欧阳志云等. 乌梁素海野生芦苇群落生物量及影响因子分析. 植物生态学报, 2004, 28(2): 246-251. DOI:10.17521/cjpe.2004.0036] |
| [14] |
Zhu Huabing, Yan Shaohua, Feng Ke et al. Nutrients uptake in eutrophic water and sediment by water hyacinth and cattail. Jiangsu Journal of Agricultural Sciences, 2012, 28(2): 326-331. [朱华兵, 严少华, 封克等. 水葫芦和香蒲对富营养化水体及其底泥养分的吸收. 江苏农业学报, 2012, 28(2): 326-331.] |
| [15] |
Zhang Xiling, Wang Lixin, Liu Huamin et al. Kinetics of nutrient uptake by three emergent plants, Phragmites australis, Typha orientalis and Scirpus triqueter. Acta Ecologica Sinica, 2014, 34(9): 2238-2245. [张熙灵, 王立新, 刘华民等. 芦苇、香蒲和藨草3种挺水植物的养分吸收动力学. 生态学报, 2014, 34(9): 2238-2245.] |
| [16] |
Feng Jinmei, Zhang Hairong. Conservation and measures of Qin Lake wetland in Jiangyan. Pollution Control Technology, 2011, 24(1): 23-27. [冯锦梅, 张海荣. 浅谈姜堰市溱湖湿地生态保护与对策研究. 污染防治技术, 2011, 24(1): 23-27.] |
| [17] |
Nie Fahui, Li Juanhua, Liu Zhanmeng. The adsorptive property research of wetland soil to ammonia nitrogen at Poyang Lake. Journal of East China Jiaotong University, 2015(2): 136-142. [聂发辉, 李娟花, 刘占孟. 鄱阳湖湿地土壤对氨氮的吸附性能研究. 华东交通大学学报, 2015(2): 136-142.] |
| [18] |
Liu Cunqi, Li Ang, Li Bo et al. Dynamics of biomass, nitrogen and phosphorus storage of Phragmites australis in Baiyangdian Lake. Acta Scientiae Circumstantiae, 2012, 32(6): 1503-1511. [刘存歧, 李昂, 李博等. 白洋淀湿地芦苇生物量及氮、磷储量动态特征. 环境科学学报, 2012, 32(6): 1503-1511.] |
| [19] |
Xie Changyong, Xu Tongkai, Chen Shixia et al. Hangzhou xixi wetland plant community impact on the distribution of soil carbon nitrogen and phosphorus. Journal of Hangzhou Normal University(Natural Science Edition), 2011(6): 501-505. [谢长永, 徐同凯, 陈始霞等. 杭州西溪湿地植物群落对土壤碳氮磷分布的影响. 杭州师范大学学报(自然科学版), 2011(6): 501-505.] |
| [20] |
Li L, Han W, Thevs N et al. A comparison of the functional traits of common reed (Phragmites australis) in northern China: Aquatic vs. terrestrial ecotypes. PloS One, 2014, 9(2): e89063. DOI:10.1371/journal.pone.0089063 |
| [21] |
Chimento C, Amaducci S. Characterization of fine root system and potential contribution to soil organic carbon of six perennial bioenergy crops. Biomass and Bioenergy, 2015, 83: 116-122. DOI:10.1016/j.biombioe.2015.09.008 |
| [22] |
Cheng Cy HYH. A study and analysis on the physical shading effect of water quality control in constructed wetlands. Journal of Civil & Environmental Engineering, 2014, 9: 214-224. |
| [23] |
Li Changming, Ye Xiaoqi, Wu Ming et al. The influence of reeds and cattails growth characteristics with water depth and coexistence. Wetland Science, 2015, 13(5): 609-615. [李长明, 叶小齐, 吴明等. 水深及共存对芦苇和香蒲生长特征的影响. 湿地科学, 2015, 13(5): 609-615.] |
| [24] |
Debing J, Baoqing S, Hong Z et al. Chemical oxygen demand, nitrogen and phosphorus removal by subsurface wetlands with Phragmites vegetation in different models. Engineering in Life Sciences, 2010, 10(2): 177-183. |
| [25] |
Xiang Xuemin, Song Chunxia, Li Yansheng et al. Microorganism features of Typha Latifolia and Phragmites australis at Rhizosphere. Environmental Protection Science, 2004(4): 35-38. [项学敏, 宋春霞, 李彦生等. 湿地植物芦苇和香蒲根际微生物特性研究. 环境保护科学, 2004(4): 35-38.] |
| [26] |
Jia Qingyu, Zhou Guangsheng, Zhou Li et al. Dynamics of nitrogen content of Phragmites australis in Panjin wetland. Chinese Journal of Plant Ecology, 2008(4): 858-864. [贾庆宇, 周广胜, 周莉等. 湿地芦苇植株氮素分布动态特征分析. 植物生态学报, 2008(4): 858-864.] |
| [27] |
Bai Junhong, Wang Qinggai, Gao Haifeng et al. Dynamics change and cycle feature of nitrogen content of Phragmites australis in marsh wetland of facing sea. Wetland Science, 2010(2): 164-168. [白军红, 王庆改, 高海峰等. 向海沼泽湿地芦苇中氮含量动态变化和循环特征. 湿地科学, 2010(2): 164-168.] |
| [28] |
Guo Changcheng, Hu Hongying, Li Fengmin et al. Seasonal variation of nitrogen and phosphorus contents in the body of wetland plant Phrgmites communis and suitable harvest time. Ecology and Environmental Sciences, 2009(3): 1020-1025. [郭长城, 胡洪营, 李锋民等. 湿地植物香蒲体内氮、磷含量的季节变化及适宜收割期. 生态环境学报, 2009(3): 1020-1025.] |
| [29] |
Hendrickson QQ, Chatappaul L. Nutrient cycling following while-tree and conventional harvest in northern mixed forest. Canadian Journal of Forestry, 1988, 19: 133-140. |
| [30] |
Mcgroddy ME, Daufresne T, Hedin LO. Scaling of C:N:P stoichiometry in forests worldwide: Implications of terrestrial redfield-type ratios. Ecology, 2004, 85(9): 2390-2401. DOI:10.1890/03-0351 |
| [31] |
Koerselman W, Meuleman AF. The vegetation N:P ratio: A new tool to detect the nature of nutrient limitation. Journal of applied Ecology, 1996, 1441-1450. |
| [32] |
Dębska A, Jóźwiakowski K, Gizińska-Górna M et al. The efficiency of pollution removal from domestic wastewater in constructed wetland systems with vertical flow with common reed and Glyceria maxima. Journal of Ecological Engineering, 2015, 16: 110-118. |
| [33] |
Hernández-Crespo C, Oliver N, Bixquert J et al. Comparison of three plants in a surface flow constructed wetland treating eutrophic water in a Mediterranean climate. Hydrobiologia, 2016, 774(1): 183-192. DOI:10.1007/s10750-015-2493-9 |
 2017, Vol. 29
2017, Vol. 29 

