(2: 河海大学水文水资源学院 南京 210098)
(3: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室 南京 210008)
(2: College of Hydrology and Water Resources, Hohai University, Nanjing 210098, P.R.China)
(3: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
南京玄武湖是典型的富营养化城市湖泊,早在1980s后期已经处于严重富营养化状态.近年来通过底泥疏浚、截污等方式水质有了明显的改善.已经有不少工作研究了玄武湖重金属污染[1]以及浮游植物[2]、浮游动物的变化[3]等,但是对于玄武湖浮游细菌的研究还比较少.
浮游细菌是一种有着极高遗传多样性的生物,也是湖泊淡水生态系统的重要组成部分,其在生物化学地球循环过程中扮演着重要的角色[4-5].在城市地区,由于人类生产生活排放的大量污染物进入湖泊,改变了湖泊原有的营养负荷,使得耐污染的细菌大量繁殖.对于像玄武湖这样的处于退化状态的水生态系统,大型水生生物极少,生物多样性极低,以这些生物作为生态系统的表征指标,无法为生态系统健康的评价提供足够的信息[6].浮游细菌个体结构简单,对环境变化敏感,通过对外部环境变化的灵敏响应,其多样性和群落组成能真实反映水环境质量的状况[7],也可作为水生生态系统健康状况评估的指标[8-9].
Zeng等[10]已经对玄武湖浮游细菌的空间分布差异做了研究,但是目前尚未发现对玄武湖浮游细菌群落时间变化的研究.刘兰英等[11]通过研究福州左海的浮游细菌群落,发现季节变化是决定浮游细菌群落结构的重要因素.季节变化会导致湖泊水体温度、pH等环境因子的变化,同时改变浮游植物光合作用,导致水体中有机物含量发生变化[12].在城市水体人类活动输入的营养物质也可能对水体浮游细菌产生重要的影响[13].但是,不同环境因子对玄武湖浮游细菌群落变化影响的贡献大小目前尚不清楚.因此,有必要研究玄武湖浮游细菌群落结构的季节变化,并揭示导致这种变化的主要环境因子.
1997年,Liu等[14]首先应用末端限制性片段长度多态性(T-RFLP)技术研究微生物的多样性,与其他指纹图谱技术相比,T-RFLP具有以下优点:(1)能够迅速产生大量重复、精确的数据[15];(2)数据的输出形式允许对大量信息的快速分析;(3)根据末端限制性片段(T-RFs)的长度与现有数据库进行对比,有可能直接鉴定群落图谱中的单个菌种[16].近年来T-RFLP技术已被广泛应用于土壤[17-18]、湖泊沉积物[19]、淡水水体[20]等生境中微生物群落的研究.
本文应用T-RFLP技术,对玄武湖不同季节水体中浮游细菌群落组成进行研究,探讨浮游细菌群落组成的季节变化,进而探究浮游细菌群落演替机制.同时,通过多种多元统计方法研究浮游细菌群落组成与环境因子的关系,找出影响玄武湖浮游细菌群落组成变化的关键环境因子,相关结果可为玄武湖富营养化水体的生态修复提供参考.
1 材料与方法 1.1 样品采集与准备2011年1月至2012年1月,分4个季节在南京市玄武湖采集水体样品.在玄武湖的北湖、东南湖和西南湖3个湖区各设置2~3个采样点(图 1).最终,春、夏、秋、冬4个季节的实际样品数分别为6、8、9、9个.每次采样用采水器采集水面以下0.5 m处的水样1000 ml,分装在经过灭菌处理的蓝色玻璃瓶中,并现场测定水温(T)及pH.采集的水样立即密封避光保存在保温箱中,并尽快运回实验室分析.
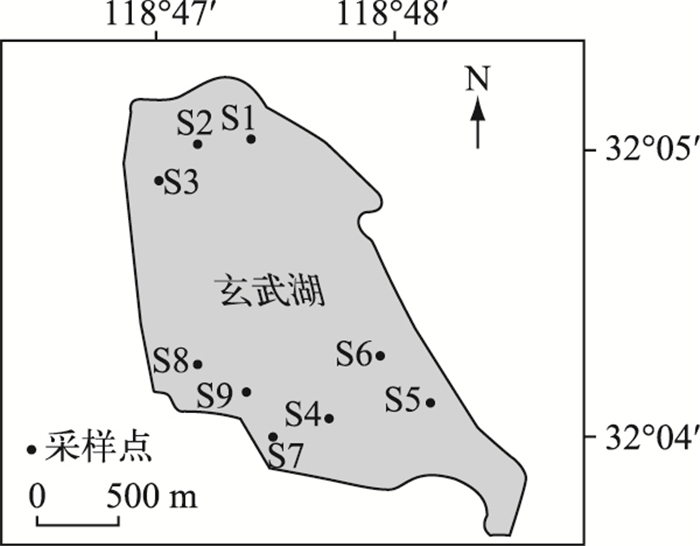
|
图 1 玄武湖采样点分布 Fig.1 Distribution of sampling sites in Xuanwu Lake |
水体pH、温度分别应用便携式pH计(PHB-4,上海雷磁)和玻璃温度计在现场测定.未过滤水样经碱性过硫酸钾消解之后,测定总磷(TP)、总氮(TN)浓度.其余水样经0.22 μm滤膜过滤,滤液通过流动注射仪(San++, SKALAR, Netherlands)测定铵态氮(NH4+-N)、硝态氮(NO3--N)和亚硝态氮(NO2--N)浓度.
1.3 T-RFLP分析取上述水样通过0.22 μm滤膜过滤,采用Zeng等[10]DNA提取方法进行DNA提取. PCR扩增反应采用细菌通用引物对27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和926R(5′-CCGTCAATTCCTTTGAGTTT-3′).前者5′端采用Cy5-N-羟基琥珀酰亚胺酯荧光标记,PCR反应体系和循环条件参照Zeng等[21]的方法进行.扩增体系为50 μl,包含5×PCR buffer 10 μl、0.25 mmol/L dNTP、2.5 mmol/L镁离子、0.2 mmol/L上下游引物、10 ng DNA模板和2 U的Taq酶,再加蒸馏水至50 μl.扩增程序为3 min 95℃的预变性,1 min 94℃变性,1 min 55℃退火,1 min 72℃延伸,循环30次,最后进行7 min 72℃的延伸,4℃保存. PCR扩增产物采用2 %琼脂糖凝胶电泳检测.
用绿豆酶30℃消化PCR产物30 min.用PCR产物纯化试剂盒(爱思进生物技术(杭州)有限公司)纯化消化后的产物.然后,用限制性核酸内切酶Hha Ⅰ(Takara, Otsu, Japan)37℃消化3 h,之后使用CEQ8000 (BeckmanCoulter, Fullerton, CA, USA)核酸片段分析仪对酶切产物进行T-RFLP分析.分析中只考虑长度介于60~600 bp(bp表示该片段所具有的碱基数,下同)以及相对丰度超过1 %的片段的末端限制性片段,即T-RFs.按照T-RFs占各个样品的丰度百分比标准化,再分别计算每个样品细菌群落的Invsimpson指数、Shannon-Wiener指数(H′)和Pielou指数(J),用它们反映水体中浮游细菌的多样性和均匀度.计算公式如下:
| $ Invsimpson = 1/\sum\limits_{i = 1}^n {{{\left( {{P_i}} \right)}^2}} $ | (1) |
| $ H\prime = - \sum\limits_{i = 1}^n {{P_i}} \cdot\;{\rm{ln}}\;{{P_i}} $ | (2) |
| $ J = H\prime /{\rm{ln}}\;S $ | (3) |
式中,Pi为峰面积占总面积的比例,即T-RFs的相对丰度;S为T-RF数.
对每个季节的多样性指数两两做t检验,若P < 0.05则认为这两个季节的多样性指数有显著差异,在图中用不同的小写字母区分.
1.4 多元统计分析非度量多维尺度分析(nonmetric multidimensional scaling, NMDS)用于判定不同样品间细菌群落结构的差异性;典范对应分析(canonical correlation analysis, CCA)用于研究环境因子对浮游细菌群落结构的影响;Mantel及偏Mantel检验用于探究环境差异与群落结构差异的相关性;基于冗余分析(redundancy analysis, RDA)的变量分割分析(variation partitioning analysis, VPA)用于研究不同环境因子对群落差异的贡献大小.所有的统计分析方法都应用R语言软件(The R Programming Language, version 3.2.3)中的Vegan程序包完成.
2 结果 2.1 玄武湖水质参数玄武湖氮、磷浓度在4个季节都已经达到了“中-富”级富营养化水平(Thomas标准[22]中-富级:无机氮介于0.5~1.5 mg/L; TP介于0.03~0.10 mg/L),大部分都达到了“富”级水平(Thomas标准富级:无机氮>1.5 mg/L; TP>0.1 mg/L).在秋、冬季TN浓度有着明显的提高,平均浓度分别达到2.321和3.038 mg/L(表 1).
| 表 1 玄武湖水体物理化学指标 Tab.1 Physico-chemical parameters of Xuanwu Lake |
根据T-RFLP图谱中T-RF数和丰度,分别计算各样品细菌的多样性指数. Invsimpson指数表明夏季玄武湖细菌群落的多样性要显著高于春季和冬季,Shannon-Wiener指数也表明夏季的细菌群落多样性相对要比其他季节高.此外,从Pielou指数看出夏季细菌群落中物种分布较为均匀. Invsimpson和Shannon-Wiener指数都表明玄武湖在春季细菌群落的多样性最低,并显著低于其他季节(P < 0.05)(图 2).
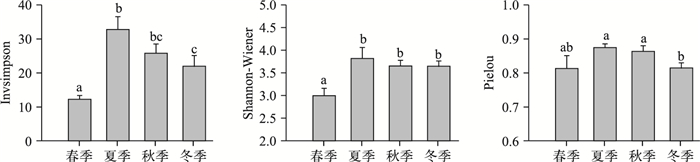
|
图 2 玄武湖4个季节浮游细菌群落Alpha多样性指数变化 Fig.2 Variations of the Alpha diversities of the bacterioplankton community in Xuanwu Lake in four seasons |
为了探究不同季节玄武湖浮游细菌群落结构的可能差异,计算了样品间T-RFs的差异性(Bray-Curtis距离),采用NMDS分析方法,绘制出样品的二维分布图(图 3).可以看出,玄武湖不同季节的样品彼此重叠很小,这表明不同季节之间有比较显著的差异.其中,春季和冬季的样品点距离相对比较相近,秋季和夏季的点比较相近,这表明春季、冬季样品中细菌群落组成比较相似,夏季和秋季样品中细菌群落组成相对比较相似.从图中箭头可以看出,箭头的指向不是一条直线,从春季变化到夏季后有“折返”的现象,通过秋季又到达和春季相近的冬季,从中可看出玄武湖中浮游细菌群落组成的季节性演替.
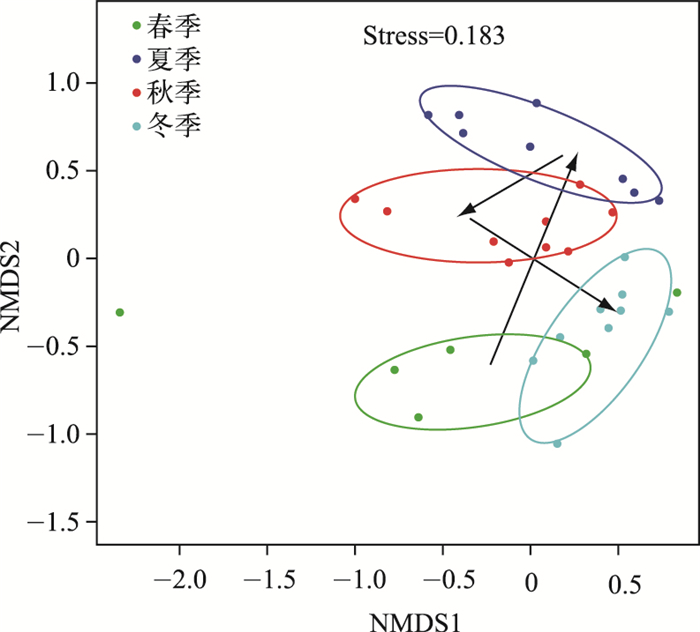
|
图 3 玄武湖浮游细菌群落结构的NMDS分析 Fig.3 Two-dimensional NMDS map of composition of bacterioplankton community structure in Xuanwu Lake |
由于本次研究数据趋势对应分析(detrended correspondence analysis, DCA)排序前4轴最大值为3.02,介于3~4,因此单峰模型和线性模型都适用[23].应用CCA分析探究环境变量对浮游细菌群落的影响.通过vif.cca函数计算每个环境变量的膨胀因子(variance inflation factors, VIF)值[24](分别为1.56、1.27、1.50、6.51、5.60、2.73、2.40),均小于20,因此所有环境因子均保留. CCA分析结果表明,轴1和轴2分别解释了11.3 %和7.9 %的样本变异(图 4).为了检验每个环境因子对细菌群落结构影响的显著性,使用vegan程序包中的envfit函数进行分析.结果(表 2)表明,温度、pH与排序轴有着非常显著的相关性(P < 0.001),NH4+-N和TP浓度与排序轴呈显著相关(P < 0.05),这说明温度是玄武湖年内浮游细菌群落结构的最主要影响因素,其次为pH.
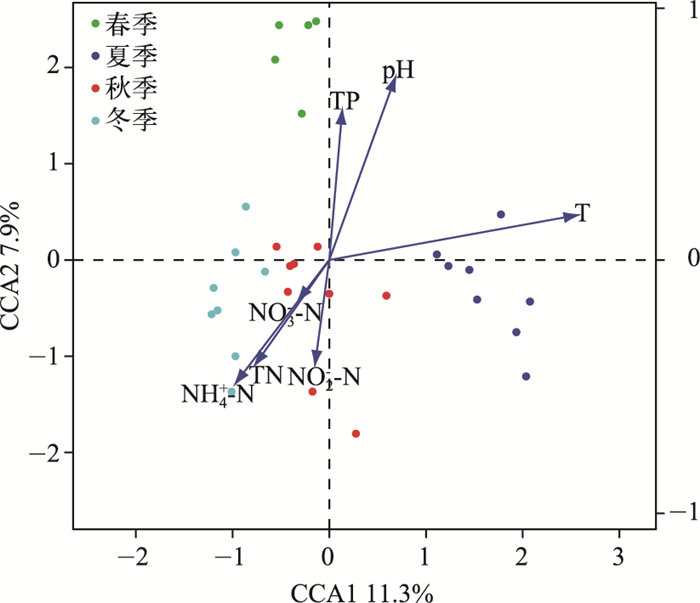
|
图 4 玄武湖样品浮游细菌群落与环境因子的CCA分析 Fig.4 CCA ordination biplot between sampling sites of Xuanwu Lake and environment factors |
| 表 2 环境因子与CCA排序轴的相关性分析 Tab.2 Correlation analysis between CCA ordination axises and environmental factors |
Mantel及偏Mantel检验被用来分析样品间浮游细菌群落结构差异与环境变量差异的相关性.样品间浮游细菌群落结构的差异通过计算样品间T-RFs组成的Bray-Curtis距离所确定,样品间环境变量的差异通过计算环境因子的欧氏距离所确定.偏Mantel检验就是在控制其他变量的情况下,分别分析温度、pH或营养物质(包括TP、TN、NH4+-N、NO3--N、NO2--N)与浮游细菌群落结构的关系.从表 3可以看出,温度以及pH的差异对于浮游细菌群落结构差异是显著相关的.然而,营养物质浓度的差异对浮游细菌群落结构差异无显著相关性.
| 表 3 玄武湖样品微生物群落组成1)和环境变量的Mantel和偏Mantel检验 Tab.3 Mantel and partial Mantel tests for the correlations between the bacterioplankton community composition in sampling sites of Xuanwu Lake and environmental variables |
为了定量分析不同类型的环境因子对于微生物群落结构变异的影响作用大小,对数据进行了VPA分析.结果(图 5)表明,pH、温度以及营养物质浓度分别单独解释了微生物群落变异的5.27 % (P < 0.05)、16.37 % (P < 0.001)和9.57 % (P=0.621).所有环境变量的解释量为33.79 %.

|
图 5 环境变量与玄武湖样品细菌群落的VPA分析 Fig.5 VPA analysis of bacterial communities in sampling sites of Xuanwu Lake and environmental variables |
本文通过T-RFLP技术研究了南京玄武湖浮游细菌群落的季节性变化. Alpha多样性指数分析表明,不同季节玄武湖浮游细菌群落的多样性是不同的.夏季玄武湖的浮游细菌多样性最高,而春季最低.邢鹏等[25]、Wu等[26]对太湖浮游细菌的研究也得出了类似的结论,这可能是富营养化湖泊共有的特征.研究表明,浮游细菌与浮游藻类的群落结构有着密切的相关性[27-28].浮游藻类生物量也在夏、秋季达到一年的最大值,浮游藻类分泌到胞外以及细胞破裂产生的有机物是细菌分解作用的物质基础,可能成为细菌营养物质的主要来源[29].因此,对于浮游细菌群落变化的研究可以在一定程度上反映浮游藻类群落变化.
多样性指数的季节变化说明玄武湖中细菌群落结构随着季节变化. NMDS结果表明,浮游细菌群落结构从春季开始随着时间的推移到达和春季相差最大的夏季,最终又回到和春季相近的冬季的结构.这说明随着环境因子变化到接近于最初始的状态,细菌群落也能回到近似于初始状态时的结构. Deng等[30]在研究铀污染修复时发现随着环境的变化微生物的结构发生显著变化,当一段时间后,微生物群落结构能够恢复到近似于变化前的状态.这与我们的研究结果相一致.
进一步采用CCA分析探究导致玄武湖细菌群落产生这种季节性变化的原因. CCA分析结果表明,温度、pH对群落结构有着极其重要的影响,氮、磷等营养物质对细菌群落结构有一定影响,但影响作用不如前两者.已有的研究表明,微生物群落结构和多样性与空间[31]、时间[32-33]、环境变量(如温度、pH和营养盐浓度)等因素有关[34].因此,根据环境因子的类型把环境变量划分成温度、pH和营养物质(氮、磷等)3个组,以探究何种类型的环境因子对玄武湖浮游细菌群落结构的影响最大. Mantel和偏Mantel检验结果表明,温度和pH对群落结构有着极其显著的影响(P < 0.001).但是,营养盐对群落结构差异的影响并不显著.有研究表明,在营养水平较低的湖泊中,营养盐浓度可能是细菌生长的限制因子[35].但是冯胜等[12]在研究富营养化湖泊——太湖中发现营养物质并不是浮游细菌生长的主要限制因子,本研究与其结论一致.相反,温度、pH能够显著影响浮游细菌群落结构.温度直接影响着细菌的新陈代谢能力,是细菌生长和存活最重要的影响因素之一,随着温度的升高,细胞中生物化学反应的速率和生长速率都会加快,但温度升高超过一定界限也会使机体的结构和功能受到影响[36].细菌生长同样需要一个合适的酸碱环境,不同类群的细菌有其最适宜的pH范围. Langenheder等的研究发现:在酸性的湖泊中细菌生长被抑制[37],表明不同pH对细菌群落结构有一定的选择性.在本研究中,各采样站点属于弱碱性环境,适合大部分细菌生长,同时也存在一定的梯度,因而会对浮游细菌群落结构有一定的选择性.
VPA分析表明,温度对于变异的解释量最高.营养盐虽然解释量达到了9.57 %,但是营养盐中包含了多个变量,这是多个变量共同作用的结果,且影响并不显著(P=0.621).此外,温度和pH共同解释的量仅为0.26 %,这说明温度和pH对浮游细菌群落的影响是两个不同的方向,彼此之间干扰较小,这与图 4中pH和温度箭头方向接近正交的结果是一致的.所有环境变量的解释量为33.79 %,说明还有其他一些没有检测的环境因子对浮游细菌群落结构起着重要作用.
与其他分子生物学技术相比,T-RFLP技术具有较高的分辨率,而且毛细管电泳装置一次可以检测多个样品,对于大范围长时间尺度的微生物群落结构分析研究具有较好的实用性.但是,由于基因组DNA提取、PCR扩增等实验过程中产生的偏倚性[38-39],T-RFLP可能无法完全准确地反映环境样品中细菌群落的结构和多样性.同时,也有研究表明,对不同物种的序列进行限制性酶切有可能得到相同的T-RFs,因此在T-RFLP的图谱上,一个峰代表的有可能不只是一个物种,所以为了了解每个T-RFs所代表的物种,还需要结合克隆文库[40-41]等方法进一步分析.
| [1] |
Zhao Dayong, Ma Ting, Zeng Jin et al. Study on eutrophication and heavy metal pollution of Xuanwu Lake. Journal of Hohai University (Natural Sciences), 2012, 40(1): 83-87. [赵大勇, 马婷, 曾巾等. 南京玄武湖富营养化及重金属污染现状. 河海大学学报:自然科学版, 2012, 40(1): 83-87.] |
| [2] |
Mei Zhuohua, Zhang Zhehai, Zhao Chunxia et al. Dynamics of phytoplankton and water quality with control of Cyanobacteria bloom in Lake Xuanwu, Nanjing. J Lake Sci, 2010, 22(1): 44-48. [梅卓华, 张哲海, 赵春霞等. 南京玄武湖蓝藻水华治理后水质和浮游植物的动态变化. 湖泊科学, 2010, 22(1): 44-48. DOI:10.18307/2010.0106] |
| [3] |
Sun Ying, Shu Tingting, Li Jing et al. Horizontal distribution characteristics of crustacean planktons and its relationship with environmental factors in Lake Xuanwu, Nanjing City. J Lake Sci, 2012, 24(3): 422-428. [孙颖, 舒婷婷, 李静等. 南京玄武湖浮游甲壳动物的水平分布及其与环境的关系. 湖泊科学, 2012, 24(3): 422-428. DOI:10.18307/2012.0314] |
| [4] |
Newton RJ, Jones SE, Eiler A et al. A guide to the natural history of freshwater lake bacteria. Microbiol Mol Biol R, 2011, 75(1): 14-49. DOI:10.1128/MMBR.00028-10 |
| [5] |
De Figueiredo DR, Pereira MJ, Correia A. Seasonal modulation of bacterioplankton community at a temperate eutrophic shallow lake. World J Microb Biot, 2010, 26(6): 1067-1077. DOI:10.1007/s11274-009-0272-3 |
| [6] |
Huang Yi, Shu Zhongya. Bacterioplankton Index of Biotic Integrity (BP-IBI): An approach for assessing river ecosystem health in Dianchi watershed. Environmental Science, 2013, 34(8): 3010-3018. [黄艺, 舒中亚. 基于浮游细菌生物完整性指数的河流生态系统健康评价——以滇池流域为例. 环境科学, 2013, 34(8): 3010-3018.] |
| [7] |
Liu Lemian, Yang Jun, Yu Xiaoqing et al. Bacterioplankton diversity in Xiamen Houxi River Watershed along an urban-rural gradient and its relation to environmental factors. Chin J Appl Environ Biol, 2012, 18(4): 591-598. [刘乐冕, 杨军, 余小青等. 厦门后溪流域沿城乡梯度浮游细菌多样性及其与环境因子的关系. 应用与环境生物学报, 2012, 18(4): 591-598. DOI:10.3724/SP.J.1145.2012.00591] |
| [8] |
Sims A, Zhang Y, Gajaraj S et al. Toward the development of microbial indicators for wetland assessment. Water Res, 2013, 47(5): 1711-1725. DOI:10.1016/j.watres.2013.01.023 |
| [9] |
Jiang JG, Shen YF. Development of the microbial communities in Lake Donghu in relation to water quality. Environ Monit Assess, 2007, 127(1): 227-236. DOI:10.1007/s10661-006-9275-9 |
| [10] |
Zeng J, Yang L, Du H et al. Bacterioplankton community structure in a eutrophic lake in relation to water chemistry. World J Microb Biot, 2009, 25(5): 763-772. DOI:10.1007/s11274-008-9946-5 |
| [11] |
Liu Lanying, Lü Xin, Li Wei et al. Diversity of bacterioplankton community during winter and spring in the Lake Zuohai in Fuzhou. Acta Microbiologica Sinica, 2014, 54(2): 200-210. [刘兰英, 吕新, 李巍等. 福州左海湖冬春季浮游细菌群落16S rRNA多样性. 微生物学报, 2014, 54(2): 200-210.] |
| [12] |
Feng Sheng, Gao Guang, Qin Boqiang et al. Variability of bacterioplankton in the north zone of Lake Taihu. J Lake Sci, 2006, 18(6): 636-642. [冯胜, 高光, 秦伯强等. 太湖北部湖区水体中浮游细菌的动态变化. 湖泊科学, 2006, 18(6): 636-642. DOI:10.18307/2006.0612] |
| [13] |
Ni Yanyan, Zhang Jianying, Liang Luyi et al. Correlation analysis of water quality and the diversity of planktonic bacterial community in the wetland. Journal of Zhejiang University(Science Edition), 2014, 41(6): 682-688. [倪燕燕, 张建英, 梁璐怡等. 湿地水质与水系浮游细菌多样性关联研究. 浙江大学学报:理学版, 2014, 41(6): 682-688.] |
| [14] |
Liu WT, Marsh TL, Cheng H et al. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA. Appl Environ Microbiol, 1997, 63(11): 4516-4522. |
| [15] |
Marsh TL. Terminal Restriction Fragment Length Polymorphism (T-RFLP): An emerging method for characterizing diversity among homologous populations of amplicons. Curr Opin Microbiol, 1999, 2(3): 323-327. DOI:10.1016/S1369-5274(99)80056-3 |
| [16] |
Kent AD, Smith DJ, Benson BJ et al. Web-based phylogenetic assignment tool for analysis of terminal restriction fragment length polymorphism profiles of microbial communities. Appl Environ Microbiol, 2003, 69(11): 6768-6776. DOI:10.1128/AEM.69.11.6768-6776.2003 |
| [17] |
Buchan A, Newell SY, Butler M et al. Dynamics of bacterial and fungal communities on decaying saltmarsh grass. Appl Environ Microbiol, 2003, 69(1): 6676-6687. DOI:10.1128/AEM.69.11.6676-6687.2003 |
| [18] |
Tom-Petersen A, Leser TD, Marsh TL et al. Effects of copper amendment on the bacterial community in agricultural soil analyzed by the T-RFLP technique. FEMS Microb Ecol, 2003, 46(1): 53-62. DOI:10.1016/S0168-6496(03)00192-2 |
| [19] |
Zhao Dayong, Sun Yimeng, Fang Chao et al. Vertical distribution of bacterial community composition in sediments of Meiliang Bay in Taihu Lake. Journal of Hohai University (Natural Sciences), 2013, 41(4): 284-285. [赵大勇, 孙一萌, 方超等. 太湖梅梁湾不同深度沉积物中细菌群落结构组成. 河海大学学报, 2013, 41(4): 284-285.] |
| [20] |
Chink J, Lueders T, Friedrich MW et al. Archaeal community structure and pathway of methane formation on rice roots. Microb Ecol, 2004, 47(1): 59-67. DOI:10.1007/s00248-003-2014-7 |
| [21] |
Zeng J, Yang LY, Liang Y et al. Spatial distribution of bacterial communities in sediment of a eutrophic lake revealed by denaturing gradient gel electrophoresis and multivariate analysis. Can J Microbiol, 2008, 54(12): 1053-1063. DOI:10.1139/W08-098 |
| [22] |
Xie Weiping. Water quality inspection technology. Beijing: China Architecture & Building Press, 2011, 136. [谢炜平. 水质检验技术. 北京: 中国建筑工业出版社, 2011, 136.]
|
| [23] |
Lai Jiangshan, Mi Xiangcheng. Ordination analysis of ecological data using Vegan package in R. National symposium on the conservation and sustainable use of biodiversity, 2010. [赖江山, 米湘成. 基于Vegan软件包的生态学数据排序分析. 全国生物多样性保护与持续利用研讨会, 2010. ]
|
| [24] |
Groß J. Variance inflation factors. R News, 2003, 3(1): 13-15. |
| [25] |
Xing Peng, Kong Fanxiang, Gao Guang. Phylogenetic diversity and seasonal variation of bacterioplankton communities in Lake Taihu. J Lake Sci, 2007, 19(4): 373-381. [邢鹏, 孔繁翔, 高光. 太湖浮游细菌种群基因多样性及其季节变化规律. 湖泊科学, 2007, 19(4): 373-381. DOI:10.18307/2007.0404] |
| [26] |
Wu QL, Chen YW, Xu KD et al. Intra-habitat heterogeneity of microbial food web structure under the regime of eutrophication and sediment resuspension in the large subtrophical shallow lake Taihu, China. Hydrobiologia, 2007, 581: 241-254. DOI:10.1007/s10750-006-0500-x |
| [27] |
Lindström ES. Investigating influential factors on bacterioplankton community composition: Results from a field study of five mesotrophic lakes. Microbial Ecol, 2001, 42(4): 598-605. DOI:10.1007/s00248-001-0031-y |
| [28] |
Vieira RP, Gonzalez AM, Cardoso AM et al. Relationships between bacterial diversity and environmental variables in a tropical marine environment, Rio de Janeiro. Environ Microbiol, 2008, 10(1): 189-199. DOI:10.1111/j.1462-2920.2007.01443.x |
| [29] |
Jensen LM. Phytoplankton release of extracellular organic carbon, molecular weight composition, and bacterial assimilation. Mar Ecol Prog Ser, 1983, 11(1): 39-48. DOI:10.3354/meps011039 |
| [30] |
Deng Y, Zhang P, Qin Y et al. Network succession reveals the importance of competition in response to emulsified vegetable oil amendment for uranium bioremediation. Environ Microbiol, 2015. DOI: 10.1111/1462-2920.12981.
|
| [31] |
Fortunato CS, Herfort L, Zuber P et al. Spatial variability overwhelms seasonal patterns in bacterioplankton communities across a river to ocean gradient. ISME J, 2012, 6(3): 554-563. DOI:10.1038/ismej.2011.135 |
| [32] |
Crump BC, Kling GW, Bahr M et al. Bacterioplankton community shifts in an arctic lake correlate with seasonal changes in organic matter source. Appl Environ Microbiol, 2003, 69(4): 2253-2268. DOI:10.1128/AEM.69.4.2253-2268.2003 |
| [33] |
Kent AD, Yannarell AC, Rusak JA et al. Synchrony in aquatic microbial community dynamics. ISME J, 2007, 1(1): 38-47. DOI:10.1038/ismej.2007.6 |
| [34] |
Nelson CE. Phenology of high-elevation pelagic bacteria: The roles of meteorologic variability, catchment inputs and thermal stratification in structuring communities. ISME J, 2009, 3(1): 13-30. DOI:10.1038/ismej.2008.81 |
| [35] |
Chrzanowski TH, Sterner RW, Elser JJ. Nutrient enrichment and nutrient regeneration stimulate bacterioplankton growth. Microbial Ecol, 1995, 29(3): 221-230. DOI:10.1007/BF00164886 |
| [36] |
Yannarell AC, Triplett EW. Geographic and environmental sources of variation in lake bacterial community composition. Appl Environ Microbiol, 2005, 71(1): 227-239. DOI:10.1128/AEM.71.1.227-239.2005 |
| [37] |
Langenheder S, Lindström ES, Tranvik LJ. Weak coupling between community composition and functioning of aquatic bacteria. Limnol Oceanogr, 2005, 50(3): 957-967. DOI:10.4319/lo.2005.50.3.0957 |
| [38] |
Head IM, Saunders JR, Pickup RW. Microbial evolution, diversity, and ecology: A decade of ribosomal RNA analysis of uncultivated microorganisms. Microbial Ecol, 1998, 35(1): 1-21. DOI:10.1007/s002489900056 |
| [39] |
Rocker A, Burr M, Camper AK. Genotypic microbial community profiling: A critical technical review. Microbial Ecol, 2007, 54(2): 276-289. DOI:10.1007/s00248-006-9199-5 |
| [40] |
Gonzalez JM, Simo R, Massana R et al. Bacterial community structure associated with a dimethylsulfoniopropionate-producing North Atlantic algal bloom. Appl Environ Microbiol, 2000, 66(10): 4237-4246. DOI:10.1128/AEM.66.10.4237-4246.2000 |
| [41] |
Derakshani M, Lukow T, Liesack W. Novel bacterial lineages at the (sub) division level as detected by signature nucleotide-targeted recovery of 16S rRNA genes from bulk soil and rice roots of flooded rice microcosms. Appl Environ Microbiol, 2001, 67(2): 623-631. DOI:10.1128/AEM.67.2.623-631.2001 |
 2017, Vol. 29
2017, Vol. 29 


