(2: 中国科学院西北生态环境资源研究院, 冰冻圈科学国家重点实验室, 青藏高原冰冻圈观测研究站, 兰州 730000)
(2: Cryosphere Research Station on the Qinghai-Tibetan Plateau, State Key Laboratory of Cryosphere Sciences, Northwest Institute of Eco-Environment and Resources, Chinese Academy of Sciences, Lanzhou 730000, P.R.China)
氮素是水生生态系统的重要生源要素,其中溶解性无机氮(DIN)是浮游植物吸收利用氮的主要形式.一般认为铵态氮是浮游植物优先吸收利用的无机氮,有研究表明富营养化湖泊中蓝藻吸收利用的氮中8%~98%来源于铵态氮[1].路娜等[2]在巢湖研究发现,硝态氮是影响浮游植物分布的重要因素,并且有研究表明硝态氮能被硅藻优先吸收利用[3].这些研究结果表明,不同湖泊和浮游植物群落结构的不同导致藻类吸收利用的主要无机氮形式存在差异.近来大量研究结果表明[4-5],浮游植物在生长过程中会受到氮素限制作用.在日本富营养化湖泊Inba研究发现[5],夏季水体DIN浓度迅速降低,蓝藻生长受到氮限制.而溶解性有机氮(DON)是水生生态系统中总溶解性氮(TDN)的重要组分[6],在以色列Kinneret湖研究发现[6],夏季DON在TDN中所占比例达到89%. DON具有一定生物可利用性[7],可以被浮游植物直接或间接吸收利用. Dai等[8]通过室内培养实验研究发现,从滇池分离得到的无菌微囊藻株能吸收利用DON中氨基酸组分维持自身生长和毒素合成.综上所述,DON也是影响浮游植物生长的重要氮素形态,并且在水体出现氮限制情况下,能为浮游植物的生长提供重要氮源补充.
太湖位于苏、浙两省交界处,是中国的第三大淡水湖泊.近年来,太湖蓝藻水华频发,但目前关于浮游植物和氮素的时空分布及其相互关系的研究主要集中在DIN方面,而对DON的研究较少. Xu等[4]在太湖梅梁湾研究发现该湖区夏季水体出现氮限制,但考虑到太湖作为大型浅水湖泊,其营养盐和浮游植物分布存在较大的空间差异性,其他藻型湖区在蓝藻水华暴发期间是否也会出现氮限制?并且在这种氮限制环境下,DON能否被蓝藻吸收利用?因此,本研究以太湖西北湖区为研究对象,分析不同季节水质参数(水温、溶解氧和浮游细菌丰度)以及浮游植物群落组成,明确了无机和有机氮的时空分布特征,并运用典范对应分析(CCA)探讨浮游植物群落与各氮素形态之间的关系,为太湖富营养化防治和氮素循环研究提供重要参考依据.
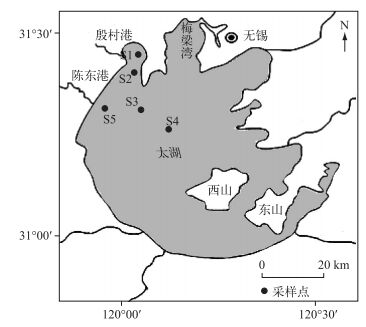
1 材料与方法 1.1 样品采集与分析方法太湖蓝藻水华主要发生在西北湖区[9],因此本文以西北湖区为研究对象,从河口至湖心设置5个采样点,S1和S5点位位于河口区,靠近入湖河流尹村港和陈东港. S4点位位于湖心区.用GPS定位系统对研究区域采样点精确定位(图 1),于2012年10月至2013年10月,每月采集表层水体样品.用YSI现场记录水温和溶解氧浓度的变化. 1 L水样加入10 ml鲁哥试剂固定,在实验室沉淀浓缩至30 ml,在倒置显微镜下进行鉴定和计数,浮游植物的鉴定方法参照《中国淡水藻类:系统、分类及生态》[10].根据浮游植物个体形状参数和细胞数计算藻细胞体积,再乘以密度得到生物量.浮游细菌样品用37%甲醛固定,DAPI(4′, 6-二脒基-2-苯基吲哚)染色,用表面荧光显微镜(Zeiss Axiovent 135 M, Germany)测定浮游细菌丰度.水样置于有冰袋的保温箱内在4 h内带回实验室做进一步处理.
|
图 1 研究区域采样点设置 Fig.1 Location of the sampling sites in studied area |
采用钼酸铵分光光度法测定总磷(TP)浓度,采用紫外分光光度法测定总氮(TN)和总溶解性氮(TDN)浓度,硝态氮(NO3--N)浓度采用酚二磺酸分光光度法测定,铵态氮(NH4+-N)浓度采用纳氏试剂分光光度法测定,亚硝态氮(NO2--N)浓度采用重氮偶氮法测定,正磷酸盐(PO43--P)浓度采用钼酸铵分光光度法测定[11].溶解性无机氮DIN=NH4+-N+NO3--N+NO2--N.溶解性有机氮DON=TDN-DIN.用TN:TP比和DIN:TP比表征水体的氮磷比.
1.2 数据分析非参数检验对总体分布不做假定,因此本文中数据采用Kruskal-Wallis非参数检验比较5个采样点环境因子参数及浮游植物细胞密度的差异性.显著性水平P=0.05.通过SPSS 16.0软件使用皮尔森(Pearson)相关系数法对浮游植物与环境因子进行相关分析.利用Canoco软件对环境因子与浮游植物数据进行典范对应分析.优势度大于0.02为优势属[12],入选物种数据矩阵.首先对物种数据进行去趋势对应分析(DCA),DCA分析结果中的第一轴长度大于3时使用CCA分析,否则使用基于线性的冗余分析(RDA).物种数据进行lg(x+1)转化.环境数据矩阵排除了环境因子之间的自相关.
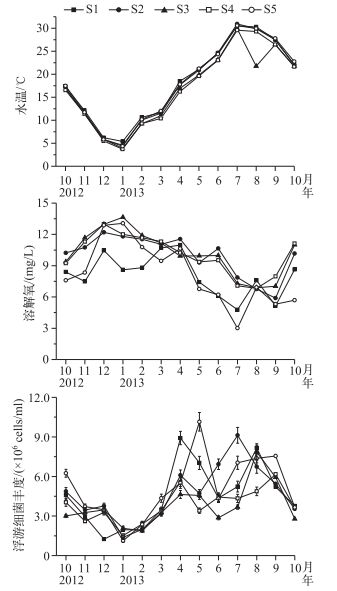
2 结果与分析 2.1 太湖西北湖区水温、溶解氧浓度和浮游细菌丰度的时空变化研究期间,太湖西北湖区5个采样点水温没有显著差异(P>0.05, n=65).水温变化范围为3.7~30.9℃,最低和最高温度分别出现在2013年1和7月. 5个采样点之间溶解氧浓度具有显著差异(P<0.05, n=65),且5个采样点溶解氧浓度都在夏季降至最低值.浮游细菌丰度没有显著差异(P>0.05, n=65),浮游细菌丰度冬季和早春(2013年1-3月)开始增加,春、夏季产生波动.除S5点位,其他4个采样点浮游细菌丰度都在夏季(2013年7-9月)达到最大值(图 2).
|
图 2 太湖西北湖区水温、溶解氧浓度和浮游细菌丰度的时空变化 Fig.2 Temporal and spatial variation of water temperature, dissolved oxygen concentration and planktonic bacterial abundance in northwest region of Lake Taihu |
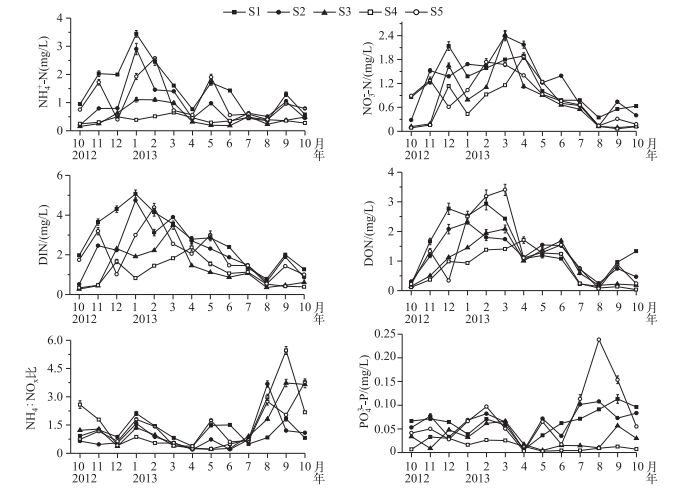
太湖西北湖区5个采样点NH4+-N浓度有显著差异(P<0.001, n=65),S1点位NH4+-N浓度最高,S4点位NH4+-N浓度最低. 5个采样点NH4+-N浓度都在冬季(2013年1-3月)达到最大值. NO3--N浓度没有显著差异(P>0.05, n=65). 5个采样点NO3--N浓度都在春、夏季(2013年4-8月)迅速降低. 5个采样点DIN浓度具有显著差异(P<0.001, n=65),其中S1点位DIN浓度最高,S4点位DIN浓度最低. S3和S4点位DIN浓度都在春、夏季(2013年4-8月)迅速降低. 5个采样点DON浓度先增加后逐渐降低,没有显著差异(P>0.05, n=65).
2012年12月、2013年3-7月,NO3--N浓度在DIN浓度中所占比例平均值大于50%,其中2013年4月,NO3--N浓度在DIN浓度中所占比例达到74%±6%. DON浓度在TDN浓度中所占比例平均值小于50%,其中夏季DON浓度在TDN浓度中所占比例最低(<30%). 5个采样点NH4:NOx比没有显著差异(P>0.05, n=65),夏季S1、S3和S4点位NH4:NOx比迅速升高. 5个采样点PO43--P浓度具有显著差异(P<0.001, n=65),S2点位PO43--P浓度最高,S5点位PO43--P浓度最低. PO43--P浓度季节波动较大,所有采样点都在春季降至最低值,S1和S4点位PO43--P浓度在夏季逐渐升高(图 3).
|
图 3 太湖西北湖区溶解性无机氮、溶解性有机氮和正磷酸盐浓度的时空变化 Fig.3 Temporal and spatial variation of dissolved inorganic nitrogen, dissolved organic nitrogen and phosphate concentrations in northwest region of Lake Taihu |
5个采样点TN:TP比(P>0.05, n=65)和DIN:TP比(P>0.05, n=65)均没有显著差异. TN:TP比变化范围为4~61,其中5个采样点TN:TP比在夏季基本上都小于20. DIN:TP比变幅范围为1~31,S3和S4点位在2013年4-8月期间,迅速降低(图 4).

|
图 4 太湖西北湖区TN:TP和DIN:TP比的时空变化 Fig.4 Temporal and spatial variation of ratio of TN:TP and DIN:TP in northwest region of Lake Taihu |
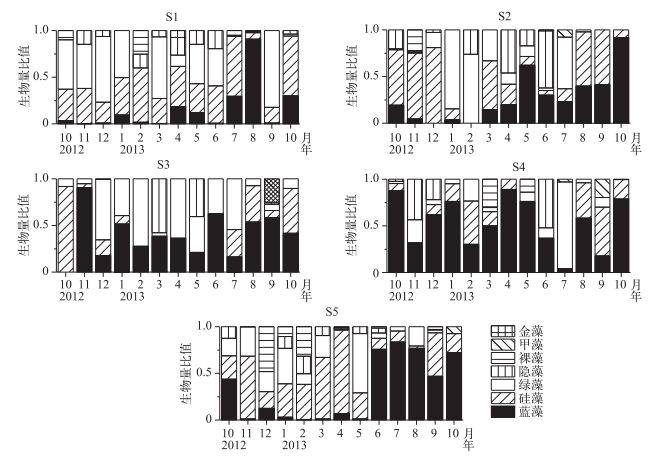
5个采样点蓝藻、硅藻、绿藻和隐藻生物量所占比值平均值分别为34%±15%、29%±9%、25%±13%和9%±0.1%. 2013年4月S1点位金藻生物量所占比值达到7%. 2012年12月,S5点位裸藻生物量所占比值达到48%. S3点位未发现裸藻,S1点位未发现甲藻(图 5).浮游植物优势属包括微囊藻、鱼腥藻、颤藻、脆杆藻、小环藻、直链硅藻、栅藻、小球藻、纤维藻、丝藻、四角藻、四星藻、十字藻和隐藻.
|
图 5 太湖西北湖区浮游植物群落组成的时空变化 Fig.5 Temporal and spatial variation of phytoplankton community in northwest region of Lake Taihu |
5个采样点的蓝藻(P>0.05, n=65)、绿藻(P>0.05, n=65)和隐藻细胞密度(P>0.05, n=65)均没有显著差异,但硅藻细胞密度存在显著差异(P<0.001, n=65). S1点位蓝藻细胞密度从2013年6月的1.5×105 cells/L增加到8月的1.0×108 cells/L,S2、S4和S5点位蓝藻细胞密度都在秋季(2012年10月和2013年9月)达到最大值. S2和S5硅藻细胞密度在2013年2-4月期间逐渐升高,达到3.4×106 cells/L.绿藻与硅藻细胞密度呈显著正相关(r=0.357, P<0.001, n=65),除S4点位,其他采样点都在秋季(2013年10-12月)达到最大值.隐藻主要出现在春季(2013年4-6月)和秋季,S2点位隐藻细胞密度在2013年6月达到最大值7.4×105 cells/L(图 6).
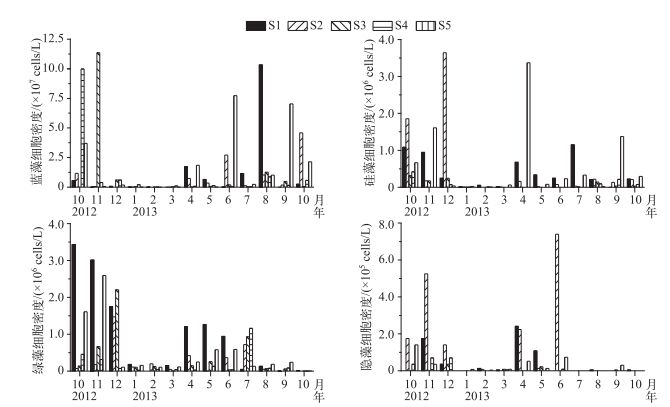
|
图 6 太湖西北湖区蓝藻、硅藻、绿藻和隐藻细胞密度的时空变化 Fig.6 Temporal and spatial variation of Cyanophyta, Bacillariophyta, Chlorophyta and Cryptophyta cell density in northwest region of Lake Taihu |
物种数据经DCA分析得到第一轴梯度为3.051,因此采用单峰模型的排序方法CCA.物种与环境相关性在4个轴上的累积变化率达到89.2%,第一轴占44.3%(表 1). NH4+-N、NO3--N和DON这3个环境因子与第一物种排序轴呈正相关,相关系数分别为0.5742、0.3610和0.4462. TN:TP比与第二物种排序轴呈正相关,相关系数为0.5961.蒙特卡洛检验值P=0.002<0.05.
| 表 1 浮游植物组成与环境因子CCA分析结果 Tab.1 Results from CCA of dominant genera in relation to environmental factors |
本文研究发现,太湖西北湖区浮游植物主要是由蓝藻、硅藻、绿藻和隐藻组成,这与太湖以往的研究结果一致[13].西北湖区蓝藻生物量在浮游植物中所占比例最高(34%),但低于太湖另一重度富营养化湖区——梅梁湾(38%)[13]. 5个采样点的蓝藻细胞密度没有显著差异,可能是由于风、浪等混合作用的结果[14].有研究表明[15],隐藻适宜低光照高有机质的水环境,而太湖水体特点是悬浮物浓度高,透明度低,因此隐藻和蓝藻的相互竞争演替趋势明显,本文也发现2013年3和6月,S2、S3和S4点位隐藻生物量所占比例高于50%.硅藻生物量所占比例(25%)高于以往在太湖北部的研究结果(20%)[16],且河口区S1和S5点位的硅藻细胞密度显著高于湖心区S4.邓建明等[17]对太湖流域入湖河流浮游植物群落结构的研究结果表明,直链硅藻和脆杆藻是河流浮游植物中的优势属,本文研究也表明直链硅藻和脆杆藻是西北湖区优势属.因此,陈东港和殷村港2条入湖河流中的硅藻可能受水流驱动而漂入河口.此外,硅藻细胞密度与绿藻细胞密度呈显著正相关(r=0.357, P<0.001, n=65),直链硅藻、小环藻和栅藻、四角藻都分布在第四象限(图 7),说明硅藻和绿藻2种藻类所需的生态环境条件基本一致,这与李娣等[18]在太湖的研究结果相一致.
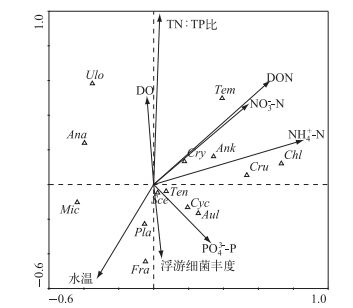
|
图 7 环境因素与浮游植物CCA排序图 Fig.7 CCA ordination diagram of the environmental factors and phytoplankton community (微囊藻Mic,鱼腥藻Ana,颤藻Pla,脆杆藻Fra,小环藻Cyc,直链硅藻Aul,栅藻Sce,小球藻Chl,纤维藻Ank,丝藻Ulo,四角藻Ten,四星藻Tem,十字藻Cru,隐藻Cry) |
NH4+-N是夏季西北湖区水体DIN的主要组分.大量研究表明,藻类吸收利用、沉积物释放以及河道输入和蓝藻本身死亡分解都是影响其动态变化的重要因素[19-20].本文研究发现,蓝藻细胞密度与NH4+-N浓度呈显著负相关,而与PO43--P没有显著相关性(表 2),表明夏季蓝藻大量生长吸收利用营养盐可能是引起NH4+-N浓度迅速降低的重要原因.此外,西北湖区水体DO在2013年7-9月期间降至最低值,其中S5点位DON浓度仅为3.0 mg/L.由于西湖区是太湖湖泛易发区域,并且有研究表明,太湖DO在夏季会出现短时间尺度上的分层现象[21],因此并不排除水体会出现间歇性厌氧.范成新等[20]在太湖研究发现,夏季气温较高,有利于沉积物分解,形成水体缺氧或厌氧环境,从而增加沉积物NH4+-N的释放.因此,夏季沉积物NH4+-N的释放可能是西北湖区水体中NH4+-N的重要来源.本文研究发现,夏季水体NH4+-N浓度最低降至0.23 mg/L,因此推测,春夏季蓝藻在生长过程中消耗的NH4+-N通过沉积物释放得以补充,这也解释了为什么蓝藻细胞密度与NH4+-N的相关系数较低.
| 表 2 蓝藻细胞密度与环境因子的Pearson相关分析 Tab.2 Pearson correlation coefficient of Cyanophyta abundance and environmental factors |
McCarthy等[22]在全太湖研究发现,NH4:NOx比的季节变化规律为冬春季逐渐降低,夏季基本稳定,秋季逐渐升高.这与本文的研究结果并不完全一致,西北湖区NH4:NOx比在夏季逐渐增加,表明太湖各湖区NH4:NOx比可能存在显著差异.此外,DIN的组分对浮游植物群落结构具有重要影响,在美国Okeechobee湖研究发现[22],随着NH4:NOx比升高,蓝藻在浮游植物生物量中所占比值增加,硅藻所占比值降低.本文也发现,西北湖区5个采样点NH4:NOx比在冬季逐渐降低,硅藻在浮游植物生物量中所占比值由23%±14%增加到32%±26%,由于硅藻对NO3--N的吸收利用[3],因此夏季S1、S3和S4点位NH4:NOx比升高,并且S3点位蓝藻在浮游植物生物量中所占比值由16%增加到59%.这与周涛[23]在太湖野外监测中的结果相一致,氮源中NH4+-N比例的升高有利于增强蓝藻的竞争优势.
本文研究发现,春季和早夏西北湖区水体DIN的主要组分是NO3--N,这与富营养化湖泊巢湖的研究结果一致[24].春季太湖流域农田生态系统开始大量使用氮肥,吴庆乐等[25]通过同位素示踪研究发现氮肥是太湖水体NO3--N的重要来源.此外春季属于丰水期[26],太湖流域水稻田中氮素流失的主要形态是NO3--N[27],因此NO3--N浓度在春季达到峰值.冯露露等[28]通过对太湖1年的野外监测数据进行相关分析研究发现,微囊藻丰度与NO3--N浓度呈显著负相关,而本文也研究发现,蓝藻细胞密度与NO3--N浓度呈显著负相关(表 2),这些研究结果表明,NO3--N可以被蓝藻吸收利用.
3.3 太湖西北湖区水体氮限制近来大量研究结果表明,在富营养化湖泊蓝藻水华暴发期间,水体容易出现氮限制[4, 29]. Xu等[4]在太湖北部研究发现,夏季水体出现氮限制时NH4+-N浓度降至0.05 mg/L,NO3--N浓度降至0.65 mg/L.本研究也发现夏季蓝藻细胞密度最高达到1.0×108 cells/L时,除S1点位,其他点位在2013年8月NO3--N浓度均低于0.15 mg/L.一般认为浮游植物利用NH4+-N消耗的能量少, NH4+-N是浮游植物优先利用的氮素形式,只有NH4+-N耗尽后才吸收NO3--N.因此,夏季较低的NO3--N浓度表明水体可能出现氮限制,而通过上文分析,沉积物中NH4+-N的释放可能是维持水体保持较高NH4+-N浓度的重要因素.
此外,TN:TP比也被广泛应用以表征湖泊中浮游植物生长过程出现的氮磷限制作用,但湖泊的富营养化级别对该阈值具有重要影响[30].有研究表明,重度富营养化湖泊TN:TP比低于9.5表明水体出现氮限制[30].此外,DIN:TP比低于4也可以指示水体出现氮限制[31].本研究发现由于春季春耕农田大量施加氮肥,水体氮磷比升高;夏季高温和间歇性缺氧反硝化作用引起氮素损失导致氮磷比降低. 2013年7月,太湖西北湖区S2点位TN:TP比为8.7,S1点位DIN:TP比为3.1;2013年8月,S5和S2点位TN:TP比分别为4.4和5.9;2013年9月,S3点位TN:TP比为7.9,S3和S5点位DIN:TP比为3.8.因此,氮磷比以及水体的实际氮磷浓度表明,太湖西北湖区夏季水体可能出现氮限制,这与以往在太湖藻型湖区—梅梁湾的研究结果相一致[4].
3.4 太湖西北湖区有机氮的时空变化西北湖区DON浓度与NO3--N和NH4+-N浓度均呈显著正相关,表明部分DON与DIN具有相同的来源机制.有研究表明,浮游植物[6]和沉积物[32]释放的DON是水体中DON的重要来源,在洱海沉积物中发现DON在TDN中所占比例达到40%[33].在Kinneret湖[6]、英格兰河口[34]研究发现浮游植物以及浮游细菌释放DON引起DON在TDN中的所占比例呈春季低、秋季高的季节变化规律,但本文研究结果与此相反,综上所述,沉积物中DON的释放可能是太湖西北湖区DON的主要来源.
有研究表明,DON中尿素、游离态氨基酸具有一定生物可利用性,尿素浓度的升高可以促进微囊藻的生长[35-36].韩晓霞等[37]在太湖研究发现,西北湖区尿素浓度最高可达0.078 mg/L;杨柳等[38]在梅梁湾研究发现浮游植物对尿素的吸收速率低于NH4+-N但高于NO3--N.本文研究发现西北湖区DON与蓝藻细胞密度呈显著负相关(表 2).因此,太湖西北湖区夏季水体出现氮限制时,DON可能是蓝藻氮素利用的重要补充.这与在日本海的研究结果相一致[39],蓝藻水华期间水体出现氮限制,表征蓝藻生物量的特征色素—玉米黄素与DON浓度呈显著负相关.此外,有研究表明DON能被生物和光降解生成NH4+-N[40-42],因此蓝藻对DON的利用也可能是通过间接吸收利用DON生物和光降解再生的DIN这一途径.但也有研究表明,浮游细菌可以吸收利用DON中的游离态氨基酸[43],本文研究发现,2013年6-8月期间,S1和S5点位DON浓度迅速降低,浮游细菌丰度逐渐升高.因此,浮游细菌对DON的分解利用可能也是影响DON变化的重要因素.
4 结论1) 太湖西北湖区表层水体浮游植物主要是由蓝藻、硅藻、绿藻和隐藻组成. 5个采样点的蓝藻细胞密度没有显著差异,可能是受到风、浪等混合作用的结果.硅藻与绿藻细胞密度呈显著正相关,直链硅藻、小环藻和栅藻、四角藻分布在同一象限,表明调查中出现的硅藻和绿藻所需的生态环境条件基本一致.春季和早夏,部分点位隐藻相对生物量高于50%,表明隐藻与蓝藻的相互竞争趋势显著.
2) CCA排序图结果表明,无机(NH4+-N、NO3--N)和有机氮(DON)浓度以及TN:TP比是影响太湖西北湖区浮游植物优势属分布的重要环境因子.春季施肥是太湖NO3--N的主要来源,蓝藻细胞密度与NO3--N浓度呈显著负相关,表明蓝藻对NO3--N的吸收利用是影响其变化的重要因素.沉积物NH4+-N的释放使得蓝藻细胞密度与NH4+-N的显著相关性水平和相关系数与NO3-相比较低.
3) 西北湖区TN:TP比和DIN:TP比从春季开始逐渐降低,在夏季降至最低值,湖区平均值分别为9±4和3±2.并且夏季NO3--N浓度降至0.15 mg/L,表明浮游植物,尤其是蓝藻的生长可能受到氮素限制作用.
4) 沉积物中DON的释放可能是DON的重要来源,其在TDN中所占比例呈夏季低、春季高的季节变化规律,并且与蓝藻细胞密度呈显著负相关,表明在氮限制条件下,可能是蓝藻氮素利用的重要补充.
| [1] |
Ferber LR, Levine SN, Lini A et al. Do cyanobacteria dominated in eutrophic lakes because they fix atmospheric nitrogen?. Freshwater Biology, 2004, 49(6): 690-708. DOI:10.1111/fwb.2004.49.issue-6 |
| [2] |
Lu Na, Yin Hongbin, Deng Jiancai et al. Spring community structure of phytoplankton from Lake Chaohu and its relationship to environmental factors. J Lake Sci, 2010, 22(6): 950-956. [路娜, 尹洪斌, 邓建才等. 巢湖流域春季浮游植物群落结构特征及其与环境因子的关系. 湖泊科学, 2010, 22(6): 950-956. DOI:10.18307/2010.0620] |
| [3] |
Heil CA, Revilla M, Glibert PM et al. Nutrient quality drives differential phytoplankton community composition on the southwest Florida Shelf. Limnology and Oceanography, 2007, 52(3): 1067-1078. DOI:10.4319/lo.2007.52.3.1067 |
| [4] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [5] |
Kagami M, Hirose Y, Ogura H. Phosphorus and nitrogen limitation of phytoplankton growth in eutrophic Lake Inba, Japan. Limnology, 2013, 14(1): 51-58. DOI:10.1007/s10201-012-0385-5 |
| [6] |
Berman T, Bronk DA. Dissolved organic nitrogen: A dynamic participant in aquatic ecosystems. Aquatic Microbial Ecology, 2003, 31: 279-305. DOI:10.3354/ame031279 |
| [7] |
Bronk DA, See JH, Bradley P et al. DON as a source of bioavailable nitrogen for phytoplankton. Biogeosciences, 2007, 4(3): 283-296. DOI:10.5194/bg-4-283-2007 |
| [8] |
Dai R, Liu H, Qu J et al. Effects of amino acids on microcystin production of the Microcystis aeruginosa. Journal of Hazardous Material, 2009, 161(2/3): 730-736. |
| [9] |
Liu Jutao, Yang Yongsheng, Gao Junfeng et al. Characteristics of cyanobacteria bloom grading and its temporal and spatial variation in Taihu Lake. Resources and Environment in the Yangtze Basin, 2011, 20(2): 156-160. [刘聚涛, 杨永生, 高俊峰等. 太湖蓝藻水华分级及其时空变化. 长江流域资源与环境, 2011, 20(2): 156-160.] |
| [10] |
Hu Hongjun, Wei Yinxin eds. The freshwater algae of China—Systematic, taxonomy and ecology. Beijing: Science Press, 2006, 100-150. [胡鸿钧, 魏印心. 中国淡水藻类:系统、分类及生态. 北京: 科学出版社, 2006, 100-150.]
|
| [11] |
Chen Weimin, Huang Xiangfei, Zhou Wanping eds. Observation methods in lake ecocystem. Beijing: China Environmental Sciences Press, 2005, 122-130. [陈伟民, 黄祥飞, 周万平. 湖泊生态系统观测方法. 北京: 中国环境科学出版社, 2005, 122-130.]
|
| [12] |
Sun Cuici, Wang Youshao, Sun Song et al. Analysis dynamics of phytoplankton community characteristics in Daya Bay. Acta Ecologica Sinica, 2006, 26(12): 3948-3958. [孙翠慈, 王友绍, 孙松等. 大亚湾浮游植物群落特征. 生态学报, 2006, 26(12): 3948-3958. DOI:10.3321/j.issn:1000-0933.2006.12.005] |
| [13] |
Chen YW, Qin BQ, Teubner K et al. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu, a large shallow lake in China. Journal of Plankton Research, 2003, 25(1): 445-453. |
| [14] |
Wu Tingfeng, Zhu Gangwei, Qin Boqiang et al. Prior wind field induced hydrodynamics and its influence on cyanobacterial bloom in northern bays of Lake Taihu, China. J Lake Sci, 2012, 24(3): 409-415. [吴挺峰, 朱广伟, 秦伯强等. 前期风场控制的太湖北部湖湾水动力及其对蓝藻水华影响. 湖泊科学, 2012, 24(3): 409-415. DOI:10.18307/2012.0312] |
| [15] |
Liu Xia, Lu Xiaohua, Chen Yuwei. Temporal and spatial dynamics of Cryptophytes biomass in the north of Lake Taihu. J Lake Sci, 2012, 24(1): 142-148. [刘霞, 陆晓华, 陈宇炜. 太湖北部隐藻生物量时空动态. 湖泊科学, 2012, 24(1): 142-148. DOI:10.18307/2012.0120] |
| [16] |
Liu Xia, Lu Xiaohua, Chen Yuwei. Long-term evolution of planktonic diatoms and their relationships with environmental factors in Lake Taihu. Acta Scientiae Circumstantiae, 2012, 32(4): 821-827. [刘霞, 陆晓华, 陈宇炜. 太湖浮游硅藻时空演化与环境因子的关系. 环境科学学报, 2012, 32(4): 821-827.] |
| [17] |
Deng Jianming, Xu Caiping, Chen Yuwei et al. Comparison of the phytoplankton community in major rivers of the Taihu Basin. Resources Science, 2011, 32(2): 210-216. [邓建明, 徐彩平, 陈宇炜等. 太湖流域主要河道浮游植物类群对比研究. 资源科学, 2011, 32(2): 210-216.] |
| [18] |
Li Di, Li Xuwen, Niu Zhichun et al. Structure of phytoplankton community and relationship between phytoplankton community and water quality in Taihu Lake. Ecology and Environmental Sciences, 2014, 23(11): 1814-1820. [李娣, 李旭文, 牛志春等. 太湖浮游植物群落结构及其与水质指标间的关系. 生态环境学报, 2014, 23(11): 1814-1820. DOI:10.3969/j.issn.1674-5906.2014.11.014] |
| [19] |
Wu Yali, Xu Hai, Yang Guijun et al. Progress in nitrogen pollution research in Lake Taihu. J Lake Sci, 2014, 26(1): 19-28. [吴雅丽, 许海, 杨桂军等. 太湖水体氮素污染状况研究进展. 湖泊科学, 2014, 26(1): 19-28. DOI:10.18307/2014.0103] |
| [20] |
Fan Chengxin, Zhang Lu, Qin Boqiang et al. Migration mechanism of biogenic elements and their quantification on sediment-water interface of Lake Taihu: Ⅰ. Spatial variation of the ammonium release rates and its source and sink fluxes. J Lake Sci, 2004, 16(1): 10-20. [范成新, 张路, 秦伯强等. 太湖沉积物-水界面生源要素迁移机制及定量化——1.铵态氮释放速率的空间差异及源-汇通量. 湖泊科学, 2004, 16(1): 10-20. DOI:10.18307/2004.0102] |
| [21] |
Zhao Linlin, Zhu Mengyuan, Feng Longqing et al. Stratification and its driving factors of water physicochemical variables in large shallow Lake Taihu. J Lake Sci, 2011, 23(4): 649-656. [赵林林, 朱梦圆, 冯龙庆等. 太湖水体理化指标在夏季短时间尺度上的分层及其控制因素. 湖泊科学, 2011, 23(4): 649-656. DOI:10.18307/2011.0423] |
| [22] |
McCarthy MJ, James RT, Chen Y et al. Nutrient ratios and phytoplankton community structure in the large, shallow, eutrophic, subtropical Lakes Okeechobee (Florida, USA) and Taihu (China). Limnology, 2009, 10(3): 215-227. DOI:10.1007/s10201-009-0277-5 |
| [23] |
Zhou Tao. The role of nitrogen in bloom formation and maintenance of Lake Taihu [Dissertation]. Nanjing: Nanjing University, 2013. [周涛. 氮在太湖水华形成与维持中的作用[学位论文]. 南京: 南京大学, 2013. ] http://cdmd.cnki.com.cn/Article/CDMD-10284-1013191894.htm ]
|
| [24] |
Zhang M, Xu J, Xie P. Nitrogen dynamics in large shallow eutrophic Lake Chaohu, China. Environmental Geology, 2008, 55(1): 1-8. DOI:10.1007/s00254-007-0957-6 |
| [25] |
Wu Qingle, Ruan Xiaohong, Wu Chaoming et al. Analyses of sources and transformation of nitrogen as a contaminant in the river and lake water in the western region of Taihu Lake basin. Acta Scientiae Circumstantiae, 2015, 35(12): 3883-3889. [吴庆乐, 阮晓红, 吴朝明等. 太湖西部河湖氮污染物来源及转化途径分析. 环境科学学报, 2015, 35(12): 3883-3889.] |
| [26] |
Qin B, Xu P, Wu Q et al. Environmental issues of Lake Taihu, China. Hydrobiologia, 2007, 581: 3-14. DOI:10.1007/s10750-006-0521-5 |
| [27] |
Zhang Gang. Study on N & P pollution flux from agricultural non-point sources of the main paddy soils in Tai-Lake region [Dissertation]. Nanjing: Nanjing Agricultural University, 2007. [张刚. 太湖地区主要类型稻田氮磷面源污染通量的研究[学位论文]. 南京: 南京农业大学, 2007. ] http://cdmd.cnki.com.cn/article/cdmd-10307-2008031377.htm ]
|
| [28] |
Feng Lulu, Li Zhengkui, Zhou Tao. Temporal and spatial distribution of phytoplankton and various forms of inorganic nitrogen in Lake Taihu. J Lake Sci, 2012, 24(5): 739-745. [冯露露, 李正魁, 周涛. 太湖浮游植物和各种形态无机氮的时空分布特征. 湖泊科学, 2012, 24(5): 739-745. DOI:10.18307/2012.0515] |
| [29] |
Chaffin JD, Bridgeman TB, Bade DL. Nitrogen constrains the growth of lake summer cyanobaceria blooms in Lake Erie. Advances in Microbiology, 2013, 3: 16-26. DOI:10.4236/aim.2013.36A003 |
| [30] |
Abell JM, Özkundakci D, Hamilton DP. Nitrogen and phosphorus limitation of phytoplankton growth in New Zealand lakes: Implications for eutrophication control. Ecosystems, 2010, 13(7): 966-977. DOI:10.1007/s10021-010-9367-9 |
| [31] |
Matthews R, Hilles M, Pelletier G. Determining trophic state in Lake Whatcom, Washington (USA), a soft water lake exhibiting seasonal nitrogen limitation. Hydrobiologia, 2002, 468(1/2/3): 107-121. |
| [32] |
Zehr JP, Paulsen SG, Axler RP et al. Dynamics of dissolved organic nitrogen in subalpine Castle Lake, California. Hydrobiologia, 1988, 157(1): 33-45. DOI:10.1007/BF00008808 |
| [33] |
Gao Yuewen, Wang Shengrui, Zhang Weihua et al. Seasonal variations of dissolved organic nitrogen in sediments of Lake Taihu. Research of Environmental Sciences, 2012, 25(6): 659-665. [高悦文, 王圣瑞, 张伟华等. 洱海沉积物中溶解性有机氮季节性变化. 环境科学研究, 2012, 25(6): 659-665.] |
| [34] |
Badr EA, Tappin AD, Achterberg EP. Distributions and seasonal variability of dissolved organic nitrogen in two estuaries in SW England. Marine Chemistry, 2008, 110: 153-164. DOI:10.1016/j.marchem.2008.04.007 |
| [35] |
Davis TW, Harke MJ, Marcoval MA et al. Effects of nitrogenous compounds and phosphorus on the growth of toxic and non-toxic strains of Microcystis during bloom events. Aquatic Microbial Ecology, 2010, 61: 149-162. DOI:10.3354/ame01445 |
| [36] |
Donald DB, Bogard MJ, Finlay K et al. Comparative effects of urea, ammonium, and nitrate on phytoplankton abundance, community composition, and toxicity in hypereutrophic freshwaters. Limnology and Oceanography, 2011, 56(6): 2161-2175. DOI:10.4319/lo.2011.56.6.2161 |
| [37] |
Han Xiaoxia, Zhu Guangwei, Xu Hai et al. Source analysis of urea-N in Lake Taihu during summer. Environmental Science, 2014, 35(7): 2547-2556. [韩晓霞, 朱广伟, 许海等. 太湖夏季水体中尿素的来源探析. 环境科学, 2014, 35(7): 2547-2556.] |
| [38] |
Yang Liu, Zhang Ming, Liu Zhengwen. Uptake of various forms of nitrogen by phytoplankton community in spring in Lake Taihu. J Lake Sci, 2011, 23(4): 605-611. [杨柳, 章铭, 刘正文. 太湖春季浮游植物群落对不同形态氮的吸收. 湖泊科学, 2011, 23(4): 605-611. DOI:10.18307/2011.0417] |
| [39] |
Kim TH, Kim G. Factors controlling the C:N:P stoichiometry of dissolved organic matter in the N-limited, cyanobacteria-dominated East/Japan Sea. Journal of Marine Systems, 2013, 115/116: 1-9. DOI:10.1016/j.jmarsys.2013.01.002 |
| [40] |
Tupas L, Koike I. Simultaneous uptake and regeneration of ammonium by mixed assemblages of heterotrophic marine bacteria. Marine Ecology Progress Series, 1991, 70: 273-282. DOI:10.3354/meps070273 |
| [41] |
Grzybowski W. The significance of dissolved organic matter photodegradation as a source of ammonium in natural waters. Oceanologia, 2002, 44(3): 355-365. |
| [42] |
Vähätalo AV, Zepp RG. Photochemical mineralization of dissolved organic nitrogen to ammonium in the Baltic Sea. Environmental Science & Technology, 2005, 39(18): 6985-6992. |
| [43] |
Bradley PB, Sanderson MP, Frischer ME et al. Inorganic and organic nitrogen uptake by phytoplankton and heterotrophic bacteria in the stratified Mid-Atlantic Bight. Estuarine, Coastal and Shelf Science, 2010, 88: 429-441. DOI:10.1016/j.ecss.2010.02.001 |
 2017, Vol. 29
2017, Vol. 29 
