(2: 中国科学院大学, 北京 100043)
(3: 暨南大学, 广州 510632)
(2: University of Chinese Academy of Sciences, Beijing 100043, P.R.China)
(3: Jinan University, Guangzhou 510632, P.R.China)
湖泊与流域之间能量与物质的交换是湖沼学研究的核心内容之一.已有的研究表明湖泊消费者所需的物质和能量不仅来源于湖泊中以浮游植物为主(也包括底栖藻类、大型水生植物等)的内源有机碳;还可能来源于湖泊外的输入,即外源有机碳[1].外源有机碳随地表径流等过程进入湖泊,并以溶解有机碳(DOC)和颗粒有机碳(POC)的形式成为湖泊外源碳库的主要组成部分.作为地球水圈有机碳的主要载体和生物体的主要底物,DOC占湖泊总有机碳量的80%~90%[2],在控制水生态系统的物理、化学、生物性质中起着重要的作用.
浮游甲壳动物主要包括桡足类和枝角类, 是影响湖泊生态系统结构与功能的关键类群.一直以来,人们普遍认为浮游动物的能量(有机碳)主要来自湖泊中的内源有机碳——浮游植物,但是高原深水湖泊的内源有机碳通常较少,而外源有机碳对湖泊碳库的补给作用较为明显[2].浮游动物既是细菌和浮游植物的牧食者, 又是鱼类的捕食对象.国内的研究主要集中在富营养化严重的浅水湖泊,而在沿岸带较少的高原深水湖泊,浮游动物作为湖泊生态系统中的主要初级消费者,在影响湖泊的水质、初级生产力以及食物网结构等方面扮演着重要角色.在贫营养的高原深水湖泊中,外源有机碳对浮游动物的贡献如何?利用途径如何?这些问题在近期才受到人们的关注[3-5],目前,在这方面的研究已经取得了一些进展,而这些进展的获得主要得益于稳定同位素技术在生态学和环境科学领域的应用[6].
稳定同位素标记法是将生物标记法与稳定同位素技术相结合的一种新的研究方法,目前已经被应用到微生物群落结构、食物网等多个领域的研究中.生物标记物是由某一种或者某一类生物合成的特征性有机化合物[7],在生态学领域常用的生物标志物主要是脂肪酸类.脂肪酸是细胞膜的重要组分,由于在食物链传递过程中该组分可以保持结构不变,且不同构型的脂肪酸可以指示不同类的生物,例如细菌、硅藻、甲藻、绿藻等,因此利用脂肪酸的特异性可以有效指示食物网结构特征.例如,Boschker等[8]利用磷脂脂肪酸(PLFA)的同位素值研究了Scheldt河口春季水华期间的浮游生物的群落结构,发现绿藻和硅藻的混合群落占据主导地位,中间盐度区主要是硅藻水华,河口下游自养区硅藻水华生物量低于上游河口非自养区.此外,葡萄糖作为生物体内新陈代谢不可或缺的营养物质,以葡萄糖为示踪剂为微生物对碳源的代谢机理研究提供了一个科学有效的途径[9]. Ziegler等[10]将13C标记的葡萄糖加入土壤进行短期培养,并应用GC-IRMS分析技术测定PLFAs的稳定同位素组成,研究土壤微生物对葡萄糖C的循环利用情况.石宁宁等[11]利用13C标记葡萄糖分析γ-聚谷氨酸的代谢途径,证明了葡萄糖主要用于能量代谢和菌体合成,只有少量参与了γ-PGA合成,而谷氨酸为γ-PGA单体的主要来源.
抚仙湖是一个大型贫营养湖泊,近年来由于人类的频繁活动,流域岸边的生态植被被破坏,大量的外源物质随径流流入湖泊而导致抚仙湖的外源碳增加,并且抚仙湖水体有机营养物质逐年升高,浮游植物生物量增加了7~10倍,透明度下降了2.7 m,综合营养状态指数上升了2.1倍[12],但整体而言该湖仍为贫营养状态.通常,外源有机碳对贫营养湖泊生产力的影响更为显著.该类湖泊中外源输入有机碳是否会被浮游动物利用以及相关的利用途径尚缺少研究.本研究将13C标记的葡萄糖作为外源DOC代表物,将其加入抚仙湖水样中进行野外原位控制实验.通过分析样品中浮游植物与浮游动物的种类、数量、PLFA生物标志物及其稳定同位素特征,研究外源DOC对湖泊甲壳类浮游动物碳源的贡献比例及其变化.研究结果对于了解湖泊流域物质能量交换和相关途径具有重要参考价值.
1 材料与方法 1.1 湖泊背景介绍抚仙湖(24°21′28″~24°38′00″N, 102°49′12″~102°57′26″E)位于云南省东部的滇中盆地中心,面积212 km2,海拔1722 m,最大水深157.3 m,是我国典型的高原深水湖泊[13].抚仙湖为贫营养型湖泊,水质清澈透明,含沙量很小,湖水中各生物营养元素浓度很低,生物生产力较低[14].近年来,湖区水质出现富营养化加速的发展趋势,湖区内出现了Ⅱ类水,透明度明显下降[15].
1.2 研究方法2013年6-7月在抚仙湖北部湖区(澄江县)同步采集0~5 m混合水样,分别装入18个100 L的桶中,分为6组,每组设3个平行.不添加13C标记的葡萄糖为对照组;5个实验组分别对应添加13C标记的葡萄糖后第1、3、6、9和第12 d,每桶添加葡萄糖量为30 mg. 13C标记的葡萄糖初始的碳同位素比值在99%以上.
用5 L柱状采水器采集桶中水样,取50 ml水样用于测定总氮(TN)、总磷(TP)、溶解性总氮(DTN)、溶解性总磷(DTP)浓度;2 L水样经由Whatman GF/C膜过滤,用于测定叶绿素a(Chl.a)浓度;取500 ml水样,立即加入5 ml鲁哥试剂固定,用于浮游植物定量分析;用30 μm浮游生物网过滤5 L水样,加入2 ml甲醛溶液固定,用于浮游动物定量分析;分批取2 L水样在GF/F膜上过滤(Φ47 mm,预先450℃灼烧5 h),分别用于颗粒有机物(POM)与细菌和藻类磷脂脂肪酸(PLFA)的碳稳定同位素测定,过滤好的GF/F膜立刻放入冰箱-20℃冷冻保存,带回实验室处理. GF/F膜过滤后的水样经48℃烘干浓缩成残渣,获得溶解性有机物(DOM)样品.
1.3 分析方法 1.3.1 水体理化指标测定实验期间用YSI多参数水质剖面仪(Yellow Spring Instruments, USA)获取桶内水体温度、电导率(Cond.)、氧化还原电位(ORP)、pH值、溶解氧(DO)等数据,结果见表 1.期间天气状况较为稳定,桶内水体温度逐步由20.9±0.07升至29.06±0.17℃,DO含量变化范围为97.60%±0.17%~108.67%±6.16%.
| 表 1 实验组水样理化特征 Tab.1 Physical and chemical properties of experimental groups |
TN、TP、DTN、DTP浓度采用联合消解方法消解, 紫外光催化-过硫酸钾氧化分光光度法进行测定[16]. Chl.a浓度经Whatman(GF/C)滤膜过滤,用乙醇萃取分光光度法测定[17].
1.3.3 浮游生物定性与定量分析浮游植物和浮游动物采用Utermöhl计数法[18],将采集的水样静置浓缩48 h后,用细小虹吸管吸取上清液,浓缩至30 ml,并加2 ml福尔马林溶液保存于50 ml的塑料瓶中,计数前将样品充分摇匀.浮游植物取0.1 ml样品于0.1 ml的计数框中,采用表面荧光显微镜(Zeiss Axiovent 135 M, Germany)在10×40倍视野下进行计数;浮游动物样品用宽口吸管吸取5 ml,注入大型浮游动物计数框中,在10×4倍视野下进行计数,计数3片,取其平均值,最后将视野内的浮游植物和浮游动物个数换算成每升水样中所含浮游植物(cells/L)或浮游动物的数量(ind./L).浮游植物与浮游动物以每升水所含浮游植物或浮游动物的数量来表示密度.浮游植物和浮游甲壳动物种类的鉴定参考《淡水浮游生物研究方法》[19-22].
1.3.4 稳定碳同位素测定POM/DOM的碳同位素测定POM与DOM样品研磨至粉末状,均经同位素质谱仪(Delta Plus, Finnigan)测定其碳稳定同位素含量.
浮游动物的碳同位素:用30 μm浮游生物网过滤足量的甲壳类浮游动物,放入装有蒸馏水的烧杯中,在15~25℃条件下放置5 h以清空浮游动物肠道内含物.随即在解剖镜下手工将浮游动物分类(主要挑选大型枝角类、桡足类),每种类型挑选足够数量的样品装入锡囊中,冷冻保存(-20℃).带回实验室经冷冻干燥后,采用同位素质谱仪(Delta Plus,Finnigan)测定其稳定碳同位素值.
磷脂脂肪酸(PLFA)的碳同位素:取收集有POM的GFF膜经冷冻干燥后,利用Bligh-Dyer方法[23],经过BD相提取液溶解,离心震荡分液,旋转蒸发,层析柱过滤,获得极性脂,再经过皂化,然后加入甲醇盐酸溶液形成脂肪酸甲酯(FAME),萃取FAME相,最后利用气相色谱-同位素质谱仪(GC-c-IRMS)(Thermo Finnigan, Breman, Germany)获得PLFA同位素比值(δ13C).同位素δ值(‰)表示:
| ${\rm{ \mathsf{ δ} }} = ({R_{{\rm{sample}}}}/{R_{{\rm{standard}}}} - 1) \times 1000$ |
式中,R为同位素丰度比,Rsample为样品中的同位素丰度比,Rstandard为标准物质的同位素丰度比.本文主要应用的是碳同位素比值即δ13C,标准碳稳定同位素δ13C参照海相碳酸盐岩标准(VPDB,Vienna Pee Dee Belemnite).所有样品重复分析2次以上.为确保仪器分析的一致性,每测定5~10个样品即分析1~2个标样.同位素与生物量的相关性采用SPSS 20.0软件进行分析.
2 结果与分析 2.1 浮游生物群落结构分析样品中共发现浮游植物24种,隶属6个门,蓝藻门、隐藻门、硅藻门、裸藻门、绿藻门和甲藻门.其中绿藻门种类最多,占37.50%,其次是蓝藻门和硅藻门,分别占16.67%,甲藻门最少,仅占4.17%.在数量上占绝对优势的是蓝藻门,约占总密度的62.05%,其次是隐藻门(12.42%)和硅藻门(7.95%),绿藻门种类虽然最多,但是相对密度仅为7.92%(表 2).此外,蓝藻门中几乎未发现铜绿微囊藻、水华微囊藻、惠氏微囊藻及微小微囊藻,主要为其他微囊藻.
| 表 2 实验期间浮游植物种类与数量变化 Tab.2 Changes of phytoplankton species and quantity during the experiment |
甲壳类浮游动物共鉴别出6个属,分别为哲水蚤、蚤状溞、象鼻溞、网纹溞、无节幼体、剑水蚤(表 3).数量最多的是象鼻溞,最小值为6.67 ind./L,最大值为161.33 ind./L;其次是网纹溞和蚤状溞,网纹溞数量最小值为0.67 ind./L,最大值是5.33 ind./L;蚤状溞最小值为0.67 ind./L,最大值为2.67 ind./L;数量最少的是哲水蚤和剑水蚤,只在第3 d时出现,数量为0.67 ind./L.象鼻溞作为优势种群(57%~100%),在所有桶均有检出.象鼻溞在处理组中的数量显著高于对照组中的数量(P<0.01).无节幼体仅在1个桶中检出.蚤状溞仅在对照组的1个桶中检出,在处理组的2个桶均有检出.网纹溞在对照组也仅有1个桶检出,在处理组3个桶中均有检出.
| 表 3 实验期间甲壳类浮游动物种类与数量变化 Tab.3 Changes of species and quantity of planktonic crustaceans during the experiment |
蚤状溞、象鼻溞和网纹溞数量随时间的变化趋势存在很大的差异.从数量上看,象鼻溞占据绝对优势;从第0~6 d,象鼻溞数量呈直线增加,网纹溞数量先增加后降低,蚤状溞是先降低后增加;第6~12 d,象鼻溞数量不断减少,而网纹溞和蚤状溞数量变化趋势一致,都是先减少后增加(图 1).
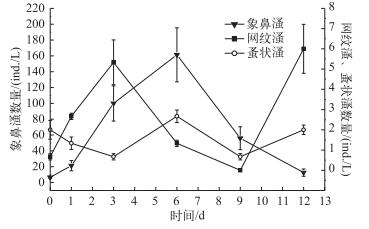
|
图 1 甲壳类浮游动物数量随时间的变化 Fig.1 Variation of planktonic crustaceans number over time |
根据相关文献,实验所提取的PLFA中,i-C15、C16:1ω7、n-C16、C18:1ω7、n-C18来源于细菌,而C18:2ω6主要来源于绿藻或硅藻[8].细菌和绿藻/硅藻的PLFA的δ13C值变化趋势相同(图 2),在第1 d时达到最大值,但是细菌类(i-C15、C16:1ω7、n-C16、C18:1ω7、n-C18)的δ13C值增长幅度远大于绿藻/硅藻的PLFA(C18:2ω6)的δ13C值增长幅度;之后,细菌和绿藻/硅藻的δ13C值都开始不断地下降,最终与未加入13C标记葡萄糖的对照组样品的δ13C值接近.
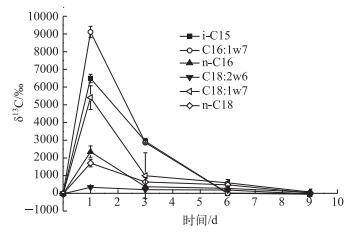
|
图 2 PLFA的δ13C值变化趋势 Fig.2 Change of the stable isotope ratios of PLFA |
POM与DOM变化趋势有显著差异,POM的变化幅度比较大,而DOM变化幅度比较平缓(图 3).未加入13C标记葡萄糖时(对照组),POM和DOM的δ13C值分别为-13.99‰和-14.84‰.加入葡萄糖后,POM的δ13C值在第1 d即达到峰值,为2322.149‰,之后就开始呈下降趋势,在第12 d时达到260.19‰.而DOM的δ13C值变化极为平缓,从第1~6 d缓慢增加,到第6 d达到了最大值,为211.99‰,之后开始缓慢下降.哲水蚤、象鼻溞、蚤状溞3种浮游动物的δ13C值变化趋势基本一致,表明其碳的来源基本相同.未加入13C标记的葡萄糖时(对照组),哲水蚤、象鼻溞和蚤状溞的δ13C值分别为-23.39‰、-23.88‰和-21.43‰.在加入13C标记的葡萄糖1 d之后,哲水蚤、象鼻溞和蚤状溞的δ13C值迅速增加,第3 d时均达到最大值,分别为1650.15‰、2152.02‰和2473.78‰;第3 d之后哲水蚤、象鼻溞和蚤状溞的δ13C值持续下降,第12 d降到最低,分别为927.17‰、697.14‰和598.87‰.以上结果表明, 浮游动物与细菌和POM等的同位素峰值出现时间存在着一定的时间差.整体而言,浮游动物的δ13C最高值出现在第3 d,晚于POM最高值的出现时间(第1 d),将以上结果与DOM的δ13C值并未出现显著升高趋势的结果相联系,可知细菌能够快速利用投加的葡萄糖,并将其部分转化为POM,随后浮游动物很可能优先利用了以DOM为主要碳源的细菌.这一点将在随后进行详细讨论.
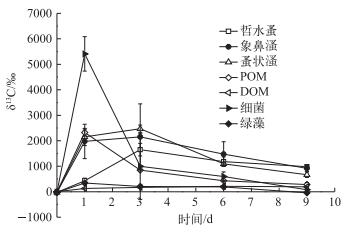
|
图 3 细菌、绿藻、浮游动物以及DOM、POM的δ13C值变化趋势 Fig.3 Changes of δ13C of bacteria, chlorophyta, planktonic crustaceans, DOM and POM |
以C18:1ω7和C18:2ω6分别作为细菌和浮游植物的代表,以此来比较细菌-浮游植物-浮游动物以及POM和DOM的δ13C值变化情况(图 3),为了进一步表明它们之间的相关性,对浮游动物、细菌、绿藻的δ13C值与POM及DOM的δ13C值进行相关分析,结果见表 4.细菌与POM的δ13C值变化趋势非常相似,POM的δ13C值与绿藻δ13C值并不相似(图 3),细菌与POM也呈极显著相关(P<0.01),POM与绿藻存在显著相关性(表 4),二者结果相呼应.蚤状溞与象鼻溞呈极显著相关(P<0.01),DOM与哲水蚤呈显著相关(P<0.05),绿藻均与蚤状溞、象鼻溞以及POM存在显著相关性(P<0.05).
| 表 4 浮游动物、细菌、绿藻的δ13C值与DOM及POM的δ13C值的相关分析 Tab.4 Pearson correlation coefficient of δ13C of planktonic crustaceans, bacteria, chlorophyta, DOM and POM |
磷脂脂肪酸作为生物细胞膜的重要组成部分,具有结构多样性和很高的生物学特异性,是非常有效的特定生物标志物;同时,外源与内源DOC具有不同的碳稳定同位素特征,通过细菌和不同来源有机物的碳稳定同位素的分析,可以区分外源与内源DOC对细菌碳源的贡献[24].因此,磷脂脂肪酸谱图分析与稳定同位素技术相结合,可以为确定生物种群间的相互关系及对整个生态系统的能量流动进行准确定位[25]. Rajendran等[26]用PLFA技术研究了日本某富营养化湖泊沉积物中的生物量.检测出的磷脂脂肪酸大多数属于细菌类群, 多聚非饱、脂肪酸及长链脂肪酸较少.本研究中将13C标记的葡萄糖作为碳源,通过提取磷脂脂肪酸研究细菌和藻类生物量的变化.结果表明i-C15、C16:1ω7、n-C16、C18:1ω7、n-C18来源于细菌,而C18:2ω6主要来源于绿藻或硅藻[8],并得出细菌和藻类的δ13C值,则13C富集的PLFA所代表的生物就是参与了13C标记葡萄糖代谢的生物[27].
进入水生生态系统中的外源有机碳主要包括DOC和POC,其中大部分外源碳以DOC形式进入水体.外源DOC可作为碳源为浮游细菌所吸收,增加浮游细菌的生物量从而进入到湖泊食物网当中. Kritzberg等[28]在一个寡营养并富含腐殖质的湖泊中的研究结果表明,该湖40%~80%的细菌生物量的碳源来自于外源性有机碳.本研究中,随着13C标记的葡萄糖的加入,细菌、POM和浮游动物的δ13C值几乎同时急剧增加(图 3),且前3 d趋势一致,说明浮游动物同时利用了细菌与POM.从δ13C值增长的幅度来看,外源DOC加入实验组后,细菌能够极其迅速地分解利用DOC,继而通过细菌吸收利用后形成细胞颗粒,随之生成DOC与POC,最后通过浮游动物摄食再进入传统食物链[29-30].因此,本实验中POM的δ13C值也随细菌显示出快速增加的趋势(图 3).外源性DOC本身可作为一种基质参与水生微生物的新陈代谢. Carignan等[31]研究表明细菌可利用外源DOC进行呼吸作用.本实验中,细菌的δ13C值在1 d之后不断下降(图 3),这是由于细菌通过呼吸作用,将13C以CO2的形式不断释放的结果[29-30].
3.2 浮游动物对外源有机碳的利用方式和途径如果外源性碳首先被初级生产者或初级消费者吸收利用,外源性碳则由细菌将陆源碳传递到食物网上一级,即通过上行效应影响食物链[32].第1 d后,当甲壳类浮游动物的δ13C值仍在增加之时,细菌和POM的δ13C值已急剧下降,说明甲壳类浮游动物摄食了细菌以及细菌的代谢产物POM(图 3).所选的3种甲壳类浮游动物中哲水蚤属于桡足类,而象鼻溞和蚤状溞属于枝角类,且都是滤食性浮游动物,从水中滤食细小的食物,主要包括细菌、藻类和碎屑等[33].第1 d时,象鼻溞和蚤状溞的δ13C值比哲水蚤的δ13C值大(图 3),且POM和细菌与象鼻溞和蚤状溞相关性比与哲水蚤的相关性明显,DOM与哲水蚤的相关性比与象鼻溞和蚤状溞相关性明显(表 4),进一步表明了象鼻溞和蚤状溞主要摄食细菌及细菌代谢的颗粒物,而哲水蚤主要摄食DOM;第3 d时,哲水蚤和象鼻溞、蚤状溞的δ13C值比较接近,仍低于象鼻溞和蚤状溞的δ13C值,说明对外源有机碳的竞争中,象鼻溞和蚤状溞占据主导地位,而哲水蚤相对弱一些.以上结果表明细菌对枝角类浮游动物的碳源有重要的影响. Banta等[34]用细菌悬浮液培养一种枝角类,结果证实其孤雌生殖世代达到1600多代.而大多数哲水蚤通常被归为植食性桡足类,但是实际上哲水蚤的食物构成中也有部分是来自于其他有机颗粒物[35].经典食物网的研究结果表明,浮游动物利用外源有机碳的途径主要有:1)直接摄食有机碎屑;2)摄食利用了外源有机碳的异养细菌[7].而浮游动物利用内源有机碳(浮游植物)的途径主要有:1)直接摄食浮游植物;2)摄食浮游植物有机碎屑;3)摄食利用了浮游植物碳源的细菌.
本研究中甲壳类浮游动物的δ13C值与POM的δ13C值变化趋势相似,极有可能是异养细菌快速利用DOC后代谢产生POM所引起的结果.实验中,绿藻的δ13C值在加入葡萄糖时,由-27.07‰增加到342.44‰(图 3),之后,绿藻的δ13C值与溶解性有机物(DOM)的δ13C值较接近(图 3).这说明了两种可能性:①浮游植物可能利用了细菌产生的富含13C的CO2,②实验添加的葡萄糖参与到了浮游植物的光合作用过程中. Hama等[36]利用13C示踪和气相色谱-质谱联用技术结合的方法,分析Hakata湾硅藻群落所分泌的溶解有机物部分,发现在12 h的培养过程中,中性醛糖占释放的DOC的47%~59%,其中葡萄糖是最主要的成分,且葡萄糖主要以葡聚糖的形态释放.相对于由浮游植物固定后经各种途径转换后再释放到水体中的溶解有机物,由浮游植物直接释放的溶解有机物以碳水化合物为主,其中葡萄糖又是最主要的成分[36-37],更容易被细菌所利用.总体而言,本研究采集的抚仙湖水样中,浮游植物的平均密度小于文献报道的抚仙湖的平均密度[38],说明采样点营养水平较低,浮游植物贡献的有机碳量并不高.
3.3 外源有机碳对细菌和浮游动物的贡献一般而言,细菌更喜欢利用低碳氮比(C:N)、易降解的内源DOC, 但是外源性DOC也是细菌生长、代谢的重要碳源. Berggren等[39]研究发现,低分子量的外源有机碳对细菌、原生动物和后生动物二级生产力的贡献率分别为80%、54%和23%,通过摄食浮游细菌,这部分碳源能被有效地传递到更高营养级别.有研究发现在贫营养湖泊中,外源性有机碳对浮游动物碳源的贡献率为22%~75%[40].本实验中,绿藻的δ13C值与浮游动物并不接近,这可能与加入的葡萄糖的高生物可利用性有关.尽管葡萄糖也能够参与浮游植物的光合作用过程中,但是它更可能被细菌优先利用.在初级生产力较低的寡营养湖泊中,细菌与浮游植物具有营养盐竞争关系.在寡营养条件下,细菌在与浮游植物竞争摄取磷方面占据优势地位[31].抚仙湖地处高海拔地区,紫外辐射强烈.胞外酶和强紫外辐射可以提高外源性DOC的细菌可利用性.细菌是吞噬性微生物(如鞭毛虫和纤毛虫)和滤食性浮游动物(如大型枝角类)的良好食物,而桡足类可以选择性摄食纤毛虫和鞭毛虫.因此,外源DOC可通过被细菌转化为其生物量进入食物链,并不断向更高营养级传递[32].此外,水力停留时间对于水生生物对外源性碳的利用率会产生一定的影响.抚仙湖属大型深水湖泊,水力停留时间比较长,而有机碳在水体中滞留的时间愈长,被利用的机率愈高[41].整体而言,抚仙湖是较典型的贫营养湖泊,初级生产力较低,内源贡献不足以支持浮游动物的生长活动.因此,外源有机碳对抚仙湖的食物网结构影响较大,对浮游动物的碳源起到了重要贡献.
4 结论通过13C标记的实验,探讨抚仙湖甲壳类浮游动物对外源有机碳的利用途径.结果表明:1)外源有机碳首先被细菌和浮游动物吸收利用;2)细菌吸收的外源碳一部分通过自身的代谢作用形成细胞颗粒,浮游动物通过摄食颗粒性有机物(POM),而获得这部分的碳源,而细菌产生的CO2可能会被浮游植物利用.研究结果证明在初级生产力低、内源碳不足以供给消费者生长需求的贫营养水体中,外源有机碳对浮游动物的碳源起到了重要的支撑作用.
| [1] |
Richardson JS, Zhang Y, Marczak LB. Resource subsidies across the land-freshwater interface and responses in recipient communities. River Research and Applications, 2010, 26(1): 55-66. DOI:10.1002/rra.1283 |
| [2] |
Wetzel RG. Limnology: Lake and river ecosystems. Eos Transactions American Geophysical Union, 2001, 21(2): 1-9. |
| [3] |
Grey J, Jones RI, Sleep D. Stable isotope analysis of the origins of zooplankton carbon in lakes of differing trophic state. Oecologia, 2000, 123(2): 232-240. DOI:10.1007/s004420051010 |
| [4] |
Pace ML, Cole JJ, Carpenter SR et al. Whole-lake carbon-13 additions reveal terrestrial support of aquatic food webs. Nature, 2004, 427(6971): 240-243. DOI:10.1038/nature02227 |
| [5] |
Cole JJ, Carpenter SR, Pace ML et al. Differential support of lake food webs by three types of terrestrial organic carbon. Ecology Letters, 2006, 9(5): 558-568. DOI:10.1111/ele.2006.9.issue-5 |
| [6] |
Fry B. Stable isotope ecology. New York: Springer, 2006, 204-212.
|
| [7] |
Boschker HTS, Middelburg JJ. Stable isotopes and biomarkers in microbial ecology. FEMS Microbiology Ecology, 2002, 40(2): 85-95. DOI:10.1111/fem.2002.40.issue-2 |
| [8] |
Boschker HTS, Kromkamp JC, Middelburg JJ. Biomarker and carbon isotopic constraints on bacterial and algal community structure and functioning in a turbid, tidal estuary. Limnology and Oceanography, 2005, 50(1): 70-80. DOI:10.4319/lo.2005.50.1.0070 |
| [9] |
Liu Zhanfeng, Li Liangjun, Ren Zheng et al. The advance in isotope labeled glucose. Nuclear Techniques, 2013, 36(1): 103021-103027. [刘占峰, 李良君, 任征等. 同位素标记葡萄糖的研究进展. 核技术, 2013, 36(1): 103021-103027.] |
| [10] |
Ziegler SE, White PM, Wolf D et al. Tracing the fate and recycling of 13C-labeled glucose in soil. Soil Science, 2005, 170(10): 767-778. DOI:10.1097/00010694-200510000-00002 |
| [11] |
Shi Ningning, Xu Hong, Yao Jun et al. Investigation of metabolic routes to γ-Poly(glutamic acid) by 13C-labeled glucose as medium carbon source. Chinese Journal of Process Engineering, 2007, 7(1): 145-148. [石宁宁, 徐虹, 姚俊等. 利用13C标记葡萄糖分析γ-聚谷氨酸的代谢途径. 过程工程学报, 2007, 7(1): 145-148.] |
| [12] |
Wang Lin, Tang Jinyan, Liu Yu et al. Study on the vulnerability of environment in Fuxian Lake. Hubei Agricultural Sciences, 2012, 51(14): 2965-2970. [王林, 唐金焰, 刘宇等. 抚仙湖生态环境脆弱性分析研究. 湖北农业科学, 2012, 51(14): 2965-2970.] |
| [13] |
Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences ed. Lake Fuxian. Beijing: Ocean Press, 1990. [中国科学院南京地理与湖泊研究所. 抚仙湖. 北京: 海洋出版社, 1990.]
|
| [14] |
Gao Wei, Chen Yan, Xu Min et al. Trend and driving factors of water quality change in Lake Fuxian(1980-2011). J Lake Sci, 2013, 25(5): 635-642. [高伟, 陈岩, 徐敏等. 抚仙湖水质变化(1980-2011)趋势和驱动力分析. 湖泊科学, 2013, 25(5): 635-642. DOI:10.18307/2013.0503] |
| [15] |
Pan Jizheng, Xiong Fei, Li Wenchao et al. Spatial-temporal dynamic changes of the water transparency and their influencing factors in Lake Fuxian, Yunnan Province. J Lake Sci, 2008, 20(5): 681-686. [潘继征, 熊飞, 李文朝等. 云南抚仙湖透明度的时空变化及影响因子分析. 湖泊科学, 2008, 20(5): 681-686. DOI:10.18307/2008.0519] |
| [16] |
Lei Ligai, Ma Xiaozhen, Wei Fuxiang et al. Research progress of determination of total nitrogen and total phosphorus in seawater. Hebei Journal of Industrial Science and Technology, 2011, 28(1): 72-76. [雷立改, 马晓珍, 魏福祥等. 水中总氮、总磷测定方法的研究进展. 河北工业科技, 2011, 28(1): 72-76. DOI:10.7535/hbgykj.2011yx01019] |
| [17] |
Pápista É, Ács É, Böddi B. Chlorophyll-a determination with ethanol—A critical test. Hydrobiologi, 2002, 485(123): 191-198. |
| [18] |
Utermöhl H. Neue wege in der quantitativan erfassung des planktons(Mit besondere Berü-cksichtigung des Ultraplanktons). Verh Int Verein Theor Angew Limnol, 1931, 5: 567-595. |
| [19] |
Zhang Zongshe, Huang Xiangfei. Research methods of freshwater plankton. Beijing: Science Press, 1991. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.]
|
| [20] |
Hu Hongjun, Wei Yinxin. The freshwater algae of China—Systematics, taxonomy and ecology. Beijing: Science Press, 2006. [胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社, 2006.]
|
| [21] |
Research Group of Carcinology, Institute of Zoology, Academia Sinica ed. Fauna sinica crustacea·freshwater copepods. Beijing: Science Press, 1979. [中国科学院动物研究所甲壳动物研究组. 中国动物志甲壳纲:淡水桡足类. 北京: 科学出版社, 1979.]
|
| [22] |
Jiang Xiezhi, Du Nanshan. Fauna Sinica Crustacea·Freshwater Cladocera. Beijing: Science Press, 1979. [蒋燮治, 堵南山. 中国动物志甲壳纲:淡水枝角类. 北京: 科学出版社, 1979.]
|
| [23] |
Bligh EG, Dyer WJ. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099 |
| [24] |
Van den Meersche KK, Van Rijswijk P, Karline S et al. Autochthonous and allochthonous contributions to mesozooplankton diet in a tidal river and estuary: Integrating carbon isotope and fatty acid constraints. Limnology and Oceanography, 2009, 54(1): 62-74. DOI:10.4319/lo.2009.54.1.0062 |
| [25] |
Zhao Dayong, Yan Wenming, Feng Jingwei et al. Applications of phospholipid fatty acid analysis in the microbial ecology studies of lake sediment. Chemistry & Bioengineering, 2009, 26(12): 17-20. [赵大勇, 燕文明, 冯景伟等. 磷脂脂肪酸分析在湖泊沉积物微生物生态学研究中的应用. 化学与生物工程, 2009, 26(12): 17-20. DOI:10.3969/j.issn.1672-5425.2009.12.004] |
| [26] |
Rajendran N, Matsuda O, Imamura N et al. Variation in microbial biomass and community structure in sediments of eutrophic bays as determined by phospholipid ester-linked fatty acids. Applied and Environmental Microbiology, 1992, 58(2): 562-571. |
| [27] |
Ge Yuan, He Jizheng, Zheng Yuanming et al. Stable isotope probing and its applications in microbicalecology. Acta Ecologica Sinica, 2006, 26(5): 1574-1582. [葛源, 贺纪正, 郑袁明等. 稳定性同位素探测技术在微生物生态学研究中的应用. 生态学报, 2006, 26(5): 1574-1582.] |
| [28] |
Kritzberg ES, Cole J, Pace ML et al. Bacteria growth on allochthonous carbon in humic and nutrient-riched lakes: Results from whole-lake 13C addition experiments. Ecosystems, 2006, 9(3): 489-499. DOI:10.1007/s10021-005-0115-5 |
| [29] |
Azam F, Fenchel T, Field J et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series, 1983, 10(3): 257-263. |
| [30] |
Jansson M, Persson L, De Roos AM et al. Terrestrial carbon and intraspecific size-variation shape lake ecosystems. Trends in Ecology and Evolution, 2007, 22(6): 316-322. DOI:10.1016/j.tree.2007.02.015 |
| [31] |
Carignan R, Planas D, Vis C. Planktonic production and respiration in oligotrophic shield lakes. Limnology and Oceanography, 2000, 45(1): 189-199. DOI:10.4319/lo.2000.45.1.0189 |
| [32] |
Tang Yali, Cheng Dongmei, Liu Zhengwen et al. Differntial support of lake food webs by allochthonous organic carbon. Ecological Science, 2014, 33(1): 161-165. [唐雅丽, 程冬梅, 刘正文等. 外源性有机碳对淡水生态系统食物网的贡献. 生态学报, 2014, 33(1): 161-165.] |
| [33] |
Institute of Animal, Chinese Academy of Science, crustaceans research group ed. Chinese animal. Beijing: Science Press, 1979. [中国科学院中国动物志委员会. 中国动物志. 北京: 科学出版社, 1979.]
|
| [34] |
Banta AM. Population density as related to sexand to evolution in Cladocera. The American Naturalist, 1937, 71(732): 34-49. DOI:10.1086/280704 |
| [35] |
Zhang Guangtao, Li Chaolun, Sun Song et al. Feeding habit of Calanussinicus(Crustacea: Copepoda) during spring and autumn in the Bohai Sea studied with herbivore index. Scientia Marina, 2006, 70(3): 381-388. DOI:10.3989/scimar.2006.70n3 |
| [36] |
Hama T, Yanagi K. Production and neutral aldose composition of dissolved carbohydrates excreted by natural marine phytoplankton populations. Limnology and Oceanography, 2001, 46(8): 1945-1955. DOI:10.4319/lo.2001.46.8.1945 |
| [37] |
Biddanda B, Benner R. Carbon, nitrogen, and carbohydrate fluxes during the production of particulate and dissolved organic matter by marine phytoplankton. Limnology and Oceanography, 1997, 42(3): 506-518. DOI:10.4319/lo.1997.42.3.0506 |
| [38] |
Pan Jizheng, Xiong Fei, Li Wenchao et al. Structure distribution and it's impact factors of phytoplankton community in Fuxian Lake. Acta Ecological Sinica, 2009, 29(10): 5376-5385. [潘继征, 熊飞, 李文朝等. 抚仙湖浮游植物群落结构、分布及其影响因子. 生态学报, 2009, 29(10): 5376-5385. DOI:10.3321/j.issn:1000-0933.2009.10.024] |
| [39] |
Berggren M, Strom L, Laudon H et al. Lake secondary production fueled by rapid transfer of low molecular weight organic carbon from terrestrial sources to aquatic consumers. Ecology Letters, 2010, 13(7): 870-880. DOI:10.1111/ele.2010.13.issue-7 |
| [40] |
Yokokawa T, Nagata T. Linking bacterial community structure to carbon fluxes in marine environments. Journal of Oceanography, 2010, 66(1): 1-12. DOI:10.1007/s10872-010-0001-4 |
| [41] |
Algesten G, Sobek S, Bergstro MAK et al. Role of lakes for organic carbon cycling in the boreal zone. Global Change Biology, 2005, 10(1): 141-147. |
 2017, Vol. 29
2017, Vol. 29 

