(2: 中国水利水电科学研究院, 北京 100038)
(2: China Institute of Water Resource and Hydropower Research, Beijing 100038, P. R. China)
三峡水库香溪河流域是我国三大磷矿储备区之一,流域内以磷化工为主的企业分布广泛,长久缺乏监管的磷矿开采和加工形成大量的磷矿废弃地和矿渣堆积,经雨水淋溶和地表径流,持续成为香溪河水体磷的主要来源.近年来,在三峡水库香溪河库湾冬、春季常暴发拟多甲藻(Peridiniopsis sp.)水华,水华期大面积水域呈现酱油色,影响库湾沿岸工农业用水,持续引发社会关注[1-2].
先前的研究表明水体氮、磷等营养组分对淡水Kinneret湖的甲藻水华暴发有重要影响[3-4].实际上,拟多甲藻水华暴发的水域,其磷浓度远小于蓝藻水华频繁暴发水体的磷浓度[5],这是因为拟多甲藻相对其他藻类有特有的生理竞争优势:拟多甲藻具有分泌胞外磷酸酶的功能,因此能在无机磷浓度较低的情况下,利用胞外磷酸酶催化水解可酶解磷为无机态正磷酸盐以满足自身需要,并在水体中占据种群优势[6]; 拟多甲藻的二氧化碳浓缩机制(CO2-concentrating mechanism,CCM)体现在受环境CO2而非HCO3-浓度的限制,在水华暴发过程中,其触发CCM机制运作的CO2浓度可低于5 μmol/L[6-7];拟多甲藻由于其特有的昼夜垂直迁移运动,在白天光照充足时,停留在水体表层或近表层的真光层中,便于吸收光能进行光合作用,而在黑夜,则进入营养盐含量较高的深层水体,对氮、磷营养元素进行暗吸收,为第2 d的光合作用进行物质准备[8],尤其在我国三峡库区,拟多甲藻呈现规律的昼夜垂直迁移规律,早晨8:00到晚上19:00左右,在水体表层和亚表层分布,此后经历约2 h过渡,从晚上21:00开始至次日早晨6:00左右,分布于深水层中[9].
本研究通过在拟多甲藻水华期对香溪河库湾水体中浮游植物种群和水体磷浓度进行监测,结合实验室研究拟多甲藻对环境中磷的生理学响应,分析拟多甲藻水华暴发与水体中磷浓度的关系,揭示磷在其暴发过程中的生理学机制.
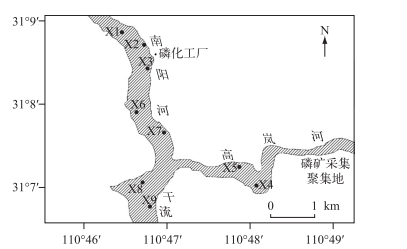
1 材料与方法 1.1 采样点布设于2015年2月22日3月5日拟多甲藻暴发期,对三峡水库香溪河库湾水华区域采集水样与浮游植物样品,其中南阳河支流由北向南设置5个采样点(X1、X2、X3、X6、X7),高岚河支流由东向西设置2个采样点(X4、X5),香溪河干流设置2个采样点(X8、X9)(图 1).采样期间,三峡水库水位在167.73~169.07 m之间,采样区域都处于回水区.
|
图 1 香溪河库湾采样点分布 Fig.1 Distribution of sampling sites in Xiangxi River Bay |
水质样品采集时取表层水样.使用YSI-650多参数水质分析仪现场测定溶解氧(DO)、电导率和pH值.将水样带回实验室后,按照《水和废水监测分析方法》测定水样中总磷(TP)、总氮(TN)和氨氮浓度等指标[10].
浮游植物的定性样品采用25#浮游生物网进行采集.取表层水样1 L,用鲁哥试剂固定后,以沉降器将样品沉淀96 h,虹吸上清液后,将水样浓缩到30 ml,保存并计数.浮游植物的定量、定性分析均使用Olympus BX43光学显微镜,定性分析鉴定其所属门类,定量分析采用浮游植物计数框,获得细胞密度.
1.3 藻种的分离与培养使用酒精喷灯拉伸灭菌过的巴斯德毛细管到极细并可虹吸的程度,在Olympus BX4光学显微镜下以毛细管虹吸水样中的单个拟多甲藻细胞,将其转移到盛有灭菌Carefoot培养基[11]的12孔真空包装细胞培养板中,放入光照培养箱中培养,培养条件为:温度15±1℃、光暗比12 h:12 h、光强25 μE/(m2·s).约2周取少量分离的藻种培养镜检,选取无污染、单一培养的拟多甲藻转接到含150 ml新鲜Carefoot培养基的三角瓶中扩大培养,培养条件同上.在多次传代培养中持续多次镜检以确保为纯种拟多甲藻.
将分离成纯种的拟多甲藻扩大培养后,取对数期藻液去上清液,藻细胞用无磷Carefoot培养基清洗5次,转入无磷Carefoot培养基7 d以消耗细胞内贮藏的磷. 7 d后,将藻液离心,使用无磷Carefoot培养基清洗3次,分别转接到磷终浓度为0、0.005、0.020、0.100和0.600 mg/L的Carefoot培养基里,培养条件同上.因两处水华发生位于磷化工厂和磷矿采集聚集地的下游,考虑高磷背景,将最高磷浓度设置到0.600 mg/L.
1.4 测定指标与方法 1.4.1 比生长速率的测定通过细胞计数来表征拟多甲藻的生长情况.按下式计算比生长速率(μ):
| $ \mu {\rm{ = }}\left( {\ln {x_2}-\ln {x_1}} \right)/\left( {{t_2}-{t_1}} \right) $ | (1) |
式中,x1和x2分别表示对数期起始时(t1)和结束时(t2)的藻细胞密度.
1.4.2 快速光反应曲线(rapid light curves,RLC)的测定取对数生长期的5种磷浓度梯度培养的拟多甲藻,将藻细胞暗适应20 min后,以浮游植物荧光分析仪(PHYTO-PAM, Waltz公司,德国)测定其快速光反应曲线,光强梯度设定为1、32、64、192、320、512、704、960、1088和1216 μmol photons/(m2·s)等[12].快速光反应曲线通过以下公式拟合[13]:
| $ rETR = ET{R_{\max }}\left( {1-{{\rm{e}}^{-\alpha \cdot PAR/ETR\max }}} \right){{\rm{e}}^{-\beta \cdot PAR/ETR\max }} $ | (2) |
式中,ETRmax是最大电子传递速率,α是快速光反应曲线的初始斜率,PAR是光合活性辐射(μmol photons/(m2·s)),β是PSII衰减时候快速光反应曲线的斜率值.
1.4.3 光合放氧测定无机碳吸收效率(P-C曲线)配制无碳缓冲液(Ci-free buffer):将Bis-tris propane(BTP)加入到无碳的Carefoot培养基中,配制成终浓度为30 mmol/L的缓冲液,用1 mol/L的HCl调节pH值至1.0,然后通高纯氮气30 min,最后用新鲜饱和NaOH溶液将pH值调至8.0,贮存备用[14].
离心搜集5个不同外源磷浓度梯度培养的对数生长期拟多甲藻细胞,去上清液,重悬浮于无碳缓冲液中,冲洗3次.取3 ml清洗后无碳的藻液于Clark氧电极型光合放氧仪(Chlorolab 2,Hansatech Instruments Ltd.,Norfolk,UK)的反应槽内,循环水浴控温在15℃,在光强为500 μE/(m2·s)条件下,利用藻细胞光合固碳能力使胞内无机碳枯竭,当藻细胞光合放氧达到0,即CO2补偿点时,通过微量进样针从加样孔加入不同浓度的微量NaHCO3溶液,测定藻细胞的光和放氧速率.通过以下方程对实验数据进行非线性拟合,其中K0.5为藻细胞的光合作用无机碳亲和力的表观半饱和常数,即为光合速率达到最大值的一半时的无机碳浓度[15]:
| $ v = {V_{\max }}\left[{{\rm{DIC}}} \right]/\left( {{K_{0.5}} + \left[{{\rm{DIC}}} \right]} \right) $ | (3) |
式中,v是光合速率,Vmax是无机碳饱和状态下的光合速率,[DIC]是无机碳浓度,K0.5是表观无机碳亲和力常数,是光合活性达到最大值一半时对应的无机碳浓度值.
1.5 统计分析方法现场采样与实验室均取样3份,重复实验检测3次.实验数据用Origin软件分析,并用均值±标准差表示.利用SPSS 13.0软件进行Pearson相关性分析(双侧检验).
2 结果与分析 2.1 香溪河库湾水华期浮游植物与环境因子的相关性分析 2.1.1 香溪河库湾水华期浮游植物与水体磷的分布对香溪河库湾拟多甲藻水华暴发时期9个采样点的浮游植物进行分析,结果表明,南阳河支流的X1、X2、X3、X6点位的浮游植物优势种为拟多甲藻,其密度占浮游植物总密度的比例超过了90 %,X7点位处TP浓度最低,采样时表层水未发生甲藻水华,其优势种为硅藻;高岚河支流的X4、X5点位也是水华暴发的重点区域,优势种拟多甲藻的细胞密度在107 cells/L左右,其密度占浮游植物总密度的比例也超过了90 % (图 2).

|
图 2 香溪河库湾浮游植物群落组成 Fig.2 Community composition of phytoplankton in Xiangxi River Bay (*表示差异显著,P<0.05, 下同) |
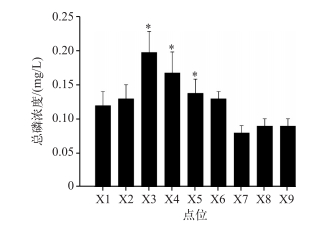
从图 3可以看出,香溪河库湾X3、X4、X5点位的TP浓度较高,分别达到了0.20、0.17和0.14 mg/L;X1与X2点位的TP浓度低于0.15 mg/L,这是因为X1和X2点位位于南阳河支流沿岸磷化工厂上游,磷化工厂向水体贡献的营养盐为下游点位X3、X6的拟多甲藻提供了迅速生长所需的磷源;X8、X9点位在香溪河干流上,由于春季水位较高,长江干流来水的顶托作用稀释了水体TP浓度[16],因此X8和X9点位水体TP浓度不高,低于0.1 mg/L,也并未发生水华.
|
图 3 香溪河库湾水体总磷浓度 Fig.3 Concentrations of total phosphorus in Xiangxi River Bay |
香溪河库湾水华期浮游植物细胞密度与pH、电导率、DO、TN和氨氮浓度无显著相关关系,细胞密度与水体TP浓度呈显著正相关(Pearson系数r=0.791,P<0.05;表 1).
| 表 1 香溪河库湾水华期浮游植物密度与水质理化指标参数的相关性分析 Tab.1 Correlation analysis between the phytoplankton abundance and the water physicochemical parameters during the water bloom period in Xiangxi River Bay |
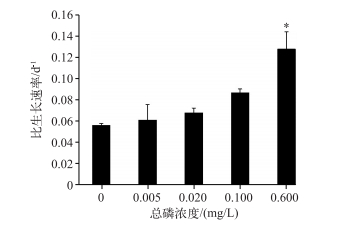
对6种不同磷浓度培养基培养的纯种拟多甲藻比生长速率进行比较(图 4),结果表明磷浓度越高,拟多甲藻生长越快,比生长速率越高. 0~0.1 mg/L磷浓度条件下培养的拟多甲藻的比生长速率从0.0567±0.0012 d-1升高到0.0811±0.0034 d-1,0.6 mg/L磷浓度下培养的拟多甲藻的比生长速率有显著升高,为0.1281±0.0161 d-1(P<0.05).这说明,高浓度磷能显著促进拟多甲藻的生长.
|
图 4 不同总磷浓度条件下拟多甲藻的比生长速率 Fig.4 Specific growth rate of Peridiniopsis at different total phosphorus concentrations |
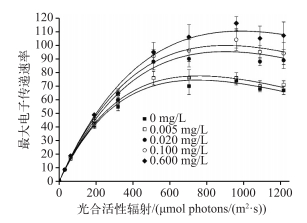
不同磷浓度培养的拟多甲藻的RLC曲线有显著差异(图 5). RLC曲线的初始斜率(α)和ETRmax均随着培养基磷浓度的升高而显著升高(P<0.05)(表 2). RLC曲线的初始斜率反映其光合效率,结果显示外源磷的增加可提高拟多甲藻的光合效率;外源磷供给越多,拟多甲藻的RLC曲线越高,ETRmax也越高,这说明高磷的营养条件使得其达到ETRmax的光饱和值增大,对于光能的捕获更加高效,电子传递速率更快.
|
图 5 不同总磷浓度条件下拟多甲藻的快速光曲线 Fig.5 Rapid light curves of Peridiniopsis at different total phosphorus concentrations |
| 表 2 不同总磷浓度条件下拟多甲藻快速光曲线的光合参数 Tab.2 Photosynthetic parameters in RLC-curves of Peridiniopsis at different total phosphorus concentrations |
从拟多甲藻对外源无机碳的吸收曲线(P-C曲线)可以看出,磷浓度越高,拟多甲藻能达到的最大光合放氧值(Pmax)也越高(P<0.05),0~0.1 mg/L磷浓度条件下培养的拟多甲藻的Pmax均在0.002 μmol O2/(μg Chl.a·min)左右,0.6 mg/L磷浓度培养的拟多甲藻则达到了0.016 μmol O2/(μg Chl.a·min)(图 6).由于Pmax的差异显著,因此不宜用表观无机碳亲和力常数K0.5来评价拟多甲藻对无机碳的吸能能力,以P-C曲线的初始斜率来衡量不同培养条件下拟多甲藻对无机碳的亲和力(表 3)[17].环境中磷浓度越高,越能提高拟多甲藻的固碳效率,0~0.1 mg/L的磷浓度下培养的拟多甲藻的P-C曲线初始斜率低于0.00020,0.6 mg/L磷浓度下培养的拟多甲藻显著升高到了0.00056(P<0.05).说明高磷条件可显著增强拟多甲藻对无机碳的吸收.

|
图 6 不同总磷浓度条件下拟多甲藻的P-C曲线 Fig.6 P-C curves of Peridiniopsis at different total phosphorus concentrations |
| 表 3 不同总磷浓度条件下拟多甲藻P-C曲线的动力学参数 Tab.3 Kinetic parameters in the P-C curves of Peridiniopsis at different total phosphorus concentrations |
围绕三峡水库拟多甲藻水华暴发的生态学机理研究已经很多,由于其暴发地属于河湖态深水水库,大量的研究关注水库水文条件与其形成的关系[18-19],以及拟多甲藻垂直迁移行为与水库水文条件的关系等[9, 20].而三峡水库香溪河流域是我国最大的磷矿开发与加工的基地之一,磷矿的开采和化工加工产业仍然不可避免地给库湾水体增加了营养盐负担.
磷是浮游植物生长所需的必须元素,参与细胞的生长和能量的传递等重要新陈代谢过程,是组成生命体不可或缺的结构和功能成分;对于水华藻类而言,磷常常是水体中限制性因素,缺磷影响细胞的合成以磷酸酯为基础的DNA和RNA,影响ATP的合成,导致细胞代谢过程中的能量缺乏,并抑制光合作用[21-23].本研究显示,水体磷浓度越高,拟多甲藻生长越迅速,其光合效率越高,高浓度的外源磷条件还促进了拟多甲藻对无机碳的吸收.由此推断,在香溪河水库,高磷背景可能是甲藻水华暴发的关键因素之一.
光系统Ⅱ(PSII)的相对电子传递速率表示叶绿体中色素通过PSII向光合反应链传递电子的能力,并间接反映其光化学效率的高低[24-25].本研究中实验室验证了较高浓度磷条件下培养的拟多甲藻具有较高的光能利用效率和相对最大电子传递速率,这可能是因为磷浓度较高的环境,藻细胞能向光合磷酸化供应的无机磷增加,光合磷酸化的能力提高,加快了与之相联系的电子传递,促使电子受体质体醌的氧化还原过程,提高了光能的利用效率[26]和电子传递速率,最终体现为光合效率的显著升高.
Beardall等[27]的研究显示,磷限制条件下Chlorella的CCM机制受到抑制,其K0.5值从无限制磷源的4.48 μmol/L升高至12.67 μmol/L;而本研究通过梯度给予其磷源,高磷条件下其P-C曲线的初始斜率显著高于低磷培养条件,香溪河采样也证实,高磷水体中拟多甲藻的细胞密度较高,这可能是因为高磷条件充足的磷供给加快了ATP的高效合成,增加了细胞质膜上的H+-ATP酶的活性,使得无机碳在质膜上的运输变得更快速高效[28-30].光合与固碳能力互相促进,最终体现为拟多甲藻比生长速率增大,在短时间产生极大的生物量.
因此,香溪河库湾水体磷可能是拟多甲藻暴发的一个重要因素,在水文条件难以改变的情况下,对区域磷矿产业的控源截污应是控制拟多甲藻水华暴发的有效手段.
| [1] |
Hu Sheng, Liu Guoxiang, Zhou Guangjie et al. Peridinium polonicum, a new record of freshwater toxic Dinoflagellate from China. J Wuhan Bot Res, 2008, 26(5): 454-457. [胡圣, 刘国祥, 周广杰等. 波兰多甲藻, 中国淡水产毒甲藻新记录. 武汉植物学研究, 2008, 26(5): 454-457.] |
| [2] |
Zhang Q, Liu GX, Hu ZY. Morphological differences and molecular phylogeny of freshwater blooming species, Peridiniopsis spp. (Dinophyceae) from China. European Journal of Protistology, 2011, 47: 149-160. DOI:10.1016/j.ejop.2011.03.001 |
| [3] |
Kawabata Z, Hirano Y. Growth pattern and cellular nitrogen and phosphorus contents of the dinoflagellate Peridinium penardii Lemm. causing a freshwater red tide in a reservoir. Hydrobiologia, 1995, 312: 115-120. DOI:10.1007/BF00020767 |
| [4] |
Gophen M, Smith VH, Nishri A et al. Nitrogen deficiency, phosphorus sufficiency, and the invasion of Lake Kinneret, Israel, by the N2-fixing cyanobacterium Aphanizomenon ovalisporum. Biomedical and Life Sciences, 1999, 61: 293-306. |
| [5] |
Hodgkiss IJ, Ho KC. Are changes in N: P ratios in coastal waters the key to increased red tide blooms?. Hydrobiology, 1997, 352: 141-147. DOI:10.1023/A:1003046516964 |
| [6] |
Berman-Frank I, Erez J. Inorganic carbon pools in the bloom-forming Dinoflagellate Peridinium gatunense. Limnology and Oceanography, 1996, 41: 1780-1789. DOI:10.4319/lo.1996.41.8.1780 |
| [7] |
Berman-Frank I, Erez J, Kaplan A. Changes in inorganic carbon uptake during the progression of a dinoflagellate bloom in a lake ecosystem. Canadian Journal of Botany, 1997, 76: 1043-1051. |
| [8] |
Olsson P, Graneli E. Observations on diurnal vertical migration and phased cell division for three marine dinoflagellates. Journal of Plankton Research, 1991, 13: 1313-1324. DOI:10.1093/plankt/13.6.1313 |
| [9] |
Yang Zhengjian, Liu Defu, Yi Zhongqiang et al. Diurnal vertical migration of Peridiniopsis sp. in Xiangxi Bay of Three Gorges Reservoir. Res Environ Sci, 2010, 23: 26-32. [杨正健, 刘德富, 易仲强等. 三峡水库香溪河库湾拟多甲藻的昼夜垂直迁移特性. 环境科学研究, 2010, 23: 26-32.] |
| [10] |
"Monitoring and analysis method of water and wastewater" editorial board of State Environmental Protection Administration of China. Monitoring and analysis method of water and wastewater. Fourth Edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法. 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [11] |
Carefoot JR. Culture and heterotrophy of the freshwater dinoflagellate, Peridinium cinctum fa. ovoplanum Lindeman. Journal of Phycology, 1968, 4: 129-131. DOI:10.1111/jpy.1968.4.issue-2 |
| [12] |
Jinzhu X, Xinghua W, Yanjun Y et al. Changes in growth, photosynthesis and chlorophyll fluorescence in the freshwater dinoflagellate Peridinium umbonatum (Peridiniales, Pyrrophyta) in response to different temperatures. Phycologia, 2016, 55(4): 469-477. DOI:10.2216/PH15-148.1 |
| [13] |
Platt T, Gallegos CL, Harrison WG. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton. Journal of Marine Research, 1980, 38: 687-701. |
| [14] |
Qiu BS, Gao KS. Effects of CO2 enrichment on the bloom-forming cyanobacterium Microcystis aeruginosa (Cyanophyceae): physiological responses and relationships with the availability of dissolved inorganic carbon. Journal of Phycology, 2002, 38: 721-729. DOI:10.1046/j.1529-8817.2002.01180.x |
| [15] |
Rotatore C, Colman B. The acquisition and accumulation of inorganic carbon by the unicellular green alga Chlorella ellipsoidea. Plant, Cell & Environment, 1991, 14: 377-382. |
| [16] |
Xu Yaoyang, Wang Lan, Han Xinqin et al. Dynamics of suspended solids in Xiangxi Bay of Three Gorges Reservoir during spring algal bloom period. Chin J Appl Ecol, 2009, 20(4): 963-969. [徐耀阳, 王岚, 韩新芹等. 三峡水库香溪河库湾春季水华期间悬浮物动态. 应用生态学报, 2009, 20(4): 963-969.] |
| [17] |
Wu XH, Wu ZX, Song LR. Phenotype and temperature affect the affinity for dissolved inorganic carbon in a cyanobacterium Microcystis. Hydrobiologia, 2011, 675: 175-186. DOI:10.1007/s10750-011-0815-0 |
| [18] |
Zhu Aimin, Qiao Ye, Liang Youguang et al. Monitoring and investigation of Peridiniopsis sp. water bloom in Tongzhuang River of Three Gorges Reservoi. J Hydroecology,, 2012, 33(4): 49-53. [朱爱民, 乔晔, 梁友光等. 三峡水库支流童庄河拟多甲藻水华的监测. 水生态学杂志, 2012, 33(4): 49-53.] |
| [19] |
Zhu Aimin, Li Sixin, Hu Jun et al. The mechanism for occurrence of Perdiniopsis blooms in the tributaries of Three Gorges Reservoir. Acta Ecol Sin, 2014, 34(11): 3071-3080. [朱爱民, 李嗣新, 胡俊等. 三峡水库支流拟多甲藻水华的形成机制. 生态学报, 2014, 34(11): 3071-3080. DOI:10.5846/stxb201304090646] |
| [20] |
Xu Yaoyang, Cai Qinghua, Li Daofeng et al. Preliminary Report on Diei Vertical Distribution Patterns of Peridiniopsis in Xiangxi Bay of the Three Gorges Reservoir. J Wuhan Bot Res, 2008, 26(6): 608-612. [徐耀阳, 蔡庆华, 黎道丰等. 三峡水库香溪河库湾拟多甲藻昼夜垂直迁移分布初步研究. 武汉植物学研究, 2008, 26(6): 608-612.] |
| [21] |
Schlüter LR, Riemann B, Sondergaard M. Nutrient limitation in relation to phytoplankton carotenoid chlorophyll a ratios in freshwater mesocosms. Journal of Plankton Research, 1997, 19: 891-906. DOI:10.1093/plankt/19.7.891 |
| [22] |
Grárciá-Sánchez MJ, Fernández JA, Niell FX. Photosynthetic response of P-deficient Gracilaria tenuistipitata under two different phosphate treatments. Physiologia Plantarum, 1996, 96: 601-606. DOI:10.1111/ppl.1996.96.issue-4 |
| [23] |
Ou MM, Wang Y, Cai WM. Physiological and biochemical changes in Microcystis aeruginosa Qutz. in phosphorus limitation. Journal of Integrative Plant Biology, 2005, 47: 692-702. DOI:10.1111/jipb.2005.47.issue-6 |
| [24] |
Lazár D. Chlorophyll a fluorescence induction. Biochimica et Biophysica Acta, 1999, 1412: 1-28. DOI:10.1016/S0005-2728(99)00047-X |
| [25] |
Huovinen P, Matos J, Pinto IS et al. The role of ammonium in photoprotection against high irradiance in the red alga Grateloupia lanceola. Aquatic Botany, 2006, 84: 308-316. DOI:10.1016/j.aquabot.2005.12.002 |
| [26] |
Lobban CS, Harrison PJ, Duncan MJ. The physiological ecology of seaweeds. New York: Cambridge University Press, 1985, 11-22.
|
| [27] |
Beardall J, Roberts S, Raven JA. Regulation of inorganic carbon acquisition by phosphorus limitation in the green alga Chlorella emersonii. Canadian Journal of Botany, 2005, 83(7): 859-864. DOI:10.1139/b05-070 |
| [28] |
Beardall J. Effects of photon flux density on the "CO2 concentrating mechanism" of the cyanobacterium Anabaena variabilis. Journal of Plankton Research, 1991, 13: 133-141. |
| [29] |
Beardall J, Giordano M. Ecological implications of microalgal and cyanobacterial CCMs and their regulation. Functional Plant Biology, 2002, 29: 335-347. DOI:10.1071/PP01195 |
| [30] |
Raven JA, Beardall J. CO2 acquisition mechanisms in algae: Carbon dioxide diffusion and carbon dioxide concentrating mechanisms. In: Larkum A, Raven JA, Douglas S eds. Advances in photosynthesis: Photosynthesis in the algae. Dordrecht: Kluwer, 2003: 225-244.
|
 2017, Vol. 29
2017, Vol. 29 

