(2: 新疆大学绿洲生态教育部重点实验室, 乌鲁木齐 830046)
(3: 新疆智慧城市与环境建模普通高校重点实验室, 乌鲁木齐 830046)
(4: 美国圣路易斯大学可持续发展中心, 圣路易斯 63108)
(5: 美国孟菲斯大学地球科学系, 孟菲斯 38152)
(6: 澳大利亚联邦科工组织水土研究所, 堪培拉 2601)
(2: Key Laboratory of Oasis Ecology, Xinjiang University, Urumqi 830046, P. R. China)
(3: Key Laboratory of Xinjiang Wisdom City and Environment Modeling, Urumqi 830046, P. R. China)
(4: Center for Sustainability, Saint Louis University, St. Louis 63108, USA)
(5: Department of Earth Sciences, University of Memphis, Memphis 38152, USA)
(6: Commonwealth Scientific and Industrial Research Organization, Land and Water, Canberra 2601, Australia)
水环境既是人类生产、生活的基础,又是各类污染物的主要归宿之一.近几十年来,随着艾比湖流域经济快速发展和人口急剧增长,人类对水资源的开发不断加剧,使水环境逐渐恶化,水体污染日益加剧[1].目前,水体质量评价的指标很多,主要依据地表水的用途进行分类.通常以一些水化学参数(如五日生化需氧量(BOD5)、化学需氧量(COD))作为基准对地表水进行评价.如:刘萌等[2]、朱媛媛等[3]均以一些常规水化学参数对地表水进行现状分析及评价.然而水体荧光也是了解水质状况的一项参数,分析水体中溶解性有机质(DOM)的结构,有利于进一步了解水质.目前,可利用荧光光谱法对不同河流的荧光光谱特性进行分析.荧光光谱法具有快速、高灵敏度、低检测限、所需样品量少和对样品结构无破坏等特点[4].近年来,荧光光谱技术的发展实现了对激发和发射波长的同步快速扫描,并可生成三维激发发射荧光光谱图.三维荧光光谱法为大型湖泊和河流的水质监测提供了潜在应用的可能.国外对此研究开展较早并取得了迅猛的发展和应用,利用荧光光谱技术可以快速、实时地分析各种水质状况,并能取得很好的效果[5-6],如:三维荧光广泛应用于定量分析水体中的DOM组成结构,揭示了DOM在河流、湖泊、地下水、海洋及污水等水环境中的特征[7-9].早期一些学者通过识别5个荧光特征峰表征水体中的DOM组成结构[10-11].近年来,许多研究人员应用区域积分、平行因子、自组织神经网络等一些常规方法表征DOM组成结构.精河与博尔塔拉河是艾比湖的主要入湖河流,不仅对艾比湖国家级自然保护区的生态环境有重要的作用,而且为博乐市与精河县等地区提供了农业用水,这对绿洲农业的发展起着决定性的作用.因此,了解水质状况和DOM的结构组成对改善其河流生态环境及维护生态系统结构与功能都有着重要影响.
本文首先利用平行因子法与三维荧光区域积分法对精河与博尔塔拉河的DOM组分及其相对含量进行分析,其次探讨了水质参数与荧光指数的关系, 为艾比湖流域河流治理与生态环境修复提供理论支持.
1 材料与方法 1.1 研究区概况艾比湖是新疆第一大咸水湖,是亚洲干旱区典型的内陆湖泊.湖泊地处准格尔盆地中心,远离海洋,水蒸汽难以到达,但研究区的水分来自大西洋[12].艾比湖承接奎屯河、阿奇克苏河、精河、大河沿子河及博尔塔拉河来水.由于近几十年来气候的变化,入湖河流径流量逐年减少.其中奎屯河、阿奇克苏河及大河沿子河年径流量逐年减少,而作为入湖的主要河流精河与博尔塔拉河年径流量变化不大.因此,选择精河与博尔塔拉河作为研究对象.博尔塔拉河、精河流域(44°00′~45°23′N,79°53′~83°53′E,图 1)位于准噶尔盆地西南边缘,博尔塔拉蒙古自治州境内,东部与塔城市相邻,南部与伊宁市相邻.博尔塔拉河、精河流域西边、南边、北边三面环山,中间为狭长谷地,东部与准噶尔盆地连为一体,基本上可分为山、谷、盆3大地貌单元.盆地海拨从300 m左右逐渐降低到艾比湖水面的196 m.盆地由山前洪积、过渡区冲积、中心区湖积平原及湖泊组成.
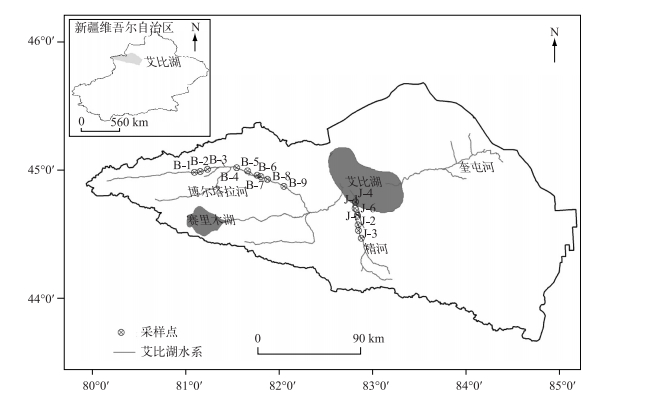
|
图 1 研究区示意图 Fig.1 The sketch map of study area |
样品于2016年3月20日3月29日分别采自艾比湖流域的博尔塔拉河与精河.从河流中间取水,沿博尔塔拉河上游每隔2 km采集一个水样,精河从上游的下天吉水库往下每隔2 km采集一个水样,在采集水样的同时,用GPS同步记录采样点的经纬度坐标.利用水质检测仪(YSI 600)现场检测河水的pH值、溶解氧(DO),把水样冷藏在<4℃冷藏箱内,运回实验室立即依据《生活饮用水标准检验方法》(GB/T 5750—2006)测定BOD5、COD、总氮(TN)、总磷(TP)、铵态氮(NH4+-N)等水质参数,并用预先灼烧过的0.22 μm滤膜过滤,收集30 ml滤液于棕色玻璃瓶中置于4℃下保存.
三维荧光光谱(EEM)的获取采用日本日立F-7000型荧光分光光度计.激发波长(Ex)为200~550 nm,狭缝宽度5 nm,增量5 nm;发射波长(Em)为280~550 nm,狭缝宽度5 nm,增量2 nm. PMT电压为700 V,扫描速度为2400 nm/min.所有水样的三维荧光光谱分别减去空白光谱,以去除拉曼散射的影响;在位于发射波长等于激发波长或2倍激发波长的光谱区域内,将瑞利散射及上方的光谱数据均赋为0,以消除瑞利散射的影响.
1.3 分析方法 1.3.1 平行因子分析法平行因子分析法(PARAFAC)[13]是基于三线性分解理论,采用交替最小二乘原理的迭代类型三维数阵分解算法,将一个由多个EEM数据构成的三维阵列X分解为3个载荷矩阵后,对DOM的三维荧光光谱进行解谱.
1.3.2 三维荧光区域积分法荧光区域积分法是通过计算特定区域标准体积(Φ)i, n和整体区域标准体积(ΦT, n)反映对应区域具有特定结构荧光物质的含量和相对含量[14-15]:
| $ {\mathit{\Phi }_i} = \sum\limits_{{\rm{ex}}} {\sum\limits_{{\rm{em}}} {I\left( {{\lambda _{{\rm{ex}}}} \cdot {\lambda _{{\rm{em}}}}} \right)\Delta {\lambda _{{\rm{ex}}}}} } \cdot \Delta {\lambda _{{\rm{em}}}} $ | (1) |
| $ {\mathit{\Phi }_{T, n}} = \sum\limits_{i = 1}^5 {{\mathit{\Phi }_{i, n}}} $ | (2) |
| $ {\mathit{\Phi }_{i, n}} = M{F_i} \cdot {\mathit{\Phi }_i} $ | (3) |
| $ {P_{i, n}} = \frac{{{\mathit{\Phi }_{i, n}}}}{{{\mathit{\Phi }_{T, n}}}} \times 100\% $ | (4) |
式中,Δλex为激发波长间隔;Δλem为发射波长间隔;I(λex,λem)指激发与发射波长所对应的荧光强度;Pi, n为荧光物质的相对含量;MFi是倍乘系数,区域Ⅰ为20.4,区域Ⅱ为16.4,区域Ⅲ为4.81,区域Ⅳ为8.76,区域Ⅴ为1.76.
1.4 数据分析与处理采用SigmaPlot 12.5软件对各指标进行分析,同时使用Matlab 2012a软件对三维荧光进行平行因子模型分析及三维荧光区域积分.
2 结果与分析 2.1 主要入湖河流三维荧光光谱特征采用平行因子分析法对精河与博尔塔拉河进行三维荧光光谱进行解谱,分析其河流DOM的不同组分.精河与博尔塔拉河水质均识别出4个荧光组分(图 2),包括C1(260/420 nm)腐殖酸等有机质[16-17]、C2(240,240/490 nm)UVC类腐殖质[18]、C3(220/280,300/450 nm)蛋白质类有机质[19-20]以及C4(260,270/530 nm)类腐殖质[18].
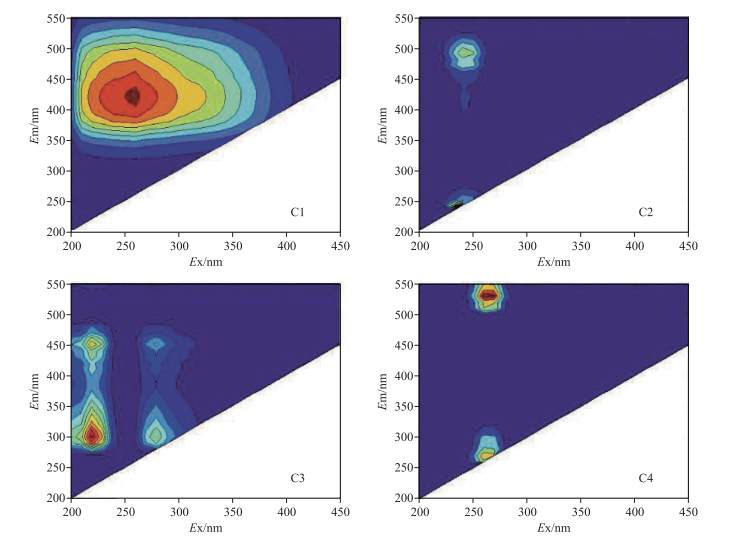
|
图 2 基于平行因子分析法的艾比湖主要入湖河流荧光组分 Fig.2 Fluorescence components identified by PARAFAC model in the main inflow rivers of Lake Ebinur |
为了更深入地了解DOM荧光特征,采用三维荧光区域积分法定量分析DOM荧光组分特征,利用连续的激发和发射波长将三维荧光光谱划分为5个区域[21]:区域Ⅰ(Ex/Em=220~250/280~330 nm)为络氨酸类蛋白质;区域Ⅱ(Ex/Em=220~250/330~380 nm)为色氨酸类蛋白质;区域Ⅲ(Ex/Em=220~250/380~550 nm)为类富里酸;区域Ⅳ(Ex/Em=250~400/280~380 nm)为溶解性微生物代谢产物;区域Ⅴ(Ex/Em=250~400/380~550 nm)为类腐殖酸.通过计算特定区域光谱积分和整体区域标准体积之比,反映对应区域具有特定结构荧光物质的含量和相对含量(图 3).
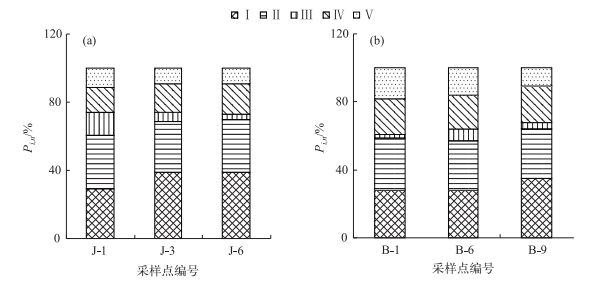
|
图 3 精河(a)和博尔塔拉河(b)DOM组分的分布百分比 Fig.3 Distributions of the abundance of DOM components in Jinghe River(a) and Bortala River(b) |
本研究选取的精河J-1采样点位于精河县城附近,J-3采样点在精河上游的下天吉水库,J-6采样点位于县城和下天吉水库中间处.博尔塔拉河B-1采样点位于温泉县附近,B-6采样点在中间的村庄,B-9采样点大致在进入博乐市附近.精河络氨酸类蛋白质P1, n相对较大的部分介于29.438%~39.099%之间,色氨酸类蛋白质P2, n介于29.773%~31.013%之间,类富里酸P3, n在3.189%~13.653%之间,溶解性微生物代谢产物P4, n在14.464%~17.645%之间,类腐殖酸P5, n介于9.154%~11.605%之间.精河DOM的主要成分是络氨酸类蛋白质与色氨酸类蛋白质. J-3采样点的络氨酸类蛋白质(39.099%)含量最高,上游J-6采样点类富里酸(3.183%)含量最低;而J-6采样点的溶解性微生物代谢产物相对含量高于J-3采样点,总体上看精河水体中类蛋白质是DOM的主要成分(图 3a).博尔塔拉河络氨酸类蛋白质P1, n相对较大的部分介于27.937%~35.239%之间,色氨酸类蛋白质P2, n变化范围在28.807%~30.962%之间,类富里酸P3, n相对较少的部分介于1.689%~7.159%之间,溶解性微生物代谢产物P4, n介于19.949%~21.72%之间,类腐殖酸P5, n在10.708%~18.398%之间.络氨酸类蛋白质与色氨酸类蛋白质是博尔塔拉河DOM的主要成分(图 3b).综上所述,精河与博尔塔拉河DOM的主要成分是类蛋白质有机质和溶解性微生物代谢产物,两条河流的DOM组分中,各个组分的相对含量具有一定的差异性但相差不大,说明精河与博尔塔拉河三维荧光特性相似.
2.2 主要入湖河流荧光指数荧光指数现在已被广泛应用,它能为认识DOM的组成和性质提供有效的信息.本文选取了一些常规的荧光指数描述水体的荧光指数特性(图 4).
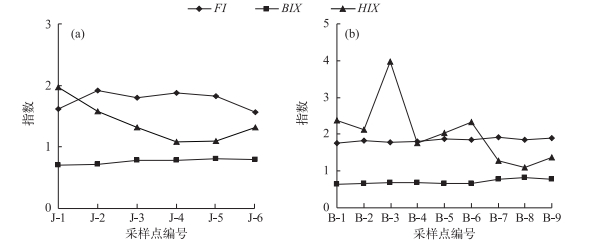
|
图 4 精河(a)与博尔塔拉河(b)各采样点荧光指数的变化 Fig.4 Changes of the fluorescence index of water samples in Jinghe River (a) and Bortala River (b) |
狭义的荧光指数(fluorescence index, FI)定义为370 nm激发波长下,发射波长在470和520 nm处的荧光强度比值,该值在1.4左右代表陆地或土壤源输入,而在1.9左右代表微生物活动引起的自生来源,用来区分DOM的不同来源[22].精河水质FI在1.6~2.0之间;博尔塔拉河FI变幅更小,呈一条水平直线的趋势.两条河流的FI值都在1.8左右波动,说明两条河流中微生物活动是DOM组分转化的主要驱动力.
自生源指数(biological index,BIX)定义为254 nm激发波长下,发射波长在380和430 nm处的荧光强度比值. BIX>1代表生物或细菌引起的自生来源,而介于0.6~0.7之间代表陆地源输入或受人类影响较大, 是反映DOM中自生贡献比例的指标[23].精河与博尔塔拉河水质的BIX均在0.6~0.8之间,表明河水中腐殖质来源主要受到人类活动的影响,可能与人类的耕种、施肥、灌溉等活动紧密相关.
腐殖化指数(humification index,HIX)定义为254 nm激发波长下,发射波长在435~480 nm与300~345 nm波段内的荧光强度平均值的比值. HIX<4时,说明DOM腐殖化程度较弱,而高达10~16时,则说明DOM具有显著的腐殖质特征[22].博尔塔拉河水质的HXI变幅较大,但总体上都小于4;精河水质HIX均小于4,说明精河与博尔塔拉河DOM组分腐殖化程度均较弱.综上所述,精河与博尔塔拉河水质主要受到人类活动及微生物活动的影响.
2.3 主要入湖河流水质现状对精河6个采样点和博尔塔拉河9个采样点的水质状况进行分析发现,精河与博尔塔拉河的pH变化范围均在7.93~8.20之间,即河水呈弱碱性.精河BOD5浓度低于博尔塔拉河,且变幅小.精河与博尔塔拉河COD浓度相差不大,COD均值与中位数重叠,说明这两条河流水体COD浓度变化不大.博尔塔拉河NH4+-N浓度平均值大于精河,且变幅较大(图 5).
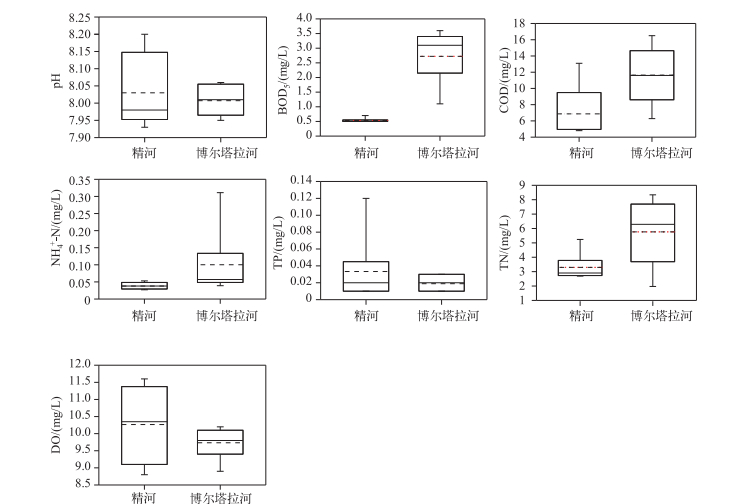
|
图 5 精河与博尔塔拉河水质参数统计描述(虚线代表平均值) Fig.5 Statistical description of water quality parameters in Jinghe River and Bortala River |
河水中TN、TP浓度是影响水体富营养化的主要因素.精河河水中TP浓度相对博尔塔拉河的高,而博尔塔拉河水体TN浓度比精河的高(图 5),且均超出了国家《地表水环境质量标准》(GB 3838—2002)Ⅴ类水域功能标准.这两条河流水体中TN浓度普遍较高可能是因为雨水冲刷岸边土壤以及农作物施肥.这两条河流水体中DO浓度普遍较高,超出了国家《地表水环境质量标准》中DO标准4倍多.
2.4 主要入湖河流水质参数与荧光指数的关系为了探讨水质参数与荧光指数的关系,对主要入湖河流精河与博尔塔拉河的水质参数与荧光指数进行相关分析.结果(表 1)表明,BIX与TN浓度以及HIX与NH4+-N浓度的相关性较强,相关系数R分别为0.831和0.684,均呈显著相关(P<0.01);HIX与TN浓度的R为0.604,呈显著相关(P<0.05). BIX与水质参数(pH、BOD5、COD、NH4+-N、TP、TN)之间均呈负相关,仅与TN浓度的相关性显著. BIX反映DOM腐殖质来源与人类活动有关,说明人类活动对河流TN浓度有影响. HIX与水质参数(pH、BOD5、COD、NH4+-N、TP、TN)均呈正相关,仅与NH4+-N以及TN浓度相关性显著. HIX的大小反映DOM组分腐殖化程度,说明河流NH4+-N和TN浓度与河流中有机质腐殖化的强弱有关.
| 表 1 水质参数与荧光指数相关性矩阵 Tab.1 Correlation matrix of water quality parameters and fluorescence indexes |
针对表 1中荧光指数与水质参数具有显著性相关,首先选取与荧光指数呈显著相关的水质参数,再将荧光指数分别与水质参数进行3次函数拟合(图 6).可以看出HIX与NH4+-N浓度的3次拟合关系最好,且呈显著相关(R=0.908,P<0.01).其次为BIX与TN浓度,呈显著负相关(R=0.844,P<0.01).而HIX与TN浓度的3次拟合关系一般(R=0.678,P<0.05).
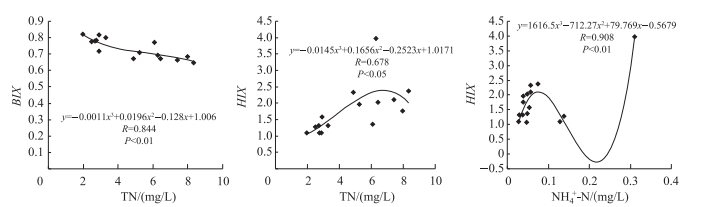
|
图 6 水质参数与荧光指数的关系 Fig.6 Relationship between water quality parameters and fluorescence indexes |
本文首次尝试探讨荧光指数与水质参数的关系,结果表明主要入湖河流3种荧光指数之间仅有BIX与HIX呈现显著负相关. BIX反映的是DOM中腐殖质有机质的来源,而HIX反映的是DOM腐殖化程度的强弱,所以河流DOM中腐殖质的来源与DOM腐殖化程度没有直接关系. FI被用于指示DOM中腐殖质的来源[24],主要入湖河流的FI值在1.8左右(图 6),说明河流DOM中的腐殖质主要是由微生物活动引起的;BIX均小于1,说明主要入湖河流的腐殖质来源受到了人类活动的影响.然而FI与BIX和HIX无显著相关性,说明河流中微生物的活动与DOM组分腐殖化强弱无关,与人类活动也没有直接关系. HIX与NH4+-N和TN浓度呈显著正相关,说明腐殖化程度的强弱与氮元素的迁移、转化活动紧密相关. BIX与TN浓度呈显著负相关,说明氮元素的转化、迁移去向与腐殖质的来源不同.总而言之,主要入湖河流的荧光指数与水质参数确实存在某种关系,本文对3种荧光指数与水质参数的研究存在单一性,不能全面说明荧光指数与多种水质参数的耦合关系,需进一步开展深入研究.
致谢: 感谢艾比湖国家级湿地自然保护区陈丽华等工作人员的帮助,以及在稿件修改中得到了杨建英老师的帮助,在此致以诚挚的感谢!| [1] |
Wang Chouming, Zhang Yi, Shi Huihua et al. Macrozoobenthic community structure and bioassessment of water quality in Lake Dongting. J Lake Sci, 2016, 28(2): 395-404. [王丑明, 张屹, 石慧华等. 洞庭湖大型底栖动物群落结构和水质评价. 湖泊科学, 2016, 28(2): 395-404. DOI:10.18307/2016.0220] |
| [2] |
Liu Meng, Chen Shijian. Ground water quality assessment of Hong hu Area based on the Nemerow Index and principal component analysis method. Journal of Central China Normal University:Nat. Sci., 2016, 50(4): 633-640. [刘萌, 陈世俭. 基于内梅罗指数与主成分分析的洪湖地区地下水水质评价. 华中师范大学学报:自然科学版, 2016, 50(4): 633-640.] |
| [3] |
Zhu Yuanyuan, Tian Jinjun, Li Hongliang et al. Water qaulity assessment and pollution profile identification of Danjiangkou Reservoir, China. Journal of Agro-Environment Science, 2016, 35(1): 139-147. [朱媛媛, 田进军, 李红亮等. 丹江口水库水质评价及水污染特征. 农业环境科学学报, 2016, 35(1): 139-147. DOI:10.11654/jaes.2016.01.019] |
| [4] |
Wu J, Pons MN, Potier O. Waste water fingerprinting by UV-visible and synchronous fluorescence spectroscopy. Water Science and Technology, 2006, 53(4/5): 449-456. |
| [5] |
Baker A, Inverarity R, Charlton M et al. Detecting river pollution using fluorescence spectrophotometry:Case studies from the Ousebum NE England. Environ Pollut, 2003, 124(1): 57-70. DOI:10.1016/S0269-7491(02)00408-6 |
| [6] |
Baker A. Fluorescence properties of some farm wastes:Implications for water quality monitoring. Water Research, 2002(1): 189-195. |
| [7] |
Zhang YL, Yin Y, Feng LQ et al. Characterizing chromophoric dissolved organic matter in Lake Tianmuhu and its catchment basin using excitation-emission matrix fluorescence and parallel factor analysis. Water Research, 2011, 45(16): 5110-5122. DOI:10.1016/j.watres.2011.07.014 |
| [8] |
Goldman JH, Rounds SA, Needoba JA. Applications of fluorescence spectroscopy for predicting percent wastewater in an urban stream. Environmental Science & Technology, 2012, 46(8): 4374-4381. |
| [9] |
Yu HB, Song YH, Tu X et al. Assessing removal efficiency of dissolved organic matter in wastewater treatment using fluorescence excitation emission matrices with parallel factor analysis and second derivative synchronous fluorescence. Bioresource Technology, 2013, 144: 595-601. DOI:10.1016/j.biortech.2013.07.025 |
| [10] |
Wu H, Zhou Z, Zhang Y et al. Fluorescence-based rapid assessment of the biological stability of landfilled municipal solid waste. Bioresource Technology, 2012, 110(2): 174-183. |
| [11] |
He XS, Xi BD, Wei ZM et al. Fluorescence excitation-emission matrix spectroscopy with regional integration analysis for characterizing composition and transformation of dissolved organic matter in landfill leachates. Journal of Hazardous Materials, 2011, 190(1/2/3): 293. |
| [12] |
Zhang F, Tiyip T, Johnson VC et al. Evaluation of land desertification from 1990 to 2010 and its causes in Ebinur Lake region, Xinjiang China. Environ Earth Sci, 2015, 73(9): 5731-5745. DOI:10.1007/s12665-014-3830-4 |
| [13] |
Wang Shuhang, Wang Wenwen, Jiang Xia et al. Distribution of chromophoric dissolved organic matter in Li hu Lake using excitation-emission matrix fluorescence and parallel factor analysis. China Environmental Science, 2016, 36(2): 517-524. [王书航, 王雯雯, 姜霞等. 基于三维荧光光谱平行因子分析技术的蠡湖CDOM分布特征. 中国环境科学, 2016, 36(2): 517-524.] |
| [14] |
Huguet A, Vacher L, Relexans S et al. Properties of fluorescentdissolved organic matter in the Gironde Estuary. Organic Geochemistry, 2009, 40(6): 706-719. DOI:10.1016/j.orggeochem.2009.03.002 |
| [15] |
Chen W, Westerhoff P, Leenheer JA et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter. Environmental Science & Technology, 2003, 37(24): 5701-5710. |
| [16] |
Jin H, Cho J. Prediction of BOD, COD, and total nitrogen concentrations in a typical urban river using a fluorescence excitation-emission matrix with PARAFAC and UV absorption indices. Sensors, 2012, 12: 972-986. DOI:10.3390/s120100972 |
| [17] |
Cheng Qinglin, Zheng Binghui, Wang Shengrui et al. Optical signatures of chromophoric dissolved organic matter in water body of Tien Lake. Spectroscopy and Spectral Analysis, 2014, 34(3): 698-703. [程庆霖, 郑丙辉, 王圣瑞等. 滇池水体有色溶解性有机质(CDOM)三维荧光光谱特征. 光谱学与光谱分析, 2014, 34(3): 698-703.] |
| [18] |
Feng Weiying, Wang Shengrui, Zhang Sheng. Effect of pH on the fluorescence characteristics of dissolved organic matter in the sediment and overlying water from Erhai Lake. Environmental Chemistry, 2014, 33(2): 229-235. [冯伟莹, 王圣瑞, 张生. pH对洱海沉积物-上覆水溶解性有机质荧光特征影响. 环境化学, 2014, 33(2): 229-235. DOI:10.7524/j.issn.0254-6108.2014.02.022] |
| [19] |
Ma Lina, Zhang Hui, Tan Wenbing et al. Evolution of dissolved organic matter properties in a constructed wetland of Xiao River, Hebei. Spectroscopy and Spectral Analysis, 2016, 36(1): 206-212. [马丽娜, 张慧, 檀文炳. 河北洨河人工湿地水体溶解性有机物性质的演化过程研究. 光谱学与光谱析, 2016, 36(1): 206-212.] |
| [20] |
Wang Qilei, Jiang Tao, Zhao Zheng et al. Spectral characteristics of dissolved organic matter (DOM) in waters of typical agricultural watershed of Three Gorges Reservoir areas. Environmental Chemistry, 2016, 37(6): 2082-2092. [王齐磊, 江韬, 赵铮等. 三峡库区典型农业小流域水体中溶解性有机质的光谱特征. 环境科学, 2016, 37(6): 2082-2092.] |
| [21] |
Vodacek A, Hoge FE, Swift RN et al. The in situ and airborne fluorescence measurements to determine UV absorption coefficients and DOC concentrations in surface waters. Limnology and Oceanography, 1995, 40(2): 411-415. DOI:10.4319/lo.1995.40.2.0411 |
| [22] |
Cory RM, McKnight DM. Fluorescence spectroscopy reveals biquitous presence of oxidized and reduced quinones in dissolved organic matter. Environmental Science & Technology, 2005, 39(21): 8142-8149. |
| [23] |
Wang Z, Wu Z, Tang S. Characterization of dissolved organic matter in a submerged membrane bioreactor by using threedimensional excitation and emission matrix fluorescence spectroscopy. Water Research, 2009, 43: 1533-1540. DOI:10.1016/j.watres.2008.12.033 |
| [24] |
Mc Knight DM, Boyer EW, Westerhoff PK et al. Spectro fluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity. Limnology and Oceanography, 2001, 46(1): 38-48. DOI:10.4319/lo.2001.46.1.0038 |
 2017, Vol. 29
2017, Vol. 29 


