(2: 水利部南京水利水文自动化研究所, 南京 210012)
(2: Nanjing Automation Institute of Water Conservancy and Hydrology, Nanjing 210012, P. R. China)
面对蓝藻水华频繁暴发的世界性难题,各国均在努力探索治理方法.目前,控制蓝藻水华的方法主要有化学药剂杀藻、混凝剂沉降、营养盐控制和生物操纵抑制等[1-3].同时,一些新兴除藻技术也应运而生.近十多年来超声波控藻技术受到关注,并被认为具备良好前景[4-6].超声波在水介质产生的“空化效应”、微射流和自由基,可使藻细胞造成机械和声化学损害[7-8].首先,超声处理能够直接破坏藻类光合系统,降低其光合活性.研究表明铜绿微囊藻(Microcystis aeruginosa)在超声处理下,其光合系统将产生瞬时危害[9].这可能是因为蓝藻细胞体内的光合色素遭到了破坏,从而光合活性降低[10].然而,现有研究多基于实验室培养的单细胞铜绿微囊藻,而微囊藻群体因细胞内不同光合色素含量的差异使得其最大光能转化效率比单胞微囊藻高出2.32~2.41倍[11].这种差异或许会影响微囊藻群体对超声波的响应差异.此外,超声处理解除后藻类生理变化情况也同样值得关注,然而目前对超声处理后的藻细胞活性恢复过程的研究较少.因此有必要进一步研究微囊藻群体在超声波处理下光合活性的变化及超声解除后的恢复情况.另外,超声波能够通过破坏蓝藻细胞内的伪空胞来实现沉降控藻.研究发现,在28 kHz、120 W的超声条件下,伪空胞在仅3 s的超声处理后即发生破裂,迫使80 %的藻细胞发生沉降[9].然而,经超声破碎的伪空胞结构在适宜的条件下能够重新恢复. Rodriguez-Molares等[12]定量检测了超声处理对铜绿微囊藻的沉降作用,分析了伪空胞的再生过程.此外,微囊藻群体的粒径要比单细胞微囊藻大很多倍,根据斯托克斯公式:v=[2(ρ-ρ0)r2/9η]·g(v为颗粒迁移速率,ρ和ρ0分别为颗粒与介质的密度,r为颗粒半径,η为介质的粘滞系数,g为重力加速度),藻类粒径的平方与其在静水中垂向迁移速率呈正相关[12].因此以微囊藻群体为对象,研究其在超声处理时的沉降过程及超声解除后的浮力恢复过程具有重要实践意义,可以提高超声控藻的彻底性和针对性.
1 材料与方法 1.1 实验材料 1.1.1 微囊藻群体2015年7月3日,采集太湖梅梁湾(31°24′N, 120°13′E)水下0.5 m处的藻样,过0.15 mm孔径的筛网,选取留在筛网上的大群体微囊藻,镜检发现大群体微囊藻以铜绿微囊藻为主.采用筛选后的微囊藻配制藻细胞悬液用于实验(藻悬液的叶绿素a浓度为1.18 μg/ml).
1.1.2 超声装置采用的小型超声发生装置见图 1,频率设定为35 kHz, 温度维持在25℃.超声强度采用Mason等[13]使用的热量法测定.即200 ml蒸馏水置于400 ml烧杯中,持续超声5 min,分别在0、1、2、3、4和5 min时测定水温.每个数值测量3次并计算平均值,超声强度计算公式为:

|
图 1 超声装置示意图 Fig.1 Ultrasonic device |
| $ P = \frac{{{\rm{d}}T}}{{{\rm{d}}t}}Cp \cdot M $ | (1) |
| $ UI = P/V $ | (2) |
式中,P为输入功率(W),UI为超声强度(W/cm3),V为溶液体积(ml),T为温度(℃),t为超声处理时间(s),Cp为常压下25℃时水的比热容(4.18 J/(kg·K)),M为水的质量(kg).通过计算,该装置的超声强度为0.0353 W/cm3.
1.2 实验方法 1.2.1 超声处理及培养本研究控制超声处理时间和处理后的培养时间2个变量.分别取200 ml上述藻悬液置于400 ml烧杯中,超声处理5、30、60、300 s,另外设置空白对照组.随后将藻样转至玻璃试管中,置于光照培养箱内静置培养96 h.培养光强为30 μmol (photons)/(m2·s),温度为25℃,光暗比为12 h :12 h.以上每个处理设置3个平行.
1.2.2 光合活性测定藻类活体叶绿素荧光通常用来表征藻类光合活性,经过暗适应的藻细胞在低强度测量光条件下会发出初始荧光Fo,经过饱和脉冲高光强后发出最大荧光Fm,随后计算Fv/Fm = (Fm-Fo)/Fm.该比值表示光系统Ⅱ原初反应的最大量子产率,即原初反应的最大光化学效率[14].本研究采用Fv/Fm表征藻细胞的光合活性.分别取培养0、1、3、6、24、48、72、96 h后藻悬液2 ml,暗适应20 min,采用AquaPen-C AP-C 100叶绿素荧光仪(饱和脉冲光强为3200 μmol (photons)/(m2·s))测定藻细胞叶绿素a荧光,并计算Fv/Fm.
1.2.3 叶绿素a浓度测定胞内叶绿素a浓度参照《水和废水监测分析方法》[15]进行测定.分别取培养0、0.5、24、48、72、96 h后的藻悬液测定其叶绿素a浓度.其中培养0 h的样品为超声处理摇匀后即时测定;而其余藻样采取分层测定,即取上层45 ml藻悬液作为悬浮或漂浮藻细胞叶绿素a浓度,底层5 ml藻液作为沉降藻细胞叶绿素a浓度.计算叶绿素a浓度垂直分布比例.此外,采用光学显微镜根据Reynolds等[16]的方法对超声处理前后及恢复培养过程中藻细胞浓度进行检测.
1.3 数据分析文中数据均以3次平行实验的平均值和标准差表示.采用SPSS 19.0软件对不同超声处理时间和培养时间的实验结果的差异显著性进行单因素方差分析(One-way ANOVA),显著性水平设为P < 0.05.
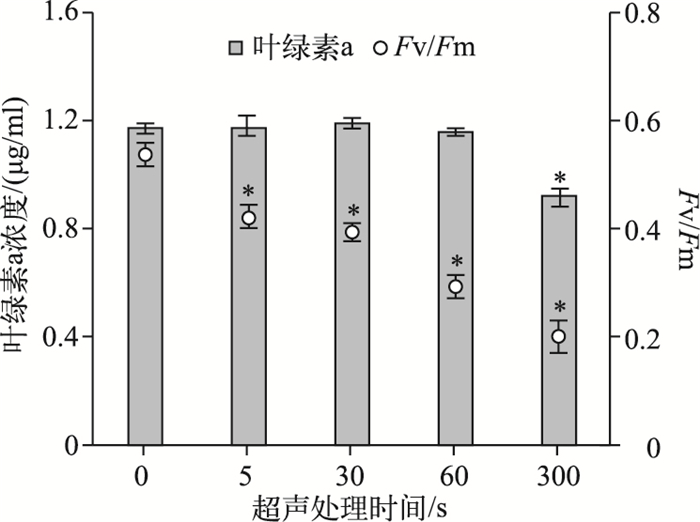
2 结果 2.1 超声处理对微囊藻群体光合活性的瞬时抑制作用藻细胞光合活性随处理时间延长而快速降低,其中超声处理60 s和300 s的藻细胞光合活性分别降低了45.5 %和62.8 % (图 2).此外,当超声处理时间少于60 s时,胞内叶绿素a浓度没有发生明显变化.而处理时间延长至300 s,胞内叶绿素a浓度下降了22.1 %.
|
图 2 不同超声处理时间对微囊藻群体光合活性和叶绿素a浓度的影响(*表示在P < 0.05水平差异显著) Fig.2 Instant damages to Microcystis colonies indicated by photosynthetic activities and chlorophyll-a concentration under ultrasound treatment for different time (* indicated the significant level of P < 0.05) |
对照组的光合活性在培养过程中波动很小(Fv/Fm为0.55左右).而超声处理5 s的藻细胞光合活性相对于对照组降低了20 %左右,且在培养96 h内没有恢复至对照组水平.其余实验组中,藻细胞受抑制的光合活性能在24 h内快速恢复至超声处理5 s的水平(图 3).

|
图 3 不同超声处理时间后微囊藻群体光合活性的恢复情况 Fig.3 Effect of different exposure time on the recovery process of photosynthetic activities of Microcystis colonies |
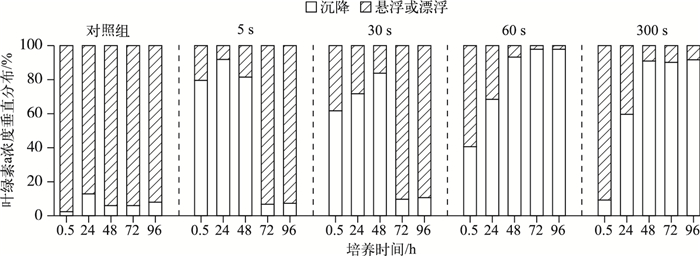
在实验过程中,对照组的绝大多数藻细胞漂浮或悬浮在水柱中(图 4).对超声处理组而言,短时间(0.5 h)培养后,水柱中叶绿素a去除率随处理时间的延长而逐渐降低,且去除率最大的为5 s超声组(79.5 %).然而,恢复培养至72 h,5 s或30 s超声处理组的藻细胞又大量(超过90 %)恢复浮力处于悬浮或漂浮状态,而经60 s和300 s超声处理的藻细胞则彻底丧失了上浮能力.
|
图 4 不同超声处理时间对微囊藻群体沉降及浮力恢复过程的影响 Fig.4 Effect of different exposure time on the sedimentation character of Microcystis colonies and their recovery processes of floatation |
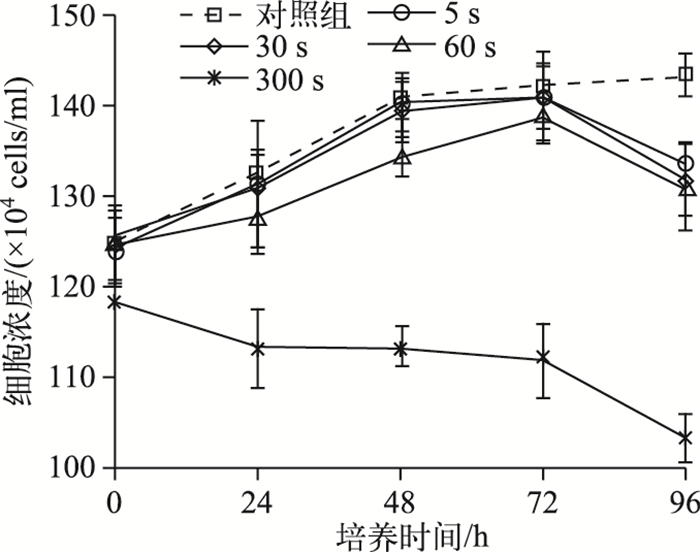
不同超声处理时间对微囊藻细胞生长的抑制作用可知,超声处理60 s时能在不造成藻细胞瞬时破碎的情况下抑制藻细胞生长; 而超声处理300 s可能造成了藻细胞瞬时破裂,使得整个培养过程中藻细胞浓度持续降低(图 5).
|
图 5 不同超声处理时间对微囊藻细胞生长的抑制作用 Fig.5 Effect of different exposure time on the growth of Microcystis cells |
高等植物和藻类进行光合作用时,光合系统的捕光色素复合体首先捕获光量子后被激发.在PSⅡ处于开放状态时,激发后的能量大部分传递到反应中心用于光化学反应和驱动电子传递链,小部分以荧光和热能散失.当PSⅡ受损时,传递到反应中心的能量就会降低,根据能量守恒定律,此时以荧光和热散失的能量就会上升.因此通过测定叶绿素荧光可以监测PSⅡ的反应情况,可表征藻细胞光合活性[14].通过实验发现超声处理在仅导致少量叶绿素a浓度降低时,微囊藻水华的光合活性就受到明显抑制(图 2).在35 kHz,0.0353 W/cm3的超声条件下,处理60 s和300 s分别导致叶绿素a浓度下降了0.7 %和22.1 %;而光合活性抑制率分别达到45.5 %和62.8 %.这说明在该条件下,60 s的超声处理在基本不破坏藻细胞的同时显著抑制其光合活性,而300 s的处理导致超过1/5的藻细胞发生破裂. Zhang等[10]采用25 kHz,0.32 W/cm3的超声装置,对250 ml铜绿微囊藻悬液超声处理300 s, 结果发现叶绿素a浓度、藻蓝素浓度和光合放氧率分别降低了21.3 %、44.8 %和40.5 %,与本研究取得相近的藻细胞抑制效果.但Zhang等[10]采用了大约是本研究9倍的超声强度,这说明超声处理对微囊藻群体的抑制作用比室内培养的单细胞微囊藻要剧烈得多.以下两个原因或许可以解释这种差异:1)水体中含有多种藻类,不同种属对超声波的敏感程度不同. Purcell等[17]发现同等超声条件下,丝状蓝藻——水华束丝藻(Aphanizomenon flos-aquae)的去除率为99 %,显著高于单细胞铜绿微囊藻(去除率为16 %). Rajasekhar等[18]也有类似发现,相对铜绿微囊藻而言,卷曲鱼腥藻(Anabaena circinalis)更容易被超声波破坏.此外,野外超声控藻发现超声波能够选择性地抑制水华蓝藻生长[19]. 2)相同藻种在野外和室内培养下存在形态和生理差异.微囊藻的群体形态和伪空胞结构对超声波的“空化效应”极其敏感,即使超声处理没有破碎细胞,也会将群体打散或者使伪空胞破裂.
3.2 光合活性恢复进一步研究发现,大部分受超声波抑制的光合活性能够在较短时间内恢复(图 3).超声处理30、60、300 s后光合活性分别在培养至1、3、24 h时恢复至对照组的80 %左右(图 3).而处理5 s的藻细胞在培养期间光合活性均维持在对照组的80 %左右,没有表现出明显的恢复阶段.这说明超声处理时间在5~300 s期间可能至少发生了两种完全不同的光合抑制机制.为便于分析,将超声处理5 s对微囊藻群体光合活性的抑制作用称为“瞬时超声光合活性抑制(Instant ultrasonic inhibition of photosynthetic activity;IUI-PA)”.这可以解释为部分光合系统Ⅱ的结构性受损而导致的抑制作用.首先,超声处理破坏了蓝藻细胞内捕光色素复合体——藻胆体.藻胆体是附着在类囊体膜上,具有光能量吸收和传递的功能单位,其捕获光量子后传递到类囊体膜上的反应中心,驱动光合系统运行[20].而藻胆体主要由藻胆蛋白组成,该蛋白在结构上为“空心棒状”,与伪空胞具有类似的空心结构[21-22],因此更容易在“空化效应”中迅速破损,降低光能利用效率[10].其次,有研究发现,超声处理能够造成类囊体片层断裂和部分藻胆体从类囊体膜上脱落,导致电子传递链受阻,降低光合效率[23].从本研究实验结果可知,IUI-PA在短时间超声处理内发生,需要较长时间恢复甚至不可逆转.另外,能够快速恢复的抑制称为“可恢复超声光合活性抑制(Renewable ultrasonic inhibition of photosynthetic activity;RUI-PA)”. RUI-PA或许与细胞膜或内囊体膜通透性的改变有关,Tang等[24]发现超声“空化效应”产生的自由基能够增加膜的通透性.
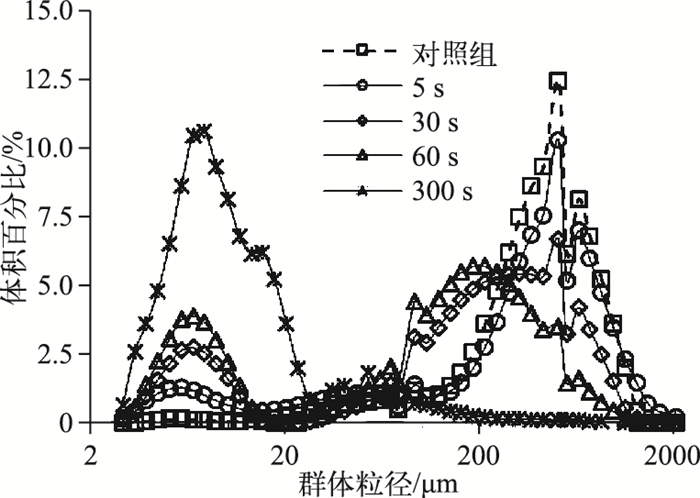
3.3 超声处理过程中的群体粒径变化微囊藻群体在超声处理后的下沉和上浮过程显示,超声处理后静置培养0.5 h后,5 s超声处理组的叶绿素a浓度去除率最大(为79.5 %),随着超声处理时间的延长,叶绿素a浓度的去除率(即藻细胞沉降速率)显著降低(图 4).为进一步分析产生该结果的原因,参考Li等[25]的方法分析超声处理对群体粒径的影响.结果显示,经5 s超声处理的微囊藻群体粒径分布与未处理的微囊藻群体相近,分布范围分别为180~1000 μm(占总生物量的71 %)和200~1000 μm(占总生物量的82 %).而随着超声处理时间的延长,超声能量的持续输入使得微囊藻大群体逐渐被振散为小群体或单细胞.超声处理300 s后,微囊藻群体粒径主要分布在3~22 μm(占总生物量的94 %)(图 6).有研究表明,在静水条件下,微囊藻群体的垂向迁移速率与群体粒径的平方呈显著正相关[26].因此实验组中经5 s超声处理后藻样叶绿素a浓度下降最快,且随着超声处理时间延长,叶绿素a浓度的去除速率显著降低.此外,微囊藻群体粒径分布也说明在超声场中藻细胞的伪空胞破裂发生在大量群体振散之前. Lee等[9]发现仅3 s的超声处理就能造成伪空胞破裂,导致80 %的藻细胞沉降.
|
图 6 不同时间超声处理后微囊藻群体的粒径分布 Fig.6 Effect of different exposure time on size distribution of Microcystis colonies |
Rodriguez-Molares等[12]在分析超声处理对室内培养铜绿微囊藻的沉降和伪空胞再生过程时发现破裂的伪空胞能在24 h内重新形成,但在恢复培养的1周内藻细胞未能获得浮力上浮; 伪空胞的重新恢复是破裂的伪空胞被同化以及新伪空胞的形成过程; 短时间内新形成的伪空胞在结构上和原有的伪空胞存在较大差异.因此,即使伪空胞得以形成,藻细胞依然无法获得足够的浮力上浮.而在本研究中,经5 s或30 s超声处理的微囊藻群体在培养72 h后又大量恢复浮力上浮(图 4).存在这种差异的原因可能主要是微囊藻水华与室内培养的微囊藻在形态结构和伪空胞数量上有明显差异.所以,超声处理后野外微囊藻水华的浮力恢复过程更快.
此外,在本研究中,经60 s或300 s超声处理后的藻细胞在整个培养过程中未能大量恢复浮力上浮(图 4).并且培养至96 h时,各实验组的微囊藻细胞浓度均显著下降(图 5),说明长时间(大于60 s)的超声处理对藻细胞损伤极大,出现大量衰亡,甚至会导致细胞破裂. Li等[27]将微囊藻群体经超声处理后(20~1100 kHz,30 W,360 s),在BG11中继续培养,120 h内未发现微囊藻群体恢复浮力上浮.因此,本研究的超声条件(35 kHz,0.0353 W/cm3)60 s的处理基本上能使微囊藻群体丧失上浮能力,同时保证了细胞完整性,避免了藻细胞破裂使水质恶化.如果使用60 s的间歇式多次超声处理就可以彻底使水华下沉,就能实现超声波控藻的安全环保,节能高效.
4 结论1) 本研究的超声条件下(35 kHz,0.0353 W/cm3),短时间(小于30 s)的超声处理能显著抑制微囊藻群体的光合活性,但超声解除后光合活性得到恢复.
2) 小于60 s的超声处理后,微囊藻群体的胞内叶绿素a浓度没有明显变化,不会造成藻细胞破裂.而较长时间的处理(大于300 s)使胞内叶绿素a浓度降低了22.1 %,会导致藻细胞明显破裂.小于30 s的超声处理后,下沉的藻细胞能在72 h的恢复培养过程中大量恢复浮力上浮,而经过60 s超声处理后,藻细胞基本丧失上浮能力.
3) 使用60 s的间歇式多次超声处理可以彻底使水华下沉,又避免了藻细胞破裂使水质恶化.
| [1] |
Ahn CY, Park MH, Joung SH et al. Growth inhibition of cyanobacteria by ultrasonic radiation:Laboratory and enclosure studies. Environmental Science & Technology, 2003, 37(13): 3031-3037. DOI:10.1021/es034048z |
| [2] |
Lee TJ, Nakano K, Matsumura M. A new method for the rapid evaluation of gas vacuoles regeneration and viability of cyanobacteria by flow cytometry. Biotechnology Letters, 2000, 22(23): 1833-1838. DOI:10.1023/A:1005653124437 |
| [3] |
Rajasekhar P, Fan LH, Nguyen T et al. A review of the use of sonication to control cyanobacterial blooms. Water Research, 2012, 46(14): 4319-4329. DOI:10.1016/j.watres.2012.05.054 |
| [4] |
Murray D, Parsons SA, Jarvis P et al. The impact of barley straw conditioning on the inhibition of Scenedesmus using chemostats. Water Research, 2010, 44(5): 1373-1380. DOI:10.1016/j.watres.2009.11.014 |
| [5] |
Mason TJ. Sonochemistry and the environment-providing a "green" link between chemistry, physics and engineering. Ultrasonics Sonochemistry, 2007, 14(4): 476-483. DOI:10.1016/j.ultsonch.2006.10.008 |
| [6] |
Purcell D, Parsons SA, Jefferson B et al. Experiences of algal bloom control using green solutions barley straw and ultrasound, an industry perspective. Water and Environment Journal, 2013, 27(2): 148-156. DOI:10.1111/j.1747-6593.2012.00338.x |
| [7] |
Hao HW, Wu MS, Chen YF et al. Cavitation mechanism in cyanobacterial growth inhibition by ultrasonic irradiation. Colloids and Surfaces B:Biointerfaces, 2004, 33(3/4): 151-156. DOI:10.1016/j.colsurfb.2003.09.003 |
| [8] |
Luo J, Fang Z, Smith Jr RL. Ultrasound-enhanced conversion of biomass to biofuels. Progress in Energy and Combustion Science, 2014, 41: 56-93. DOI:10.1016/j.pecs.2013.11.001 |
| [9] |
Lee T, Nakano K, Matsumara M. Ultrasonic irradiation for blue-green algae bloom control. Environmental Technology, 2001, 22(4): 383-390. DOI:10.1080/09593332208618270 |
| [10] |
Zhang GM, Zhang PY, Liu H et al. Ultrasonic damages on cyanobacterial photosynthesis. Ultrasonics Sonochemistry, 2006, 13(6): 501-505. DOI:10.1016/j.ultsonch.2005.11.001 |
| [11] |
Zhang M, Shi XL, Yu Y et al. The acclimative changes in photochemistry after colony formation of the cyanobacteria Microcystis aeruginosa. Journal of Phycology, 2011, 47(3): 524-532. DOI:10.1111/j.1529-8817.2011.00987.x |
| [12] |
Rodriguez-Molares A, Dickson S, Hobson P et al. Quantification of the ultrasound induced sedimentation of Microcystis aeruginosa. Ultrasonics Sonochemistry, 2014, 21(4): 1299-1304. DOI:10.1016/j.ultsonch.2014.01.027 |
| [13] |
Mason T, Lorimer J, Bates D. Quantifying sonochemistry:Casting some light on a 'black art'. Ultrasonics, 1992, 30(1): 40-42. DOI:10.1016/j.ultsonch.2014.01.027 |
| [14] |
Govindjee SA. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and Photosystem Ⅱ:Basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B:Biology, 2011, 104(1/2): 236-257. DOI:10.1016/j.jphotobiol.2010.12.010 |
| [15] |
"Water and wastewater monitoring and analysis method" editorial board of State Environmental Protection Administration of China ed. Monitoring and analysis methods of water and wastewater:Fourth edition. Beijing:China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002. ]
|
| [16] |
Reynolds C, Jaworski G. Enumeration of natural Microcystis populations. British Phycological Journal, 1978, 13(3): 269-277. DOI:10.1080/00071617800650331 |
| [17] |
Purcell D, Parsons SA, Jefferson B. The influence of ultrasound frequency and power, on the algal species Microcystis aeruginosa, Aphanizomenon flos-aquae, Scenedesmus subspicatus and Melosira sp.. Environmental Technology, 2013, 34(17): 2477-2490. DOI:10.1080/09593330.2013.773355 |
| [18] |
Rajasekhar P, Fan LH, Nguyen T et al. Impact of sonication at 20 kHz on Microcystis aeruginosa, Anabaena circinalis and Chlorella sp.. Water Research, 2012, 46(5): 1473-1481. DOI:10.1016/j.watres.2011.11.017 |
| [19] |
Ahn C, Joung SH, Choi A et al. Selective control of cyanobacteria in eutrophic pond by a combined device of ultrasonication and water pumps. Environmental Technology, 2007, 28(4): 371-379. DOI:10.1080/09593332808618800 |
| [20] |
Wang Guangce, Zeng Chengkui. Structure and function of phycobilisomes:A review. Acta Hydrobiologica Sinica, 1998, 12(4): 372-377. [王广策, 曾呈奎. 藻胆体结构与功能的研究概况. 水生生物学报, 1998, 12(4): 372-377.] |
| [21] |
MacColl R. Cyanobacterial phycobilisomes. Journal of Structural Biology, 1998, 124(2/3): 311-334. DOI:10.1006/jsbi.1998.4062 |
| [22] |
Zhang Nan. Investigation of the assembly mechanism and functional regulation of phycobilisomes-The light-harvesting complex of cyanobacterial photosynthesis[Dissertation]. Jinan:Shandong University, 2013. [张楠. 蓝藻光合作用捕光色素蛋白复合物——藻胆体的组装机制及功能调节[学位论文]. 济南: 山东大学, 2013. ]
|
| [23] |
Wan Li, Shao Lulu, Lu Kaihong et al. Effects of ultrasound wave on the ultrastructure and physiological characteristics of blue-green algae (Microcystis aeruginosa). Acta Hydrobiologica Sinica, 2014(3): 516-524. [万莉, 邵路路, 陆开宏等. 超声波对铜绿微囊藻超微结构和生理特性的影响. 水生生物学报, 2014(3): 516-524. DOI:10.7541/2014.73] |
| [24] |
Tang JW, Wu QY, Hao HW et al. Effect of 1.7 MHz ultrasound on a gas-vacuolate cyanobacterium and a gas-vacuole negative cyanobacterium. Colloids and Surfaces B:Biointerfaces, 2004, 36(2): 115-121. DOI:10.1016/j.colsurfb.2004.06.003 |
| [25] |
Li M, Zhu W, Gao L. Analysis of cell concentration, volume concentration, and colony size of Microcystis via laser particle analyzer. Environmental Management, 2014, 53(5): 947-958. DOI:10.1016/j.colsurfb.2004.06.003 |
| [26] |
Nakamura T, Adachi Y, Suzuki M. Flotation and sedimentation of a single Microcystis floc collected from surface bloom. Water Research, 1993, 27(6): 979-983. DOI:10.1016/0043-1354(93)90061-L |
| [27] |
Li JP, Long H, Song C et al. Study on the removal of algae from lake water and its attendant water quality changes using ultrasound. Desalination and Water Treatment, 2014, 52(25/26/27): 4762-4771. DOI:10.1080/19443994.2013.814384 |
 2017, Vol. 29
2017, Vol. 29 
