营养盐循环是生态系统自我维持的一个关键过程,而微生物被普遍认为在营养盐循环中扮演着重要的角色.然而,在过去几十年来,人们越来越认识到动物在营养盐再生中同样发挥着重要的作用[1],动物再生的营养盐在一些水体中甚至是浮游植物生长的主要营养盐来源[2-6].氮、磷是浮游植物生长的主要营养盐限制因子,浮游动物通过摄食与同化作用将水体中的氮、磷滞留在体内,然而通过排泄将氮和磷以生物可利用的形态释放到水体中为初级生产者利用.因此,对初级生产者而言,浮游动物本身就是一个比较大的营养盐库,而且这个库既可以是汇,也可以是源[7].
影响浮游动物营养盐排泄的因素包括个体大小、温度、浮游动物对营养盐的需求、食物的数量与质量等[8-10].由于代谢速率与个体大小间的异速比例关系,对于同一种类而言,单位生物量营养盐排泄率随着个体的增大而下降;温度上升导致的代谢速率的加快使营养盐排泄率相应上升.体内氮磷比是反映浮游动物对氮磷需求的一个重要参数,种内差异小,种间差异大[10].由于体内氮磷比差异比较大,对氮、磷需求量的不同,不同种类氮、磷排泄率差异较大,小个体种类排泄率甚至超过大个体种类[9].在温带地区,溞属通常被认为具有低氮磷比和低磷排泄率特征,是磷汇;相反,剑水蚤被认为具有高氮磷比和低磷同化速率特征,倾向成为浮游植物的磷源[9, 11-12].
在我国热带和南亚热带地区,浮游动物以小型枝角类、桡足类或轮虫为优势,单位磷承载的浮游植物生物量明显高于温带地区[13].小型枝角类通常以脆弱象鼻溞(Bosmina fatalis)、颈沟基合溞(Bosminopsis deitersi)、奥氏秀体溞(Diaphanosoma orghidani)或微型裸腹溞(Moina micrura)为优势种类;桡足类以舌状叶镖水蚤(Phyllodiaptomus tunguidus)、温中剑水蚤(Mesocyclops thermocyclopoides)或博平近剑水蚤(Tropocyclops bopingi)为优势种类;轮虫以萼花臂尾轮虫(Brachionus calyciflrous)、前节晶囊轮虫(Asplanchna priodonta)或螺形龟甲轮虫(Keratella cochlearis)为优势种类[13-14].由于浮游动物种类组成的地区性差异以及氮磷含量的种间差异,假设我国热带和南亚热带地区高的单位磷承载的浮游植物生物量是由于浮游动物具有高的磷排泄率及低的排泄氮磷比.本文测定我国南亚热带水体中七种常见的浮游动物:中华拟同型溞(Daphnia similoides sinensis)、微型裸腹溞、颈沟基合溞、舌状叶镖水蚤、温中剑水蚤、前节晶囊轮虫和萼花臂尾轮虫的氮、磷含量以及在不同温度条件下的氮、磷排泄率,比较分析营养盐排泄率的种类差异以及体内氮磷含量对营养盐排泄率的影响.
1 材料与方法 1.1 实验对象舌状叶镖水蚤和温中剑水蚤采自广州流溪河水库;微型裸腹溞、颈沟基合溞、前节晶囊轮虫和萼花臂尾轮虫采自开平镇海水库;中华拟同型溞采自暨南大学浅水人工湖.在实验室分离并单种培养,喂以用BGII培养基在25℃下培养的蛋白核小球藻(Chlorella pyrenoidosa)(干重(DW)氮含量8 %,氮磷原子比为42:1).实验前,选取状态良好,体长分别为1.82±0.18、1.28±0.12、1.05±0.09、0.80±0.10、0.25±0.03、0.48±0.07和0.19±0.03 mm的中华拟同型溞、舌状叶镖水蚤、温中剑水蚤、微型裸腹溞、颈沟基合溞、前节晶囊轮虫和萼花臂尾轮虫,于德国MMM Climacell 222型人工气候箱内在拟实验温度下驯化1 h,喂以106cells/ml的蛋白核小球藻,以减少饥饿对动物营养盐排泄的影响.
1.2 实验方案实验设计了15、18、21、24、27和30℃共6个温度,每个温度设3个平行.中华拟同型溞、舌状叶镖水蚤、温中剑水蚤、微型裸腹溞、颈沟基合溞、前节晶囊轮虫和萼花臂尾轮虫每个平行实验个体数分别为70、70、100、120、200、500和800只.实验进行时,先将驯养过的浮游动物过滤到40 μm筛绢上,分别用拟实验温度的不含氮和磷的蒸馏水轻轻冲洗数次,除去动物体上黏附的藻类.将清洗过的动物转移至实验烧杯内,用拟实验温度的不含氮和磷的蒸馏水定容到100 ml.在Climacell 222型人工气候箱设定温度下无光放置0.5 h.
1.3 排泄率和体内氮、磷含量的测定浮游动物通过排遗和排泄这两个过程向水体提供营养盐.但是,排遗的营养盐是颗粒态,并不能被浮游植物直接利用,而排泄的营养盐是溶解态,能被浮游植物直接利用.浮游动物排泄的磷是溶解态无机磷,排泄的氮则包括溶解态无机氮和有机氮[10].由于本实验只分析浮游动物的排泄率,因此,在实验结束后,用0.45 μm滤膜过滤,测定滤水溶解态无机磷(DIP)和总溶解态氮(TDN)浓度,根据公式:排泄率=(结束时营养盐浓度-空白对照营养盐浓度)×实验用水体积/(实验动物干重×实验时间)计算排泄率;滤膜上的动物烘干测定干重以及体内氮磷含量.分别采用钼酸铵分光光度法(GB 11893—1989)和碱性过硫酸钾消解紫外分光光度法(GB 11894—1989)测定DIP和TDN浓度.测定浮游动物体内氮、磷含量时,先用碱性过硫酸钾将样品消解,再用上述相应方法测定.
1.4 数据处理与分析用双因素方差分析方法分析温度和浮游动物种类对氮、磷排泄率和排泄氮磷比值的影响;用Turkey多重比较方法比较分析氮、磷排泄率和排泄氮磷比值在各温度条件下以及各种类间是否存在显著差异.采用向前和向后逐步回归分析方法从个体生物量、温度、体内氮含量、体内磷含量和体内氮磷比这5个变量中筛选出显著影响氮、磷排泄率和排泄氮磷比的变量,获取筛选出来的变量对氮、磷排泄率和排泄氮磷比变化的解释率和回归方程.在此基础上,采用变差分解方法将解释率分解成各变量单独解释部分和共同解释部分,并检验各单独解释部分是否有统计意义.以上所有的统计分析均在R 3.2.5软件中用arm和vegan程序包进行.
2 结果与分析 2.1 浮游动物氮、磷含量7种浮游动物个体干重为0.6~18.3 μg,由小到大依次为萼花臂尾轮虫、颈沟基合溞、前节晶囊轮虫、微型裸腹溞、温中剑水蚤、舌状叶镖水蚤和中华拟同型溞.干重磷含量为0.49 % ~2.42 %,由小到大依次为前节晶囊轮虫、颈沟基合溞、萼花臂尾轮虫、微型裸腹溞、舌状叶镖水蚤、温中剑水蚤和中华拟同型溞.单位干重磷含量与个体干重呈显著正相关关系(R2=0.74,P=0.01).干重氮含量为5.12 % ~15.35 %,由小到大依次为前节晶囊轮虫、舌状叶镖水蚤、颈沟基合溞、萼花臂尾轮虫、中华拟同型溞、温中剑水蚤和微型裸腹溞.单位干重氮含量与个体干重的相关性不显著(R2=0.03,P=0.70).氮磷比值为11.5~43.0,由小到大依次为中华拟同型溞、舌状叶镖水蚤、温中剑水蚤、前节晶囊轮虫、萼花臂尾轮虫、微型裸腹溞和颈沟基合溞.体内氮磷比与个体干重的相关性不显著(R2=0.53,P=0.06).
2.2 磷排泄率7种浮游动物磷排泄率为0.31~2.05 μg/(mg(DW)·h)(表 1),双因素方差分析表明磷排泄率在种类间及不同温度间均存在显著差异,种类与温度交互作用不显著(表 2).磷排泄率由小到大依次为中华拟同型溞、舌状叶镖水蚤、前节晶囊轮虫、萼花臂尾轮虫、温中剑水蚤、微型裸腹溞和颈沟基合溞.除颈沟基合溞磷排泄率与温度相关性不显著外(R2=0.20, P=0.06),中华拟同型溞(R2=0.66, P<0.001)、舌状叶镖水蚤(R2=0.57, P<0.001)、前节晶囊轮虫(R2=0.73, P<0.001)、萼花臂尾轮虫(R2=0.35, P=0.01)、温中剑水蚤(R2=0.54, P<0.001)和微型裸腹溞(R2=0.43, P=0.003)磷排泄率均与温度呈显著正相关.将7种浮游动物的磷排泄率(DIP,μg/(mg(DW)·h))与温度(T)和个体干重(DW,mg)进行回归,方程为:DIP=0.80+0.024 T-0.051 DW,校正R2为0.49,P<0.001.但是,逐步回归分析表明,除了温度和个体干重影响磷排泄率外,体内氮磷比(N:P)也是影响磷排泄的重要变量(DIP=-0.004+0.024 T-0.018 DW+0.024 N:P,校正R2为0.65,P<0.001)(图 1).对温度、个体干重和体内氮磷比3个变量总解释率的变差分解的结果表明,个体体重与体内氮磷比2个变量对磷排泄率的共同解释部分(0.404)最大,其次为体内氮磷比单独解释部分(0.162),温度和个体体重这2个变量对磷排泄率的单独解释部分分别为0.068(P<0.001)和0.021(P<0.01),虽然也具有显著的统计学意义,但远小于体内氮磷比的单独解释部分(图 1d).
| 表 1 7种浮游动物在6个温度条件下的氮和磷排泄率(μg/(mg(DW)·h)) Tab.1 Excretion rates of TDN and DIP of seven zooplanktons at six temperatures |
| 表 2 温度和浮游动物种类对营养盐排泄率影响的双因素方差分析 Tab.2 Two-way ANOVA results for the effect of temperature and species on nutrient excretion rates |

|
图 1 浮游动物磷排泄速率与温度、个体干重和体内氮磷比的双变量散点图(a~c)及温度、个体干重和体内氮磷比对磷排泄率解释率的变差分解图(d,**P<0.01,***P<0.001) Fig.1 DIP excretion rate versus temperature, body weight and body N :P ratio (a-c) and Venn diagram of the variation partitioning explained by temperature, body weight and body N :P ratio (d,**P < 0.01,***P < 0.001) |
7种浮游动物氮排泄率为24~256 μg/(mg(DW)·h)(表 1),双因素方差分析表明氮排泄率在种类间及不同温度间均存在显著差异,而且种类与温度存在显著的交互作用(表 2).多重比较分析表明,中华拟同型溞氮排泄率在各温度条件下均显著小于其它6种浮游动物,而颈沟基合溞在高温条件下显著高于其它种类(表 1).中华拟同型溞(R2=0.85, P<0.001)、舌状叶镖水蚤(R2=0.72, P<0.001)、前节晶囊轮虫(R2=0.82, P<0.001)、萼花臂尾轮虫(R2=0.43, P=0.003)、温中剑水蚤(R2=0.70, P<0.001)、微型裸腹溞(R2=0.78, P=0.003)和颈沟基合溞(R2=0.88, P<0.001)氮排泄率均与温度呈显著正相关.如果将7种浮游动物的数据一起分析,逐步回归分析表明,氮排泄率(TDN,μg/(mg(DW)·h))只与温度和个体干重呈显著相关,方程为:TDN=16.86+5.05 T-5.40 DW,校正R2为0.56,P<0.001(图 2),与体内氮磷比及氮含量相关性不显著.对温度和个体干重2个变量总解释率的变差分解结果表明,个体干重与温度2个变量对氮排泄率的单独解释部分均具有非常显著的统计学意义,但体重单独解释部分高于温度(图 2c).
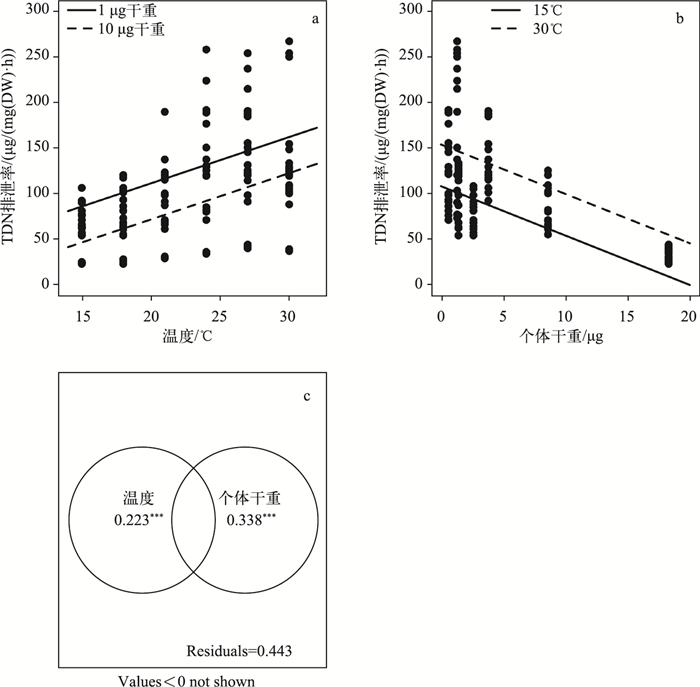
|
图 2 浮游动物氮排泄速率与温度和个体干重的双变量散点图(a~b)以及温度和个体干重对氮排泄率解释率的变差分解图(c,***P<0.001) Fig.2 TDN excretion rate versus temperature and body weight (a and b) and Venn diagram of the variation partitioning explained by temperature and body weight (c,***P < 0.001) |
7种浮游动物排泄的氮磷原子比为112~352(表 1),双因素方差分析表明浮游动物排泄的氮磷比在各种类间及不同温度间存在显著差异,而且种类与温度存在显著的交互作用(表 2).多重比较分析表明,微型裸腹溞排泄的氮磷比显著低于其它6个种类;中华拟同型溞显著低于舌状叶镖水蚤和温中剑水蚤(表 1).除前节晶囊轮虫(R2=0.09, P=0.232)和中华拟同型溞(R2=0.03, P=0.518)排泄氮磷比与温度相关性不显著外,舌状叶镖水蚤(R2=0.50, P=0.001)、颈沟基合溞(R2=0.87, P<0.001)、萼花臂尾轮虫(R2=0.32, P=0.015)、温中剑水蚤(R2=0.40, P=0.005)和微型裸腹溞(R2=0.74, P<0.001)排泄氮磷比均与温度呈显著正相关.如果将7个种类的数据一起分析,逐步回归分析表明,温度、体重和体内氮磷比是影响浮游动物排泄氮磷比的重要变量(TDN:DIP=271.5+4.7T -8.6DW-4.2N:P,校正R2为0.47,P<0.001)(图 3).对温度、个体干重和体内氮磷比3个变量总解释率的变差分解结果表明,3个变量对排泄氮磷比的共同解释部分非常小,它们各自的单独解释部分均具有非常显著的统计学意义,但相对来讲,温度单独解释部分小于个体体重和体内氮磷比(图 3d).

|
图 3 浮游动物排泄氮磷比与温度、个体干重和体内氮磷比的双变量散点图(a~c)以及温度、个体干重和体内氮磷比对排泄氮磷比解释率的变差分解图(d,***P<0.001) Fig.3 Ratio of TDN to DIP excretion versus temperature, body weight and body N :P ratio (a-c) and Venn diagram of the variation partitioning explained by temperature, body weight and body N :P ratio (d,***P < 0.001) |
一般来讲,浮游动物体内氮、磷含量以及体内氮磷比之间的比值种内差异小,种间差异大[15]. Sterner等[9]比较了温带湖泊8种甲壳类浮游动物的氮(8.2 % ~11.0 %)、磷(0.41 % ~1.58 %)含量,发现2种桡足类(细小真镖水蚤(Eudiaptomus gracilis)和齿突指镖水蚤(Acanthodiaptomus denticornis))呈现高氮低磷的特征,氮磷原子比在39~52之间;3种大型枝角类(大型溞(Daphnia magna)、长刺溞(D. longispina)和僧帽溞(D. cucullata))则呈现低氮高磷的特征,氮磷原子比在12~14之间;小型枝角类种类(长刺象鼻溞(Bosmina longispina)和短属秀体溞(Diaphanosoma brachyurum))氮、磷含量和氮磷原子比(20~29)则介于桡足类和大型枝角类之间.浮游动物碳氮比和碳磷比通常小于它们所摄入的食物,而化学计量学假说认为动物排泄的碳氮比和碳磷比是动物体碳氮比和碳磷比与食物碳氮比和碳磷比之间差值的函数[10, 16].因此,一般认为当温带地区水体浮游动物由大型枝角类占优势转变为小型种类占优势时,浮游植物容易由磷限制转变为氮限制;相反,当浮游动物由小型种类占优势转变为大型枝角类溞属占优势时,浮游植物容易由氮限制转变为磷限制.即大型枝角类溞属比较容易成为浮游植物的磷汇[17-19],而桡足类为浮游植物的磷源[9, 11].在本研究中,中华拟同型溞的氮、磷含量均高于温带地区的同属其它种类[9],但氮磷原子比与温带地区相似;两种小型枝角类(微型裸腹溞和颈沟基合溞)的氮磷原子比(40~43)高于温带地区的小型枝角类,与温带地区的桡足类(细小真镖水蚤和齿突指镖水蚤)相近;舌状叶镖水蚤磷含量高于细小真镖水蚤和齿突指镖水蚤,但氮含量和氮磷比小于真镖水蚤和齿突指镖水蚤;温中剑水蚤氮、磷含量均远高于细小真镖水蚤和齿突指镖水蚤,但氮磷比小于真镖水蚤和齿突指镖水蚤[9].以上分析表明,作为我国南亚热带地区水体的优势甲壳类浮游动物,舌状叶镖水蚤和温中剑水蚤不同于温带地区的桡足类,并不呈现低磷高氮的特征,相反,与大型枝角类相似,呈现低氮磷比特征;小型枝角类和轮虫呈现高氮磷比特征.在我国南亚热带地区水库中,浮游动物通常以桡足类为优势类群,大型枝角类溞属在水体中并没有分布或只是以很低的密度出现在捕食压力相对较低的季节[13-14],桡足类在水库营养盐循环中所起到的作用很可能类似于大型枝角类在温带地区湖泊中的作用.
3.2 氮、磷排泄率由于代谢与个体大小的异速比例关系,个体大小是影响浮游动物营养盐排泄率的一个重要因素[10],个体越大,单位生物量营养盐排泄率越小;温度上升导致的代谢速率加快使营养盐排泄率相应上升.在本研究中,个体干重和温度这2个因素解释了50 %左右的氮、磷排泄率变化,反映了个体干重和温度对营养盐排泄率的影响程度.此外,浮游动物由于氮、磷含量在种类间差异比较大,它们对营养盐的需求量表现出大的种类差异.根据化学计量学假说,浮游动物排泄的氮磷比取决于浮游动物氮磷比与摄入食物氮磷比之间的差值[10].因此,在分析影响氮、磷排泄率以及它们的比值时,除了温度和个体大小外,也考虑了浮游动物的氮、磷含量以及氮磷比值的影响.多元回归分析表明,在氮、磷含量和氮磷比值这3个因素中,只有氮磷比值对磷排泄率和排泄氮磷比有影响,而氮排泄率与氮、磷含量及氮磷比值均没有显著的相关性.相同的个体干重,浮游动物氮磷比值越高,磷排泄率越高,排泄的氮磷比相应越小.
中华拟同型溞磷排泄率略高于文献报导的溞属其它种类的排泄率[8, 20-22].但是,由于中华拟同型溞氮排泄率是文献报导的溞属其它种类的10倍以上[20],排泄的氮磷比值远高于溞属其它种类.颈沟基合溞磷排泄率远高于体型相近的长额象鼻溞[22].舌状叶镖水蚤磷排泄率与文献报导的其它哲水蚤种类(镖水蚤属和杂镖水蚤属)相似,但氮排泄率和排泄的氮磷比是镖水蚤属和杂镖水蚤属的20倍左右[20];温中剑水蚤磷、氮排泄率以及排泄的氮磷比远高于文献报导的同属另一种类——广布中剑水蚤[20].萼花臂尾轮虫和前节晶囊轮虫磷排泄率处于文献报导的轮虫排泄率变化范围内[20, 22],但氮排泄率和排泄氮磷比远高于文献报导的[20].导致本研究7种浮游动物氮排泄率高于文献报导可能的原因除了种类差异外,食物质量和数量的不同可能是另一个比较重要的原因.由于浮游动物对氮、磷的需求比例通常与食物中的氮磷比不一致,因此食物的数量与质量是影响浮游动物营养盐排泄的重要因素[10].文献报导的浮游动物氮排泄率都是从各类型水体中采集浮游动物后直接测定的,但都没有提供生境中的食物质量与数量[9].但是,本研究是在喂以高浓度的同等食物质量的蛋白核小球藻后测定的排泄率.本研究中的蛋白核小球藻的蛋白质含量高于普通藻类,氮磷原子比高达42,与微型裸腹溞和颈沟基合溞相似,但远高于其它5种浮游动物,从而可能导致这些浮游动物氮排泄率相对较高.
在我国南亚热带地区的水库,溶解态活性磷浓度通常处于检测限以下,浮游植物生长受磷限制.根据本研究的结果,如果水库中浮游植物呈现高的氮磷比值,那么浮游动物排泄的氮磷比值可能远高于浮游植物生长所需的氮磷比,一旦它们形成高的种群密度,倾向于加剧水体中溶解态可利用氮、磷供应比例的不平衡.然而,我国热带和南亚热带地区水库单位磷承载的浮游植物生物量明显高于温带地区[13],与本研究结果似乎不相符.这种情形的出现一方面可能与水库的食物质量不同于本研究中的蛋白核小球藻有关.水库浮游植物的氮磷比可能低于蛋白核小球藻,浮游动物排泄的氮磷比低于本研究结果.但是,这一点有待对水库浮游植物氮磷比的调查以及比较不同食物质量条件下浮游动物的氮排泄率变化研究加以验证.另一方面也可能与我国热带和南亚热带地区水库广泛放养滤食性鱼类有关.根据Lin等[13-14]的研究结果看,我国热带和南亚热带地区水库高的鱼类捕食压力使得水库呈现高营养水平、低浮游动物生物量的特征,表明鱼类的放养降低了浮游动物在营养盐循环中的作用以及对水层颗粒态磷的贡献,浮游动物营养盐排泄很可能并不是水库营养盐循环的关键环节.但是,浮游动物在水库营养盐循环中的重要性还有待水库现场实验加以验证.
| [1] |
Zhang Wuchang, Chen Xue, Li Haibo et al. Review of nutrient (nitrogen and phosphorus) regeneration in the marine pelagic microbial food web. Marine Science Bulletin, 2016, 35(3): 241-251. [张武昌, 陈雪, 李海波等. 海洋浮游食物网对氮、磷营养盐的再生研究综述. 海洋通报, 2016, 35(3): 241-251. DOI:10.11840/j.issn.1001-6392.2016.03.001] |
| [2] |
Capps KA, Atkinson CL, Rugenski AT. Consumer-driven nutrient dynamics in freshwater ecosystems:An introduction. Freshwater Biology, 2015, 60(3): 439-442. DOI:10.1111/fwb.2015.60.issue-3 |
| [3] |
Oliver SK, Branstrator DK, Hrabik TR et al. Nutrient excretion by crustacean zooplankton in the deep chlorophyll layer of Lake Superior. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72: 390-399. DOI:10.1139/cjfas-2014-0209 |
| [4] |
Schindler DE, Knapp RA, Leavitt PR. Alteration of nutrient cycles and algal production resulting from fish introductions into mountain lakes. Ecosystems, 2001, 4: 308-321. DOI:10.1007/s10021-001-0013-4 |
| [5] |
Zimmer KD, Herwig BR, Laurich LM. Nutrient excretion by fish in wetland ecosystems and its potential to support algal production. Limnology and Oceanography, 2006, 51: 197-207. DOI:10.4319/lo.2006.51.1.0197 |
| [6] |
Zhou Yi, Yang Hongsheng, He Yichao et al. Nitrogen and phosphorus excretion and its ecological effect by several bivalves and fouling animals. Oceanologia et Limnologia Sinica, 2002, 33(4): 424-431. [周毅, 杨红生, 何义朝等. 四十里湾几种双壳类及污损动物的氮、磷排泄及其生态效应. 海洋与湖沼, 2002, 33(4): 424-431.] |
| [7] |
Vanni MJ, Boros G, McIntyre PB. When are fish sources vs. sinks of nutrients in lake ecosystems? Ecology, 2013, 94(10): 2195-2206. |
| [8] |
He X, Wang WX. Kinetics of phosphorus in Daphnia at different food concentrations and carbon:phosphorus ratios. Limnology and Oceanography, 2007, 52(1): 395-406. DOI:10.4319/lo.2007.52.1.0395 |
| [9] |
Sterner RW, Elser J, Hessen DO. Stoichiometric relationships among producers, consumers and nutrient cycling in pelagic ecosystems. Biogeochemistry, 1992, 17: 49-67. |
| [10] |
Vanni MJ. Nutrient cycling by animals in freshwater ecosystems. Annual Review of Ecology and Systematics, 2002, 33: 341-370. DOI:10.1146/annurev.ecolsys.33.010802.150519 |
| [11] |
Lyche A, Andersen T, Christoffersen K et al. Mesocosm tracer studies. 1. Zooplanktonas sources and sinks in the pelagic phosphorus cycle of a mesotrophic lake. Limnology and Oceanography, 1996, 41(3): 460-474. DOI:10.4319/lo.1996.41.3.0460 |
| [12] |
Urabe J, Nakanishi M, Kawabata K. Contribution of metazoan plankton to the cycling of nitrogen and phosphorus in Lake Biwa. Limnology and Oceanography, 1995, 40(2): 232-241. DOI:10.4319/lo.1995.40.2.0232 |
| [13] |
Lin Q, Jiang X, Han BP et al. Does stocking of filter-feeding fish for production have a cascading effect on zooplankton and ecological state? A study of fourteen (sub)tropical Chinese reservoirs with contrasting nutrient concentrations. Hydrobiologia, 2014, 736: 115-125. DOI:10.1007/s10750-014-1896-3 |
| [14] |
Lin QQ, Duan SS, Hu R et al. Zooplankton distribution in tropical reservoirs, South China. International Review of Hydrobiology, 2003, 88: 602-613. DOI:10.1002/(ISSN)1522-2632 |
| [15] |
Urabe J. N and P cycling coupled by grazers' activities:food quality and nutrient release by zooplankton. Ecology, 1993, 74(8): 2337-2350. DOI:10.2307/1939586 |
| [16] |
Frost PC, Xenopoulos MA, Larson JH. The stoichiometry of dissolved organic carbon, nitrogen, and phosphorus release by a planktonic grazer, Daphnia. Limnology and Oceanography, 2004, 49(5): 1802-1808. DOI:10.4319/lo.2004.49.5.1802 |
| [17] |
Pitsch M, Awassi V, Susko E et al. Effects of zooplankton dynamics on epilimnetic phosphorus loss. Freshwater Biology, 2012, 57: 704-715. DOI:10.1111/fwb.2012.57.issue-4 |
| [18] |
Sommer F, Santer B, Jamieson C et al. Daphnia population growth but not moulting is a substantial phosphorus drain for phytoplankton. Freshwater Biology, 2003, 48: 67-74. DOI:10.1046/j.1365-2427.2003.00971.x |
| [19] |
Vrede T, Andersen T, Hessen DO. Phosphorus distribution in three crustacean species. Limnology and Oceanography, 1999, 44: 225-229. DOI:10.4319/lo.1999.44.1.0225 |
| [20] |
Carrillo P, Reche I, Cruz-Pizarro L. Intraspecific stoichiometric variability and the ratio of nitrogen to phosphorus resupplied by zooplankton. Freshwater Biology, 1996, 36: 363-374. DOI:10.1046/j.1365-2427.1996.00091.x |
| [21] |
Vadstein O, Brekke O, Olsen Y et al. Estimation of phosphorus release rates from natural zooplankton communities feeding on planktonic algae and bacteria. Limnology and Oceanography, 1995, 40(2): 250-262. DOI:10.4319/lo.1995.40.2.0250 |
| [22] |
Ejsmont-Karabin J, Gorelysheva Z, Kalinowska K et al. Role of zooplankton (Ciliata, Rotifera and Crustacea) in phosphorus removal from cycling:Lakes of the River Jorka watershed (Masuria lakeland, Poland). Polish Journal of Ecology, 2004, 52(3): 275-284. |
 2017, Vol. 29
2017, Vol. 29 


