(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院大学, 北京 100049)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: Graduate University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
目前,由水体富营养化导致的淡水水体有害蓝藻水华仍是全世界普遍面临的水环境问题[1].近几十年来,我国的富营养化问题日益严重,在对138个面积大于10 km2的湖泊进行调查之后发现,其中85.4 %的湖泊已处于富营养化状态,而其中更高达40.1 %的湖泊已处于重度富营养化状态[2].湖泊富营养化会产生一系列环境问题,而蓝藻水华便是其中研究最多且污染最为严重的一种.蓝藻水华的暴发不仅会对水质产生显著影响,还会产生一系列毒性很强的次级代谢产物,严重危害人类健康.其中,以微囊藻毒素的危害最为严重[3].
微囊藻毒素(MCs)是世界各地水华蓝藻产生的最为常见且危害最严重的蓝藻毒素[4-5],目前已确认的产毒蓝藻主要有微囊藻属、浮丝藻属、颤藻属、念珠藻属和鱼腥藻属等[5].研究表明,MCs为环状七肽结构,自1980s初确定结构以来,已发现90余种毒素亚型,其中以MC-LR、MC-RR和MC-YR的研究最多,而以MC-LR的毒性最强[6-8].大量文献报道指出,MCs具有很强的肝脏毒性,同时,大多数的MCs具有亲水性,在水中的溶解度最高可达1 g/L[9].此外,MCs还具有很高的热稳定性,在300℃条件下仍能维持很长时间不分解[10].目前,已有许多关于动物以及人类MCs中毒的报道,其中最为严重的事件为1996年巴西Carurau透析中心的MCs中毒事件,最终确认有52人的死亡与MCs中毒有关[11-12].此外,流行病学的研究发现,我国南方某些地区(如江苏泰兴[13]和海门[14]等)原发性肝癌的高发病率与饮用水被MCs污染相关.
太湖作为中国第三大淡水湖,因水体富营养化而导致的蓝藻水华问题由来已久,在2007年左右发生蓝藻水华的湖面面积达到最大值(1000 km2以上),并导致2007年无锡饮用水危机事件的发生[1, 15].虽然最近几年太湖蓝藻水华暴发的湖面面积没有进一步扩大,但由于太湖的季风气候等特点,在太湖北部富营养化严重区域仍频繁发生较大面积的蓝藻聚集[16].而MCs作为蓝藻的重要有毒代谢产物,对太湖已造成较为严重的污染,已有研究表明,太湖中MC-LR的平均浓度已达到1.48 μg/L,最高达2.558 μg/L,这已显著高出世界卫生组织和我国规定的饮用水含量标准(GB 5749-2006,1.0 μg/L).目前,对太湖水体中MCs的研究已较多,但多集中于对太湖全湖以及蓝藻水华暴发区域的研究[17-18],对太湖饮用水源地和水厂出厂水中的MCs分布特征及影响因素关注较少.此外,以往研究多为全年的调查,频度较低,蓝藻暴发阶段MCs的变化规律仍不清楚,并集中于对单一MCs异构体MC-LR的研究[19],而MC-RR浓度在太湖水中亦占相当大的比例.有鉴于此,我们对太湖北部贡湖湾区域某水厂水源地水源水和出厂饮用水胞内MCs以及胞外MCs浓度进行了高频检测,在分析MCs浓度随时间变化规律的基础上,对影响其浓度变化的环境因子进行分析,并对其进行相应的健康风险评价.
1 材料与方法 1.1 采样点和采样时间本研究采样点位于太湖北部贡湖湾湾口,沙渚水源地,而水厂地处江苏省无锡市范围内.在2014年8月蓝藻水华暴发期间,对目标水厂进行了为期一个月的调查,采样点设定在水厂取水口和出水口处.从8月1日开始每隔1天采集1次样品,到8月29日截止,共采集样品15次.
1.2 样品采集及预处理在取水口附近湖面,采用Hydrolab(美国)公司生产的DS5X型水质多功能探头现场测定水温、pH、溶解氧(DO)、浊度、矿化度、盐度等指标.同时,用2.5 L有机玻璃采水器采集混合水样1 L用于分析胞内和胞外MCs浓度.此外,采集1 L混合水用于检测总氮(TN)、铵态氮(NH4+-N)、总磷(TP)、高锰酸盐指数(CODMn)和叶绿素a(Chl.a)浓度.
将采集的部分水样用Whatman GF/C(0.45 μm)滤膜过滤,滤后水样用于检测胞外MCs和NH4+-N浓度,滤膜用于检测胞内MCs和Chl.a浓度.
1.3 参数测定胞内和胞外MCs浓度的检测参考文献[8, 18].首先,用5 %的乙酸将冷冻干燥后的滤膜超声萃取5 min,在悬浮液冷冻离心之后,将上清液加到HLB(200 mg, Oasis ©, Waters, Milford, MA, USA)萃取柱内.在萃取柱内液面将要消失时,分别用20 ml 5 %的甲醇和12 ml 100 %的甲醇清洗和洗脱柱子.然后,将洗脱液在40℃条件下用氮气吹干.最后,用1 ml 100 %的甲醇将残留物溶解,取其中的0.5 ml检测胞内MCs浓度.将用于检测胞外MCs浓度的滤液直接添加到HLB柱子内,而后面的步骤与以上胞内MCs检测步骤相同.在以上的萃取浓缩步骤结束之后,使用高效液相色谱仪(HPLC, Agilent 1200 series, Palo Alto, CA, USA)分析其中的MCs(-LR、-RR和-YR)浓度.高效液相色谱仪配备C18(ODS)反相色谱柱和光电二极管阵列检测器,梯度洗脱程序为30 % ~40 %乙腈和60 % ~70 %的0.05 %三氟乙酸(15 min),之后乙腈与三氟乙酸溶液按体积比30 :70混合(5 min),流速为1 ml/min.仪器检测时使用的标准品购买于Sigma-Aldrich(München, Germany).
TN和TP浓度采用过硫酸钾消解法测定[20],NH4+-N浓度应用荷兰Skalar公司生产的连续流动分析仪测定,Chl.a浓度通过热乙醇分光光度法测定[21].
1.4 健康风险评价方法本研究对出厂水中胞外MCs的健康风险评价采用风险指数(HI)法进行计算,具体计算方法参照王超等[22]和尤汉虎等[23]文献中的描述.
1.5 数据分析使用SPSS 20.0软件对数据进行标准化、Spearman相关分析和逐步回归分析.其中,在进行逐步回归分析时,为避免自变量的多重共线性,去掉相关分析中任意两个自变量相关系数大于0.8的其中一个自变量.绘图软件使用Origin 9.0软件.
2 结果与分析 2.1 水源水胞内和胞外MCs浓度的变化水源水中胞内MCs的3种异构体与总MCs浓度变化具有较高的一致性,均具有相似的波动规律,且均在下旬时浓度较高,3种MCs异构体以MC-LR和MC-RR为主,分别占总MCs的38.7 %和56.1 %.调查期间,MC-LR的平均浓度为3408.7 ng/L,浓度范围为107~15379 ng/L,最大值出现在8月21日;在前10次调查中,MC-LR浓度明显低于MC-RR,而在调查后期其浓度略有升高. MC-RR在调查期间的平均浓度为3398.8 ng/L,浓度范围为364.1~6470.4 ng/L,其最大值出现在8月25日.在调查期间MC-YR浓度较低,平均值为358 ng/L,浓度范围为21.7~1356.7 ng/L(图 1a).

|
图 1 水源水胞内及胞外MCs浓度的变化 Fig.1 Temporal variation of intraMCs and extraMCs concentrations of the source water |
在调查期间,水源水胞外MCs浓度显著低于胞内MCs浓度,并与胞内MCs具有相似的变化规律,其平均浓度为142.6 ng/L,浓度范围为11.9~512.8 ng/L.胞外MCs 3种异构体浓度的变化规律相同,均在8月23日时达到最大值,相对胞内MCs最大值出现的日期略晚,MC-LR、MC-RR和MC-YR所占比例分别为50.9 %、36.1 %和13.1 %.胞外MC-LR的平均浓度为65.7 ng/L,浓度范围为6.4~216.5 ng/L;MC-RR的平均浓度为63.5 ng/L,浓度范围为1.7~262.1 ng/L;而MC-YR的平均浓度仅为13.5 ng/L,浓度范围为3.2~34.2 ng/L(图 1b).
2.2 出厂饮用水胞内和胞外MCs浓度的变化及去除率分析在调查期间,出厂饮用水中胞内MCs仅检测到MC-LR与MC-RR两种毒素异构体,且毒素浓度都非常低,远低于国家饮用水标准规定的1 μg/L.其中,仅有3次检测到MC-LR,平均浓度为0.25 ng/L,浓度范围为0~1.64 ng/L,最大值出现在8月25日;而MC-RR的检出次数明显高于MC-LR,平均浓度为0.53 ng/L,浓度范围为0~3.19 ng/L,最大值出现在8月23日(图 2a).相对于胞内MCs,胞外MCs的浓度与检出频率均显著高于胞内MCs,但浓度最大值均出现在8月3日,除MC-YR之外,其他两种MCs异构体和总MCs浓度均在8月25日出现另一浓度高值.其中,MC-LR的平均浓度为9.47 ng/L,浓度范围为0~30.56 ng/L;MC-RR的平均浓度为10.46 ng/L,浓度范围为0~46.36 ng/L;而MC-YR的浓度相对更低,平均浓度为1.78 ng/L,浓度范围为0~5.91 ng/L(图 2b).对数据的分析可以发现,饮用水中胞外MCs浓度更高,且在调查期间都有MCs检出,总MCs的平均浓度为21.71 ng/L,浓度范围为0.18~82.84 ng/L.
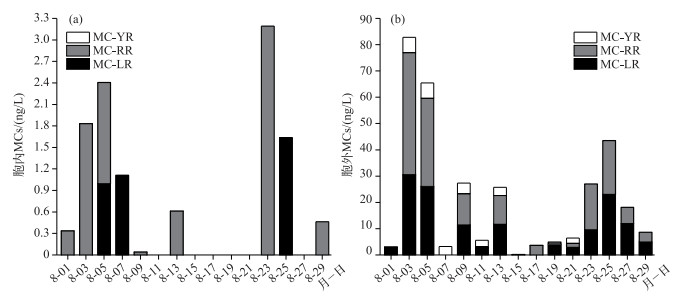
|
图 2 出厂饮用水胞内和胞外MCs浓度的变化 Fig.2 Temporal variation of intraMCs and extraMCs concentrations of the finished water |
进一步对MCs的去除率(图 3)进行分析发现,水厂对胞内MCs的去除率非常高,3种MCs异构体以及总MCs的去除率平均值均达到99.8 %以上;而对胞外MCs的去除率相对较低,MC-LR、MC-RR、MC-YR及总MCs的平均去除率分别为80.6 %、62.9 %、81.8 %和76.8 %.此外,在其中几次调查中胞外MCs的去除率较低或者为负值,这说明水厂对水源水的处理过程可能导致了胞内MCs的释放.
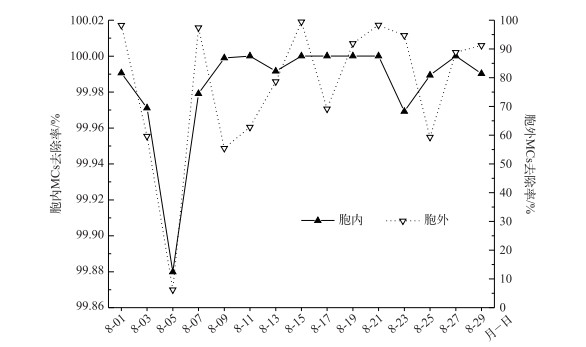
|
图 3 自来水厂对水源地水中胞内和胞外MCs的去除率 Fig.3 Removal rates of total intraMCs and extraMCs by the waterworks |
调查期间水源水的主要理化参数如表 1所示.同时,对水源水胞内与胞外MCs浓度和其他理化指标进行Spearman相关分析(表 2)发现,胞内不同MCs异构体与胞外不同MCs异构体之间具有显著相关性.此外,胞内MCs浓度与TN浓度、TP浓度、CODMn浓度和浊度呈显著正相关,其中,MC-YR浓度与NH4+-N浓度呈显著负相关,而不同MCs异构体浓度与Chl.a浓度的相关性均不显著;胞外MCs浓度与TN浓度、TP浓度、CODMn浓度、浊度和Chl.a浓度呈显著正相关,与NH4+-N浓度同样呈负相关,但不显著.
| 表 1 调查期间水源水理化参数 Tab.1 Physiochemical parameters of the source water during the survey |
| 表 2 水源水MCs浓度与其他参数的相关性分析1) Tab.2 Spearman's correlation analysis between MCs concentrations and other parameters of the source water |
水源水中胞内和胞外MCs与其他理化指标的逐步回归分析结果如表 3所示,其中,胞内MC-RR做因变量时无自变量被选出.从表中可以看出,胞内MC-LR和总MCs做因变量时,仅有TP对其有显著的影响,解释率分别为74.7 %和56.4 %;TP和胞外MC-YR对胞内MC-YR浓度的影响最为显著,且为正相关,解释率分别为69.4 %和9.3 %.胞外MC-LR做因变量时,仅有胞内MC-LR被筛出,解释率为31.4 %;而胞外MC-RR做因变量时,有4个变量被筛出,其中TP、胞内MC-RR和出厂水胞内MC-RR与其呈正相关,而出厂水胞外MC-RR与其呈负相关,解释率依次为42.4 %、4.1 %、37.9 %和8.1 %;胞外MC-YR做因变量时,仅有胞内MC-YR与其呈显著相关,解释率为42.2 %;当胞外总MCs做因变量时,胞内总MCs以及出厂水胞内总MCs被选出,且都为正相关关系,解释率分别为37.9 %和22.4 %.
| 表 3 水源水胞内和胞外MCs与其他理化指标的逐步回归分析结果* Tab.3 Results of stepwise multiple linear regression between intraMCs and extraMCs concentrations and other physiochemical parameters of the source water |
经过计算,调查期间,目标水厂出厂饮用水MCs的非致癌风险指数变化范围为5.67×10-6~2.761×10-3,均远小于1,所以,出厂水中MCs浓度对人类健康所造成的风险较小.
3 讨论MCs主要为蓝藻门中特定产毒藻产生的胞内毒素,仅在蓝藻细胞衰老等条件导致细胞破裂时才会释放到周围的环境中[24],所以当水体中具有较高浓度的胞内MCs时,胞外溶解性MCs也会相应较高,但浓度最大值出现的时间相对胞内MCs浓度最大值出现的时间要略晚,这与本研究结果一致.调查结果发现,目标水厂水源水中胞内MCs总浓度已经处在非常高的水平,浓度最高已达22461.3 ng/L,且平均浓度也处在较高水平. Su等[18]在2013年7月-2014年6月期间对太湖北部区域的调查发现,胞内MCs在7月达到最高值,平均浓度达到10930 ng/L,而在8月浓度(< 4 μg/L)显著下降,在10月又升到另一峰值.然而,本研究发现,水源水中胞外毒素浓度在调查期间一直处于较低水平,显著低于国家饮用水标准规定的1 μg/L,这与唐承佳[25]对太湖贡湖湾的研究结果一致.而高振美等[26]对太湖梅梁湾的调查结果则显著高出本研究结果,在湖区的某些区域MCs的总浓度甚至超过了1 μg/L,王经结等[17]对太湖的研究亦得到相似的结果.虽然以上研究结果中总MCs浓度已超过1 μg/L,但是MC-LR浓度仍处于较低水平,而在毛敬英[27]对太湖的研究中,胞外MC-LR的平均浓度已达到1.48 μg/L,最高浓度甚至达到2.558 μg/L.所以,综上所述,太湖北部区域水源地水源水中MCs普遍存在,尤其在蓝藻暴发季节,某些区域的MCs浓度已经接近或超过国家饮用水标准规定的限值.有鉴于此,相关部门应当加强对太湖相关区域的常规监测,并对MCs可能造成的风险进行相关评价和预警.
然而,目前对MCs的检测还大多集中于水源地及其所在湖区,而对自来水厂出厂饮用水的检测相对较少.本研究调查发现,目标水厂对水源水中胞内MCs具有很高的去除率,经处理后的自来水中仅含有微量的胞内MCs,而胞外MCs去除率相对较低,浓度亦较高.相关研究表明[28-29],传统的混凝、沉淀、过滤和加氯等净水工艺过程只能去除部分胞内MCs,对胞外溶解性MCs的去除作用不大,有时一些处理过程还会因为导致蓝藻细胞破裂而使胞外MCs浓度升高,这也可能是本研究中胞外MCs去除率相对较低的原因之一.虽然出厂饮用水中MCs浓度较低,但是胞外MCs的检出频率非常高,不排除在长时间暴露条件下对附近居民存在长期的毒性作用,所以今后应在加强自来水处理的基础上,进一步加强对MCs长期暴露毒性实验的研究.此外,由于目前使用的《地表水环境质量标准》和《生活饮用水卫生标准》中仅规定了MC-LR的限值,而对其他MCs异构体浓度限值却没有涉及,所以今后还应加强对其他主要MCs异构体的研究,进一步完善饮用水等的评价标准.
目前,对MCs时空分布影响因子的研究已经有很多,但是由于研究条件不统一,导致研究结果也各不相同.水体中氮、磷等营养物质浓度对其中产毒藻类的生长具有重要影响,研究发现,当TP浓度在一定范围内时,产毒微囊藻生物量随TP浓度的升高而升高[30],所以,水体中MCs的浓度也会随之升高.本研究逐步回归分析结果显示,理化指标仅有TP对胞内MCs浓度的影响最为显著,与胞内MCs浓度呈显著正相关,这与Rinta-Kanto等[31]以及Lee等[32]的研究一致,而亦有研究表明磷浓度与MCs浓度不存在显著相关关系[33-34].对于其他理化因子,相关的研究也有很多,但主要集中于TN、光照强度、水温、藻类生物量(Chl.a)以及细胞生长速率等.而根据本研究结果,今后应进一步加强对磷与MCs浓度之间关系的研究,同时,加强对新技术的研发,能够在去除胞内MCs的基础上,减少胞外MCs的释放.
最后,通过对水厂出厂饮用水中MCs浓度非致癌风险指数的计算,表明出厂水中MCs对人类健康存在的危害仍较小.然而,相关研究指出,MCs亦具有一定的促癌作用[35-36],这使得由MCs引起的健康风险指数显著升高,但目前仍缺少对MCs致癌斜率因子的研究,致使MCs的致癌风险指数不能量化.
| [1] |
Qin BQ, Yang GJ, Ma JR et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China. Chin Sci Bull, 2016, 61(7): 759-770. [秦伯强, 杨桂军, 马健荣等. 太湖蓝藻水华"暴发"的动态特征及其机制. 科学通报, 2016, 61(7): 759-770.] |
| [2] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [3] |
Xie P. A review on the studies related to the effects of microcystins on human health. J Lake Sci, 2009, 21(5): 603-613. [谢平. 微囊藻毒素对人类健康影响相关研究的回顾. 湖泊科学, 2009, 21(5): 603-613. DOI:10.18307/2009.0501] |
| [4] |
Xue QJ, Su XM, Xie LQ. Advances on cyanotoxin toxicology of zoobenthos. Acta Ecol Sin, 2015, 35(14): 4570-4578. [薛庆举, 苏小妹, 谢丽强. 蓝藻毒素对底栖动物的毒理学研究进展. 生态学报, 2015, 35(14): 4570-4578.] |
| [5] |
Van Apeldoorn ME, Van Egmond HP, Speijers GJ et al. Toxins of Cyanobacteria. Molecular Nutrition & Food Research, 2007, 51(1): 7-60. |
| [6] |
Gupta N, Pant SC, Vijayaraghavan R et al. Comparative toxicity evaluation of cyanobacterial cyclic peptide toxin microcystin variants (LR, RR, YR) in mice. Toxicology, 2003, 188(2/3): 285-296. |
| [7] |
Neilan BA, Pearson LA, Muenchhoff J et al. Environmental conditions that influence toxin biosynthesis in Cyanobacteria. Environmental Microbiology, 2013, 15(5): 1239-1253. DOI:10.1111/emi.2013.15.issue-5 |
| [8] |
Xue Q, Steinman AD, Su X et al. Temporal dynamics of microcystins in Limnodrilus Hoffmeisteri, a dominant Oligochaete of hypereutrophic Lake Taihu, China. Environmental Pollution, 2016, 213: 585-593. DOI:10.1016/j.envpol.2016.03.043 |
| [9] |
Rivasseau C, Martins S, Hennion MC. Determination of some physicochemical parameters of Microcystins (Cyanobacterial Toxins) and trace level analysis in environmental samples using liquid chromatography. Journal of Chromatography A, 1998, 799(1/2): 155-169. |
| [10] |
Tai ND, Lam PKS, Shaw GR et al. Toxicology and risk assessment of freshwater Cyanobacterial (Blue-Green Algal) toxins in water. Reviews of Environmental Contamination & Toxicology, 2000, 163(163): 113. |
| [11] |
Azevedo SM, Carmichael WW, Jochimsen EM et al. Human intoxication by Microcystins during renal dialysis treatment in Caruaru-Brazil. Toxicology, 2002, 181: 441-446. |
| [12] |
Carmichael WW, Azevedo S, An JS et al. Human fatalities from cyanobacteria:Chemical and biological evidence for cyanotoxins. Environmental Health Perspectives, 2001, 109(7): 663. DOI:10.1289/ehp.01109663 |
| [13] |
Zhou XF, Dong ZH, Yu SZ. A study of influencing factors on high incidence of liver cancer in Taixing. China Cancer, 1999, 8(3): 350-351. [周学富, 董志辉, 俞顺章. 泰兴地区肝癌高发因素研究. 中国肿瘤, 1999, 8(3): 350-351.] |
| [14] |
Lu WG, Lin WY. Investigation on primary liver cancer mortality trends and the high-risk factors in 1969-1999 in Haimen. Med J Commun, 2001, 15(5): 469-470. [陆卫根, 林文尧. 海门市1969~1999年原发性肝癌死亡率趋势及高发因素的探讨. 交通医学, 2001, 15(5): 469-470.] |
| [15] |
Zhang Y, Lin S, Qian X et al. Temporal and spatial variability of chlorophyll a concentration in Lake Taihu using modis time-series data. Hydrobiologia, 2011, 661(1): 235-250. DOI:10.1007/s10750-010-0528-9 |
| [16] |
Qin B, Li W, Zhu G et al. Cyanobacterial bloom management through integrated monitoring and forecasting in large shallow eutrophic Lake Taihu (China). Journal of Hazardous Materials, 2015, 287: 356-363. DOI:10.1016/j.jhazmat.2015.01.047 |
| [17] |
Wang JJ, Yang J, Xian QM et al. Characteristic of microcystin distributions and its relationships with environmental factors in Lake Taihu. J Lake Sci, 2011, 23(4): 513-519. [王经结, 杨佳, 鲜啟鸣等. 太湖微囊藻毒素时空分布特征及与环境因子的关系. 湖泊科学, 2011, 23(4): 513-519. DOI:10.18307/2011.0404] |
| [18] |
Su X, Xue Q, Steinman A et al. Spatiotemporal dynamics of Microcystin variants and relationships with environmental parameters in Lake Taihu, China. Toxins, 2015, 7(8): 3224. DOI:10.3390/toxins7083224 |
| [19] |
Huang XC, Luo HD, Huang PZ et al. Current status of microcystin contamination in source water and finished water and its environmental factors in China. J Environ Hyg, 2014, 4(5): 494-498. [黄晓淳, 骆和东, 黄培枝等. 我国水源水及饮用水中微囊藻毒素的污染现状及影响因素研究. 环境卫生学杂志, 2014, 4(5): 494-498.] |
| [20] |
Jin XC, Tu QY. Standards of eutrophication survey in lake. The second edition. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范: 第二版. 北京: 中国环境科学出版社, 1990.]
|
| [21] |
Chen YW, Chen KM, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [22] |
Wang C, Peng T, Lü YB et al. Survey and preliminary health risk assessment of drinking water and water resources in a city of Jiangnan. Envion Chem, 2014, 33(7): 1237-1238. [王超, 彭涛, 吕怡兵等. 江南某城市饮用水及其水源水中微囊藻毒素调查及初步健康风险评价. 环境化学, 2014, 33(7): 1237-1238. DOI:10.7524/j.issn.0254-6108.2014.07.027] |
| [23] |
You HH, Xiao B, Zhang YP et al. Assenment of human health risk about trihalomethanes in drinking water of a certain district in Foshan. Contemp Med, 2011, 17(23): 156-158. [尤汉虎, 肖兵, 张艳萍等. 佛山某区饮用水三卤甲烷健康风险评价. 当代医学, 2011, 17(23): 156-158. DOI:10.3969/j.issn.1009-4393.2011.23.112] |
| [24] |
Kenefick S, Hrudey S, Peterson H et al. Toxin release from Microcystis aeruginosa after chemical treatment. Water Science and Technology, 1993, 27(3/4): 433-440. |
| [25] |
Tang CJ. Microcystins and derivative volatile organic surfocompound in Gonghu Bay, Lake Taihu[Dissertation]. Shanghai:East China Normal University, 2010. [唐承佳. 太湖贡湖湾水源地微囊藻毒素和含硫衍生污染物研究[学位论文]. 上海: 华东师范大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10269-2010197443.htm ]
|
| [26] |
Gao ZM, Zhao ZH, Zhang B et al. Seasonal variation of microcystins concentration and influencing factors in Meiliang Bay, Lake Taihu. Ecol Environ Sci, 2011, 20(6/7): 1063-1067. [高振美, 赵中华, 张波等. 太湖梅梁湾水体微囊藻毒素含量的季节变化特征及其影响因素研究. 生态环境学报, 2011, 20(6/7): 1063-1067.] |
| [27] |
Mao JY. Otherness of distribution characteristics and main impact factors of microcystins in typical eutrophication lakes[Dissertation]. Chengdu:Southwest Jiaotong University, 2012. [毛敬英. 典型富营养化湖泊微囊藻毒素分布特征及主要影响因子差异性分析[学位论文]. 成都: 西南交通大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10613-1012392291.htm ]
|
| [28] |
Xiao XF, Li WQ, Liu N et al. The harm and control of the cyanobacteria toxin in eutrophication water. J China Inst Water Resour Hydropower Res, 2005, 3(2): 116-123. [肖兴富, 李文奇, 刘娜等. 富营养化水体中蓝藻毒素的危害及其控制. 中国水利水电科学研究院学报, 2005, 3(2): 116-123.] |
| [29] |
Liu C. Study on the content of microcystins in the water source of Shanghai and the optimal removal mathods[Dissertation]. Shanghai:Tongji University, 2007. [刘成. 微囊藻毒素在上海市水源地的分布状况及去除研究[学位论文]. 上海: 同济大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10247-2008016579.htm ]
|
| [30] |
Xu HP, Yang GJ, Zhou J et al. Effect of nitrogen and phosphorus concentration on colony growth of Microcystis flos-aquae in Lake Taihu. J Lake Sci, 2014, 26(2): 213-220. [许慧萍, 杨桂军, 周健等. 氮、磷浓度对太湖水华微囊藻(Microcystis flos-aquae)群体生长的影响. 湖泊科学, 2014, 26(2): 213-220. DOI:10.18307/2014.0207] |
| [31] |
Rinta-Kanto JM, Konopko EA, DeBruyn JM et al. Lake Erie Microcystis:Relationship between Microcystin production, dynamics of genotypes and environmental parameters in a large lake. Harmful Algae, 2009, 8(5): 665-673. DOI:10.1016/j.hal.2008.12.004 |
| [32] |
Lee TA, Rollwagen-Bollens G, Bollens SM et al. Environmental influence on cyanobacteria abundance and microcystin toxin production in a shallow temperate lake. Ecotoxicology and Environmental Safety, 2015, 114: 318-325. DOI:10.1016/j.ecoenv.2014.05.004 |
| [33] |
Sivonen K. Effects of light, temperature, nitrate, orthophosphate, and bacteria on growth of and hepatotoxin production by Oscillatoria agardhii strains. Applied and Environmental Microbiology, 1990, 56(9): 2658-2666. |
| [34] |
Utkilen H, Gjølme N. Iron-stimulated toxin production in Microcystis aeruginosa. Applied and Environmental Microbiology, 1995, 61(2): 797-800. |
| [35] |
Yu SZ, Zhao N, Zi XL et al. The relationship cyanotoxin (Microcystin, MC) in pond-ditch water and primary liver cancer in China. Chin J Oncol, 2001, 23(2): 96-99. [俞顺章, 赵宁, 资晓林等. 饮水中微囊藻毒素与我国原发性肝癌关系的研究. 中华肿瘤杂志, 2001, 23(2): 96-99.] |
| [36] |
Liao J, Nong QQ, Hu XM et al. Serum microcystin-LR level and influencing factors in local residents of a high risk area of hepatocellular carcinoma in Guangxi. J Environ Health, 2016, 33(11): 1003-1006. [廖娟, 农清清, 胡新梅等. 广西肝癌高发区人群血清微囊藻毒素-LR水平及影响因素分析. 环境与健康杂志, 2016, 33(11): 1003-1006.] |
 2018, Vol. 30
2018, Vol. 30 

