(2: 江西师范大学鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022)
(2: Key Laboratory of Lake Poyang Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022, P. R. China)
鄱阳湖是长江中下游典型的季节性湖泊,是我国最大的淡水湖泊,也是国际重要湿地和世界重要的候鸟栖息地.该湖位于江西省北部,承接了省内五大河流(赣江、抚河、信江、饶河和修河)来水,在维系鄱阳湖流域生态平衡和生物多样性方面有着重要的作用.河湖交错带是指河流生态系统与湖泊生态系统之间的界面区[1].它在河水与湖水混合的区域内形成一个具有潜在陡峭环境梯度的动态区,与邻近的河流生态系统或湖泊生态系统相比较,河湖交错带具有更加丰富的物种多样性,是一个重要的污染水净化区和污染缓冲区[2].鄱阳湖河湖交错带是整个鄱阳湖流域内河流生态系统与鄱阳湖生态系统之间的交错混合区域,它受鄱阳湖与五大河流两岸人类活动以及五大河流与鄱阳湖之间相互作用等的影响,对区域经济发展和生态安全有着重要作用.
鄱阳湖流域内分布有色金属矿,如饶河上游的德兴铜矿[3]、赣江上游的大余钨矿[4]等,长期开采与冶炼生产的“三废”不仅对矿区生态环境及人类生存产生了影响,而且污染物通过河流汇入鄱阳湖,大部分重金属不易被微生物降解吸收,鄱阳湖流域生态环境也因此易遭受破坏.微生物群落通过吸附、淋滤及转化等影响环境中的重金属活性[5],同样在重金属胁迫下,可降低微生物群落的活性,污染严重时还会降低微生物生物量,影响微生物的生理生化功能,最终影响环境有机质的降解[6],二者相互作用研究已引起研究者的广泛关注,为了保持鄱阳湖“青山常青,绿水常绿”,研究重金属污染与微生物群落的相互作用尤为迫切.随着分子生物学技术的发展,研究各种环境下微生物群落的特征已经日益完善,刘晋仙等[7]利用高通量测序技术发现山西中条山十八河铜尾矿区水体中微生物有8个优势科(鞘脂单胞菌科、柄杆菌科、甲基杆菌科、类诺卡氏菌科、微杆菌科、微球菌科、链球菌科和类芽孢杆菌科)的相对丰度与重金属浓度存在显著相关关系. Zhao等[8]利用变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)技术发现重金属污染物能抑制微生物的生长,只有少量具有较强抗性的微生物能存活.重金属污染对鄱阳湖微生物群落特征的影响目前研究尚少,为此,本文在检测鄱阳湖河湖交错带水体重金属浓度的基础上,利用Miseq平台高通量测序技术分析微生物群落结构及多样性特征,并寻找重金属浓度与微生物多样性之间的联系,探讨重金属污染对微生物多样性的影响,以期加深认识河湖交错带微生物在湖泊生态系统和河流生态系统中的功能与地位.
1 材料与方法 1.1 采样点分布在查阅文献及野外调研的基础上,确定了河湖交错带的采样范围,考虑到丰水期存在对重金属的稀释作用,选择在枯水期进行水样采集.采集时利用手持GPS定位仪记录采样点的地理坐标,使用电子pH仪测定实时的水温以及pH值.利用ArcGIS软件绘制采样点分布图(图 1).
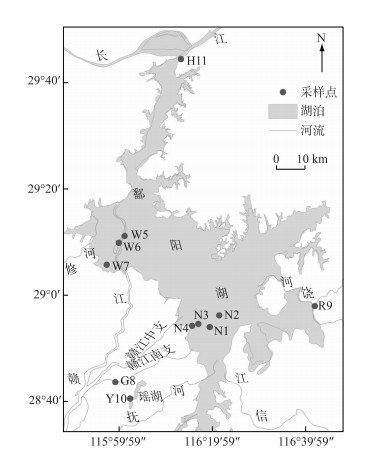
|
图 1 采样点分布 Fig.1 Distribution of sampling sites |
每个采样点采集2 L水样,装入已灭菌聚乙烯瓶中,低温保存,在实验室无菌环境下过滤.每个样品都必须经过0.85和0.22 μm孔径的滤膜过滤两次,把0.22 μm孔径的滤膜放入离心管,之后放在-80℃冰箱保存,用于测定样品中的DNA.同时每个样点采集500 ml水样用于重金属浓度的测定,由于地表水中重金属浓度一般较低,所以需要预先浓缩处理,之后再进一步测定.
1.3 样品相关测定方法 1.3.1 微生物多样性指数测定将预处理好的样品送到上海美吉生物医药科技有限公司进行Miseq平台16S rRNA测序,所用引物为338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT),利用2 %琼脂糖凝胶电泳检测PCR产物.
1.3.2 重金属浓度测定铜(Cu)、锌(Zn)、铅(Pb)、镉(Cd)的浓度依据国家标准要求的原子吸收分光光度法测定(GB/T 7475-1987).汞(Hg)浓度依据国家水利行业标准要求的原子荧光光度法测定(SL 327.2-2005).
1.4 数据处理及统计分析通过Miseq测序平台对原始数据进行过滤处理,得到优化序列,然后进行OTU聚类分析,基于聚类分析结果,利用Mothur软件对97 %相似水平的OTU作多样性指数分析.群落结构分布基于测序结果利用Excel软件作图,PCA分析和Pearson分析利用SPSS软件完成,冗余分析利用Canoco 4.5软件完成.
2 结果与分析 2.1 重金属浓度分析鄱阳湖河湖交错带各样点表层水温差异较大,平均水温为11.5℃,水温最高为13℃,而最低只有9℃.水体pH值差异较小,平均为6.76,只有W5和H11点位大于7,其他点位均在平均值左右(表 1).各点位表层水体重金属浓度有明显差别:Hg浓度在N3点位(6.5×10-4 mg/L)最高,在W6和W7点位(5.2×10-4 mg/L)最低;Cu浓度在H11点位(0.14 mg/L)最高,在N1和N3点位(0.04 mg/L)最低;Zn浓度在W5点位(0.47 mg/L)最高,在N3点位(0.34 mg/L)最低;Pb浓度在R9点位(0.08 mg/L)最高,在W5点位(0.05 mg/L)最低;Cd浓度在W7点位(4.9×10-3 mg/L)最高,在G8点位(3.9×10-3 mg/L)最低. Hg、Cu、Zn、Pb和Cd的平均浓度分别为5.9×10-4、0.09、0.41、0.06和4.5×10-3 mg/L.与我国《地表水环境质量标准》(GB 3838-2002)相比,Hg浓度为Ⅳ类标准;Cu和Zn浓度均为Ⅱ类标准;Pb浓度为Ⅴ类标准;Cd浓度为Ⅱ类标准.可见Pb、Hg污染比较严重(表 2).
| 表 1 鄱阳湖河湖交错带表层水体的物理性质 Tab.1 Physical characteristics of surface water in lake-river ecotone of Lake Poyang |
| 表 2 鄱阳湖河湖交错带表层水体重金属浓度(mg/L)* Tab.2 Heavy metal concentrations of surface water in lake-river ecotone of Lake Poyang (mg/L) |
利用Miseq测序技术研究鄱阳湖河湖交错带表层水体微生物多样性,共检测到有效序列数351830条,平均每个样品31985条,序列平均长度为445.49 bp,覆盖率为99.93 % (图 2).当Rarefaction曲线趋向平坦时,说明测序数据量合理,更多的数据量只会产生少量新的OTU.
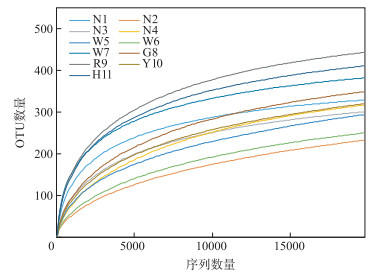
|
图 2 鄱阳湖河湖交错带表层水体微生物DNA序列的Rarefaction曲线和OTU数量关系 Fig.2 Rarefaction curves of OTUs clustered at 97 % 16S rRNA sequence identity across surface water in lake-river ecotone of Lake Poyang |
鄱阳湖河湖交错带表层水体共检测到OTU数量3618个,其中R9和H11点位的OTU数量最多,N2和W6点位最少(表 3).各样本的Coverage指数均在0.99以上,说明本次测序结果代表了样本中微生物的真实情况. Chao 1指数和Shannon指数都是R9点位(508.80,3.92)和H11点位(470.00,3.89)较高,N2点位(353.42,2.12)和W6点位(320.40, 2.19)较低,这说明R9和H11点位的微生物多样性相对较高,N2和W6点位的微生物多样性较低.而R9和H11点位的Simpson指数最低,N2和W6点位的Simpson指数最高,也证实了这一点(表 3).
| 表 3 鄱阳湖河湖交错带表层水体微生物多样性指数 Tab.3 Microbial diversity indices in lake-river ecotone of Lake Poyang |
鄱阳湖河湖交错带表层水体微生物主要包括:变形菌门(Proteobacteria,35.68 % ~87.00 %),平均含量为58.31 %;放线菌门(Actinobacteria,5.61 % ~22.78 %),平均含量为13.63 %;拟杆菌门(Bacteroidetes,1.84 % ~26.44 %),平均含量为9.69 %;疣微菌门(Verrucomicrobia,0.23 % ~7.43 %),平均含量为1.33 %.所以鄱阳湖河湖交错带表层水环境的优势菌主要是变形菌门和放线菌门.超过一半的样本变形菌门含量为50 %以上,含量最高的是N2点位(87.00 %),最低的是W7点位(35.68 %).放线菌门含量最高的是G8点位(22.78 %),最低的是W6点位(5.61 %),G8点位的放线菌门含量是W6点位的4倍多.拟杆菌门含量差异非常显著,最低为1.84 % (N2点位),而最高达到26.44 % (H11点位).而疣微菌门含量总体差异不大,基本都小于1 %,只有R9点位(7.43 %)和W7点位(2.00 %)两个样本超过了1 % (图 3),这与两地的污染情况有关. PCA分析结果(图 4)表明,H11点位离其他采样点非常远,R9和W7点位距离次之,说明H11、R9和W7点位污染严重,特别是H11点位.
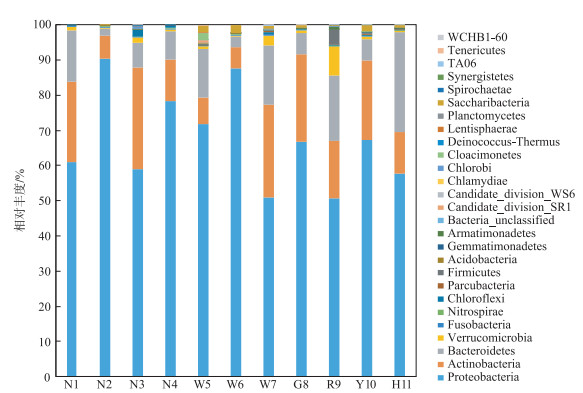
|
图 3 鄱阳湖河湖交错带表层水体微生物群落结构(门分类水平) Fig.3 Microbial community structure at phylum level in lake-river ecotone of Lake Poyang |
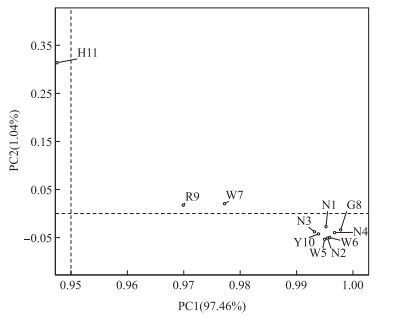
|
图 4 鄱阳湖河湖交错带表层水体微生物群落的主成分分析 Fig.4 Principal component analysis (PCA) of bacterial community in lake-river ecotone of Lake Poyang |
除了上述4种优势菌门外,OTU平均相对丰度大于0.1的还有Saccharibacteria(0~2.11 %)、厚壁菌门(Firmicutes,0~3.79 %)、绿弯菌门(Chloroflexi,0~1.21 %)、Cloacimonetes(0~2.10 %)、梭杆菌门(Fusobacteria,0~0.43 %)和硝化螺旋菌门(Nitrospirae,0.03 % ~0.27 %).
2.4 重金属对微生物多样性的影响从微生物多样性指数与重金属浓度之间的Pearson相关性可见,Cu浓度与Chao 1指数在0.05水平(双侧)上呈显著正相关;而其他重金属浓度与各个微生物的多样性指数都没有显著相关性(表 4).
| 表 4 鄱阳湖河湖交错带表层水体微生物多样性指数与重金属浓度的Pearson相关分析(n=11) Tab.4 Pearson correlation analysis among microbial diversity index and heavy metal concentrations in lake-river ecotone of Lake Poyang (n=11) |
从微生物多样性与水体相关物理性质的Pearson相关性分析发现,水温与OTU数量、Shannon指数和Simpson指数在0.05水平(双侧)上显著相关,其中与OTU数量和Shannon指数呈负相关,与Simpson指数呈正相关(表 5).水温升高一定程度上会导致微生物数量下降,水温是影响微生物多样性的一个关键因素.
| 表 5 鄱阳湖河湖交错带表层水体微生物多样性与水体物理性质的Pearson相关性(n=11) Tab.5 Pearson correlation analysis among microbial diversity index and physical characteristics of water in lake-river ecotone of Lake Poyang (n=11) |
为了更好地考察重金属浓度对微生物群落结构的影响,以重金属浓度作为环境变量,微生物门水平数据作为物种变量做冗余分析(图 5),其中轴1解释了23.2 %的环境变量,轴2解释了12.5 %的环境变量.结果表明,Cu浓度与Nitrospirae、TA06、Proteobacteria、Actinobacteria、Firmicutes、Chlamydiae、Bacteroidetes、Parcubacteria和Saccharibacteria等呈正相关,与Nitrospirae和TA06的相关性显著,与Fusobacteria呈显著负相关;Cd和Zn浓度与Bacteria_unclassified、Saccharibacteria、Tenericutes、Candidate、Lentisphaerae、Synergistetes、Cloacimonetes等呈正相关,与Bacteria_unclassified和Saccharibacteria的相关性显著,与Chloroflexi和Spirochaetae呈显著负相关;Hg浓度与Fusobacteria呈显著正相关,与Nitrospirae和TA06呈显著负相关;Pb浓度与Chloroflexi呈显著正相关,与Tenericutes、Candidate和Bacteria_unclassified呈显著负相关.这表明各种微生物对不同的重金属污染有一定的承受力,如Nitrospirae、TA06、Proteobacteria、Acidobacteria、Firmicutes、Chlamydiae、Bacteroidetes、Parcubacteria、Saccharibacteria等对Cu污染有一定的承受力,而Fusobacteria对Cu污染有指示作用.

|
图 5 冗余分析 Fig.5 RDA analysis |
本文通过Miseq平台测序发现鄱阳湖河湖交错带水体中微生物类群主要为变形菌门、放线菌门、拟杆菌门、疣微菌门,除了以上4种优势菌门还有Saccharibacteria、厚壁菌门、绿弯菌门、Cloacimonetes、梭杆菌门、硝化螺旋菌门.李璐等[9]利用分子生物学方法发现,巴丹吉林沙漠盐湖水体中主要细菌门类为γ-变形菌亚门、拟杆菌门、α-变形菌亚门、厚壁菌门和疣微菌门.任丽娟等[10]发现在湖泊水体中,典型的淡水细菌门类有21种,其中最主要的门类为变形菌门、蓝细菌门、拟杆菌门、放线菌门和疣微菌门.杜瑞芳等[11]运用PCR-DGGE技术发现乌梁素海湖滨湿地微生物群落中,优势菌门为变形菌门,相对丰度达78.6 %,其中ε变形菌纲为优势亚群.这说明变形菌门在湖泊中分布最广泛,对不同的生态环境的耐受力较高.吴兰等[12]和江玉梅等[13]都发现鄱阳湖水体和底泥沉积物中相对丰度最高的是变形菌门.本研究也发现了类似的结论.
3.2 重金属污染特征鄱阳湖河湖交错带Pb和Hg污染比较严重(表 2),究其原因,主要是河流上游的有色金属矿的开采与冶炼等人类活动影响.而已有的相关研究结果发现鄱阳湖水环境Cu污染严重,如万金保等[14]发现乐安河上游德兴铜矿、有色金属冶炼厂、化工厂等使下游水体、底泥和水生生物出现不同程度的Cu、Pb、Zn污染;张杰等[15]利用地累积指数法、潜在生态危害指数法和生态毒性效应等评价方法分析发现,鄱阳湖主要入湖口水体重金属污染程度顺序为Cu>Zn>Pb>Cd;刘惠民[16]在研究鄱阳湖水环境重金属污染中发现,重金属(Cu、Zn、Pb、Cd)浓度基本都超过国家标准.本研究与已有研究结果的差异,主要是研究方法、研究区域及研究时间等的差异导致的,深层原因则需要通过进一步采样研究.鄱阳湖的水质受五河流域的影响非常大,而河湖交错带同时受河流与湖泊双重影响,环境梯度大、微生物多样性丰富、初级生产力和次级生产力较高,是污染的缓冲区和净化区,因此,研究该区域的微生物群落与重金属污染之间的关系,为鄱阳湖流域重金属修复与治理实践提供了良好的理论与技术保障.
3.3 重金属对微生物多样性的影响近几年来,湖泊水体重金属污染日益成为湖泊研究的焦点,而重金属污染与环境微生物之间的相互关系研究则是重中之重.有研究表明微生物群落多样性明显受重金属污染的影响,而不同微生物类群对重金属的耐受程度不同[7-8];重金属Cu、Zn、Pb、Cd与微生物生物量都呈负相关[17],重金属污染影响了微生物细胞代谢等功能,使其多样性下降;尹华群也认为,通常污染程度较高的环境下微生物群落的丰度往往较低[18],即污染越严重导致微生物多样性越低.本研究中,G8点位的污染程度较高,导致该点位微生物多样性也低.但R9和H11点位重金属浓度都较高,而微生物多样性却较高(表 2和表 3). Feris等[19]研究表明,在特定的环境中,微生物多样性并不是随单一因子的改变而改变的,而是两个或两个以上的因子共同作用的结果,如pH、TOC、COD、TP、TN等. N3、N4点位Hg污染最严重,微生物多样性指数有明显的下降. N2、W6点位的微生物多样性最低,从表 2可以看出两点位的重金属污染都比较严重.总的来说,重金属污染一定程度上会导致微生物多样性的下降,但二者不是简单的线性关系,还受到其他因素的影响.
3.4 重金属对微生物群落结构的影响在特定的环境内,微生物的群落结构组成易受到周围环境变量的影响,如营养物循环、重金属浓度变化等[20-21].本研究通过分析重金属浓度与微生物门水平相对丰度之间的相关关系发现,重金属对微生物群落结构的影响非常强烈.有研究表明不同微生物对重金属污染的耐受力不同[22],本研究通过冗余分析(图 5)也得到类似结论.变形菌门在本研究中各个样点微生物群落结构中所占比例都最大,这说明变形菌门对重金属污染的耐受力非常强. Frazar等[23]与Gillan等[24]的研究也得出了类似的结论.变形菌门是细菌中最大的门,为革兰氏阴性菌,研究发现革兰氏阴性菌对Cu、Zn、Pb、Cd、Hg都有一定的耐受力,其中对Cu的耐受力较强[25]. N4和W5点位的Hg、Zn、Cd浓度明显高于G8、N1点位,而放线菌门的相对丰度却远低于G8、N1点位,这说明放线菌门对Hg、Zn、Cd的耐受力比较低,Hg、Zn、Cd一定程度上对放线菌门的生长具有抑制作用.
4 结论1) 鄱阳湖河湖交错带表层水体的Pb、Hg浓度为Ⅴ类和Ⅳ类标准,污染严重,而Cu、Zn、Cd均为Ⅱ类标准. R9、H11点位污染最严重,尤其是H11点位. R9点位位于乐安河,其上游重金属矿是导致污染严重的一个重要因素,H11点位位于湖口县,其钢铁冶炼等高污染产业是重要原因.
2) 鄱阳湖河湖交错带水体微生物群落主要为:变形菌门(平均含量为58.31 %)、放线菌门(平均含量为13.63 %)、拟杆菌门(平均含量为9.69 %)和疣微菌门(平均含量为1.33 %).
3) 变形菌门对重金属污染的耐受力很强. Hg、Zn、Cd对放线菌有一定的抑制作用.
4) 重金属污染较严重的R9、H11点位,微生物多样性却非常高,说明重金属污染对微生物多样性的影响不仅仅随单一因子的变化而变化,而是受多种因子共同作用.
| [1] |
Huang X, Hu B, Wang P et al. Microbial diversity in lake-river ecotone of Poyang Lake, China. Environ Earth Sci, 2016, 75: 965. DOI:10.1007/s12665-016-5473-0 |
| [2] |
Rader RB, Belk MC, Hotchkiss R et al. The stream-lake ecotone:Potential habitat for juvenile endangered June suckers (Chasmistes liorus). Western North American Naturalist, 2010, 70(4): 553-561. DOI:10.3398/064.070.0415 |
| [3] |
Yang SQ, Hao RX, Wu F et al. Characteristics of distribution of soil microorganisms in Dexing Copper Ore Deposit. Acta Scientiarum Naturalium Universitatis Pekinensis, 2016, 52(2): 287-294. [杨诗琴, 郝瑞霞, 吴沣等. 德兴铜矿地区土壤微生物的分布特征研究. 北京大学学报:自然科学版, 2016, 52(2): 287-294. DOI:10.13209/j.0479-8023.2015.110] |
| [4] |
Wang F, Huang YZ, Wang XL et al. Ecological risk assessment of heavy metals in surrounding soils of tungsten ores:Comparison of different evaluation methods. Environmental Chemistry, 2015, 34(2): 225-233. [王斐, 黄益宗, 王小玲等. 江西钨矿周边土壤重金属生态风险评价:不同评价方法的比较. 环境化学, 2015, 34(2): 225-233. DOI:10.7524/j.issn.0254-6108.2015.02.2014061802] |
| [5] |
Chen SH, Sun TH, Zhou QX et al. Interaction between microorganisms and heavy metals and its application. Chinese Journal of Applied Ecology, 2002, 13(2): 239-242. [陈素华, 孙铁珩, 周启星等. 微生物与重金属间的相互作用及其应用研究. 应用生态学报, 2002, 13(2): 239-242. DOI:10.13287/j.1001-9332.2002.0056] |
| [6] |
Zhang Y, Cui XY, Luo W. Effects of heavy metal pollutions on the ecological functions of soil microbes:A review. Asian Journal of Ecotoxicology, 2010, 5(3): 305-313. [张妍, 崔骁勇, 罗维. 重金属污染对土壤微生物生态功能的影响. 生态毒理学报, 2010, 5(3): 305-313.] |
| [7] |
Liu JX, Li C, Jing JH et al. Composition and environmental adaptation of microbial community in Shibahe Copper Tailing in Zhongtiao Mountain in Shanxi. Environmental Science, 2017, 38(1): 318-326. [刘晋仙, 李毳, 景炬辉等. 中条山十八河铜尾矿库微生物群落组成与环境适应性. 环境科学, 2017, 38(1): 318-326. DOI:10.13227/j.hjkx.201606201] |
| [8] |
Zhao J, Zhao X, Chao L et al. Diversity change of microbial communities responding to zinc and arsenic pollution in a river of northeastern China. Journal of Zhejiang University-Science B:Biomedicine & Biotechnology, 2014, 15(7): 670-680. DOI:10.1631/jzus.B1400003 |
| [9] |
Li L, Hao CB, Wang LH et al. Microbial diversity of salt lakes in Badain Jaran desert. Acta Microbiologica Sinica, 2015, 55(4): 412-424. [李璐, 郝春博, 王丽华等. 巴丹吉林沙漠盐湖微生物多样性. 微生物学报, 2015, 55(4): 412-424.] |
| [10] |
Ren LJ, He D, Xing P et al. Bacterial diversity and ecological function in lake water bodies. Biodiversity Science, 2013, 21(4): 421-432. [任丽娟, 何聃, 邢鹏等. 湖泊水体细菌多样性及其生态功能研究进展. 生物多样性, 2013, 21(4): 421-432. DOI:10.3724/SP.J.1003.2013.12052] |
| [11] |
Du RF, Li JY, Zhao J. Bacterial diversity in littoral wetland of Wuliangsuhai lake. Acta Microbiologica Sinica, 2014, 54(10): 1116-1128. [杜瑞芳, 李靖宇, 赵吉. 乌梁素海湖滨湿地细菌群落结构多样性. 微生物学报, 2014, 54(10): 1116-1128.] |
| [12] |
Wu L, Ge G, Gong SJ et al. Composition of bacterial community in the Lao Ye Miao Area of Lake Poyang. Resources and Environment in the Yangtze Basin, 2011, 20(8): 963-969. [吴兰, 葛刚, 龚世杰等. 鄱阳湖老爷庙水域细菌群落组成分析. 长江流域资源与环境, 2011, 20(8): 963-969.] |
| [13] |
Jiang YM, Zhang C, Huang XL et al. Effect of heavy metals in the sediment of Poyang Lake estuary on microbial communities structure base on Mi-seq sequencing. China Environmental Science, 2016, 36(11): 3475-3486. [江玉梅, 张晨, 黄小兰等. 重金属污染对鄱阳湖底泥微生物群落结构的影响. 中国环境科学, 2016, 36(11): 3475-3486. DOI:10.3969/j.issn.1000-6923.2016.11.034] |
| [14] |
Wang JB, Yan WW, Xie T. Research on heavy metals pollution status of Le'an River, Lake Poyang Basin. J Lake Sci, 2007, 19(4): 421-427. [万金保, 闫伟伟, 谢婷. 鄱阳湖流域乐安河重金属污染水平. 湖泊科学, 2007, 19(4): 421-427. DOI:10.18307/2007.0410] |
| [15] |
Zhang J, Chen X, Liu QC et al. Distribution and potential risk assessment of heavy metals in the main estuaries of Lake Poyang's tributaries. Resources and Environment in the Yangtze Basin, 2014, 23(1): 95-100. [张杰, 陈熙, 刘倩纯等. 鄱阳湖主要入湖口重金属的分布及潜在风险评价. 长江流域资源与环境, 2014, 23(1): 95-100. DOI:10.11870/cjlyzyyhj201401014] |
| [16] |
Liu HM. Research on heavy metals pollution in water environment of Poyang Lake. Environment Science and Technology, 1990(1): 1-5. [刘惠民. 鄱阳湖水环境重金属污染研究. 环境科学与技术, 1990(1): 1-5.] |
| [17] |
Wang XL, Xu JM, Yao HY et al. Effects of Cu, Zn, Cd and Pb compound contamination on soil microbial community. Acta Scientiae Circumstantiae, 2003, 23(1): 22-27. [王秀丽, 徐建民, 姚槐应等. 重金属铜、锌、镉、铅复合污染对土壤环境微生物群落的影响. 环境科学学报, 2003, 23(1): 22-27. DOI:10.13671/j.hjkxxb.2003.01.005] |
| [18] |
Yin HQ. Development and application of the microarray technology during the research on the structure and function of microbial communities for acid mine drainages from the copper mines[Dissertation]. Changsha:Central South University, 2007:35-37. [尹华群. 在铜矿矿坑水微生物群落结构与功能研究中基因芯片技术的发展与应用[学位论文]. 长沙: 中南大学, 2007: 35-37. ]
|
| [19] |
Feris K, Ramsey P, Frazar C et al. Differences in hyporheic-zone microbial community structure along a heavy-metal contamination gradient. Applied and Environ-mental Microbiology, 2003, 69(9): 563-5573. DOI:10.1128/AEM.69.9.5563-5573.2003 |
| [20] |
Liao PC, Huang BH, Huang S. Microbial community composition of the Danshui river estuary of Northern Tai-wan and the practicality of the phylogenetic method in microbial barcoding. Microbial Ecology, 2007, 54(3): 497-507. DOI:10.1007/s00248-007-9217-2 |
| [21] |
Simmons MP. Independence of alignment and tree search. Molecular Phylogenetics and Evolution, 2004, 31(3): 874-879. DOI:10.1016/j.ympev.2003.10.008 |
| [22] |
Prasad MNV. Metals in the environment:Analysis by biodiversity. Journal of Organometallic Chemistry, 2003, 669(1): 207-207. |
| [23] |
Frazar C, Gannon JE, Ramsey P et al. Differences in hyporheiczone microbial community structure along a heavy-metal contamination gradient. Applied Environmental Microbiology, 2003, 69: 5563-5573. DOI:10.1128/AEM.69.9.5563-5573.2003 |
| [24] |
Gillan DC, Danis B, Pernet P et al. Structure of sediment associated microbial communities along a heavy-metal contamination gradient in the marine environment. Applied Environmental Microbiology, 2005, 71(2): 679-690. DOI:10.1128/AEM.71.2.679-690.2005 |
| [25] |
Matyar F. Antibiotic and heavy metal resistance in bacteria isolated from the Eastern Mediterranean Sea coast. Bull Environ Contam Toxicol, 2012, 89: 551-556. DOI:10.1007/s00128-012-0726-4 |
 2018, Vol. 30
2018, Vol. 30 


