(2: 中南民族大学生命科学学院, 武汉 430074)
(2: College of Life Sciences, South-Central University for Nationalities, Wuhan 430074, P. R. China)
浮游动物是水生食物网中的重要一员,一方面通过牧食作用消耗一部分藻类初级生产力,另一方面它本身又是其他高营养级生物的食物来源,在水生态系统能量传递过程中起着重要的桥接作用.已有研究表明,光照、温度、食物和捕食等是影响浮游动物群落结构变化的主要因素.一般来说,温度是驱动浮游动物季节演替的主要因子[1];鱼类捕食会导致浮游动物群落结构的小型化[2-3];光照,尤其是紫外辐射,会诱发浮游动物的垂直迁移行为[4].这些因素对浮游动物群落结构的影响在过去几十年中得到了广泛的研究.
食物对浮游动物的影响一般多关注其数量效应,但近年来的研究表明食物质量,尤其是元素化学计量组成和不饱和脂肪酸含量,也会对浮游动物的群落结构产生重要影响[5-7].作为大部分浮游动物的食物源,悬浮物(seston)的营养质量,尤其是C/P比,得到了广泛关注.浮游动物组织中的元素组成比例各异[8],食物元素供应比例与需求比例之间的失谐可能影响其生活史.例如,溞类(Daphnia)是磷含量丰富的浮游动物,当喂食磷缺乏食物时,其生长和繁殖就会受到抑制[9-11].悬浮物的化学计量组成还会影响自然水体中浮游动物的优势物种组成[5]、生物量[12-13]和生理行为[14],甚至影响碳在生产者-初级消费者界面或食物链中的传递效率[15-16].另外,食物质量和数量对浮游动物短期生长和种群长期维持的作用不同,Andersen等[17]发现低光照处理中的高质量食物更易促进Daphnia生长,但高Daphnia生物量更易在食物质量较低但数量较多的高光照处理中出现. Sarpe等[9]也发现当食物质量高时,食物数量对Daphnia存活率影响显著,而当食物质量低时,不同食物数量处理中的Daphnia存活率均较低.
理化因子,如太阳辐射、营养盐、温度、pH、透明度等,对浮游动物的影响常见于在区域尺度上开展的比较研究[18-21].目前有关食物质量和数量对浮游动物影响的研究主要在室内或围隔实验中开展[15, 17, 22-24],野外直接的评价以食物质量较为常见[5, 12-13, 25],且常聚焦于单一种属Daphnia.考虑到夏季湖泊中植食性浮游甲壳动物的多样性较低,受高温和鱼类捕食影响大,本次采样选择在春季进行,在水体的选择上以水质相对较好的水库为主.本文的主要目的是通过对湖北省内14个水体的采样分析,探讨食物质量(以悬浮物C/P比和C/N比表示)、食物数量(以叶绿素a表示)以及其他理化因子在浮游甲壳动物群落结构塑造中的作用以及相对重要性.
1 研究方法 1.1 野外采样本研究选取湖北省范围内14个水体进行样品采集,其中湖泊4个,水库10个.野外采样分别在2014年和2015年的4月20日-5月9日进行.为了保证同一年采样时太阳辐射大致相同,所有的采样均在晴朗天气的上午10:00点左右进行,2周左右完成所有的采样工作.每一水体设置3个采样点.根据水体深浅,用5 L采水器按照间隔1 m的方式从水面往下采集15~20 L水样,充分混匀后取部分水样带回实验室用于营养盐、叶绿素a(Chl.a)浓度和悬浮物碳氮磷比测定.透明度(Secchi depth, SD)用塞氏盘现场测定;漫射衰减系数(Kd)用LI-COR 1400光量子计测定,计算公式为:
| $ {K_{\rm{d}}} =-\frac{1}{z}\ln \frac{{E\left( z \right)}}{{{E_0}}} $ | (1) |
式中,E(z)表示深度为z时的光照强度,E0表示水表面的光照强度,具体在0.2、0.5、1.0、1.5、2.0、2.5、3.0 m等深度处测定光照强度,然后回归分析得到的斜率绝对值即为Kd[26].
1.2 环境因子分析为了测定Chl.a浓度,将200~800 ml的混合水样通过GF/C膜过滤,滤膜对折用吸水纸吸干水分后放置在冰箱冷冻保存24 h,之后放入10 ml 90 %丙酮进行抽提,在冰箱保温室抽提16 h后离心,取上清液在分光光度计上测定吸光度,所用波长分别为630、645、663和750 nm.测Chl.a时过滤后的水样用于溶解性营养盐浓度的测定.总溶解性氮(TDN)浓度用碱性过硫酸钾消解,然后在紫外分光光度计上分别测定220和275 nm的吸光度.总溶解性磷(TDP)浓度经过硫酸钾消解后用钼酸铵比色法测定;氨氮(NH3-N)浓度用纳氏试剂比色法测定.上述环境因子的测定方法参考《水和废水监测分析方法》[27].各个水体的营养状态用综合营养状态指数(trophic state index, TSI)来衡量[28],该指数以TDP、Chl.a和SD为基础进行计算,公式为:
| $ TS{I_{{\rm{TDP}}}} = 4.15 + 14.42\ln \left( {{\rm{TDP}}} \right) $ | (2) |
| $ TS{I_{{\rm{Chl}}{\rm{.a}}}} = 30.6 + 9.81\ln \left( {{\rm{Chl}}{\rm{.a}}} \right) $ | (3) |
| $ TS{I_{{\rm{SD}}}} = 60-14.41\ln \left( {{\rm{SD}}} \right) $ | (4) |
| $ TSI = \left( {TS{I_{{\rm{TDP}}}} + TS{I_{{\rm{Chl}}{\rm{.a}}}} + TS{I_{{\rm{SD}}}}} \right)/3 $ | (5) |
式中,TDP和Chl.a的单位为μg/L,SD的单位为m.
1.3 浮游甲壳动物计数及计算浮游甲壳动物样品的采集通过64 μm浮游生物网的垂直拖曳来实现,上提速度约为0.5 m/s,采样深度为沉积物界面之上0.5 m到水面.采集的样品用福尔马林保存,最终浓度为5 %.物种组成和密度通过显微镜进行鉴定和计数,大部分浮游动物鉴定到种,只有数量较少的小型物种鉴定到属,枝角类和桡足类的鉴定参考文献[29-30].每一样品计数完毕后对优势物种随机选取30个进行体长测定,数量较少的物种则尽可能多地测量体长,然后利用体长-体重方程估算浮游动物的湿重[31],无节幼体未包含在本文的分析之中.
浮游甲壳动物群落的平均体长(mean body length, MBL)计算公式为:
| $ MBI = \sum\limits_{i = 1}^S {{x_i} \cdot {L_i}} /\sum\limits_{i = 1}^S {{x_i}} $ | (6) |
式中,S表示物种总数,xi表示第i个物种的密度,Li表示第i个物种的平均体长.
优势度计算公式为[32]:
| $ Y = {f_i} \cdot {n_i}/N $ | (7) |
式中,Y为优势度,ni为第i种出现的个体数,N为出现的总个体数,fi为第i种在各个站位出现的频率.为将优势种数目控制在一定范围内,规定当Y > 0.01时,该种为优势种.
1.4 悬浮物碳氮磷比测定在测定悬浮物碳氮磷比之前,混合水样先经64 μm筛绢过滤,去除浮游甲壳动物难于摄食的大颗粒物,然后用提前灼烧好的GF/F玻璃纤维滤膜(500℃, 3 h)过滤尽可能多的水样,之后用1 mol/L盐酸润洗去除无机碳的影响.滤膜经50℃干燥至恒重后在坩埚中碾磨成粉末用于元素测定.碳、氮含量用Carlo Erba NC2500元素分析仪测定;磷含量的测定同水样,先取一定量的滤膜粉末经碱性过硫酸钾氧化,然后离心取上清液测定.
1.5 统计分析由于用于分析的理化和食物因子在单位和数值大小上不同,为减少因为数值大小而引起的分析错误,在分析之前对所有数据均进行以10为底的对数转换.浮游甲壳动物群落结构特征与食物和理化因子之间的相关分析利用SPSS 14.0软件完成.浮游甲壳动物密度矩阵的除趋势对应分析(detrended correspondence analysis, DCA)最大梯度长度为3.2,表明基于单峰模型的典范对应分析(canonical correspondence analysis, CCA)更适合本研究. DCA和CCA分析通过CANOCO 5.0软件包实现,在进行向前选择法时显著性水平设置为P < 0.05,蒙特卡罗置换检验次数设为999.
2 结果与分析 2.1 采样水体理化特征采样水体的TDN浓度变化范围为0.55~3.24 mg/L,平均值为1.44 mg/L. TDP和NH3-N浓度平均值则分别为0.07和0.69 mg/L. Chl.a浓度平均值为13.8 μg/L,最小值出现在王英水库(1.1 μg/L),最大值出现在高坝洲水库(52.8 μg/L).根据TSI值,75 %的水体为富营养状态,剩下的25 %处于中营养状态. Kd约有1个数量级的变异范围,最小值出现在蔡贤水库(0.34 m-1),最大值出现在汤逊湖(3.33 m-1).悬浮物的C/N比变化范围较小,均值为8.1,最大值出现在蔡贤水库(12.2),最小值出现在2014年的梁子湖(6.0);C/P比变化范围较大,最大值出现在牛山湖(307),最小值(59)出现在罗桥水库,均值为139(表 1).
| 表 1 采样水体理化因子和悬浮物碳氮磷比 Tab.1 Physicochemical factors and seston stoichiometry in the sampling water bodies |
在本次采样中,共计鉴定到浮游甲壳动物22种,其中枝角类13种,桡足类9种.优势种为汤匙华哲水蚤(Sinocalanus dorrii)、透明溞(Daphnia hyalina)、近邻剑水蚤(Cyclops vicinus vicinus)、简弧象皮溞(Bosmina coregoni)、台湾温剑水蚤(Thermocyclops taihokuensis)和广布中剑水蚤(Mesocyclops leuckarti).在现存量组成上,密度和生物量最大值分别出现在高坝洲水库(32.7 ind./L)和2014年的梁子湖(1.05 mg/L);最小值均出现在汤逊湖,分别为0.49 ind./L和0.02 mg/L(图 1).
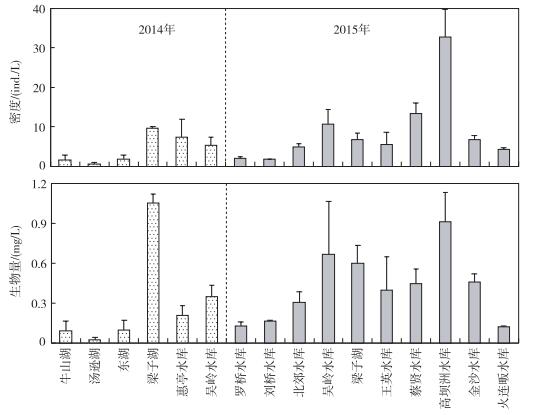
|
图 1 浮游甲壳动物密度和生物量 Fig.1 Density and biomass of crustacean zooplankton |
在群落结构组成上(图 2),近邻剑水蚤是罗桥水库、北郊水库和汤逊湖的绝对优势种,相对密度分别为98.2 %、80.0 %和70.8 %;该物种在刘桥水库、惠亭水库和东湖也占有一定优势,相对密度分别为19.2 %、15.4 %和21.8 %.透明溞在9个水体中为优势种,相对密度为27.2 % ~82.9 %,平均值为65.3 %.在吴岭水库、王英水库、牛山湖和梁子湖,与透明溞同时出现的另一优势物种为汤匙华哲水蚤,相对密度分别达到了20.7 %、8.9 %、27.9 %、14.9 % (2014年梁子湖)和39.3 % (2015年梁子湖),此物种在刘桥水库(67.1 %)、2014年的吴岭水库(42.5 %)和东湖(24.7 %)相对密度也较大.简弧象皮溞仅在高坝洲水库(23.2 %)和2014年的吴岭水库(38.3 %)占有较大优势,在刘桥水库、蔡贤水库、2014年的惠亭水库中相对密度约为10 %.台湾温剑水蚤和广布中剑水蚤由于成体数量较少,两者的幼体难于区分,故合并在一起考虑,两者在火连畈水库和东湖相对密度较大,分别为69.9 %和22.7 %.高坝洲的其余种类相对密度较大,主要由方形网纹溞(Ceriodaphnia quadrangular)和颈沟基合溞(Bosminopsis deitersi)贡献.浮游甲壳动物群落的平均体长变化范围为0.59~1.10 mm,均值为0.85 mm,最大值出现在梁子湖,最小值出现在汤逊湖.
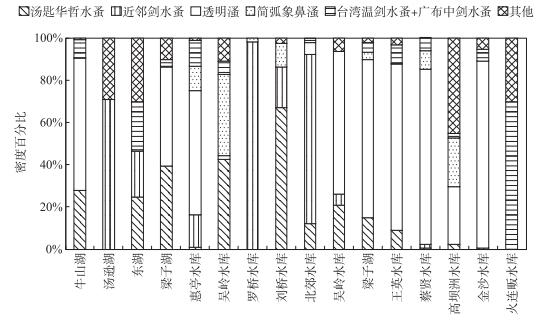
|
图 2 浮游甲壳动物群落的百分比组成 Fig.2 Percentage composition of crustacean zooplankton community |
相关分析显示,浮游甲壳动物生物量和密度与Kd均呈显著负相关(P < 0.05);平均体长随Chl.a浓度的增加而显著减小(r=-0.54, P=0.029);Daphnia的相对生物量与Kd也呈显著负相关(r=-0.68, P=0.015).浮游甲壳动物群落结构特征参数与营养盐和悬浮物C/N、C/P比均无显著相关性(P>0.05)(表 2).
| 表 2 浮游甲壳动物群落结构特征与环境因子的相关分析 Tab.2 Pearson correlation between characteristics of crustacean zooplankton community and environmental factors |
CCA分析显示7个环境因子共解释了优势浮游甲壳动物群落结构变异的37.4 %,经向前法选择后,保留在模型中的2个因子按贡献率排序为Kd和Chl.a,分别解释了群落结构总变异的11.5 % (P=0.006)和8.9 % (P=0.010).虽然排在第3、4位的C/N比和C/P比对群落结构变异解释的显著性水平分别为P=0.058和P=0.056,考虑到较少的环境因子进入模型,我们依然把这两个边际显著的因子纳入分析之中,它们分别解释了群落结构总变异的5.6 %和4.9 %,4个因子共解释了优势浮游甲壳动物群落结构总变异的30.8 % (表 3).由图 3可知,近邻剑水蚤喜好生活在Chl.a浓度高、水下光照弱的水体中,而汤匙华哲水蚤则喜好生活在水下光照较好、Chl.a浓度和悬浮物C/N比较低的水体中.透明溞喜好生活在Chl.a浓度较低、光照良好、悬浮物C/P比较高的水体中,而简弧象皮溞喜好生活在Chl.a浓度高、光照良好、悬浮物C/P比较小的水体中.台湾温剑水蚤和广布中剑水蚤喜好生活在Chl.a浓度较高、光照较好、悬浮物C/P比和C/N比较低的水环境中.
| 表 3 优势浮游甲壳动物与环境因子经向前选择法分析后的统计 Tab.3 Statistical table between dominant crustacean zooplankton and environmental factors after forward selection |
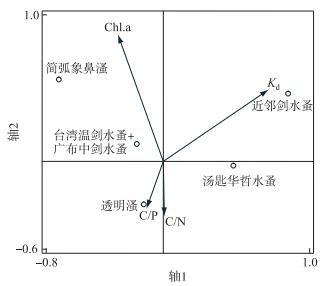
|
图 3 优势物种与环境因子的关系 Fig.3 Relationship between dominant species and environmental factors |
食物对浮游甲壳动物的影响包括食物数量和食物质量两个方面.有研究发现,浮游动物生物量,尤其是其中Daphnia的生物量与悬浮物C/P比呈显著负相关[5, 13, 25],但在本文中未发现该规律.一般来说,Daphnia对食物中C/P比的需求阈值是350左右[33],大于该值,其可能会因磷的摄入不足而导致种群衰退.在本研究中,所有采样水体的悬浮物C/P比均小于该阈值,但在具体的群落组成上,并不是所有水体均有Daphnia出现,如在无Daphnia的罗桥水库、北郊水库、火连畈水库和汤逊湖,虽然C/P比均小于150,但剑水蚤是其优势类群组成,一个明显的特点是这些水体的氮、磷含量均较高,且存在高强度的鱼类养殖活动.另外,过低的食物C/P比也会对Daphnia生长和繁殖产生负面影响,Elser等[34]发现,当食物C/P比小于120时,Daphnia生长变慢、呼吸作用变强.在本文中,悬浮物C/P比大都小于200,仅有4个水体的C/P比小于120,CCA分析发现Daphnia喜好生活在悬浮物C/P比较高的水体中.同时,浮游甲壳动物的平均体长随Chl.a浓度的增加而变小.在食物数量增加、食物质量能保证大个体Daphnia生存的情况下,这种变小的平均体长从侧面证实了部分水体存在较强的鱼类捕食作用[35].但在平均体长最小的高坝洲水库,小型枝角类(B. coregoni、C. quadrangular和B. deitersi)占比达到了68.5 %,群落组成的小型化可能更多与浮游植物的群落结构组成有关[36],而非鱼类的捕食,因为该水体为河道型水库,在采样时有大量的角甲藻出现,水色呈浅棕色.另外,如果食物源中细菌占有较大比例,小型枝角类的竞争优势也会大于Daphnia[37].在其余无Daphnia出现的水体,如刘桥水库、东湖,虽然也存在渔业活动,但个体较大的汤匙华哲水蚤在浮游动物群落中占有较大优势.一般来说,哲水蚤对食物中N的需求较高[5]. CCA分析也发现,汤匙华哲水蚤倾向于在悬浮物C/N比低的水体中出现峰值.肉食性的剑水蚤则倾向于在低C/N和C/P比、高Chl.a浓度的环境,亦即富营养化水体中出现,典型如罗桥水库、北郊水库、火连畈水库、汤逊湖和东湖.对荷兰Loosdrecht湖长达9年的研究发现,低磷需求的象鼻溞和剑水蚤丰度与悬浮物C/P比的关系并不大[25].比较2014年和2015年吴岭水库、梁子湖的浮游甲壳动物群落结构,可以看到当Daphnia优势地位降低后,汤匙华哲水蚤比例随即增大,这种变化到底是由食物因子还是鱼类捕食抑或其他因素引起,需要在今后的研究中进一步探索.
一般来说,随着食物数量增加,浮游甲壳动物生物量也上升,这在许多野外研究中得到了证实.但这种增加的趋势也会因鱼类捕食的存在而发生改变,如在长江中下游的浅水湖泊中,当总磷(TP)>0.097 mg/L时,浮游甲壳动物生物量因鱼类捕食而变得不确定,甚至在超富营养湖泊中,浮游甲壳动物生物量随Chl.a浓度的上升而下降[38].在本研究中,浮游甲壳动物密度和生物量均与Chl.a浓度不存在显著相关性.虽然本文未直接测定TP浓度,但78 %水体的TDP浓度均高于0.07 mg/L,而且所选择的水库和湖泊大都存在渔业活动,这种浮游动物现存量与食物数量之间的不显著相关可能源自鱼类的捕食作用,在亚热带的佛罗里达和温带的新西兰浅水湖泊中也发现了类似现象,鱼类捕食导致了浮游动物现存量与Chl.a浓度之间的弱或无相关性[39-41].
3.2 理化因子对浮游甲壳动物群落结构的影响水体光照漫射衰减系数可以说是营养盐、藻类、碎屑、有色可溶性有机物等指标的一个综合反映[26].虽然在本研究中浮游甲壳动物现存量与Chl.a和营养盐浓度间没有显著相关性,但Kd与浮游甲壳动物生物量和密度均呈显著负相关;而且Daphnia的相对生物量与Kd也呈显著负相关,表明Kd在浮游动物现存量的预测中具有一定优势,而且该指标简单方便易得.目前为止,许多关于浮游动物生物量预测的研究主要在温带湖泊开展,预测指标以TP和Chl.a浓度为主,但这两个指标在亚热带和热带水体的应用中经常出现弱相关或无相关性,并没有显示如温带那样的优越性.考虑到亚热带湖泊具有许多异于温带湖泊的特点,如水生植被稀少、鱼类捕食强烈等,应该在将来的研究中比较Kd与营养盐和Chl.a浓度在预测浮游动物生物量时的优劣. CCA分析发现,近邻剑水蚤喜好生活在水下光照较弱的水体,从其具体分布来看,主要出现在罗桥水库、北郊水库、汤逊湖和东湖,该物种易在富营养水体的冬季和早春形成优势种群,可以作为水体富营养化的指示物种.相比较而言,Daphnia喜好在水下光照较好的环境中出现,此时悬浮物C/P比和Chl.a浓度均较低. Laspoumaderes等[5]研究发现光照梯度对应着食物质量的改变,从而影响不同营养需求浮游动物优势种群的建立.
从对群落结构影响的贡献来讲,Kd贡献最大,这可能与其为指示水体综合性能的指标有关;食物数量排在第2位,食物质量次之.考虑到本次研究的水体悬浮物C/P比和C/N比均较低,悬浮物组成可能以藻类为主(未发表数据),亦即均具有较好的食物质量,所以在群落优势物种现存量的维持上以食物数量的影响较大,这与室内实验的结果相一致[9, 17].整体来看,食物因子解释了群落结构总变异的19.4 %,理化因子解释了18.0 %,还剩下62.6 %的变异未被解释,表明还有其他更为重要的环境因子未被纳入到分析之中,如鱼类的捕食压力.也有研究发现,水体中Ca浓度和DOC质量较低时会降低Daphnia的存活率[42-43].更多的影响因子应在将来的研究中有所体现,这样才能更好地解释不同水体中浮游动物群落结构的组成差异,为水生态系统的健康发展和管理提供科学的理论支持.
| [1] |
Sommer U, Gliwicz ZM, Lampert W et al. The PEG-model of seasonal succession of planktonic events in freshwaters. Archiv für Hydrobiologie, 1986, 106: 422-477. |
| [2] |
Mills EL, Green DM, Schiavone JA. Use of zooplankton size to assess the community structure of fish populations in freshwater lakes. North American Journal of Fisheries Management, 1987, 7: 369-378. DOI:10.1577/1548-8659(1987)7<369:UOZSTA>2.0.CO;2 |
| [3] |
Romo S, Miracle MR, Villena MJ et al. Mesocosm experiments on nutrient and fish effects on shallow lake food webs in a Mediterranean climate. Freshwater Biology, 2004, 49: 1593-1607. DOI:10.1111/fwb.2004.49.issue-12 |
| [4] |
Rhode SC, Pawlowskl M, Tollrian R. The impact of ultraviolet radiation on the vertical distribution of zooplankton of the genus Daphnia. Nature, 2001, 412: 69-72. DOI:10.1038/35083567 |
| [5] |
Laspoumaderes C, Modenutti B, Souza MS et al. Glacier melting and stoichiometric implications for lake community structure:zooplankton species distributions across a natural light gradient. Global Change Biology, 2013, 19: 316-326. |
| [6] |
Park S, Müller-Navarra DC, Goldman CR. Seston essential fatty acids and carbon to phosphorus ratios as predictors for Daphnia pulex dynamics in a large reservoir, Lake Berryessa. Hydrobiologia, 2003, 505: 171-178. |
| [7] |
McCarthy V, Donohue I, Irvine K. Field evidence for stoichiometric relationships between zooplankton and N and P availability in a shallow calcareous lake. Freshwater Biology, 2006, 51: 1589-1604. |
| [8] |
Andersen T, Hessen DO. Carbon, nitrogen, and phosphorus content of freshwater zooplankton. Limnology and Oceanography, 1991, 36: 807-814. DOI:10.4319/lo.1991.36.4.0807 |
| [9] |
Sarpe D, de Senerpont LN, Declerck SAJ et al. Food quality dominates the impact of food quantity on Daphnia life history:possible implications for re-oligotrophication. Inland Waters, 2014, 4: 363-368. DOI:10.5268/IW |
| [10] |
Park S, Brett MT, Müller-Navarra DC et al. Essential fatty acid content and the phosphorus to carbon ratio in cultured algae as indicators of food quality for Daphnia. Freshwater Biology, 2002, 47: 1377-1390. |
| [11] |
Ravet JL, Brett MT. Phytoplankton essential fatty acid and phosphorus content constraints on Daphnia somatic growth and reproduction. Limnology and Oceanography, 2006, 51: 2438-2452. DOI:10.4319/lo.2006.51.5.2438 |
| [12] |
Hessen DO. Determinants of seston C:P-ratio in lakes. Freshwater Biology, 2006, 51: 1560-1569. DOI:10.1111/fwb.2006.51.issue-8 |
| [13] |
McCarthy V, Irvine K. A test of stoichiometry across six Irish lakes of low-moderate nutrient status and contrasting hardness. Journal of Plankton Research, 2010, 32: 15-29. DOI:10.1093/plankt/fbp103 |
| [14] |
Wagner ND, Yang Z, Scott AB et al. Effects of algal food quality on free amino acid metabolism of Daphnia. Aquatic Sciences, 2017, 79: 127-137. DOI:10.1007/s00027-016-0484-1 |
| [15] |
Urabe J, Kyle M, Makino W et al. Reduced light increases herbivore production due to stoichiometric effects of light/nutrient balance. Ecology, 2002, 83: 619-627. DOI:10.1890/0012-9658(2002)083[0619:RLIHPD]2.0.CO;2 |
| [16] |
Dickman EM, Newell JM, González MJ et al. Light, nutrients, and food-chain length constrain planktonic energy transfer efficiency across multiple trophic levels. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105: 18408-18412. DOI:10.1073/pnas.0805566105 |
| [17] |
Andersen T, Færøvig PJ, Hessen DO. Growth rate versus biomass accumulation:different roles of food quality and quantity for consumers. Limnology and Oceanography, 2007, 52: 2128-2134. DOI:10.4319/lo.2007.52.5.2128 |
| [18] |
Hessen DO, Andersen T, Faafeng BA. Replacement of herbivore zooplankton species along gradients of ecosystem productivity and fish predation pressure. Canadian Journal of Fisheries and Aquatic Sciences, 1995, 52: 433-442. |
| [19] |
Pinel-Alloul1 B, André A, Legendre P et al. Large-scale geographic patterns of diversity and community structure of pelagic crustacean zooplankton in Canadian lakes. Global Ecology and Biogeography, 2013, 22: 784-795. |
| [20] |
Xiong W, Li J, Chen Y et al. Determinants of community structure of zooplankton in heavily polluted river ecosystems. Scientific Reports, 2016, 6: 22043. DOI:10.1038/srep22043 |
| [21] |
Wang SB, Xie P, Wu SK et al. Crustacean zooplankton distribution patterns and their biomass as related to trophic indicators of 29 shallow subtropical lakes. Limnologica, 2007, 37: 242-249. |
| [22] |
Miiller-Navarra1 D, Lampert W. Seasonal patterns of food limitation in Daphnia galeata:separating food quantity and food quality effects. Journal of Plankton Research, 1996, 18: 1137-1157. DOI:10.1093/plankt/18.7.1137 |
| [23] |
Hessen DO, Færøvig PJ, Andersen T. Light, nutrients, and P:C ratios in algae:grazer performance related to food quality and quantity. Ecology, 2002, 83: 1886-1898. DOI:10.1890/0012-9658(2002)083[1886:LNAPCR]2.0.CO;2 |
| [24] |
Hall SP, Leibold MA, Lytle DA et al. Stoichiometry and planktonic grazer composition over gradients of light, nutrients, and predation risk. Ecology, 2004, 85: 2291-2301. DOI:10.1890/03-0471 |
| [25] |
DeMott WR, Gulati RD. Phosphorus limitation in Daphnia:evidence from a long term study of three hypereutrophic Dutch lakes. Limnology and Oceanography, 1999, 44: 1557-1564. |
| [26] |
Zhang YL, Qin BQ, Yang LY. Spectral absorption coefficients of particulate matter and chromophoric dissolved organic matter in Meiliang Bay of Lake Taihu. Acta Ecologica Sinica, 2006, 26: 3969-3979. [张运林, 秦伯强, 杨龙元. 太湖梅梁湾水体悬浮颗粒物和CDOM的吸收特性. 生态学报, 2006, 26: 3969-3979. DOI:10.3321/j.issn:1000-0933.2006.12.007] |
| [27] |
"Water and wastewater monitoring and analysis method" editorial board of State Environmental Protection Administration of China. Monitoring and analysis methods of water and wastewater:fourth edition. Beijing: China Environmental Science Press, 2002. ["国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第4版. 北京: 中国环境科学出版社, 2002.]
|
| [28] |
Zhang M, Yu Y, Yang Z et al. The distribution of phytoplankton along trophic gradients and its mediation by available light in the pelagic zone of large eutrophic lakes. Canadian Journal of Fisheries and Aquatic Sciences, 2012, 69: 1935-1946. |
| [29] |
Jiang XZ, Du NS. Fauna Sinica, Crustacea:Freshwater Cladocera. Beijing: Science Press, 1979. [蒋燮治, 堵南山. 中国动物志:淡水枝角类. 北京: 科学出版社, 1979.]
|
| [30] |
Shen JR. Fauna Sinica, Crustacea:Freshwater Copepoda. Beijing: Science Press, 1979. [沈嘉瑞. 中国动物志:淡水桡足类. 北京: 科学出版社, 1979.]
|
| [31] |
Huang XF, Chen WM, Cai QM. Survey, observation and analysis of lake ecology. Beijing: Standards Press of China, 1999. [黄祥飞, 陈伟民, 蔡启铭. 湖泊生态调查观测与分析. 北京: 中国标准出版社, 1999.]
|
| [32] |
Xu ZL, Chen YQ. Intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea. Journal of Ecology, 1989, 8: 13-15. [徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 1989, 8: 13-15.] |
| [33] |
Becker C, Boersma M. Resource quality effects on life histories of Daphnia. Limnology and Oceanography, 2003, 48: 700-706. |
| [34] |
Elser JJ, Kyle M, Learned J et al. Life on the stoichiometric knife-edge:effects of high and low food C:P ratio on growth, feeding, and respiration in three Daphnia species. Inland Waters, 2016, 6: 136-146. |
| [35] |
Brooks JL, Dodson SI. Predation, body size, and composition of plankton. Science, 1965, 150: 28-35. DOI:10.1126/science.150.3692.28 |
| [36] |
Sun X, Tao M, Qin B et al. Large-scale field evidence on the enhancement of small-sized cladocerans by Microcystis blooms in Lake Taihu, China. Journal of Plankton Research, 2012, 34: 853-863. |
| [37] |
Iwabuchi T, Urabe J. Phosphorus acquisition and competitive abilities of two herbivorous zooplankton, Daphnia pulex and Ceriodaphnia quadrangular. Ecological Research, 2010, 25: 619-627. DOI:10.1007/s11284-010-0692-4 |
| [38] |
Wang SB. Zooplankton ecology in shallow lakes along the middle and lower reaches of the Yangtze River[Dissertation]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2008. [王松波. 长江中下游浅水湖泊的浮游动物生态学研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2008. ]
|
| [39] |
Bays JS, Crisman TL. Zooplankton and trophic state relationships in Florida lakes. Canadian Journal of Fisheries and Aquatic Sciences, 1983, 40: 1813-1819. DOI:10.1139/f83-210 |
| [40] |
Jeppesen E, Lauridsen TL, Mitchell SF et al. Trophic structure in the pelagial of 25 shallow New Zealand lakes:changes along nutrient and fish gradients. Journal of Plankton Research, 2000, 22: 951-968. |
| [41] |
Havens KE, Elia AC, Taticchi MI et al. Zooplankton-phytoplankton relationships in shallow subtropical versus temperate lakes Apopka (Florida, USA) and Trasimeno (Umbria, Italy). Hydrobiologia, 2009, 628: 165-175. DOI:10.1007/s10750-009-9754-4 |
| [42] |
Geddes P. Experimental evidence that subsidy quality affects the temporal variability of recipient zooplankton communities. Aquatic Sciences, 2015, 77: 609-621. DOI:10.1007/s00027-015-0406-7 |
| [43] |
Prater C, Wagner ND, Frost PC. Effects of calcium and phosphorus limitation on the nutritional ecophysiology of Daphnia. Limnology and Oceanography, 2016, 61: 268-278. |
 2018, Vol. 30
2018, Vol. 30 

