(2: 中国科学院大学, 北京 100049)
(3: 江西省山江湖开发治理委员会办公室, 南昌 330046)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Office of the Mountain-River-Lake Development Committee of Jiangxi Province, Nanchang 330046, P. R. China)
水文过程在湿地发育、维持、演替直至消亡的全过程中起着重要作用[1],它是形成湿地植被空间和时间异质性的关键控制性因子,其变化会引起湿地生态系统结构和功能的变化[2-3].湿地环境中,虽然淹水频率和淹水历时等与湿地植被的分布格局以及湿地植物的生长有密切的联系[4-6],但是地下水位对湿地具有重要的顶托作用,地下水位的变化影响湿地生态系统的结构和功能[1],在非淹水期,湿地植被的生长主要依赖于降水和地下水持续向表层土壤供给的水源.在干旱区与半干旱区,地下水位是最重要的环境因子之一,植被的生长和发展变化与地下水的相关研究已经开展了很多[7-9];然而在湿地生态环境中,虽然地下水位是决定群落结构的重要因子[10-12],对湿地植被的萌发、生长以及繁殖起关键作用[13-14],但地下水位与植被的研究仍然相对缺乏.在非淹水期,湿地中地下水位的高低直接影响植被生长是否面临干旱胁迫以及所受到的胁迫程度,干旱胁迫下植被通过表型可塑性的调节作用来适应逆境环境[15-16],同时植物体通过调节体内的抗氧化酶活性和游离脯氨酸等来清除活性氧自由基等有害物质,从而抵抗干旱胁迫[17-18].在地下水位以及干旱胁迫对植被的影响研究中,植物的株高和生物量等是重要的分析指标,而植物的生理特征则是机理探讨的主要依据.
灰化薹草(Carex cinerascens)是鄱阳湖湿地广泛分布的物种之一,其生物量和株高等形态学性状的季节变化及其植被群落的分布和组成结构等已经被认识[19-20],其群落分布位置和面积会受到鄱阳湖湿地水文条件的影响[21-22],已有研究探明了灰化薹草带土壤水分条件及养分等因子的关系[23-25],也有学者通过控制实验研究湿地植被对水文条件的响应,试图从机理方面来解释水文条件与植被生长之间的关系[26-27],但地下水位对植被生长的影响特征及机理分析仍然相对缺乏,尤其是灰化薹草如何响应高变幅地下水位条件的研究工作还未开展.
本研究通过设置高变幅的地下水位梯度,开展灰化薹草对不同地下水位条件的响应研究,从形态、生物量和生理特征角度来分析地下水位条件改变对灰化薹草生长的影响以及探讨灰化薹草的适宜水位条件.研究结果有助于加强鄱阳湖湿地植被的基础研究,有助于预测未来鄱阳湖不同水文情势下湿地植被的发展演替过程,并为水位与植被的交互关系研究提供数据支撑和方法借鉴.
1 材料和方法 1.1 试验材料灰化薹草隶属莎草科苔草属,是多年生草本植物,花果期为4-5月,以地下茎和根的分蘖繁殖为主,根主要分布在地表下30 cm内.在鄱阳湖区,灰化薹草是重要的建群种之一,其植被带的分布高程为13~16 m[28],群落结构单一,有少量藜蒿(Artemisia selengensis)、通泉草(Mazus japonicus)、肉根毛茛(Ranunculu spolii)和山苦荬(Ixeris chinensis)等伴生种分布在群落中下层,选择灰化薹草进行湿地植被对不同地下水位的响应研究具有一定代表性.
2014年2月底在中国科学院鄱阳湖湿地观测研究站附近洲滩的灰化薹草带采集15个直径38 cm、高30 cm的灰化薹草原状土壤(包括有机质土壤层、根系和地上部分),每个原状土壤上生长灰化薹草234±36棵,植株高度为7.00±1.72 cm,土壤总有机碳(TOC)、总氮(TN)和总磷(TP)含量分别为27.19、1.43和0.86 g/kg.
1.2 试验设计试验在中国科学院鄱阳湖湖泊湿地观测研究站(29°27′4″N,116°3′44″E)的控制试验场进行,于2014年2月下旬开始,至2014年7月中下旬收获数据.设置10、20、40、80和120 cm 5个地下水埋深处理,每个处理3个重复,对应的实验装置为高50、50、60、100和120 cm,直径38 cm的有机玻璃柱.有机玻璃柱底端5 cm处通过软管连接一个小型的储水罐,用于调节有机玻璃柱内的地下水位,每个有机玻璃柱底端均填充10 cm厚的粗砂,以保证有机玻璃柱与储水罐间内水位连通性.有机玻璃柱顶端为从洲滩采集的30 cm高的原状土壤,中间部分则填充来自洲滩上30 cm以下的经过充分混匀的土壤.有机玻璃柱外壁贴有刻度尺以确定地下自由水面的位置,有机玻璃柱外包围锡箔纸以模拟根部的黑暗环境,详细试验设计可参考文献[11].开始1周之内每天补充定量水分,保持土壤湿润,帮助灰化薹草群落从受扰动状态恢复,之后每天7:00点和17:00点对水位进行调节,下雨影响后进行人工排水.
1.3 数据获取使用TRIME-PICO TDR32便携式土壤水分测量仪定期测定表层土壤水分含量. 6月中下旬测定灰化薹草长势最旺盛时的株高、叶长、叶宽和叶片数,7月末在灰化薹草植株累积一定能量后测定灰化薹草的地上部分生物量以及叶片内超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、游离脯氨酸(Pro)含量[29]和叶绿素(Chl,包括Chl.a和Chl.b)含量[30].
1.4 统计分析利用Lilliefors检验和Levene's检验进行正态分布检验和方差齐次检验,不满足正态分布和方差齐性的数据进行对数转换,单因素方差分析用于分析处理间数据是否存在差异显著性,之后组间多重比较采用Turkey检验,转换后仍不满足方差齐性的数据进行Kruskal-Wallis非参数检验,通过SPSS软件进行统计分析,通过Origin 8.5软件做图.
2 结果与分析 2.1 地下水位对土壤表层水分含量的影响不同的地下水位埋深显著影响表层土壤的水分含量(F=219.789, df=4, P < 0.001),随着地下水位埋深的增加,表层土壤的水分含量呈降低的趋势.地下水位埋深10 cm处理组的土壤表层水分含量最高,为69.27 % ±1.65 %,显著高于其他处理组(P < 0.05).地下水位埋深80 cm(38.64 % ±1.89 %)和120 cm(37.81 % ±0.38 %)处理组间表层土壤水分含量的差异不显著(P>0.05),但显著低于其他处理组(P < 0.05).地下水位埋深20和40 cm处理组表层土壤水分含量分别为56.88 % ±1.77 %和43.75 % ±1.71 %,两者之间差异显著(P < 0.05).
2.2 地下水位对灰化薹草形态指标的影响不同的地下水位埋深显著影响灰化薹草的株高(F=14.284, df=4, P < 0.001),随着地下水位埋深的增加灰化薹草的株高呈下降的趋势.处理组间的差异主要来自于地下水位10 cm处理组(41.59±5.38 cm)与其他处理组之间(P < 0.05).灰化薹草的叶长受到地下水位的显著影响(F=15.739, df=4, P < 0.001),地下水位40、80和120 cm处理组间的灰化薹草叶长差异不显著,分别为21.85±3.34、20.00±1.85和20.65± 1.37 cm,但显著低于地下水位10 cm处理组(34.00±3.79 cm).不同地下水位处理组间灰化薹草的叶片数均为4片左右,没有显著差异(F=1.364, df=4, P < 0.314)(图 1).
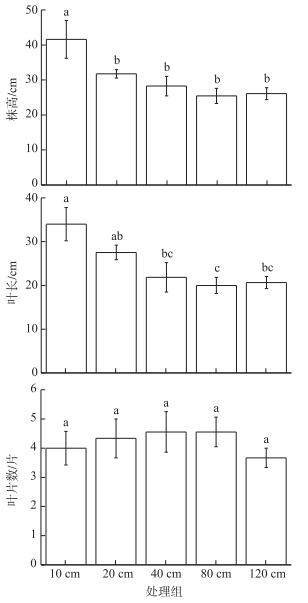
|
图 1 6月中旬不同地下水位影响下灰化薹草的株高、叶长和叶片数(数据为平均值±标准误,上标不同小写字母表示处理组之间差异显著(P < 0.05),下同) Fig.1 Height, longest leaf length and leaf number of the C. cinerascens grown at five groundwater depths in the middle of June (Data reported as the means±SD and different letters indicated the significant difference at the 0.05 significance level between treatments, the same below) |
不同地下水位处理间灰化薹草的地上生物量存在显著差异(F=520.604, df=4, P < 0.001),随着地下水位埋深的增加薹草地上生物量呈减小的趋势.地下水位10和20 cm处理组间灰化薹草地上生物量差异不显著(P>0.05),分别为0.371±0.017和0.356±0.007 g,但显著高于其他处理组(P < 0.001),分别是地下水位120 cm处理组(0.084±0.004 g)的4.4和4.2倍(图 2).
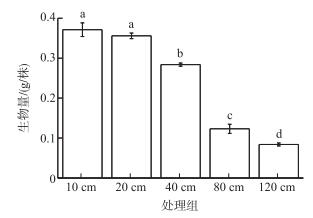
|
图 2 7月末不同地下水位影响下灰化薹草的地上生物量 Fig.2 Aboveground biomass of C. cinerascens at five groundwater depths at the end of July |
不同地下水位处理间灰化薹草SOD活性存在极显著差异(F=3.661,df=4,P=0.044),地下水位埋深120 cm处理组的灰化薹草SOD活性(184.96±11.47 U/g(FW))与80 cm处理组(211.07±20.55 U/g(FW))差异不显著(P=0.078),但显著低于其他处理组(P < 0.05).处理组间灰化薹草Pro含量的差异(F=3.430, df=4, P=0.051),主要来自于地下水位120 cm处理组(8.54±1.37 μg/g)与10 cm(6.29±0.70 μg/g)和20 cm (6.73±0.57 μg/g)处理组(P < 0.05).处理组间灰化薹草POD活性和Chl含量均存在显著差异(POD: F=7.106,df=4,P=0.006; Chl: F=5.136,df=4,P=0.016),除了地下水位埋深120 cm处理组(POD活性为106.17±45.11 U/(g·min),Chl含量为736.69±87.89 μg/g)外,POD活性和Chl含量均随着地下水位埋深的增加而减小(P < 0.05)(图 3).
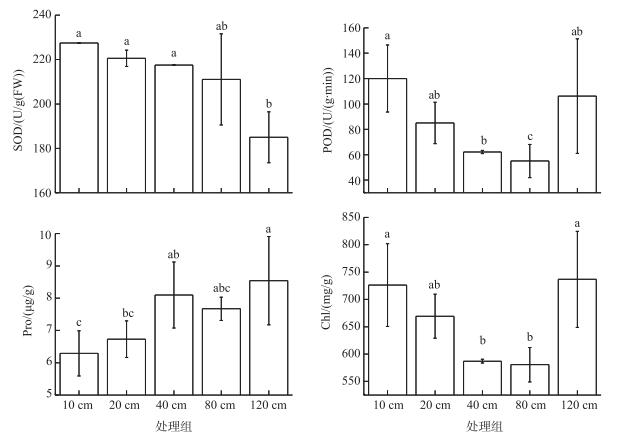
|
图 3 7月底不同地下水位影响下灰化薹草的SOD和POD活性以及Pro和Chl含量 Fig.3 SOD and POD activities, Pro and Chl contents of C. cinerascens grown at five groundwater depths at the end of July |
土壤水分含量受到降雨、地下水和气温的共同作用,但总体规律是随着地下水位埋深的增加而减小,距离地下水水面越远,通过土壤空隙间的毛管力输送的水分越少,土壤水分含量越低[17, 31-32],地下水位埋深80 cm以下土壤表层含水量的差异并不显著,说明地下水位埋深80 cm左右是地下水位对地表水分补给急剧变化的深度.许秀丽等[24]在野外监测中发现春、夏季节灰化薹草带土壤水分含量均在50 %左右,说明在本试验中地下水位埋深80 cm以下的条件已经不适宜灰化薹草生长.
克隆植物具有表型可塑性的特征,可以通过调整形态结构来适应资源有限的环境,高效利用资源,维持生命个体[15-16].地下水位埋深40 cm以下的处理组,灰化薹草均通过改变株高和叶长以适应相对较低的土壤水分含量,地下水位埋深20 cm以上的条件更适合灰化薹草的生长,在本试验中灰化薹草植株的处理组间叶片数并没有显著差异,可能是由于试验中灰化薹草的叶片数一般为3~5个,本来就比较少,且植株生长过程中又有一定的随机性.但是,杨阳等[27]在分析土壤水分含量对灰化薹草幼苗生长的影响过程中发现,灰化薹草的叶片数对不同土壤水分含量的响应存在显著差异,所以灰化薹草叶片数是否适合作为对水分条件的相应指标有待探讨.
随着地下水位埋深的增加,灰化薹草的地上生物量减小,这与张萌等[33]通过野外监测和调查得到的关于灰化薹草地上生物量随着地下水位变化存在显著差异的结果相一致.地下水位埋深10和20 cm处理组灰化薹草的地上生物量最大,且差异不显著.地上生物量代表从萌发到测定时灰化薹草地上部分的初级生产力,地下水位埋深20 cm以内的地下水位更加适宜灰化薹草的生长,地下水位埋深80 cm以下的水位,灰化薹草根部土壤的水分含量较低,不利于灰化薹草的生长,进而影响灰化薹草地上生物量的积累.
SOD和POD是植物细胞内的高效抗氧化系统,它们共同协作来清除对植物有危害的细胞内的活性氧物质[34].作为一种对抗干旱逆境的保护措施,Pro的积累能够阻止细胞膜的损伤并促进植物体的渗透调节机制[18, 35].叶绿素和植物的光合速率紧密相关,能够反映植物进行光合作用的能力和生长状况.在本试验中,SOD活性、POD活性和Chl含量随着地下水位埋深的增加而显著降低,Pro含量则随着地下水位埋深的增加而显著增高,表明相对较低的地下水位条件下,灰化薹草受到一定的干旱胁迫后其抵抗逆境的能力已经显著下降,植物体内细胞受到伤害,因此也显现出较差的生长态势.植物体对抗干旱的生理响应特征在很多研究中也得到证实[32, 34, 36],但是也有一些研究显示在干旱条件下植物体内的酶活性会有所增加[37].此外,可以发现在地下水位埋深120 cm的条件下,POD活性和Chl含量出现和其他处理组不一样的趋势(图 2),这可能是因为在此处理下灰化薹草所受到的干旱胁迫远超出机体所承受的范围,因此显示出相反的特征,或者是因为在此处理下的灰化薹草生长速率较慢因而较嫩,所以其POD活性和Chl含量均较高.
4 结论地下水位埋深对灰化薹草的生长以及其生理特征有显著的影响,随着地下水位埋深的增加,灰化薹草表现出株高降低、叶长减小和生物量积累减少的趋势.这些变化直接反映了试验期间地下水位对灰化薹草的影响,表明地下水位埋深20 cm以内更加适宜灰化薹草的生长,而地下水位埋深超过80 cm之后灰化薹草的生长受到严重抑制.处理间灰化薹草的生理特征反映了地下水位埋深超过40 cm就会对灰化薹草产生一定的干旱胁迫,这也解释了地下水位埋深40 cm处理下灰化薹草长势较地下水位埋深10和20 cm处理略差的原因.生理指标反映灰化薹草所受的胁迫状况,形态特征反映在干旱胁迫影响下灰化薹草的长势变化,结合地下水位埋深40 cm处理组与其他处理组灰化薹草的特征差异可以推断,相对于植物的生理特征,其形态指标对地下水位变化及干旱胁迫的响应较为滞后.
致谢: 感谢陈宇炜研究员对文章稿件以及返修回复的修改和建议, 感谢姚磊同学在生理实验方法上提供的帮助!| [1] |
Deng W, Pan XL, Luan ZQ. Advances in wetland hydrology. Advances in Water Science, 2003, 14(4): 521-527. [邓伟, 潘响亮, 栾兆擎. 湿地水文学研究进展. 水科学进展, 2003, 14(4): 521-527.] |
| [2] |
Valk AGVD. Water-level fluctuations in north American prairie wetlands. Hydrobiologia, 2005, 539(1): 171-188. DOI:10.1007/s10750-004-4866-3 |
| [3] |
Renöfält B, Merritt DM, Nilsson C. Connecting variation in vegetation and stream flow:the role of geomorphic context in vegetation response to large floods along boreal rivers. Journal of Applied Ecology, 2007, 44(1): 147-157. DOI:10.1111/j.1365-2664.2006.01223.x |
| [4] |
Miller RC, Zedler JB. Responses of native and invasive wetland plants to hydroperiod and water depth. Plant Ecology, 2003, 167(1): 57-69. DOI:10.1023/A:1023918619073 |
| [5] |
Garssen AG, Baattruppedersen A, Voesenek LA et al. Riparian plant community responses to increased flooding:a meta-analysis. Global Change Biology, 2015, 21(8): 2881-2890. DOI:10.1111/gcb.12921 |
| [6] |
Bayley SE, Guimond JK. Effects of river connectivity on marsh vegetation community structure and species richness in montane floodplain wetlands in Jasper National Park, Alberta, Canada. Ecoscience, 2016, 15: 377-388. DOI:10.2980/15-3-3084 |
| [7] |
Horton JL, Kolb TE, Hart SC. Physiological response to groundwater depth varies among species and with river flow regulation. Ecological Applications, 2001, 11(4): 1046-1059. DOI:10.2307/3061011 |
| [8] |
Danyar S, Song Y, Jumakeld M. Influence of groundwater level change on vegetation coverage and their spatial variation in arid regions. Journal of Geographical Sciences, 2004, 14(3): 323-329. DOI:10.1007/BF02837413 |
| [9] |
Chen S, Su X, Fang L et al. Carex dynamics as an environmental indicator in the Poyang Lake wetland area:Remote sensing mapping and GIS analysis. Annals of GIS, 2007, 13(1/2): 44-50. DOI:10.1080/10824000709480631 |
| [10] |
Weiher E, Keddy PA. The assembly of experimental wetland plant communities. Oikos, 1995, 73(3): 323-335. DOI:10.2307/3545956 |
| [11] |
Feng WJ, Xu LG, Wang XL et al. Response of Carex cinerascens populations to groundwater level gradients in the Poyang Lake wetland. Acta Ecologica Sinica, 2016, 36(16): 5109-5115. [冯文娟, 徐力刚, 王晓龙等. 鄱阳湖洲滩湿地地下水位对灰化薹草种群的影响. 生态学报, 2016, 36(16): 5109-5115.] |
| [12] |
Hose GC, Bailey J, Stumpp C et al. Groundwater depth and topography correlate with vegetation structure of an upland peat swamp, Budderoo Plateau, NSW, Australia. Ecohydrology, 2015, 7(5): 1392-1402. |
| [13] |
Kennedy MP, Milne JM, Murphy KJ. Experimental growth responses to groundwater level variation and competition in five British wetland plant species. Wetlands Ecology and Management, 2003, 11(6): 383-396. DOI:10.1023/B:WETL.0000007194.01073.6b |
| [14] |
Booth EG, Loheide ISP. Comparing surface effective saturation and depth-to-water-level as predictors of plant composition in a restored riparian wetland. Ecohydrology, 2012, 5(5): 637-647. DOI:10.1002/eco.250 |
| [15] |
Vretare V, Weisner SEB, Strand JA et al. Phenotypic plasticity in Phragmites australis, as a functional response to water depth. Aquatic Botany, 2001, 69(2/3/4): 127-145. DOI:10.1016/S0304-3770(01)00134-6 |
| [16] |
Li HL, Zhi YB, Lei GC et al. Plant growth, reproduction characters and biomass allocation in response to water level gradient in the clonal plant Spartina anglica. Acta Ecologica Sinica, 2009, 29(7): 3525-3531. [李红丽, 智颖飙, 雷光春等. 不同水位梯度下克隆植物大米草的生长繁殖特性和生物量分配格局. 生态学报, 2009, 29(7): 3525-3531.] |
| [17] |
Chen YN, Li WH, Xu HL et al. The influence of groundwater on vegetation in the lower reaches of Tarim River, China. Acta Geographica Sinica, 2003, 58(4): 542-549. [陈亚宁, 李卫红, 徐海量等. 塔里木河下游地下水位对植被的影响. 地理学报, 2003, 58(4): 542-549. DOI:10.11821/xb200304008] |
| [18] |
Samantha P, Kumari B, Dubey RS. Reactive oxygen species, ascorbate-glutathione pool, and enzymes of their metabolism in drought-sensitive and tolerant indica rice (Oryza sativa L.) seedlings subjected to progressing levels of water deficit. Protoplasma, 2013, 250: 585-600. DOI:10.1007/s00709-012-0444-0 |
| [19] |
Ge G, Zhao AN, Zhong YY et al. Patterns of dominant populations of plants in islets of Poyang Lake. Wetland Science, 2011, 9(1): 19-25. [葛刚, 赵安娜, 钟义勇等. 鄱阳湖洲滩优势植物种群的分布格局. 湿地科学, 2011, 9(1): 19-25.] |
| [20] |
Wu Q, Yao B, Zhu LL et al. Seasonal variation in plant biomass of Carex cinerascens and its carbon fixation assessment in a typical Poyang Lake marshland. Resources and Environment in the Yangtza Basin, 2012, 21(2): 215-219. [吴琴, 尧波, 朱丽丽等. 鄱阳湖典型苔草湿地生物量季节变化及固碳功能评价. 长江流域资源与环境, 2012, 21(2): 215-219.] |
| [21] |
Yu L, He LH, Zhang Q et al. Effects of the Three Gorges project on the typical wetland vegetation of Poyang Lake. Geographical Research, 2011, 30(1): 134-144. [余莉, 何隆华, 张奇等. 三峡工程蓄水运行对鄱阳湖典型湿地植被的影响. 地理研究, 2011, 30(1): 134-144.] |
| [22] |
Zhang L, Yin J, Jiang Y et al. Relationship between the hydrological conditions and the distribution of vegetation communities within the Poyang Lake National Nature Reserve, China. Ecological Informatics, 2012, 11(11): 65-75. DOI:10.1016/j.ecoinf.2012.05.006 |
| [23] |
Xu JX, Xu LG, Jiang JH et al. Change of vegetation community structure and the relationship between it and soil nutrients in typical beaches in Poyang Lake area. Wetland Science, 2013, 11(2): 186-191. [许加星, 徐力刚, 姜加虎等. 鄱阳湖典型洲滩植物群落结构变化及其与土壤养分的关系. 湿地科学, 2013, 11(2): 186-191.] |
| [24] |
Xu XL, Zhang Q, Li YL et al. Inner-annual variation of soil water content and groundwater level in a typical islet wetland of Lake Poyang. J Lake Sci, 2014, 26(2): 260-268. [许秀丽, 张奇, 李云良等. 鄱阳湖典型洲滩湿地土壤含水量和地下水位年内变化特征. 湖泊科学, 2014, 26(2): 260-268. DOI:10.18307/2014.0213] |
| [25] |
Wang X, Han J, Xu L et al. Soil characteristics in relation to vegetation communities in the wetlands of Poyang Lake, China. Wetlands, 2014, 34: 829-839. DOI:10.1007/s13157-014-0546-x |
| [26] |
You HL, Xu LG, Jiang JH et al. Responses of typical hygrophytes root growth characteristics to extreme water regimes in beach wetland of Poyang Lake, China. Chinese Journal of Ecology, 2013, 32(12): 3125-3130. [游海林, 徐力刚, 姜加虎等. 鄱阳湖典型洲滩湿地植物根系生长对极端水情变化的响应. 生态学杂志, 2013, 32(12): 3125-3130.] |
| [27] |
Yang Y, Cao Y, Zhang SJ et al. Effects of soil moisture regime on rhizomatic germination and young shoot growth of Carex cinerascens. Journal of Ecology and Rural Environment, 2015, 31(2): 180-187. [杨阳, 曹昀, 张素娟等. 水分条件对灰化苔草根茎萌发及幼苗生长的影响. 生态与农村环境学报, 2015, 31(2): 180-187. DOI:10.11934/j.issn.1673-4831.2015.02.007] |
| [28] |
Wang XL, Xu JY. Collection of wetland plants in Poyang Lake. Beijing: Science Press, 2016, 100. [王晓龙, 徐金英. 鄱阳湖湿地植物图谱. 北京: 科学出版社, 2016, 100.]
|
| [29] |
Zhang ZA, Zhang SM, Wei RH. Experimental guide of plant physiology. Beijing: China Agricultural Scientech Press, 2004. [张治安, 张美善, 蔚荣海. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 2004.]
|
| [30] |
Li ZD, Han RH, Liao GL et al. A comparative study on the different extraction techniques about the chlorophyll concentration of plant leaf. Journal of Guangdong University of Education, 2011, 31(3): 80-83. [李志丹, 韩瑞宏, 廖桂兰等. 植物叶片中叶绿素提取方法的比较研究. 广东第二师范学院学报, 2011, 31(3): 80-83.] |
| [31] |
Ma YH, Zhang TH, Liu XP. Eco-physiological response of Phragmites communis to water table changes in the Horqin Sand Land. Acta Ecologica Sinica, 2013, 33(21): 6984-6991. [马赟花, 张铜会, 刘新平. 干旱区沙地芦苇对浅水位变化的生理生态响应. 生态学报, 2013, 33(21): 6984-6991.] |
| [32] |
Li F, Qin X, Xie Y et al. Physiological mechanisms for plant distribution pattern:responses to flooding and drought in three wetland plants from Dongting Lake, China. Limnology, 2013, 14(1): 71-76. DOI:10.1007/s10201-012-0386-4 |
| [33] |
Zhang M, Ni LY, Xu J et al. Annual dynamics of the wetland plants community in Poyang Lake in response to water-level variations. Research of Environmental Sciences, 2013, 26(10): 1057-1063. [张萌, 倪乐意, 徐军等. 鄱阳湖草滩湿地植物群落响应水位变化的周年动态特征分析. 环境科学研究, 2013, 26(10): 1057-1063.] |
| [34] |
Supratim B, Aryadeep R, Progya PS et al. Differential antioxidative responses of indica rice cultivars to drought stress. Plant Growth Regulation, 2010, 60(1): 51-59. DOI:10.1007/s10725-009-9418-4 |
| [35] |
Ainlhout F, Zunzunegui M, Barradas MCD et al. Comparison of proline accumulation in two mediterranean shrubs subjected to natural and experimental water deficit. Plant and Soil, 2001, 230(2): 175-183. DOI:10.1023/A:1010387610098 |
| [36] |
Zhu XL, Lou LH, Wang H. Physiological and biochemical characteristics of four species of Carex with drought stress. Journal of Zhejiang Forestry College, 2009, 26(5): 656-662. [朱小楼, 楼炉焕, 王慧. 土壤干旱胁迫对4种薹草植物生理生化特性的影响. 浙江林学院学报, 2009, 26(5): 656-662.] |
| [37] |
Kusvuran S, Ellialtioglu S, Polat Z. Antioxidative enzyme activity, lipid peroxidation, and proline accumulation in the callus tissues of salt and drought tolerant and sensitive pumpkin genotypes under chilling stress. Horticulture Environment and Biotechnology, 2013, 54(4): 319-325. DOI:10.1007/s13580-013-1042-6 |
 2018, Vol. 30
2018, Vol. 30 

