(2: 中国科学院大学, 北京 100049)
(3: 中南民族大学资源与环境学院, 武汉 430074)
(4: 云南省环境科学研究院高原湖泊流域污染过程与管理云南省重点实验室, 昆明 650034)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: College of Resources and Environmental Science, South-Central University for Nationalities, Wuhan 430074, P. R. China)
(4: Yunnan Key Laboratory of Pollution Process and Management of Plateau Lake-watershed, Yunnan Institute of Environmental Science, Kunming 650034, P. R. China)
湖泊富营养化造成湖泊生态系统服务功能急剧下降,对流域居民的生活影响显著,是目前全球突出的环境污染问题.湖泊作为典型的复杂动态系统,其状态对驱动力的非线性响应特点使湖泊生态系统在外部驱动(如营养和温度)的微小变化下就可能发生突变,从清水状态转变为浊水状态[1].系统的突变会影响生态系统服务功能(水安全、渔业产量以及居住环境等)的发挥[2],因此,甄别湖泊生态系统突变过程中的稳定性变化,避免发生突变,成为湖泊生态系统动态变化研究的热点,也是湖泊生态系统管理的迫切需求[1].
湖泊系统发生突变是由于系统的稳定性减弱、系统抵抗外界干扰的能力下降所导致的[3-4].有关系统稳定性机制的探讨成了研究的重点,如生物多样性以及群落嵌套性等与系统稳定性的关系[5-6].早期的生态学家认为丰富的生物多样性有助于维持生态系统的稳定[7-8],后期的研究发现丰富的生物多样性并不总是使生态系统更加稳定[4].有些复杂的、生物多样性高的系统反而比简单的系统更加不稳定,因而认为物种的组合方式及相互关系对生态系统的稳定起更大的作用[9].研究多样性与稳定性之间的关系,首先需要研究系统的多样性格局,而系统所处的不同状态(研究区域的尺度、物种、湖泊背景值等)会使多样性呈现出不同的格局[10-11],例如在全球变化的背景下,温带地区的物种多样性增加,而赤道地区的物种多样性却在减少[12].因此,不同湖泊生物群落多样性与稳定性之间的关系,需要针对具体的湖泊生物群落进行研究.
云贵高原是中国生物多样性最丰富的地区,近几十年来随着人类活动的加剧,物种丧失以及生物多样性衰减十分严重[13],湖泊生态系统变得极其不稳定,蓝藻暴发常见.未来全球变化和人类活动背景下,湖泊生态系统可能出现突变,导致生态系统服务功能严重受损并且难以恢复,因此加强该区域湖泊生态系统多样性和稳定性的研究对减少湖泊生态系统突变风险十分关键.洱海的研究已经发现该湖富营养化过程中发生了突变[14],云南其他湖泊同样受人类活动影响较大,而对这些湖泊生态系统是否存在突变还有待研究.阳宗海作为云贵高原九大湖泊之一,相关的古湖沼研究也已经展开,例如Zhang等对近百年来阳宗海的铅、锌污染以及粒度进行研究,发现该湖泊流域自1980s中期后受人类活动(冶矿及土地开发)的干扰,水土流失严重[15],陶等则通过研究近百年以来的硅藻群落发现,该湖泊的水体富营养化、重金属污染和湖泊水文调控是造成硅藻群落不同阶段变化的主要因素[16],但是有关该湖泊生态系统的多样性和稳定性的研究尚未开展,因此有必要根据阳宗海本身的特性,开展长时间序列的高分辨率数据分析,探讨湖泊生态系统的多样性和稳定性,进而为该湖的管理决策提供科学支撑.
摇蚊科昆虫,隶属于双翅目,作为重要的淡水底栖生物之一[17],其分布广泛,且具有种类丰富、对环境变化敏感以及生命周期较短的特性,能够很好地反映湖泊环境变化[18].另外,摇蚊作为重要的次级消费者,在淡水食物网中发挥承上启下的重要作用,既消费藻类和碎屑沉积物,同时又被很多鱼类和无脊椎动物所捕食[19],为关联湖泊生态系统变化过程提供有效证据.除在现生淡水生态学的巨大潜在价值,摇蚊在古湖沼学中也备受青睐,由于幼虫头壳为几丁质组成,因此能够很好地保存在湖泊沉积物中[18],这为进行古生态研究提供了可靠的生物指标.本文旨在已有研究[15-16, 20]基础上进一步开展以下3个方面的研究工作:(1)了解人类活动加剧的情况下湖泊营养水平的演变特征;(2)了解摇蚊群落多样性格局并探讨摇蚊群落多样性及稳定性对湖泊营养变化的响应; (3)探讨人类活动加剧的条件下摇蚊群落多样性和稳定性之间的关系.
1 方法 1.1 研究区概况阳宗海(24°5l′~24°58′N, 102°58′~103°01′E)为高原断陷湖泊,位于云南省昆明市宜良县、呈贡县和玉溪市的澄江县之间,海拔约1708 m,湖泊面积约为31 km2,平均水深为22 m,最大水深为30 m[20-21],是云南省的第3大深水湖,隶属于珠江流域南盘江水系.湖区位于亚热带高原季风区[22],年均温度为14.5℃,年降雨量约为963 mm,湖水主要来源于大气降水、摆依河、七星河、阳宗河以及地下水,并经由汤池河汇入南盘江[23].湖区人口主要集聚在东北的汤池镇以及西南的阳宗镇,1950s人口迅速增加,对周边森林的砍伐以及土地开垦造成森林覆盖率下降、水土流失加重[15, 24]. 1960年阳宗海修建了火力发电厂,并引入摆依河河水以缓解用水压力[15, 20]. 1980s以前,该区域经济以农业为主,入湖的污染物主要来源于农业面源污染以及生活污水的排放,但湖泊营养物质的积累依然以pH值、氧化还原电位以及有机质等天然因素的影响为主[23];1990s以前,阳宗海大部分区域水质良好,此后湖区周边的工矿业、渔业以及旅游业兴起,随着工业排污、网箱养鱼以及生活污水排放力度的不断加大,湖泊水质日趋恶化. 1996年随着阳宗海电厂开始发电,大量有利于藻类生长的温水排入湖中,阳宗海连续暴发水华,当地随后取缔水域网箱养鱼,湖泊水质得到明显改善[25],2004年与1995年相比,工矿用地增加了1倍左右,流域侵蚀强度呈现增强的趋势,湖泊的营养水平依旧不断上升,2013年沉积物的总氮(TN)含量达到约8 mg/g,叶绿素a(Chl.a)含量为100 μg/g[16, 20, 24].
1.2 样品采集与前期处理2007年使用重力采样器在湖泊中心最深处(24°53′50″N,102°59′49″E,图 1)获取一长度为44 cm的柱状岩芯,现场按0.5 cm间隔分样,将样品密封于自封袋内并编号,带回实验室4℃冷藏保存.本文摇蚊鉴定、环境指标(总有机碳(TOC)含量、TN含量和TOC/TN摩尔比)都采用深度为39.5 cm以上的岩芯.摇蚊表层样品(0~9 cm)以1 cm为间隔、亚表层及深层样品(9~44 cm)以0.5 cm为间隔进行处理并鉴定;环境指标以1 cm为间隔进行测度.
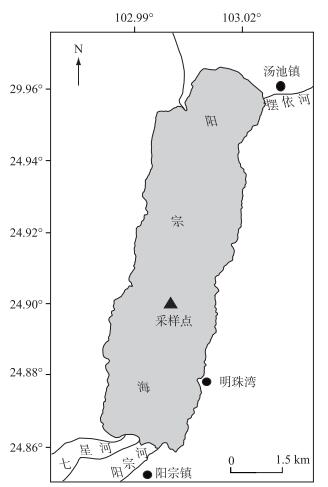
|
图 1 阳宗海及采样点位置 Fig.1 Location of Lake Yangzong and the sampling site |
摇蚊亚化石的处理根据标准实验室方法[26]进行:样品中加入10 %的KOH,将样品放在75℃的水浴锅中加热15 min后,依次过212和90 μm筛网,将筛网中的样品冲洗至烧杯内,在25倍体式显微镜下将摇蚊头壳亚化石手工捡出,用Hyderomatrix®将其封片.在100~400倍生物显微镜下根据文献[27-29]进行摇蚊鉴定.每个沉积样品中摇蚊亚化石统计数至少达到50个壳体.
1.3 数理统计环境指标(TOC和TN含量)的测定结果参考作者已发表数据[15].
将摇蚊丰度转换成相对丰度,用TILIA 2.0.b.5画摇蚊属种组合图,并在R 3.32软件中使用CONISS聚类分析和Broken-stick将摇蚊组合进行分区.本文基于摇蚊频度数据分别测算物种丰富度(richness)、均匀度(Invsimpson指数,即Simpson指数的倒数)和相似度(Jaccard指数)[30-33]. Jaccard指数的变化综合了物种丰富度和均匀度的信息[33],代表了群落相似度.降维对应分析(detrending correspondence analysis,DCA)用于提取摇蚊种群的动态变化[34]. DCA第1轴长度为2.75个标准单位[34],因此选用PCA(Principal Components Analysis)的1轴得分(PCA1)代表摇蚊群落的主要变化.选取一阶滞后自相关系数(ar1)作为群落稳定性指标[14],使用Gaussian kernel对PCA1剔除趋势得到残差,基于残差计算ar1[35]. ar1的变化特征取决于所选的数据集以及在数据分析时具体参数的设定[35],为了观察所有参数组合下ar1的变化趋势并检测其敏感性和稳定性,我们模拟出100对时间序列对ar1的变化趋势进行敏感性分析(即对获得ar1所设定的参数(滚动窗宽(rolling window size)及滤波带宽(filtering bandwidth))做敏感性分析.对时间序列选取20 % ~75 %范围内的滚动窗宽和5~200范围内的滤波带宽分别以5 %和10 %为增量进行估算,并用Kendall τ对窗宽和带宽的组合进行量化. Kendall τ<0时,说明ar1呈现下降趋势;Kendall τ>0时,则显示上升趋势)以及显著性检验(显著性检验是用来检验第一类错误(“弃真”错误):即所有的Kendall τ值并不是随机产生的,ar1的升高趋势也不是随机的[35].本文的空假设为ar1的增长趋势是随机性的.为了检验空假设,我们模拟产生了100个和原始数据有着相同相关结构以及概率分布的替代数据集,并对每个模拟产生的数据集用Kendall τ来估计ar1的趋势,最后将模拟数据集的Kendall τ值与原始数据的Kendall τ>0进行显著性分析).
摇蚊多样性的计算、DCA和PCA分析都在R3.32的vegan包[36]中实现,ar1及其敏感性分析和显著性分析均在R3.32的earlywarnings包[35]中计算,PCA1和环境指标(TOC和TN含量)的突变点检测在Regime_detection3-2[37]中完成.
2 结果 2.1 钻孔年代序列与环境指标该钻孔年代框架详见文献[15],39.5 cm的岩心年代范围测定为1820s-2006年.
1820s以来,阳宗海沉积物中TOC和TN含量的变化趋势一致,分别保持在0.60 %和0.06 %左右,TOC/TN摩尔比在5~7之间波动;在1950s-1995年期间,三者都呈增长的趋势,尤其在1990-1995年期间增幅最大,在1995年达到峰值,TOC含量为4.30 %,TN含量为0.33 %,TOC/TN摩尔比值为15.22;1995-2006年期间,三者先降低后升高,2000年达到最小值后开始升高,说明湖泊的外源有机质相对含量经历了上升—下降—上升3个阶段(图 2).
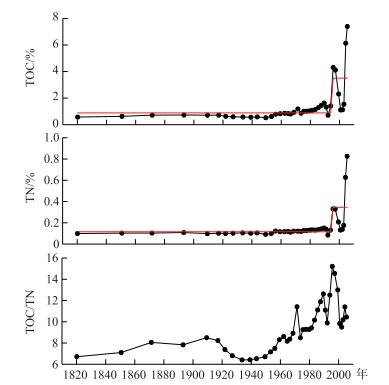
|
图 2 阳宗海沉积物的营养指标:总有机碳(TOC)含量;总氮(TN)含量;TOC/TN摩尔比 Fig.2 Nutrient indicators in sediment of Lake Yangzong |
阳宗海岩芯中的摇蚊亚化石共鉴定有34个属种(图 3),主要属种包括Procladius sp.、Chironomus plumosus-type(C. plumosus-type)、Microchironomus tenner-type以及Tanytarsus mendax-type(T. mendax-type). CONISS聚类分析及Broken-stick模型将摇蚊群落分成两个大的组合带:
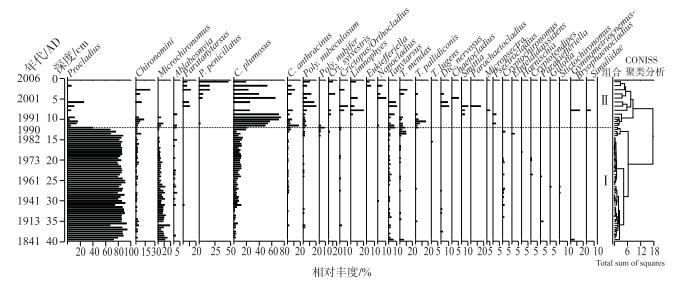
|
图 3 阳宗海沉积岩芯主要摇蚊组合图谱 Fig.3 Percentage abundance of selected chironomid taxa in Lake Yangzong |
组合带Ⅰ(1820s-1990年):1820s-1960年间,Procladius sp.在岩芯中的相对丰度最高(约85 %),Microchironomus tenner-type其次(10 %),其他属种零星出现;1960-1990年间,Procladius sp.仍占最大比例(约80 %),Microchironomus相对丰度降低(约3 %)、C. plumosus-type相对丰度均有所升高(约9 %);摇蚊组合在1990年前后发生显著变化,由Procladius sp.优势种向C. plumosus-type转变.
组合带Ⅱ(1990-2006年):Procladius sp.相对丰度快速降低(约10 %),Microchironomus减少并逐渐消失,而C. plumosus-type(约60 %)快速增长成为优势种.其他部分属种尽管相对丰度不高,但在该期间逐渐出现,如Crictopus、Paratanytarsus penicillatus-type、C. anthracinus-type、Polypedilum和Tanytarsus都有所增加.湖泊中比较少见的溪流种如Smittia、Chaetocladius、Parachaetocladius、Simuliidae也出现了.
结合摇蚊组合图谱可见阳宗海摇蚊种类相对较多.总体而言,摇蚊多样性、均匀度和相似度呈升高的趋势,三者在升高前都比较平稳.物种丰富度从1950s开始逐渐增加,均匀度从1990s初开始波动上升;1820s-1960s期间,相似度在0.3上下波动,从1960s开始持续上升(图 4).

|
图 4 阳宗海摇蚊群落的物种丰富度、均匀度(Invsimpson指数)和相似度(Jaccard指数)格局 Fig.4 Diversity (species richness), evenness (Invsimpson) and similarity (Jaccard) patterns of chironomid assemblages in Lake Yangzong |
摇蚊群落组合PCA1在1820s-1990年间总体变幅不大,摇蚊群落比较稳定;1990年迅速升高,群落发生突变(P=0.01)(图 5a). ar1在1935-1960年期间比较稳定,随后在1960年起快速升高(图 5d),揭示系统稳定性降低,这比群落突变提前了30 a左右.
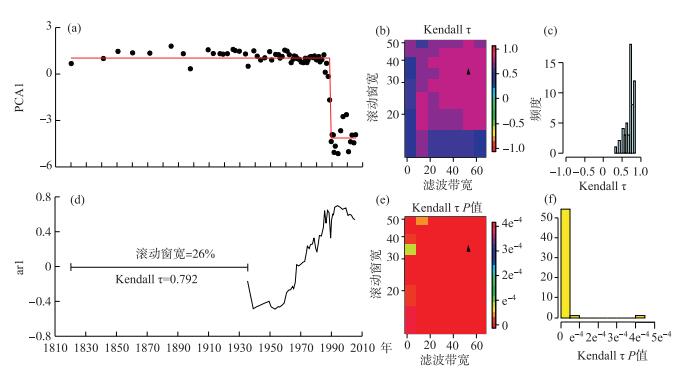
|
图 5 阳宗海摇蚊群落突变点、稳定性及其稳定性的敏感性与显著性分析((a)PCA1(黑色实心圆)及其突变前后均值(红色实线);(b)敏感性分析热图(黑色三角形代表本文中选取的滚动窗宽及滤波带宽);(c)摇蚊群落稳定性(ar1)的敏感性分析Kendall τ的频度分布;(d)摇蚊群落稳定性(ar1);(e)摇蚊群落稳定性(ar1)的显著性分析热图(黑色三角形代表本文中选取的滚动窗宽及滤波带宽);(f)显著性分析中Kendall τ P值的频度分布) Fig.5 Detection of critical points of chironomid assemblages (PCA1), its stability (ar1) and sensitivity analysis and significance testing of stability in Lake Yangzong |
(1) 敏感性分析结果发现Kendall τ值都大于0(图 5b、c),说明ar1的升高趋势与窗宽及带宽的参数设定均无关. (2)显著性检验结果发现ar1的升高趋势都是显著的(P=0.01)(图 5e、f),因此对任何滚动窗宽及滤波带宽的组合而言,Kendall τ>0是显著的且不是随机产生的.
3 讨论阳宗海的摇蚊群落(PCA1)以及营养指标(TOC含量、TN含量和TOC/TN摩尔比)在1990s初发生突变. TOC/TN摩尔比在1950-1990s初期间持续升高,反映湖泊外源有机质的增多[15, 20, 38].陆生种Smittia及溪流种Chaetocladius、Parachaetocladius、Simuliidae以及喜好细颗粒物的Microchironomus于1990年后出现[39],说明湖泊中地表径流输入较大,沉积物中的粗颗粒物增多,这也与Zhang等有关阳宗海研究中粗颗粒物增大的结论相一致[15];Limnophyes通常出现在浅水湖泊中,可作为湖泊水位变化的指示种,阳宗海的入湖及自产水量一直在减少[21, 40],该属种在1990年后出现可能是受湖泊水位下降的影响. 1990s初之前,阳宗海仍处于低—中营养水平,摇蚊群落以深水种Procladius sp.为主要属种,1990s初起,网箱养鱼、工业排污和电厂排放温水使TOC、TN含量和水温升高,湖泊生物的呼吸作用由此加强,特别是藻类迅速增多[16],湖泊下层的含氧量以及透明度由此下降[41],T. mendax-type喜好浑浊的水体[17],其出现也表明湖泊水质恶化,水体透明度下降. 1990s起,阳宗海的网箱养鱼活动兴起,养殖的鱼类优先捕食自由捕食型的Procladius sp.,该属种的快速减少可能是受到鱼类捕食及厌氧环境的影响.而C. plumosus-type、C. anthracinus-type、Polypedilum nubeculosum-type(Poly. nubeculosum-type)和Cricotopus一般都出现在富营养的水体中,且C. plumosus-type是能在低氧环境下生存的筑巢捕食型属种,因此优势种Procladius sp.的减少以及缺氧的环境使得该种取代 Procladius sp.成为主要优势种[40-43];P.penicillatus-type和Tanytarsus是典型的暖水种,且Tanytarsus一般出现生产力较高的水域,这两个属种的增加可能是受到阳宗海电厂温水排放及水体富营养化的影响.虽然在1995-2000期间,相关部门随后对周边渔业养殖进行整顿[44].整顿后阳宗海沉积物的TOC和TN的相对含量也的确有所下降,Procladius sp.相对丰度稍有升高,但之后周边区域开发力度加强导致水土流失加重,这使得TOC和TN含量从2000年开始再一次快速上升,群落中C. plumosus-type增加,而Procladius sp.却几乎消失.
摇蚊群落的物种丰富度在1950s前几乎不超过6个属种,1950s后持续升高,1990年达到了12个属种;虽然多样性有在1950s-1990s期间升高的,但是在此期间群落的均匀度却并未出现明显的变化,均匀度一直到1990s初后才开始升高.由于均匀度只是强调群落属种丰度的分布而不关注群落组分的变化,因此丰度越大的种属对群落均匀度的影响越大.在1990s初之前,群落的优势种一直都是相对丰度较大的 Procladius sp.(80 % ~90 %),其他属种的更替以及相对丰度的变化未能改变群落的整体均匀度;1990s初以后,Procladius sp.逐渐消失,虽然C. plumosus-type相对丰度升高,但是该种的相对丰度仅占60 %左右,其他种属(如Poly. nubeculosum-type、C. anthracinus-type和Limnophyes等)的相对丰度有比较大幅的增加,因此群落整体的均匀度随之升高.相似度指数结合了物种丰富度以及均匀度两方面的信息,是综合评价群落组成的指标,Jaccard指数从1970s初开始持续升高,表明群落的相似度也在持续升高;ar1的升高说明群落的弹性变小,群落的稳定性从1960s起逐渐降低,群落从扰动中恢复的速率在降低,在时间序列上,摇蚊群落相似度升高,这与Jaccard相似度指数在1970s后的持续升高相吻合.
阳宗海有机质含量的增多与人类活动存在显著的相关性[20],TOC/TN摩尔比的升高也可以反映人类活动强度增大导致外源有机质输入的增多,为了了解人类活动加强的背景下,摇蚊群落多样性、均匀度以及其稳定性在湖泊营养变化驱动下的变化,本文分别对TOC/TN摩尔比和物种丰富度、均匀度、稳定性做相关性分析,发现摇蚊群落的物种丰富度、均匀度以及稳定性都和TOC/TN摩尔比呈正相关(图 6).受人类活动影响,1980s后土壤侵蚀加剧[44],加之周边工矿业、旅游业以及渔业的兴起,工农业以及生活污水的排放量增大,导致入湖的营养物质增多,摇蚊群落的组分及各个属种的丰度都发生了变化,多样性、均匀度、相似度随之升高,稳定性降低.
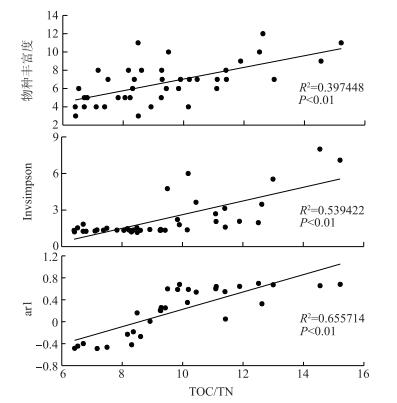
|
图 6 环境驱动力(TOC/TN摩尔比)与摇蚊群落的物种丰富度、均匀度及稳定性指标的相关格局 Fig.6 Relationships between environmental forcing (TOC/TN) and diversity (species richness), evenness (Invsimpson) and stability (ar1) of chironomid assemblages |
在岩礁鱼类的研究中发现,多样性的增加提高了鱼类产量,多样性成为除温度以外影响鱼类产量的第二大驱动力,且物种丰富度的增加有助于增强物种之间的功能互补,从而提高群落的稳定性[45-47].通过对阳宗海的多样性及稳定性做相关性分析(图 7)发现ar1与物种丰富度呈正相关,摇蚊群落的稳定性随着物种丰富度的升高而降低,在人类活动强度增大的条件下,二者的变化并不一致,再次证实了丰富的生物多样性并不一定会增加生态系统的稳定性.研究多样性与稳定性的关系,有必要了解物种之间以及各个物种受环境影响而产生的变化[5],物种的组合方式及相互关系对生态系统的稳定性影响可能更大[9].张景慧等也认为生物多样性与稳定性关系的内在机制通常是从不同的角度考虑,如果生物多样性的提高只是增大了平均值而没有改变其他变量,那么系统的稳定性就会提高[45],阳宗海摇蚊群落的物种丰富度、均匀度和相似度都是升高的,优势种的转变和均匀度的升高使群落组成发生了较大变化而变得更加不稳定.本文只对摇蚊群落展开多样性与稳定性之间关系的探讨,为实现多个指标之间相互验证,还应对其他生物指标如藻类、浮游动物等进行多样性和稳定性的研究,扩展到整个湖泊生态系统的变化来深入研究阳宗海响应气候变化和人类活动的特点.

|
图 7 摇蚊群落物种多样性与稳定性(ar1)的相关格局 Fig.7 Relationships between early warning indicators and diversity indices |
阳宗海岩芯中摇蚊群落多样性和均匀度对湖泊营养水平(TOC和TN含量)的演变有明显的响应过程,1820s-1980s末期间,湖泊营养物质积累主要受湖泊pH值、有机质等自然因素的影响,积累速度较慢,物种丰富度和均匀度均无明显变化,群落相似度大体呈逐年上升的趋势,湖泊系统稳定在贫—中营养水平. 1990s-2006年期间湖泊营养水平主要受到人类活动影响,经历了上升、下降再上升的过程,摇蚊群落组成在1990年开始发生较大转变. 1820s-2006年期间,物种丰富度、均匀度和相似度总体上都呈升高的趋势,多样性的升高反而伴随的是群落稳定性的降低,1960年左右就发现群落稳定性开始降低,1990年群落出现突变点.对云南湖泊生物多样性以及有关系统稳定性的研究应当及时开展,为制定适当的保护和治理措施提供科学依据和数据支撑.
| [1] |
Zhang K, Dearing JA, Dawson TP et al. Poverty alleviation strategies in eastern China lead to critical ecological dynamics. Science of the Total Environment, 2015, 506/507: 164-181. DOI:10.1016/j.scitotenv.2014.10.096 |
| [2] |
Scheffer M, Hosper SH, Meijer ML et al. Alternative equilibria in shallow lakes. Trends in Ecology & Evolution, 1993, 8(8): 275-279. DOI:10.1016/0169-5347(93)90254-M |
| [3] |
Kinzig AP, Ryan P, Etienne M et al. Resilience and regime shifts:Assessing cascading effects. Ecology and Society, 2006, 11(1): 1599-1604. |
| [4] |
McCann KS. The diversity-stability debate. Nature, 2000, 405: 228-233. DOI:10.1038/35012234 |
| [5] |
Ives AR, Carpenter SR. Stability and diversity of ecosystems. Science, 2007, 317(5834): 58-62. DOI:10.1126/science.1133258 |
| [6] |
Bloch C, Higgins C, Willing M et al. Effects of large-scale disturbance on metacommunity structure of terrestrial gastropods:temporal trends in nestedness. Oikos, 2007, 116: 395-406. DOI:10.1111/oik.2007.116.issue-3 |
| [7] |
Odum EP. Fundamentals of ecology. Philadelphia: Saunders, 1953.
|
| [8] |
MacArthur RH. Fluctuations of animal populations and a measure of community stability. Ecology, 1955, 36: 533-536. DOI:10.2307/1929601 |
| [9] |
Tilman D. Biodiversity:population versus ecosystem stability. Ecology, 1996, 77(2): 350-363. DOI:10.2307/2265614 |
| [10] |
Chen XL, Chen GJ, Lu HB et al. Long-term diatom biodiversity responses to productivity in lakes of Fuxian and Dianchi. Biodiversity Science, 2015, 23(1): 89-100. [陈小林, 陈光杰, 卢慧斌等. 抚仙湖和滇池硅藻生物多样性与生产力关系的时间格局. 生物多样性, 2015, 23(1): 89-100. DOI:10.17520/biods.2014213] |
| [11] |
Zemunik G, Turner BL, Lambers H et al. Increasing plant species diversity and extreme species turnover accompany declining soil fertility along a long-term chronosequence in a biodiversity hotspot. Journal of Ecology, 2016, 104(3): 1-14. DOI:10.1111/1365-2745.12546 |
| [12] |
Dornelas M, Gitelli NJ, Mcgill B et al. Assemblage time series reveal biodiversity change but not systematic loss. Science, 2014, 344(6181): 296-299. DOI:10.1126/science.1248484 |
| [13] |
Jia J, Zhang SX. The characteristics and protection status of biodiversity in Yunnan province. Green China, 2006, 13: 5-54. [贾静, 张树兴. 云南生物多样性的特点与保护现状. 绿色中国, 2006, 13: 5-54.] |
| [14] |
Wang R, Dearing JA, Langdon PG et al. Flickering gives early warning signals of a critical transition to a eutrophic lake state. Nature, 2012, 492(7429): 419-422. DOI:10.1038/nature11655 |
| [15] |
Zhang EL, Liu EF, Shen J et al. One century sedimentary record of lead and zine pollution in Yangzong lake, a highland lake in southestern China. Journal of Environmental Sciences, 2012, 24(7): 1189-1196. DOI:10.1016/S1001-0742(11)60896-6 |
| [16] |
Tao JS, Chen GJ, Chen XL et al. Long-term pattern of diatom community responses to water pollution and hydrological regulation in Yangzong Lake. Geographical Research, 2016, 35(10): 1899-1911. [陶建霜, 陈光杰, 陈小林等. 阳宗海硅藻群落对水体污染和水文调控的长期响应模式. 地理研究, 2016, 35(10): 1899-1911. DOI:10.11821/dlyj201610009] |
| [17] |
Bronmark C, Hansson LA eds. Translated by Han BP et al. The biology of lakes and ponds: Second Edition. Beijing: Higher Education Press, 2013. Bronmark C, Hansson LA. [韩博平等译. 湖泊与池塘生物学: 第二版. 北京: 高等教育出版社, 2013. ]
|
| [18] |
Hildrew AG, Townsend CR, Hasham A. The predatory Chironomidae of an iron-rich stream:feeding ecology and food web structure. Ecological Entomology, 1985, 10: 403-413. DOI:10.1111/j.1365-2311.1985.tb00738.x |
| [19] |
Langdon PG, Ruiz Z, Wynne S et al. Ecological influences on larval chironomid communities in shallow lakes:Implications for palaeolimnological interpretations. Freshwater Biology, 2010, 55(3): 531-545. DOI:10.1111/fwb.2010.55.issue-3 |
| [20] |
Liu YL, Zhang EL, Liu EF et al. TOC and Black Carbon records in sediment of Lake Yangzong, Yunnan Province under the influence of human activities during the past century. J Lake Sci, 2017, 29(4): 1018-1028. [刘一兰, 张恩楼, 刘恩峰等. 人类活动影响下的云南阳宗海近百年有机碳与黑炭湖泊沉积记录. 湖泊科学, 2017, 29(4): 1018-1028. DOI:10.18307/2017.0426] |
| [21] |
Li Y. Calculation of minimum ecological water requirement of Yangzong Lake. Yangtze River, 2010, 41(9): 32-38. [李英. 云南阳宗海最小生态需水量分析. 人民长江, 2010, 41(9): 32-38.] |
| [22] |
Yan YP, Li ZY, Dong MH et al. Yeasts from Yangzonghai Lake in Yunnan (China):diversity and extracellular enzymes. Acta Microbiologica Sinica, 2013, 53(11): 1205-1212. [严亚萍, 李治滢, 董明华等. 云南阳宗海酵母菌种群结构及产胞外酶测试. 微生物学报, 2013, 53(11): 1205-1212.] |
| [23] |
Zhang YX, Liu JT, Wang JZ et al. Distribution of phosphorus in the sediment of Yangzonghai lake and its influencing factors. Safety and Environmental Engineering, 2013, 20(6): 43-48. [张玉玺, 刘景涛, 王金罩等. 阳宗海沉积物中磷的分布及其影响因素. 安全与环境工程, 2013, 20(6): 43-48.] |
| [24] |
Zhu Y. Study on environmental background of Yangzonghai lake basin. Environmental Science Survey, 2008, 27(5): 75-78. [祝艳. 阳宗海流域环境背景状况. 环境科学导论, 2008, 27(5): 75-78.] |
| [25] |
Li ZY. Water pollution in Yangzonghai Lake and its control. Yunnan Environmental Science, 1999, 18(3): 36-38. [李振宇. 阳宗海水质污染极其控制. 云南环境科学, 1999, 18(3): 36-38.] |
| [26] |
Brooks SJ. Fossil midges (Diptera:Chironomidae) as palaeoclimatic indicators for the Eurasian region. Quaternary Science Reviews, 2006, 25(15): 1894-1910. DOI:10.1016/j.quascirev.2005.03.021 |
| [27] |
Oliver DR, Roussel ME. The insects and arachnids of Canada. Part 11. The genera of larval midges of Canada. Diptera:Chironomidae. Ottawa: Agriculture Canada Publication, 1983.
|
| [28] |
Wiederholm T. Chironomidae of the Holarctic region-keys and diagnoses part 1:Larvae. Entomologica Scandinavica, 1983, 19: 1-457. |
| [29] |
Rieradevall M. An identification guide to subfossil Tanypodinae larvae (Insecta:Diptera:Chironomidae) based on cephalic setation. Journal of Paleolimnology, 2001, 25(1): 81-99. DOI:10.1023/A:1008185517959 |
| [30] |
Simpson EH. Measurement of diversity. Nature, 1975, 163: 688. |
| [31] |
Jaccard P. Nouvelles recerches sur la distribution florale. Bull.Soc. Vaudoise Sci. Nat, 1908, 44: 223-270. |
| [32] |
Mafurran AE ed. Translated by Zhang F et al. Measuring biological diversity. Beijing: Science Press, 2011. Mafurran AE. [张峰等译. 生物多样性测度. 北京: 科学出版社, 2011. ]
|
| [33] |
Hill MO, Gauch Jr HGG. Detrended correspondence analysis:an improved ordination technique. Vegetatio, 1980, 42(1/2/3): 47-58. DOI:10.1007/BF00048870 |
| [34] |
Braak CJFT, Prentice IC. A theory of gradient analysis. Advances in Ecological Research, 1988, 18: 271-317. DOI:10.1016/S0065-2504(08)60183-X |
| [35] |
Dakos V, Carpenter SR, William AB et al. Methods for detecting early warnings of critical transitions in time series illustrated using simulated ecological data. PLoS One, 2012, 7(7): 1-20. DOI:10.1371/journal.pone.0041010 |
| [36] |
Oksanen J, Blanchet FG, Kindt R et al. Vegan: Community ecology package: ordination, diversity and dissimilarities. R package version 2. 4-3.
|
| [37] |
Rodionov SN. A seuential algorithm for testing climate regime shifts. Geohpysical Research Letters, 2004, 31: 1-4. |
| [38] |
Mayers PA. Organic geochemical proxies of paleoceanographic, paleolimnologic and paleolimatic processes. Organic Geochemistry, 1997, 27: 213-250. DOI:10.1016/S0146-6380(97)00049-1 |
| [39] |
Zhang EL, Tang HQ, Cao YM et al. The effects of soil erosion on chironomid assemblages in Lugu Lake over the past 120 years. International Review of Hydrobiology, 2013, 98(3): 165-172. DOI:10.1002/iroh.v98.3 |
| [40] |
Brooks SJ, Langdon PG, Heiri O. The identification and use of palaearctic chironomid larvae in palaeoecology. London: Quaternary Research Association, 2007.
|
| [41] |
Kalff J ed. Translated by Gu BH et al. Limnology inland water ecosystems. Beijing: Higher Education Press, 2011. Kalff J. [古滨河等译. 湖沼学: 内陆水生态系统. 北京: 高等教育出版社, 2011. ]
|
| [42] |
Little J, Smol J. Changes in fossil midge (Chironomidae) assemblages in response to cultural activities in a shallow, polymictic lake. Journal of Paleolimnology, 2000, 23(2): 207-212. DOI:10.1023/A:1008005604602 |
| [43] |
Brodersen KP, Quinlan R. Midges as palaeoindicators of lake productivity, eutrophication and hypolimnetic oxygen. Quaternary Science Reviews, 2006, 25(15): 1995-2012. DOI:10.1016/j.quascirev.2005.03.020 |
| [44] |
Zhao ZH, Zhang NM, Hu XW et al. Yunsheng.Effects of composition and structure of natural organic matter on phosphorus fractions in sediment from Lake Yangzonghai, Yunnan Province. J Lake Sci, 2017, 29(2): 308-316. [赵忠红, 张乃明, 扈学文等. 云南阳宗海表层沉积物有机质组成结构对磷赋存形态特征的影响. 湖泊科学, 2017, 29(2): 308-316. DOI:10.18307/2017.0206] |
| [45] |
Zhang JH, Huang YM. Biodiversity and stability mechanisms:understanding and future research. Acta Ecologica Sinica, 2016, 36(13): 3859-3870. [张景慧, 黄永梅. 物多样性与稳定性机制研究进展. 生态学报, 2016, 36(13): 3859-3870. DOI:10.5846/stxb201411062196] |
| [46] |
Loreau M, Hector A. Partitioning selection and complementary in biodiversity experiments. Nature, 2001, 412(6842): 72-76. DOI:10.1038/35083573 |
| [47] |
Duffy JE, Lefcheck JS, Stuart-Smith RD et al. Biodiversity enhances reef fish biomass and resistance to climate change. PNAS, 2016, 113(22): 6230-6236. DOI:10.1073/pnas.1524465113 |
 2018, Vol. 30
2018, Vol. 30 

