湖泊有色可溶性有机物(CDOM)是溶解性有机物中的光活性部分,一般来源于外源腐殖质的输入和内源水生植物的降解[1-3]. CDOM在湖泊生态系统中具有重要作用.首先,CDOM可以吸收紫外和可见波段范围内的光,一方面造成了水下光合有效辐射的衰减,从而在一定程度上抑制了浮游植物和沉水植物的生长[4],另一方面又可以减轻紫外辐射对水生生物的伤害,保护了水生态系统.其次,CDOM富含碳、氮和磷等湖泊生源要素,在光化学作用下可以释放出易被微生物和水生植物利用的低分子量化合物,从而对湖泊富营养化进程和碳循环等有着巨大影响[5-6].
CDOM化学成分复杂,一般认为其主要由类腐殖质和类蛋白等一系列物质组成[7].研究发现,类腐殖质分子上某些官能团与水体中的痕量金属元素有很强的结合能力,从而在重金属的迁移和归趋过程中起着重要作用[8],而类腐殖质中类腐殖酸与类富里酸的相对比例又极大地影响着其光吸收特性[9].此外,CDOM中所含有的类蛋白等生物可利用组分与异养细菌的新陈代谢有较强的正相关性[10],其含量的变化可以显著改变水体中微生物的群落结构[11].因此,研究CDOM组分的变化情况,对于评估CDOM在水生态系统中的作用有着重要的意义.
过去的20~30年内,由于流域内和周围城市大量氮和磷营养盐的输入,太湖面临着严重的富营养化问题,并频繁暴发蓝藻水华.藻华衰亡对湖泊CDOM的贡献已有较多研究[12-13],但针对蓝藻暴发和衰亡过程中湖泊CDOM的组成变化的研究甚少.平行因子分析(PARAFAC)技术可以有效地将CDOM三维荧光光谱分解成各个独立的荧光组分,并已被广泛应用于水体中CDOM荧光成分的动态变化研究[3, 14-15],因此本研究采用三维荧光光谱和平行因子分析法,对湖泊实地调查和模拟试验的样品进行分析,并结合水质理化参数的测定,考察蓝藻水华暴发和衰亡对湖泊CDOM的影响.
1 材料与方法 1.1 研究区域和采样位点太湖(30°56′~31°33′N, 119°54′~120°36′E),位于长江三角洲地区,是中国五大淡水湖之一(面积为2338 km2),同时也是典型的富营养化湖泊[16].过去30年来,蓝藻水华已经成为严重的环境问题[17].梅梁湾位于太湖西北部,面积144 km2,受东南季风的影响,每年5-9月均有大量的蓝藻堆积于湾内湖面上,使得其叶绿素a平均浓度可达到近50 μg/L[18].
为考察藻华暴发对湖泊CDOM的影响,于藻华暴发季节(2016年8月)进行湖泊采样调查,各位点分布如图 1所示,其中位点1#~3#分别为武进港、直湖港和梁溪河入湖河口,位点8#和9#为梅梁湾湾口,而位点12#代表湖心位置.受主导风向的影响,实验期间大量蓝藻堆积在位点2#处,因此模拟实验所使用的蓝藻样品在此处采集.中国科学院南京地理与湖泊研究所太湖湖泊生态系统研究站(TLLER)位于梅梁湾东侧近湾口处,本次野外模拟实验在该研究站内进行.

|
图 1 研究区域位置和采样位点分布 Fig.1 Location of studied area and sampling sites |
采集太湖梅梁湾、开敞区等12个位点(图 1)的表层水样(水面下30~50 cm),同时测定水温、pH和溶解氧(DO)等指标,所采集样品置于4℃冷藏箱保存,回实验室后立即测定叶绿素a(Chl.a)、总氮(TN)、总磷(TP)、硝态氮(NO3--N)和铵态氮(NH4+-N)等水质参数,并进行三维荧光扫描.
1.3 模拟试验实验前一天于位点2#采集蓝藻,藻种鉴定结果表明,铜绿微囊藻为优势种.将采集的蓝藻分别加入到含400 L湖水(直接从湖中泵入)的塑料容器中,使得Chl.a初始浓度分别约为150、100和50 μg/L,每个浓度设3个平行.太湖蓝藻在夏季处于氮限制状态[18],为观察藻类生长和衰亡两个阶段对湖泊CDOM的影响,在实验初始和中间各添加1次氯化铵.实验过程中,每天上午6:00和下午6:30测定水温、pH和DO浓度等指标,在检测完这些理化性质之后,充分搅拌后取样,样品在Chl.a、NO3--N和NH4+-N浓度等水质参数测定前置于4℃冰箱中保存.
1.4 理化性质分析和光谱扫描水温、pH和DO等指标使用YSI 6600多功能水质仪现场测定,Chl.a、TN、TP、NO3--N和NH4+-N浓度的测定按照国家环境保护总局标准分析方法[19]进行.水样经0.7 μm预灼烧的玻璃纤维滤膜过滤后,采用日立F-7000荧光分光光度计进行CDOM三维荧光光谱扫描,激发波长(Ex)和发射波长(Em)扫描范围分别为200~450和250~600 nm,扫描步长5 nm,狭缝宽度5 nm,扫描速度12000 nm/min.
1.5 数据处理为消除水的拉曼散射和瑞利散射的影响,将获得的荧光光谱矩阵数据减去Milli-Q超纯水三维荧光光谱数据,并将图谱中Ex≥Em、2×Ex≤Em及Ex=Em±10~15 nm等区域中的数据以0代替.为便于不同仪器间的比较,对荧光强度进行定标处理,即将0.01 mg/L硫酸奎宁的稀硫酸溶液在Ex/Em=350 nm/450 nm下的荧光强度定义为1个归一化荧光单位,单位为QSU[12].
采用SPSS 18.0软件进行相关性分析和差异性检验,P < 0.05说明相关性或差异性显著.采用Sigmaplot 12.5和Matlab R2011a软件进行作图.
2 结果与讨论 2.1 湖泊调查 2.1.1 理化性质湖泊采样在下午2:00-4:00进行,天气多云且风力小于3级,因此大量蓝藻上浮并堆积在梅梁湾湖面上.各采样点中河口位置(位点1#~3#)的蓝藻最为密集,其平均Chl.a浓度达到283.20 μg/L,梅梁湾(位点4#~9#)次之,平均Chl.a浓度为82.00 μg/L,开敞区(位点10#~12#)最低,只有23.00 μg/L(表 1).与Chl.a浓度相对应,河口TN和TP浓度最高,其中位点1#的TN和TP浓度分别达到10.2和0.22 mg/L,开敞区相对较低,但TN和TP浓度平均值也分别达到2.45和0.07 mg/L.尽管TN浓度很高,无机氮浓度却相对较低,3个区域的NH4+-N浓度均只有0.08~0.09 mg/L.藻类的光合作用消耗了水中HCO3-(CO2),因此所有采样位点的pH均在11左右.采样当天梅梁湾湖面的蓝藻大多呈黄绿色,表明有部分蓝藻已开始衰亡,藻的衰亡消耗了水体中的氧,使得梅梁湾水体的DO水平显著低于河口和开敞区,其中位点8#的DO浓度仅有4.17 mg/L.
| 表 1 湖泊基本水质参数 Tab.1 Values of water parameters in original water from Lake Taihu |
为考察太湖梅梁湾和开敞区CDOM的分布特征和组成情况,对样品进行了三维荧光扫描(图 2), 可以看出,荧光峰有4个,包括类富里酸物质和类腐殖酸物质的荧光峰A(Ex/Em=255 nm/455 nm)和C(Ex/Em=360 nm /455 nm),和类色氨酸和酪氨酸物质的荧光峰B(Ex/Em=280 nm/320 nm)和D(Ex/Em=230 nm/340 nm)[20].其中,类腐殖酸物质(C峰)在武进港入湖河口(位点1#)有较强的荧光峰,但是随着采样位点向湖心方向移动,其强度逐渐减小,到湖心(位点12#)时,C峰已经消失.

|
图 2 不同采样点表层水样CDOM的三维荧光光谱 Fig.2 EEM Spectra of the CDOM at different sampling sites |
相关性分析经常被用来判定湖泊中不同荧光组分来源的差异[12].一般来讲,如果类蛋白物质与类腐殖酸荧光峰之间具有相关性,那么可以认为它们具有相同的来源.因此,太湖表层水样中类腐殖酸荧光峰A和C与类蛋白荧光峰B和D的荧光强度呈显著正相关(表 2,P < 0.01),表明这两类物质可能具有相似的来源[12],而这些荧光峰的强度与Chl.a浓度又呈现显著正相关(表 2,P < 0.01),说明藻华的暴发对湖泊水体类蛋白物质和类腐殖酸物质的产生均具有重要作用.
| 表 2 太湖表层水样各荧光峰强度与Chl.a浓度的相关性分析 Tab.2 Correlations between different fluorecence intensities and Chl.a concentration |
利用平行因子分析法(PARAFAC)对湖泊水样的三维荧光光谱进行分析,当因子数大于3时,核一致函数值小于50 %,且残差降低甚少,因此建立因子数为3的PARAFAC模型,获得3种荧光组分(图 3).组分1在最大发射波长320 nm处有2个最大的激发波长(225 nm和275 nm),其发射波长与图 2中的B峰位置相同,表征的是类酪氨酸荧光物质.组分2也有2个最大的激发波长,分别在235和300 nm处,最大发射波长为350 nm,与图 2中的D峰位置相似,代表类色氨酸物质,这2个组分都被认为是由水里的生物死亡降解所产生.组分3的2个最大激发波长和1个最大发射波长分别为260、355和460 nm,与图 2中A峰和C峰相似,被认为可能是由陆源输入的类腐殖质荧光物质[12].从解析出的3个荧光峰图谱可以看出,3个组分中类酪氨酸物质的荧光强度最高,类腐殖酸物质最低.
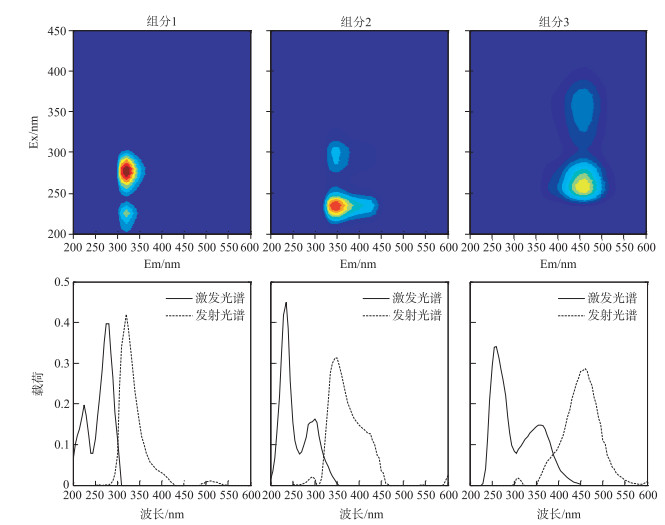
|
图 3 PARAFAC模型解析出的3个组分 Fig.3 The PARAFAC model output showing fluorescence signatures of three components identified |
根据PARAFAC分析结果中的得分值计算3个组分对各样品荧光强度的贡献率,结果发现,类腐殖酸荧光所占比例基本呈现从梅梁湾至湖心方向逐渐下降的趋势,该现象可能是河道输入的类腐殖酸物质逐步被稀释造成.但是前文分析结果表明藻华的暴发对湖泊类腐殖酸物质的产生具有重要作用,而类腐殖酸荧光所占比例与叶绿素a浓度又呈极显著正相关(r2=0.906,P < 10-5),因此可以推测,除稀释作用外,藻华暴发程度的差异可能是类腐殖酸荧光的比例从梅梁湾至湖心方向逐渐下降的另一个重要原因.
2.2 藻华暴发和衰亡模拟试验为进一步探索藻华对湖泊CDOM的影响,于太湖湖岸进行藻华暴发和衰亡模拟试验,3个处理中各理化性质随时间的变化情况见图 4.由于实验初期添加了NH4Cl,Chl.a浓度在前3天迅速上升,与之相对应,NH4+-N浓度急剧下降,在第3天下午所添加的NH4+-N已经全部消耗,而溶解氧浓度则急剧上升,并呈现出明显的昼夜变化.第4天开始藻逐渐变黄,而Chl.a浓度也呈现下降趋势,表明藻开始衰亡,至实验结束时各处理组中Chl.a浓度已下降至初始水平.藻的衰亡降解需要消耗大量的溶解氧,因此这个阶段DO开始下降,到第8天已下降至3.2 mg/L.由于有机氮的矿化需要一定的时间,因此第2次添加的NH4+-N继续被消耗,直到第6~8天才开始上升.矿化作用为蓝藻的再暴发提供了一定量的营养元素,从第8天开始蓝藻逐渐变绿,而DO和pH也呈现上升趋势.第2次添加NH4+-N后,不同处理中NH4+-N浓度的变化差异显著(P < 0.01, ANOVA),具体表现为初始藻浓度越高,NH4+-N浓度越低,其原因可能与蓝藻的同化作用和微生物硝化作用有关.
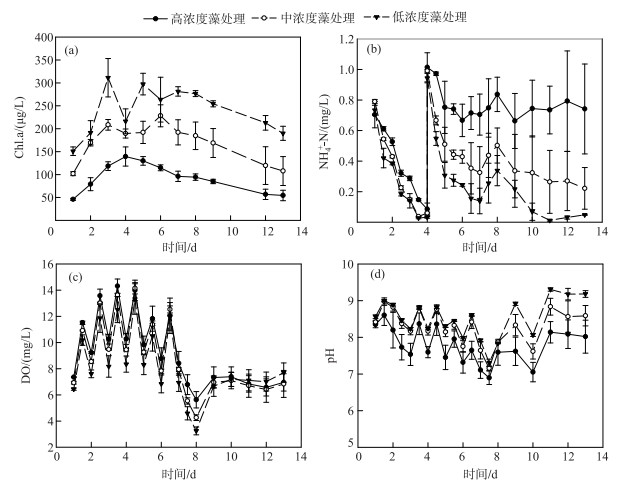
|
图 4 不同浓度藻的处理中Chl.a(a)、NH4+-N(b)、DO(c)和pH(d)随时间的变化 Fig.4 Temporal variations of Chl.a(a), NH4+-N(b), DO(c) and pH(d) in different treatments |
微生物的好氧降解能够迅速降低湖泊CDOM含量[21],但是我们发现藻华暴发初期藻的同化作用和暴发中后期微生物的反硝化作用在去除CDOM中同样有着巨大的贡献.一般情况下,蓝藻的光合作用会消耗水中溶解的CO2,使得水体pH值升高.但是许多研究表明,蓝藻可以利用溶解性有机碳进行自身细胞的合成[22],Silaban等[23]甚至发现添加有机碳后,蓝藻的生长速率得到大大提高.本研究中,不同处理组中的Chl.a浓度均在前3天急剧上升,而pH值仅在第1天少量上升,到第3天才呈现出昼夜变化的趋势,表明实验初期蓝藻可能利用了水体中溶解性有机碳进行生长.反硝化一般发生在DO浓度低于0.7 mg/L的沉积层与水柱厌氧界面处[24],然而前期研究结果表明藻附生菌的反硝化能够在DO浓度较高的环境中发生[25].实验第8天DO已经下降至3.2 mg/L,而由于藻和微生物的呼吸作用,夜间DO浓度可能会更低,因此根据NO3--N浓度在第2次添加NH4+-N后出现的白天上升、夜间下降的昼夜变化情况,结合不同处理中总氮浓度的减少(数据未列出),可推测体系中存在着耦合硝化反硝化作用,从而消耗了水体中的溶解性有机物.
与太湖表层水体相似,模拟试验水样的三维荧光光谱同样解析出3个荧光组分(图 5),其中组分1(类酪氨酸荧光物质)的荧光峰位置分别为Ex/Em=225 nm/320 nm和Ex/Em=275 nm /320 nm,组份2(类色氨酸物质)的荧光峰位置分别为Ex/Em=235 nm /345 nm和Ex/Em=300 nm /345 nm,均与湖泊水样相应荧光峰的位置基本一致.组分3(类腐殖酸物质)的2个荧光峰位置分别为Ex/Em=260 nm /445 nm和Ex/Em=330 nm /445 nm,与湖泊水样相比,其激发波长和发射波长均有一定程度的蓝移(图 3和图 5),相似的蓝移现象在Zhang等[12]的蓝藻降解试验中也曾被发现.研究表明,类腐殖酸荧光峰的发射波长与其芳香性显著相关,具体表现为芳香性越强,发射波长越长[26].湖泊外源CDOM主要来源于陆源植物和土壤有机质的分解和淋溶,其芳香性高于内源类腐殖质[27],因此模拟试验中类腐殖酸物质荧光峰的蓝移可能是内源所占的比例增大造成[28].

|
图 5 PARAFAC模型解析出的3个组分 Fig.5 The PARAFAC model output showing fluorescence signatures of three components identified |
利用PARAFAC模型中的得分值计算3个组分对总荧光强度的贡献率(图 6),结果发现,整个实验过程中初始藻浓度越高,类蛋白物质(组分1和组分2)所占比例越低,类腐殖酸物质(组分3)的比例越高(P < 0.01, ANOVA).而添加了中等浓度和高浓度的藻处理中,实验结束时类腐殖酸物质(组分3)占总荧光物质的比例显著高于实验初始时(P < 0.01, ANOVA),这证明了前文藻华暴发可以改变湖泊CDOM组成结构的推测.
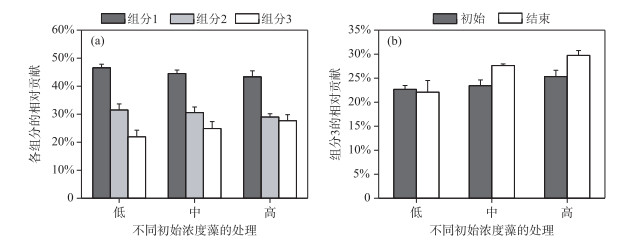
|
图 6 整个实验过程中各组分占总荧光物质的比例(a)和实验始末组分3占总荧光物质的比例(b) Fig.6 Ratios of each component to total fluorescence substances during the experiment(a) and the initial and final ratios of component 3 to total fluorescence substances in different treatments(b) |
在生长和衰亡阶段,蓝藻可以为细菌提供大量的营养元素和躲避浮游动物滤食的庇护场所,使得异养型的藻附生菌和浮游细菌大大增殖[29].研究表明,这些异养型微生物在CDOM的代谢过程中具有双重作用,它们既是CDOM的生产者,又是CDOM的消费者[30],因此藻华暴发过程中急剧增殖的藻附生菌和浮游细菌在促进CDOM产生的同时,又大大加快了CDOM的微生物降解速率.在富营养化程度较高的太湖西北湖区,夏季大量的蓝藻群体过度堆积,导致水华下层容易出现蔽光的环境[13],从而极大地削弱了湖泊CDOM的光降解效率. Stedmon等[31]发现,浮游植物降解所产生的内源类腐殖质主要由光降解去除,而类蛋白物质则同时受到光降解和微生物降解的作用.因此,藻华暴发和衰亡过程中,藻的降解导致了类腐殖酸物质和类蛋白物质含量的升高,但是由于受藻华直接或间接的影响,CDOM中类腐殖酸物质的降解速率远低于类蛋白物质,从而造成了类腐殖酸物质相对比例的升高.由此可以推测,蓝藻水华的长期暴发可能是除河道输入外,梅梁湾类腐殖酸物质的比例高于开敞区的另一个重要原因.
3 结论湖泊调查和模拟实验结果表明蓝藻是太湖CDOM的重要来源.藻华的暴发可以改变湖泊CDOM的组成,促进类腐殖酸物质比例的升高.蓝藻水华的长期暴发可能是除河道输入外,梅梁湾类腐殖酸物质的比例高于开敞区的另一个重要原因.
致谢: 感谢中国科学院太湖湖泊生态系统研究站为本研究提供研究场地和实验仪器设备的支持.| [1] |
Arvola L, Äijälä C, Leppäranta M. CDOM concentrations of large Finnish lakes relative to their landscape properties. Hydrobiologia, 2016, 780(1): 37-46. DOI:10.1007/s10750-016-2906-4 |
| [2] |
Rochelle-Newall EJ, Fisher TR. Production of chromophoric dissolved organic matter fluorescence in marine and estuarine environments:an investigation into the role of phytoplankton. Marine Chemistry, 2002, 77(1): 7-21. DOI:10.1016/S0304-4203(01)00072-X |
| [3] |
Zhou Y, Yao X, Zhang Y et al. Potential rainfall-intensity and pH-driven shifts in the apparent fluorescent composition of dissolved organic matter in rainwater. Environmental Pollution, 2017, 224: 638-648. DOI:10.1016/j.envpol.2017.02.048 |
| [4] |
Sempéré R, Para J, Tedetti M et al. Variability of solar radiation and CDOM in surface coastal waters of the northwestern Mediterranean Sea. Photochemistry & Photobiology, 2015, 91(4): 851-861. |
| [5] |
Nelson NB, Siegel DA, Carlson CA et al. Tracing global biogeochemical cycles and meridional overturning circulation using chromophoric dissolved organic matter. Geophysical Research Letters, 2010, 37(3): L03610. |
| [6] |
Zhang Y, Liu M, Qin B et al. Photochemical degradation of chromophoric-dissolved organic matter exposed to simulated UV-B and natural solar radiation. Hydrobiologia, 2009, 627(1): 159-168. DOI:10.1007/s10750-009-9722-z |
| [7] |
Coble PG. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy. Marine Chemistry, 1996, 51(4): 325-346. DOI:10.1016/0304-4203(95)00062-3 |
| [8] |
Worms IAM, Adenmatten D, Miéville P et al. Photo-transformation of pedogenic humic acid and consequences for Cd(Ⅱ), Cu(Ⅱ) and Pb(Ⅱ) speciation and bioavailability to green microalga. Chemosphere, 2015, 138: 908-915. DOI:10.1016/j.chemosphere.2014.10.093 |
| [9] |
Spencer RGM, Butler KD, Aiken GR. Dissolved organic carbon and chromophoric dissolved organic matter properties of rivers in the USA. Journal of Geophysical Research Biogeosciences, 2015, 117: G03001. |
| [10] |
Cammack WKL, Kalff J, Prairie YT et al. Fluorescent dissolved organic matter in lakes:Relationships with heterotrophic metabolism. Limnology and Oceanography, 2004, 49(6): 2034-2045. DOI:10.4319/lo.2004.49.6.2034 |
| [11] |
Piccini C, Conde D, Pernthaler J et al. Alteration of chromophoric dissolved organic matter by solar UV radiation causes rapid changes in bacterial community composition. Photochemical & Photobiological Sciences, 2009, 8(9): 1321-1328. |
| [12] |
Zhang Y, van Dijk MA, Liu M et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter(CDOM) in eutrophic shallow lakes:field and experimental evidence. Water Research, 2009, 43(18): 4685-4697. DOI:10.1016/j.watres.2009.07.024 |
| [13] |
Zhou Y, Jeppesen E, Zhang Y et al. Chromophoric dissolved organic matter of black waters in a highly eutrophic Chinese lake:Freshly produced from algal scums?. Journal of Hazardous Materials, 2015, 299(6): 222-230. |
| [14] |
Tfaily MM, Corbett JE, Wilson R et al. Utilization of PARAFAC-Modeled Excitation-Emission Matrix(EEM) Fluorescence Spectroscopy to identify biogeochemical processing of dissolved organic matter in a Northern Peatland. Photochemistry & Photobiology, 2015, 91(3): 684-695. |
| [15] |
Oloibiri V, De CS, Chys M et al. Characterisation of landfill leachate by EEM-PARAFAC-SOM during physical-chemical treatment by coagulation-flocculation, activated carbon adsorption and ion exchange. Chemosphere, 2017, 186: 873-883. DOI:10.1016/j.chemosphere.2017.08.035 |
| [16] |
Qin B. Lake Taihu, China:dynamics and environmental change. Springer Science & Business Media, 2008. |
| [17] |
Guo L. Doing battle with the green monster of Taihu Lake. Science, 2007, 317(5842): 1166-1166. DOI:10.1126/science.317.5842.1166 |
| [18] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [19] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods ed. Water and wastewater monitoring and analysis methods: 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002. ]
|
| [20] |
Hudson N, Baker A, Reynolds D. Fluorescence analysis of dissolved organic matter in natural, waste and polluted waters-A review. River Research and Applications, 2007, 23: 631-649. DOI:10.1002/(ISSN)1535-1467 |
| [21] |
Hanamachi Y, Hama T, Yanai T. Decomposition process of organic matter derived from freshwater phytoplankton. Limnology, 2008, 9(1): 57-69. DOI:10.1007/s10201-007-0232-2 |
| [22] |
Wan N, Abernathy M, Tang KH et al. Cyanobacterial photo-driven mixotrophic metabolism and its advantages for biosynthesis. Frontiers of Chemical Science and Engineering, 2015, 9(3): 308-316. DOI:10.1007/s11705-015-1521-7 |
| [23] |
Silaban A, Bai R, Gutierrez-Wing MT et al. Effect of organic carbon, C:N ratio and light on the growth and lipid productivity of microalgae/cyanobacteria coculture. Engineering in Life Sciences, 2014, 14(1): 47-56. DOI:10.1002/elsc.201200219 |
| [24] |
Brandes JA, Devol AH, Deutsch C. New developments in the marine nitrogen cycle. Chemical Reviews, 2007, 38(20): 577-589. |
| [25] |
Chen X, Jiang H, Sun X et al. Nitrification and denitrification by algae-attached and free-living microorganisms during a cyanobacterial bloom in Lake Taihu, a shallow Eutrophic Lake in China. Biogeochemistry, 2016, 131(1/2): 135-146. |
| [26] |
Ateia M, Ran J, Fujii M et al. The relationship between molecular composition and fluorescence properties of humic substances. International Journal of Environmental Science & Technology, 2017, 14(4): 868-880. |
| [27] |
Mcknight DM, Boyer EW, Westerhoff PK et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity. Limnology and Oceanography, 2001, 46(1): 38-48. DOI:10.4319/lo.2001.46.1.0038 |
| [28] |
Boehme J, Wells M. Fluorescence variability of marine and terrestrial colloids:Examining size fractions of chromophoric dissolved organic matter in the Damariscotta River estuary. Marine Chemistry, 2006, 101(1/2): 95-103. |
| [29] |
Niu Y, Shen H, Chen J et al. Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China. Water Research, 2011, 45(14): 4169-4182. DOI:10.1016/j.watres.2011.05.022 |
| [30] |
Guillemette F, del Giorgio PA. Simultaneous consumption and production of fluorescent dissolved organic matter by lake bacterioplankton. Environmental Microbiology, 2012, 14(6): 1432-1443. DOI:10.1111/j.1462-2920.2012.02728.x |
| [31] |
Stedmon CA, Markager S. Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis. Limnology and Oceanography, 2005, 50(5): 1415-1426. DOI:10.4319/lo.2005.50.5.1415 |
 2018, Vol. 30
2018, Vol. 30 

