(2: 中国科学院大学, 北京 100049)
(3: 天津市水利科学研究院, 天津 300061)
(4: 南京工程学院, 南京 211167)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Tianjin Hydraulic Research Institute, Tianjin 300061, P. R. China)
(4: Nanjing Institute of Technology, Nanjing 211167, P. R. China)
受温室效应、人类活动等影响,部分湖泊、河流富营养化日益严重,蓝藻水华已成为全球瞩目的环境问题之一[1].高密度蓝藻聚集时,大量蓝藻在湖岸带聚集且不易扩散[2];类似重富营养化静水水体区域,蓝藻能够堆积数十厘米,随后腐烂分解释放氮、磷等营养物质[3-4],为蓝藻生长繁殖提供营养源[5-6].
关于蓝藻分解所引起的水质污染效应,更多的研究侧重于室内模拟高密度蓝藻聚集情况下水质变化特征[3-4],已有大量研究表明高密度蓝藻在衰亡过程能够释放大量营养盐及溶解性有机质(DOM)至水体中[7-8].然而高密度蓝藻聚集后易死亡并且形成有机碎屑,一部分蓝藻碎屑在水体表层被好氧异养微生物利用[9-10];大部分蓝藻碎屑却沉降至沉积物表面,其分解会导致沉积物碳(C)、氮(N)、磷(P)含量增加[11].同时藻屑有机质作为底栖微生物重要的能量来源,能够加快微生物代谢进程[12],引起沉积物-水界面氮、磷营养盐通量增加[13-14],对沉积物与水中营养盐组成及沉积物微生物群落组成造成一定改变[15].另一方面,沉积物作为氮、磷等污染负荷的重要“释放源”,富含有机氮(ON)与有机磷(OP),其释放氮、磷污染负荷的途径主要有两种:①沉积物-水界面的新鲜与新生不稳定有机质(OM)矿化快速释放;②长期埋藏在沉积物中的有机质矿化缓慢释放[16]. Anna等[17]研究发现沉积物-水界面的不稳定ON、OP具有更高的分解速率,释放的无机氮(DIN)、尿素和溶解性游离氨基酸贡献了27 % ~75 %藻类N需求量.藻屑作为沉积物中新生OM易降解,降解过程中可能会引发沉积物溶氧环境和pH的变化,沉积物分解释放碳、氮、磷等污染物易受水体和沉积物基本理化性质的影响,从而改变沉积物矿化产物及沉积物-水界面营养盐循环. Lomstein等[18]研究发现在厌氧条件下,高密度石莼有机碎屑与底泥作用下可增加ON矿化速率,释放高浓度无机氮至上覆水中.因此,沉积物中内源氮和磷的释放又会成为藻类生长的营养源,为藻类繁殖和蓝藻水华频繁暴发做出一定贡献[19].
针对蓝藻分解所引起的水环境污染效应,以往文献多以蓝藻由衰到亡过程对沉积物-水界面氮、磷释放的影响展开研究,而不同密度蓝藻有机质碎屑堆积与底泥相互作用导致的氮、磷释放鲜有文献报道.因此本文针对藻屑堆集现象,以及此现象可能产生的环境问题展开研究.本实验参考于桥水库大坝夏季时期蓝藻常规密度(108 cells/L,Chl.a浓度为50~60 μg/L),在湖心区采集沉积物柱,设置6个藻屑质量添加梯度,通过测定上覆水中氮、磷及有机物相关指标,探索静态条件下随着藻屑堆积密度增加沉积物中碳、氮、磷等营养物质释放的动态变化趋势,探讨频繁暴发的水华引起藻屑堆积现象对水生态系统的影响作用.
1 材料与方法 1.1 样品采集与处理实验水样和泥样均取自于桥水库.于2017年7月8日在于桥水库湖心区(40°02′7.29″N,117°32′36.58″E),用装有Φ 86 mm×500 mm有机玻璃管的柱状采泥器采集沉积物柱18根,吸取样柱中的上覆水,现场测定水温、溶解氧(DO)和pH.剩余水样保存于带有冰盒的保温箱中,用于水质理化指标分析.柱子上部缓慢注满原水并用橡皮塞塞紧,以免扰动底泥.采集水库底层水样25 L在实验室经0.45 μm醋酸纤维滤膜过滤后作为沉积物柱静态培养实验补给水.所有样品尽快运回实验室置于恒温室(27±1℃),模拟夏季蓝藻代谢死亡时的温度,于暗处静置2 h使沉积物样稳定.在大坝区用浮游生物网(孔径64 μm)采集浓缩藻液10 L,带回实验室反复冻融4~5次以保证藻类死亡(细胞破碎并有藻蓝蛋白及其他内溶物流出),经蒸馏水反复清洗,以5000转/min转速离心得到浓缩藻浆,置于-70℃冰箱中保存备用.使用时用冷冻干燥机冻干,并研磨过80目筛得到干藻屑.
表层沉积物和藻屑的碳、氮、磷含量如表 1所示.
| 表 1 表层沉积物和藻屑理化性质 Tab.1 Physical and chemical properties of surface sediments and algal detritus |
夏季于桥水库大坝水体Chl.a平均浓度为50~60 μg/L[20],为了解夏季现今水华密度下藻屑堆积所引起的污染效应,设置x1组(加入0.06 g干藻;约6 g(dw)/m2;相当于Chl.a 60 μg/L).由于沉降至沉积物表面处藻屑堆积量可能随时间增多,因此设置其他4个藻屑添加梯度,具体如表 2所示.以不添加藻屑组为对照组.每个处理组均设置3个平行.
| 表 2 实验处理组设置 Tab.2 Setting of treatment in the experiment |
首先缓慢虹吸柱样中的上覆水,将冻干的藻屑按上述添加量添加于表层沉积物处,重新沿管壁缓缓注入过滤后的水样至上覆水30 cm处(沉积物高度均为30 cm,上覆水高度为19 cm),此过程中均未扰动沉积物表面.实验培养温度与采样时现场温度相同,为27±1℃,避光培养.开始培养当天记为0小时,按时间序列分别在第0、3、18、42、66和102小时采样.用便携式溶氧仪(HQ40D,哈希)测定沉积物-水界面层DO和pH,采集水-沉积物界面0~1 cm处上覆水样(100 ml)用于水质指标监测,采完样后沿管壁缓慢补充相同体积原水至原位置.
1.3 分析方法 1.3.1 水体基本理化指标测定实验期间采用便携式溶氧仪(HQ40D,哈希)测定水体DO和pH.
1.3.2 营养盐指标测定溶解性总氮(DTN)、溶解性有机氮(DON)、铵态氮(NH4+-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)和正磷酸盐(PO43--P)浓度测定所用液体为过0.45 μm醋酸纤维膜的上覆水.分析方法均参照《水和废水监测分析方法(第四版)》[21].其中DON为DTN与DIN浓度(NH4+-N、NO3--N、NO2--N之和)之差;通过称取过100目筛孔的15~20 mg泥样,用去离子水定溶至50 ml,参考水体TN和TP浓度方法测定沉积物中TN和TP含量;Chl.a浓度采用丙酮提取法测定[21].
一定时间间隔内营养盐平均释放速率(v)采用下式计算:
| $ {v_{{t_m} \sim {t_n}}} = (C{'_m}-C{'_n})/({t_m}-{t_n}) $ | (1) |
| $ C{'_n} = {C_n} + (C{'_{n-1}}-{C_0}) \cdot \frac{{{V_0}}}{V} $ | (2) |
式中, vtm~tn为tn~tm时间段内营养盐平均释放速率(mg/(L ·h));C′m、C′n和C′n-1分别为第m、n和n-1(≥2)次校正后的上覆水浓度(mg/L);tm和tn分别为第m次和第n次采样时间点(h);Cn为第n(≥1)次测定出的上覆水浓度(mg/L);C0为培养水浓度(mg/L);V和V0分别为柱样上覆水体积(L)和每次取样体积(L).
1.3.3 有机物指标测定紫外可见光全波扫描(UV-Vis):将经GF/F膜(450℃灼烧4 h)过滤的水样用紫外可见分光光度计(UV2700,岛津)扫描测定DOM吸收光谱,扫描范围为200~800 nm,间隔为1 nm;沉积物TOC含量采用元素分析仪(EA3000)测定.
SUVA254:指在254 nm波长下紫外吸光系数与溶液中DOC浓度(mg/L)的比值,值越大,说明有机物分子量、有机质的腐殖化水平以及有机物的芳香度越大[22].
1.3.4 数据处理数据采用Excel 2013软件进行计算,并用Origin 9.0软件绘制数据图;采用SPSS 20.0软件进行数据相关性分析.
2 结果与分析 2.1 藻屑堆积对水体基本理化指标的影响由于每个实验柱上覆水来自于同一地点,所以在第0小时DO和pH相同.各添加组在添加藻屑之后上覆水DO浓度迅速下降(图 1a),18小时后基本处于0.1 mg/L左右,并且5个添加组DO浓度无显著性差异(P>0.05).而对照组DO浓度由第0小时的7.56 mg/L下降至第18小时的1.58 mg/L,降低了5.98 mg/L;之后除了第42小时DO浓度低于1 mg/L外,其他时间DO环境均处于1.2~1.6 mg/L的缺氧环境,与5个添加组形成显著性差异(P < 0.05).与DO变化趋势相同,各个实验组pH在实验期间不断下降(图 1b),但均处于7.67~8.89之间,属于弱碱性状态;且藻屑添加组pH值均低于对照组.
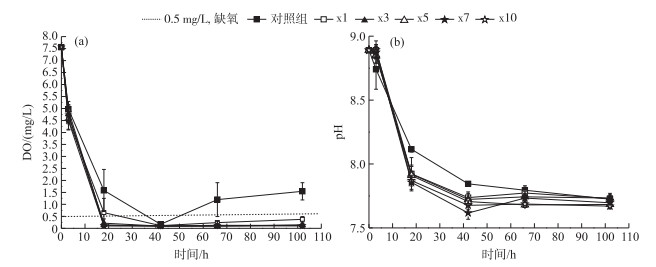
|
图 1 不同处理组DO浓度(a)和pH(b)变化 Fig.1 The variation of dissolved oxygen concentration(a) and pH(b) in different treatments |
实验初始DOC浓度为39.21 mg/L,各实验组培养后DOC浓度均降低(图 2a).实验开始3 h后,对照组和x1组DOC浓度均高于其他实验组,分别为47.40和47.32 mg/L.实验结束后,对照组DOC浓度降低了6.28 mg/L;x3、x5和x7组DOC浓度变化量均低于对照组;而x1和x10组DOC浓度变化最大,分别降低了17.02和12.35 mg/L,为其他藻屑添加组DOC浓度减小量的4倍或以上. SUVA254值与DOC浓度变化趋势相反,至实验结束,各实验组SUVA254值均有不同程度增加(图 2b);其中对照组SUVA254值增加量最低,为0.14 L/(mg ·m);其他藻屑添加组除x7组外,SUVA254值增加量均高于对照组,且实验结束时各添加组SUVA254值均处于0.54~1.74 L/(mg ·m)之间.
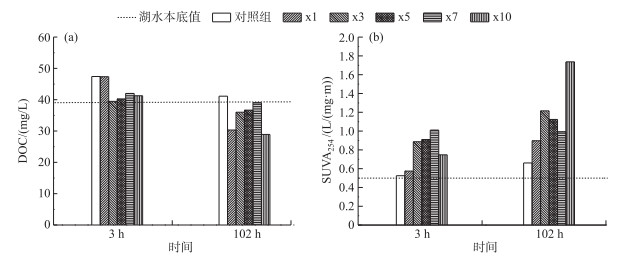
|
图 2 不同处理组上覆水DOC浓度(a)和SUVA254值(b)随培养时间的变化特征 Fig.2 The variation of DOC concentration(a) and SUVA254 (b) in different treatments during incubation period |
实验起始DON浓度为4.05 mg/L,在整个实验过程中各个实验组DON浓度随时间逐渐增加(图 3a).实验开始后3 h,各实验组DON浓度均增加,其中x10组变化量最高,为13.31 mg/L;至实验结束,各实验组DON浓度为初始的6.08~11.20倍.各实验组DON浓度相比,实验开始后3 h,对照组与x1组DON浓度无显著差异,其他藻屑添加组(藻密度在6 g(dw)/m2以上)的DON浓度在实验开始后3 h显著增加,浓度增加量分别为对照组和x1组的8.38~22.19和5.03~13.31倍;且各实验组DON前3 h平均释放速率最高,与藻屑密度呈正比,其中对照组和x10组分别为0.13和4.44 mg/(L ·h),有明显差异.
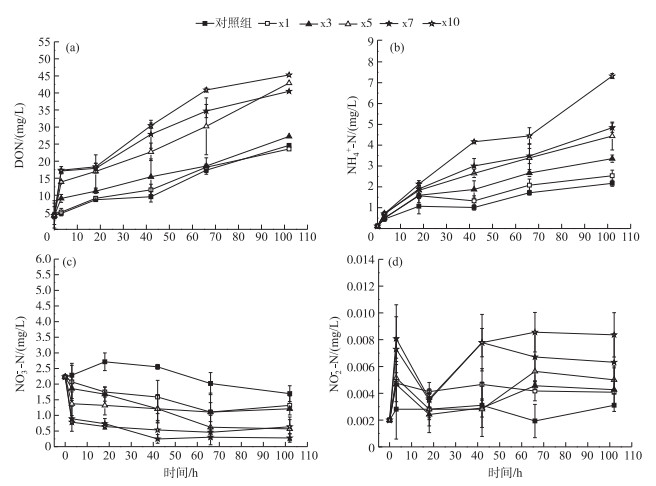
|
图 3 不同处理组上覆水氮形态浓度随培养时间的变化特征 Fig.3 The variation of different forms of nitrogen in the overlying water of different treatments during incubation period |
与DON变化趋势相同,各实验组NH4+-N浓度随时间增加(图 3b),其释放浓度与藻屑密度有关,且各个实验组之间具有显著性差异(P < 0.05).其中x10组整个实验阶段NH4+-N平均释放速率最高,为0.06 mg/(L ·h),至实验结束,NH4+-N浓度增加至7.32 mg/L,为初始浓度的6倍.与对照组相比,藻屑添加组NH4+-N浓度较高,培养18小时后即超过饮用水源地水质标准(NH4+-N≤1.0 mg/L),实验结束时为对照组的18.40~62.04倍.
各实验组NO3--N浓度在实验期间逐渐降低(图 3c),且对照组NO3--N浓度高于藻屑添加组,浓度维持在1.70~2.72 mg/L之间.而x7和x10组NO3--N浓度在第3小时分别骤降为0.74和0.65 mg/L,随后不断降低并在第42小时后维持稳定,其余藻屑添加组NO3--N浓度也逐渐降低,但均高于x7和x10组. NO2--N浓度均低于0.01 mg/L(图 3d),可近似为0 mg/L.
2.3.2 上覆水磷浓度变化短期培养阶段各实验组PO43--P浓度均有所增加(图 4).在第3小时各藻屑添加组PO43--P浓度均有所增加,而第3小时和18小时各实验组PO43--P浓度无显著变化,18~102小时之间PO43--P浓度迅速增加.藻屑添加组PO43--P浓度均高于对照组,尤其是藻屑添加量在18 g(dw)/m2(x3组)或以上的实验组,实验结束时,PO43--P浓度为0.54~0.57 mg/L.实验前3小时,各藻屑添加组PO43--P平均释放速率远低于DON和NH4+-N平均释放速率,处于0.002~0.03 mg/(L ·h)之间,且高于整个实验阶段平均释放速率(0.003~0.006 mg/(L ·h)).
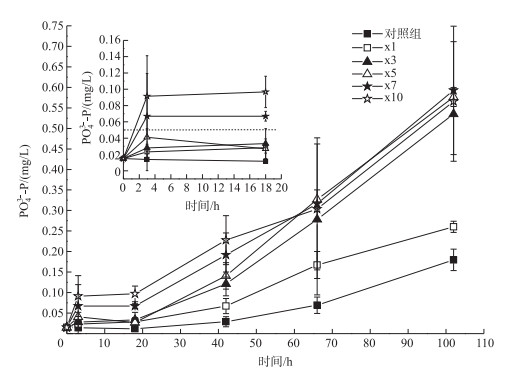
|
图 4 不同处理组上覆水PO43--P浓度随培养时间的变化特征 Fig.4 The variation of PO43--P in the overlying water of different treatments during incubation period |
上覆水中各形态氮、无机磷及DOC浓度与藻密度的关系如图 5所示.在藻屑堆积情况下,上覆水DTN、DON与NH4+-N浓度与藻密度呈线性正相关(P < 0.05),释放量(y,mg/L)与藻屑密度(x,mg/m2)分别表现为:y=0.28x+14.30(R2=0.93)、y=0.24x+9.61(R2=0.94)和y=0.03x+1.11(R2=0.93).与之相反,上覆水中NO3--N浓度与藻屑密度呈线性负相关(R2=0.80,P < 0.05),DOC、PO43--P浓度与藻屑密度现为多项式关系:y=-3.87306×10-4x3+0.036x2-0.89x+43.84(R2=0.92)和y=-6.52×10-5x2+0.0065x+0.058(R2=0.97),说明在设置的藻屑密度范围内,藻屑密度与DOC和PO43--P浓度并非线性相关,可能是受多方面因素影响的原因.

|
图 5 藻密度与上覆水DOC、各种形态氮、PO43--P浓度之间的关系 Fig.5 Relationship between the concentrations of DOC, nitrogen, PO43--P in overlying water and the densities of algal detritus |
氮、磷作为藻类生长繁殖的主要限制性元素,其流域陆源输入虽然得到一定的控制[23],但受多方面的环境及人为因素影响,蓝藻水华仍持续发生,导致藻屑有机质堆积同时使得沉积物富含活性有机质,成为生物内源氮、磷蓄积库[19].对照组采自于桥水库湖心区,表层沉积物碳含量为4.73 %,静态培养过程中,由于沉积物中微生物活动及颗粒态有机质分解消耗氧气,导致DO浓度在18小时内急剧降低至2 mg/L以下,形成缺氧环境.而藻屑属于易降解有机质,沉降至沉积物中后进一步增加沉积物需氧量[24].实验期间添加藻屑组沉积物-水界面1 cm处上覆水DO快速消耗,18小时后DO浓度均低于0.5 mg/L,远低于未添加藻屑的对照组,造成水体厌氧. García-Robledo等[25]研究微藻碎屑沉降对底栖细菌群落的影响发现,微藻碎屑沉降后加速细菌群落的快速增长,并且微生物活性与碳源添加量有关[26].随着不同密度藻屑加入为微生物提供新鲜碳源,异养微生物活性得到不同程度激发,加速新陈代谢速度,消耗水体大量DO[25].造成对照组水体DO浓度与藻屑添加组存在显著性差异(Pt < 0.05)(表 3).并在分解的过程中产生大量有机酸及二氧化碳(公式(3)),所以随着藻密度增加,本实验中上覆水pH不断降低(图 1b),且藻屑添加组pH均低于对照组.
| 表 3 藻屑添加组与对照组NH4+-N、DTN、DON、PO43--P、DO浓度差异显著性检验(t检验)* Tab.3 T test results of the concentrations of NH4+-N, DTN, DON, PO43--P and DO between the algae-addition treatments and the control |
| $ {\rm{11}}{{\rm{C}}_{\rm{6}}}{{\rm{H}}_{{\rm{12}}}}{{\rm{O}}_{\rm{6}}}{\rm{ + 24}}{{\rm{O}}_{\rm{2}}}{\rm{ + 8N}}{{\rm{H}}_{\rm{4}}}^{\rm{ + }}{\rm{ + 8HC}}{{\rm{O}}_{\rm{3}}}^-\Leftrightarrow {\rm{8}}{{\rm{C}}_{\rm{5}}}{{\rm{H}}_{\rm{8}}}{{\rm{O}}_{\rm{2}}}{\rm{N + 34C}}{{\rm{O}}_{\rm{2}}}{\rm{ + 54}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (3) |
一般认为植物碎屑降解主要由3个过程组成,尽管这些过程有很大部分的重合[27].首先碎屑降解初期是可溶性物质(与细胞死亡或自溶有关)的快速释放过程,且不受微生物活动干扰[25].然后,微生物通过生物酶分解不稳定生物大分子,释放出DOC和DON.最终剩余的大分子物质如纤维素和半纤维素等,开始极其缓慢的分解过程[28].由于DOM中碳生物量超过50 %,所以DOC常作为间接指标来示踪DOM变化[28]. Wickland等[28]研究发现在无菌情况下,藻类细胞在3小时内可释放15 %的细胞有机物(IOM)至水体中.本实验中在第3小时各实验组DOC浓度均有不同程度的增加,可能是由于藻屑细胞内溶物释放导致. Li等[29]研究表明DOC浓度影响微生物群落活性及多样性,微生物细菌密度与DOC浓度呈正比,多样性与DOC浓度呈反比.实验结束时各处理组DOC浓度均降低(图 2a),且DOC/DON比值有明显降低,DOC/DON比值处于8.01~9.04之间(图 6). Lomstein等[18]利用微宇宙装置研究石莼有机碎屑与底泥相互作用后所产生的矿化产物发现DOC/DON比值增加.本实验结果与之相反,可能受藻密度影响,藻密度越大,微生物细菌较多,DOC优先DON被利用,导致实验结束时DOC/DON比值减小且与藻密度呈反比[30].但DOC浓度与藻屑密度并无显著相关性(P>0.05)(图 5),可能是由于DOC浓度受到诸多因素影响,如来源、组成、微生物活性和胶体颗粒物吸附等[31]. SUVA值作为评估DOC化学性质的重要参数,被广泛应用至水生态系统中[31]. Hong等[32]总结相关文献中藻源性DOM的SUVA254值,发现其值处于0.50~2.30 L/(mg ·m)之间,外源性有机物SUVA254值高,处于3.20~4.70 L/(mg ·m)之间.至实验结束各组SUVA254值虽有不同程度的增加,但均处于0.50~1.80 L/(mg ·m)之间,说明水体中DOM部分来源于藻源性有机物.

|
图 6 培养阶段不同处理组上覆水DOC/DON比值变化特征 Fig.6 The variation of DOC/DON in the overlying water of different treatments during incubation period |
本实验研究结果表明,不同密度藻屑堆积情况下,沉积物中氮、磷释放浓度均有不同程度的增加,尤其以DON、NH4+-N和PO43--P为主(图 2,3).上覆水作为污染物释放的汇聚区,可反映沉积物-水界面污染物释放过程.蓝藻碎屑本身是氮、磷的生物内源,可直接分解释放出氮、磷;同时其沉降到沉积物表面,又能通过矿化作用改变沉积环境的生物理化条件,从而影响沉积物中氮、磷营养盐释放,两者的贡献量孰轻孰重难以分辨,但其结果均增加了上覆水中氮、磷营养盐负荷.各添加组与对照组DTN、DON、NH4+-N和PO43--P浓度进行差异显著性检验(t检验),Pt值如表 3所示. DTN、DON与PO43--P检验Pt值除x1组外,均小于0.05,表现出与对照组的显著性差异,表明在藻屑密度为18 g(dw)/m2或以上堆积情况下,沉积物中可短期内释放DTN、DON与PO43--P.而各添加组NH4+-N检验的Pt值均小于0.05,与对照组形成显著性差异,表明在藻屑密度为6 g(dw)/m2或以上堆积情况下,沉积物中可短期内释放NH4+-N并引起上覆水浓度出现明显变化. Zhu等[2]对不同湖区藻华由衰到亡模拟实验发现,藻华衰亡使得部分湖区沉积物营养盐释放浓度增加,与本实验结果相符.整个实验过程对照组DON浓度随时间增加,x3、x5、x7和x10组上覆水DON浓度在3 h内快速增加,高于对照组与x1组;且各个实验组DON占据DTN比例超过80 %,为DTN主要形态,说明培养期间DON一部分可能来源于沉积物有机质(SOM).尚丽霞等[4]在高密度蓝藻降解实验研究发现在蓝藻分解过程中释放大量DTN,并且DTN释放速率与藻密度呈正比.整个实验阶段,对照组与x10组DTN平均释放速率分别为0.21和0.45 mg/(L ·h),而在无沉积物条件下,x10组藻屑密度时DTN释放速率为0.06 mg/(L ·h)(未发表数据),可见无沉积物作用下藻屑自身分解释放DTN速率远小于同等藻屑量条件下有沉积物的实验组,同时也远小于x10组与对照组的差值(0.24 mg/(L ·h)).据此计算,若不添加沉积物条件下,实验结束时藻屑降解所产生的DTN释放浓度为5.98 mg/L,远小于本实验中添加沉积物条件下x10组最终释放的DTN浓度(53.29 mg/L),有可能是因为藻屑和沉积物协同作用,即促进了沉积物矿化,同时也加速了藻屑降解,从而释放了大量DTN.但对于沉积物矿化与藻屑分解贡献量无法进行量化,需进一步研究.
蓝藻碎屑分解释放的不稳定DON易被微生物利用继而被分解为小分子有机酸或者NH4+-N[33]. NH4+-N作为DON矿化的主要产物(公式(4)),来源主要有以下几个部分:①沉积物中DON矿化产生;②藻屑分解产生的PON转化为DON,DON被微生物利用转化为NH4+-N[34];③微生物裂解死亡释放的氨基酸氨化产生NH4+-N[35];④厌氧环境下NO3--N通过异化作用还原为NH4+-N[4].各实验组NH4+-N浓度随时间增加,NH4+-N在18 h后成为DIN主要形态氮,而各个实验组别NO3--N浓度逐渐降低.相关性分析表明,NH4+-N与DO、NO3--N、DOC浓度均呈显著负相关,NO3--N和DOC浓度呈显著正相关(表 4). O2和NH4+-N是硝化作用正常进行的必要元素[36],藻屑堆积加速了上覆水O2消耗,硝化作用受到抑制,可能导致NO3--N异化还原为NH4+-N[4],大量NH4+-N释放至间隙水中,从而引起上覆水中NH4+-N浓度增加,所以一部分NH4+-N可能来源于NO3--N的异化还原作用.由于大量藻屑添加,造成沉积物DO减少或不足,NO3--N作为电子受体参与藻屑有机质矿化过程,且藻屑密度越大,NO3--N消耗量越大(图 5). García-Robledo等[37]研究发现石莼碎屑加速沉积物中O2消耗与NO3--N还原作用,导致上覆水中O2、NO3--N浓度降低,这与本实验研究结果一致.至实验结束,各个藻屑添加组氨氮浓度增加量处于2.41~7.20 mg/L,高于对照组氨氮的增加量(2.05 mg/L),所以NH4+-N的一部分增量可能来自于沉积物和藻屑降解释放.因此在藻屑堆积情况下,沉积物中短期内可释放大量DON、NH4+-N至上覆水中,其中NH4+-N释放浓度与藻屑密度呈线性正相关(R2=0.98)(图 5c).
| 表 4 上覆水基本理化性质与污染物浓度之间的相关性分析 Tab.4 Correlation between physio-chemical properties of overlying water and the concentration of pollutants |
| $ {\rm{R-CH(N}}{{\rm{H}}_{\rm{2}}}{\rm{)-COOH + }}{{\rm{H}}_{\rm{3}}}{{\rm{O}}^{\rm{ + }}} \Leftrightarrow {\rm{R-C}}\left( {\rm{O}} \right){\rm{ - COOH + N}}{{\rm{H}}^{\rm{ + }}}_{\rm{4}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (4) |
作为PO43--P的重要载体,铁结合态磷(Fe-P)不稳定,受氧化还原电位控制[38]. Zhang等[39]研究发现蓝藻碎屑堆积消耗水体DO,表明沉积物中氧化还原电位降低,随后沉积物间隙水中SRP与Fe2+浓度升高,可能由于Fe-P解析所致.本实验中上覆水DO浓度快速降低,引起沉积物氧化还原电位降低,与Zhang等[39]的研究结果一致.相关性分析表明,各个实验组PO43--P浓度与DO浓度均呈显著负相关(表 4),说明PO43--P浓度受DO浓度影响较大,PO43--P有可能一部分来源于铁结合态磷释放[39],并且这一作用随蓝藻碎屑量增大而加强(图 5e).各实验组PO43--P浓度与本实验中设置的藻屑添加密度呈正比(R2=0.97),并且藻屑添加组PO43--P浓度高于对照组.同时无沉积物作用下x10组藻屑释放PO43--P速率为0.003 mg/(L·h)(未发表数据),至实验结束时可释放0.31 mg/L PO43--P,但低于本实验添加沉积物条件下x10组实验结束时的PO43--P浓度(0.57 mg/L),与DTN的结果一致.有研究表明,在DOM矿化过程中P的释放优先C[40],PO43--P作为藻类水华发生的重要限制因素[41],藻屑堆积通过藻屑自身分解或者通过微生物分解、耗氧等生物理化过程改变引起的PO43--P释放需引起重视.
因此,不同密度藻屑堆积后,上覆水中DOC、氮磷营养盐浓度均有不同程度增加.对照组的污染物释放数据表明,沉积物持续向上覆水释放碳氮磷营养物质;藻屑添加组SUVA254值表明DOM(包括DOC/DON/DOP)可能有部分来自于藻屑分解释放,并且藻屑与沉积物相互作用后上覆水氮、磷浓度高于两者的单独作用.但现有数据对于藻屑分解与沉积物矿化贡献量无法量化,因此下一步将采用同位素示踪方法研究这些过程对上覆水DOC和氮磷浓度增加的贡献,进一步了解藻屑堆积对沉积物-水界面污染物释放的影响机制.
4 结论藻屑堆积情况下可增加沉积物需氧量,快速消耗底层水DO使其浓度下降至0.5 mg/L以下,同时伴随着上覆水中pH不断降低,使得沉积物-水界面理化环境发生转变.与此同时,上覆水DOC浓度变化由于受多方面因素的影响,实验第3小时各藻屑添加组上覆水DOC浓度均有不同程度地增加,紫外-可见吸收光谱参数SUVA254值表明部分DOC来源于藻屑分解作用.上覆水氮磷浓度受藻屑密度影响较大,特别是DON、NH4+-N和PO43--P,增加浓度与藻屑密度呈正比,最高平均释放速率分别为4.44、0.20和0.03 mg/(L·h).因此,藻屑堆积情况下沉积物可成为氮磷的重要“源”,驱动蓝藻水华再次暴发,需对其进行严密监控,防止其大范围暴发引发水质危机.
致谢: 本文的研究工作得到了天津市水务局引滦工程于桥水库管理处及天津市水利科学研究院的大力协助,金勇在现场采样工作中提供支持和帮助,在此深表谢意!| [1] |
Xu HC, Cai HY, Yu GH et al. Insights into extracellular polymeric substances of cyanobacterium Microcystis aeruginosa using fractionation procedure and parallel factor analysis. Water Research, 2013, 47(6): 2005-2014. DOI:10.1016/j.watres.2013.01.019 |
| [2] |
Chen BF, Feng MH, Shang LX et al. Effects on cyanobacterial growth and water quality after harvesting accumulated cyanobacteria in autumn:An in-situ experiment in Lake Chaohu. J Lake Sci, 2016, 28(2): 253-262. [陈丙法, 冯慕华, 尚丽霞等. 秋季聚积蓝藻打捞对蓝藻生长及水质影响的原位实验. 湖泊科学, 2016, 28(2): 253-262. DOI:10.18307/2016.0203] |
| [3] |
Zhu MY, Zhu GW, Zhao LL et al. Influence of algal bloom degradation on nutrient release at the sediment-water interface in Lake Taihu, China. Environmental Science and Pollution Research, 2013, 20(3): 1803-1811. DOI:10.1007/s11356-012-1084-9 |
| [4] |
Shang LX, Ke F, Li WC et al. Laboratory research on the contaminants release during the anaerobic decomposition of high-density cyanobacteria. J Lake Sci, 2013, 25(1): 47-54. [尚丽霞, 柯凡, 李文朝等. 高密度蓝藻厌氧分解过程与污染物释放实验研究. 湖泊科学, 2013, 25(1): 47-54. DOI:10.18307/2013.0101] |
| [5] |
Hansen LS, Blackburn TH. Effect of algal bloom deposition on sediment respiration and fluxes. Marine Biology, 1992, 112(1): 147-152. DOI:10.1007/BF00349738 |
| [6] |
Yu JL, Li YM, Liu XL et al. The fate of cyanobacterial detritus in the food web of Lake Taihu:A mesocosm study using C-13 and N-15 labeling. Hydrobiologia, 2013, 710(1): 39-46. DOI:10.1007/s10750-012-1205-y |
| [7] |
Ask J, Karlsson J, Persson L et al. Whole-lake estimates of carbon flux through algae and bacteria in benthic and pelagic habitats of clear-water lakes. Ecology, 2009, 90(7): 1923-1932. DOI:10.1890/07-1855.1 |
| [8] |
Valdemarsen T, Quintana CO, Flindt MR et al. Organic N and P in eutrophic fjord sediments-rates of mineralization and consequences for internal nutrient loading. Biogeosciences, 2015, 12(6): 1765-1779. DOI:10.5194/bg-12-1765-2015 |
| [9] |
Buchan A, LeCleir GR, Christopher AG et al. Master recyclers:features and functions of bacteria associated with phytoplankton blooms. Nature Reviews Microbiology, 2014, 12(10). DOI:10.1038/nrmicro3326 |
| [10] |
Li K, Guan BH, Liu ZW. Experiments on decomposition rate and release forms of nitrogen and phosphorus from the decomposing cyanobacterial detritus. J Lake Sci, 2011, 23(6): 919-925. [李柯, 关保华, 刘正文. 蓝藻碎屑分解速率及氮磷释放形态的实验分析. 湖泊科学, 2011, 23(6): 919-925. DOI:10.18307/2011.0614] |
| [11] |
Garcia-Robledo E, Corzo A. Effects of macroalgal blooms on carbon and nitrogen biogeochemical cycling in photoautotrophic sediments:an experimental mesocosm. Marine Pollution Bulletin, 2011, 62(7): 1550-1556. DOI:10.1016/j.marpolbul.2011.03.044 |
| [12] |
Corzo A, Van Bergeijk SA, Garcia-Robledo E. Effects of green macroalgal blooms on intertidal sediments:net metabolism and carbon and nitrogen contents. Marine Ecology Progress Series, 2009, 380: 81-93. DOI:10.3354/meps07923 |
| [13] |
Henderson RK, Baker A, Parsons SA et al. Characterisation of algogenic organic matter extracted from cyanobacteria, green algae and diatoms. Water Research, 2008, 42(13): 3435-3445. DOI:10.1016/j.watres.2007.10.032 |
| [14] |
Neubauer ATA, Pedersen AGU, Finster K et al. Benthic decomposition of Zostera marina roots:A controlled laboratory experiment. Journal of Experimental Marine Biology and Ecology, 2004, 313(1): 105-124. DOI:10.1016/j.jembe.2004.08.003 |
| [15] |
Shao KQ, Gao G, Chi KX et al. Decomposition of Microcystis blooms:Implications for the structure of the sediment bacterial community, as assessed by a mesocosm experiment in Lake Taihu, China. Journal of Basic Microbiology, 2013, 53(6): 549-554. DOI:10.1002/jobm.201100532 |
| [16] |
Valdemarsen T, Kristensen E, Holmer M. Metabolic threshold and sulfide-buffering in diffusion controlled marine sediments impacted by continuous organic enrichment. Biogeochemistry, 2009, 95(2/3): 335-353. DOI:10.1007/s10533-009-9340-x |
| [17] |
Tyler AC, McGlathery KJ, Anderson IC. Benthic algae control sediment-water column fluxes of organic and inorganic nitrogen compounds in a temperate lagoon. Limnology and Oceanography, 2003, 48(6): 2125-2137. DOI:10.4319/lo.2003.48.6.2125 |
| [18] |
Lomstein B, Guldberg LB, Neubauer Anne-Turi A et al. Benthic decomposition of Ulvalactuca:A controlled laboratory experiment. Aquatic Botany, 2006, 85(4): 271-281. DOI:10.1016/j.aquabot.2006.05.006 |
| [19] |
Sundbäck K, Miles A, Hulth S et al. Importance of benthic nutrient regeneration during initiation of macroalgal blooms in shallow bays. Marine Ecology Progress Series, 2003, 246: 115-126. DOI:10.3354/meps246115 |
| [20] |
Wang YR, Chen XC, Chen BF et al. The release effect of pollutants in sediment-water interface after algal-debris accumulated on sediments. Acta Scientiae Circumstantiae, 2017(2): 1-18. [王亚蕊, 陈向超, 陈丙法等. 藻屑堆积对沉积物-水界面污染物的释放效应. 环境科学学报, 2017(2): 1-18. DOI:10.13671/j.hjkxxb.2017.0279] |
| [21] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods eds. Water and Wastewater Monitoring and Analysis Methods: 4th edition. Beijing: China Environmental Science Press, 2002: 243-250, 254-257, 670-671. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002: 243-250, 254-257, 670-671. ]
|
| [22] |
Yang LY, Choi JH, Hur J. Benthic flux of dissolved organic matter from lake sediment at different redox conditions and the possible effects of biogeochemical processes. Water Research, 2014, 61: 97-107. DOI:10.1016/j.watres.2014.05.009 |
| [23] |
Zhang X, Zheng JW, Zhou MF et al. Effect of increasing nitrogen/phosphours ratio in loading on the growth on Vallisneria spinulosa. J Lake Sci, 2017, 29(4): 880-886. [张雪, 郑建伟, 周茂飞等. 外源氮磷负荷比增加对刺苦草(Vallisneria spinulosa)生长的影响. 湖泊科学, 2017, 29(4): 880-886. DOI:10.18307/2017.0411] |
| [24] |
Morrison JM, Murphy CL, Baker K et al. Microbial communities mediating algal detritus turnover under anaerobic conditions. Peer J, 2017, 5: e2803. DOI:10.7717/peerj.2803 |
| [25] |
Garc'ia-Robledo E, Corzo A, de Lomas JG et al. Biogeochemical effects of macroalgal decomposition on intertidal microbenthos:A microcosm experiment. Marine Ecology Progress Series, 2008, 356: 139-151. DOI:10.3354/meps07287 |
| [26] |
Reed DC, Rassweiler A, Arkema KK. Biomass rather than growth rate determines variation in net primary production by giant kelp. Ecology, 2008, 89(9): 2493-2505. DOI:10.1890/07-1106.1 |
| [27] |
Castaldelli G, Welsh DT, Flachi G et al. Decomposition dynamics of the bloom forming macroalga Ulvarigida C. Agardh determined using a 14C-carbon radio-tracer technique. Aquatic Botany, 2003, 75(2): 111-122. DOI:10.1016/S0304-3770(02)00167-5 |
| [28] |
Wickland KP, Neff JC, Aiken GR. Dissolved organic carbon in Alaskan boreal forest:Sources, chemical characteristics, and biodegradability. Ecosystems, 2007, 10(8): 1323-1340. DOI:10.1007/s10021-007-9101-4 |
| [29] |
Li D, Sharp JO, Saikaly PE et al. Dissolved organic carbon influences microbial community composition and diversity in managed aquifer recharge systems. Applied and Environmental Microbiology, 2012, 78(19): 6819-6828. DOI:10.1128/AEM.01223-12 |
| [30] |
Gobler CJ, Sanudo-Wilhelmy SA. Cycling of colloidal organic carbon and nitrogen during an estuarine phytoplankton bloom. Limnology and Oceanography, 2003, 48(6): 2314-2320. DOI:10.4319/lo.2003.48.6.2314 |
| [31] |
Weishaar JL, Aiken GR, Bergamaschi BA et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon. Environmental Science & Technology, 2003, 37(20): 4702-4708. DOI:10.1021/es030360x |
| [32] |
Hong HC, Mazumder A, Wong MH et al. Yield of trihalomethanes and haloacetic acids upon chlorinating algal cells, and its prediction via algal cellular biochemical composition. Water Research, 2008, 42(20): 4941-4948. DOI:10.1016/j.watres.2008.09.019 |
| [33] |
Barber A, Lalonde K, Mucci A et al. The role of iron in the diagenesis of organic carbon and nitrogen in sediments:A long-term incubation experiment. Marine Chemistry, 2014, 162: 1-9. DOI:10.1016/j.marchem.2014.02.007 |
| [34] |
Mulholland MR, Gobler CJ, Lee C. Peptide hydrolysis, amino acid oxidation, and nitrogen uptake in communities seasonally dominated by Aureococcus anophagefferens. Limnology and Oceanography, 2002, 47(4): 1094-1108. DOI:10.4319/lo.2002.47.4.1094 |
| [35] |
Feng MH, Ngwenya BT, Wang L et al. Bacterial dissolution of fluorapatite as a possible source of elevated dissolved phosphate in the environment. Geochimicaet Cosmochimica Acta, 2011, 75(19): 5785-5796. DOI:10.1016/j.gca.2011.07.019 |
| [36] |
Rysgaard S, Risgaard-Petersen N, Peter S et al. Oxygen regulation of nitrification and denitrification in sediments. Limnology and Oceanography, 1994, 39(7): 1643-1652. DOI:10.4319/lo.1994.39.7.1643 |
| [37] |
García-Robledo E, Revsbech NP, Risgaard-Petersen N et al. Changes in N cycling induced by Ulva detritus enrichment of sediments. Aquatic Microbial Ecology, 2013, 69(2): 113-122. DOI:10.3354/ame01626 |
| [38] |
Chen M, Ye TR, Krumholz LR et al. Temperature and cyanobacterial bloom biomass influence phosphorous cycling in eutrophic lake sediments. PLoS One, 2014, 9(3): e93130. DOI:10.1371/journal.pone.0093130 |
| [39] |
Zhang L, Liao QJH, Gu XZ et al. Oxygen and phosphorus dynamics in freshwater sediment after the deposition of flocculated cyanobacteria and the role of tubificid worms. Journal of Hazardous Materials, 2014, 266: 1-9. DOI:10.1016/j.jhazmat.2013.12.008 |
| [40] |
Aminot A, Kérouel R. Dissolved organic carbon, nitrogen and phosphorus in the NE Atlantic and the NW Mediterranean with particular reference to non-refractory fractions and degradation. Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 2004, 51(12): 1975-1999. DOI:10.1016/j.dsr.2004.07.016 |
| [41] |
Mort HP, Slomp CP, Gustafsson BG et al. Phosphorus recycling and burial in Baltic Sea sediments with contrasting redox conditions. Geochimicaet Cosmochimica Acta, 2010, 74(4): 1350-1362. DOI:10.1016/j.gca.2009.11.016 |
 2018, Vol. 30
2018, Vol. 30 

