(2: 南京林业大学生物与环境学院, 江苏省环境工程重点实验室, 南京 210037)
(2: Key Laboratory of Environmental Engineering of Jiangsu Province, College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, P. R. China)
溶解性有机质(dissolved organic matter, DOM)是细菌、藻类和植物经过复杂生化过程形成的不均匀有机混合物,在水陆生态系统中具有重要作用[1-2]. DOM中含有多种亲水、疏水官能团,如羧基、羟基、酚基和羰基等,可通过化学螯合、疏水分配、极性作用以及氢键等机制与有机污染物相互作用,从而影响污染物在环境中的形态、迁移、生物有效性和风险[3-4].
四环素类药物(tetracycline antibiotics, TCs)是一种典型的抗生素,广泛应用于人体和动物的医疗及畜禽养殖. TCs在生物体内代谢不完全,约30 % ~90 %通过废水和粪便进入水环境中,导致TCs在地表水中残留(0.13~0.51 μg/L),诱导耐药细菌的产生和抗性基因的形成,对人体健康和生态环境造成潜在风险[5-6].近年来,荧光猝灭因其高敏感性、简便性和无损性等优点被广泛用来研究DOM与污染物的相互作用[7-8].其原理为荧光团与猝灭剂接触时,可通过激发态碰撞、能量转移和稳定态形成等机制导致荧光团荧光性降低. DOM成分复杂,不同荧光团的光谱往往会重叠,但采用三维荧光图谱结合平行因子模型(excitation emission matrix fluorescence with parallel factor analysis, EEM-PARAFAC)可以有效地分析独立荧光组分与污染物之间的作用特征[9-10].此外,结合二维相关光谱分析(two-dimensional correlation spectroscopy, 2D-COS)可进一步定性表征不同DOM组分与污染物之间的作用顺序[11-12].因此,联用多种光谱手段可从不同层面阐述DOM与四环素之间的相互作用特征[13-14].
本研究选择玄武湖和太湖的DOM作为研究对象,选择湖泊水体污染物备受关注的抗生素TCs(文献报道太湖水体TC浓度为0~87.9 ng/L,玄武湖水体TC浓度为0~5.21 ng/L)[15-16],采用荧光猝灭滴定,结合同步荧光光谱、2D-COS、EEM-PARAFAC以及紫光可见光谱(UV-Vis),研究TCs与湖泊DOM之间的相互作用特点,揭示天然有机质DOM与TCs相互作用的微观机制,以期为理解TCs在湖泊生态系统中的迁移转化和生态风险提供理论依据.
1 材料和方法 1.1 药剂准备和DOM采集盐酸四环素(Tetracycline hydrochloride, TC)纯度为>99.9 %,购自美国Sigma Aldrich公司,其他试剂均为分析纯,用水为Milli-Q超纯水.
2017年6月分别采集太湖(30°56′~31°34′N,119°54′~120°36′E)和玄武湖(32°34′~32°50′N,118°47′~118°49′E)的表层水,用GF/F玻璃纤维滤膜(450℃灼烧4 h)过滤,得到太湖DOM和玄武湖DOM.将2个湖泊的DOM在4℃条件下透析24 h(3500 Da),去除无机盐和有机小分子.最后,用Milli-Q超纯水稀释使得2个湖泊DOM的溶解性有机碳(dissolved organic carbon, DOC)浓度为30 mg/L,冷冻保存.
1.2 荧光猝灭滴定分别取15 ml 2个湖泊的DOM到50 ml棕色玻璃管中,再向管中添加一定量的TC储备液和0.02 mol/L的磷酸盐缓冲液(pH=7.0),使最终反应体系为:总体积30 ml,DOC浓度为15 mg/L,TC浓度为0~70 mg/L.用聚四氟乙烯塞密封后,25℃下恒温震荡.预实验表明DOM与TC在8 h内达到反应平衡.对照实验表明反应过程中挥发和吸附损失小于1 %.平衡后测定DOM-TC混合液的紫外和荧光光谱.
1.3 分析方法DOC值由TOC-Vcph型总有机碳分析仪(岛津,日本)测定;UV-Vis光谱由UV-2550型紫外分光光度计(岛津,日本)测定,以Milli-Q纯水为空白,扫描波段为200~800 nm,间隔为1 nm,以700 nm处吸收值执行基线校正.同步荧光光谱和EEM由F-7000型荧光分光光度计(日立,日本)测定,激发光源为700 V的光电倍增管和150 W氙弧灯.同步荧光光谱的扫描激发波长为200~450 nm,间隔1 nm,发射波长与激发波长差值Δλ=60 nm,扫描速度240 nm/min. EEM的扫描激发波长200~450 nm,间隔5 nm,扫描发射波长250~550 nm,间隔1 nm,激发和发射夹缝宽度5 nm,扫描速度1200 nm/min.采集EEM后,按仪器方法消除误差,并通过瑞利效应赋值和拉曼散射综合区域标准化消除干扰峰.采用Matlab(2012a)软件中的drEEM工具箱消除内滤效应,并将荧光强度标准化为激发波长350 nm处的拉曼信号强度(RU350)[17].
1.4 模型分析 1.4.1 二维相关图谱(2D-COS)分析二维相关图谱相较于一维图谱,不仅可分辨出重叠峰和隐藏峰,并且可通过信号峰之间变化的关系来研究荧光团和猝灭剂的相互作用[18].对TC浓度不同的DOM同步荧光光谱进行2D-COS分析,用2D Shige version 1.3(关西大学,日本)软件进行标准化分析,并将结果用Matlab(2012a)软件绘制图谱.
1.4.2 PARAFAC分析PARAFAC分析将获得的荧光强度以三向数据矩阵I×J×K(样品数量×激发波长×发射波长)形式输出,并通过交替最小二乘算法把所有样品的整个荧光数据矩阵分解成3个线性项和1个残留数组[2]. PARAFAC的矩阵公式如下:
| $ {X_{jik}} = \sum\limits_{f = 1}^F {{a_{if}}\cdot{b_{if}}\cdot{c_{kf}} + {e_{jik}}} {\rm{ }} $ | (1) |
式中, i =1、2、…、I;j =1、2、…、J;k =1、2、…、K;f为某个荧光组分;F为荧光组分总数目; e为残差.用drEEM工具箱对样品的EEM进行运算,并对运算结果用残差分布和“S4T6C3”算法验证.设定每个荧光组分的最大荧光强度(Fmax)与其相应浓度成固定比例.
1.4.3 Ryan-Weber模型拟合PARAFAC分离的DOM组分与TC之间的反应模型使用Ryan-Weber非线性等式拟合相关参数[19].该模型基于静态猝灭过程.设定每个荧光组分初始荧光强度为100,Ryan-Weber非线性模型如式(2)所示:
| $ F = \left( {\frac{{{F_{{\rm{end}}}} - 100}}{{2K{\rm{ }}\cdot{C_{\rm{L}}}}}} \right)\\\left( {K{\rm{ }}\cdot{C_{\rm{L}}} + K{\rm{ }}\cdot{C_{{\rm{TC}}}} + 1 - \sqrt {{{\left( {K{\rm{ }}\cdot{C_{\rm{L}}} + K{\rm{ }}\cdot{C_{{\rm{TC}}}} + 1} \right)}^2} - 4K\cdot{C_{\rm{L}}}\cdot{C_{{\rm{TC}}}}} } \right) + 100 $ | (2) |
式中, CTC为TC浓度(μmol/L),F为荧光组分与对应浓度TC结合后的荧光强度相对初始荧光强度的百分值,Fend为滴定达到理论终点时的荧光组分的荧光强度相对初始荧光强度的百分值,CL为荧光组分中配体L的浓度(μmol/L),K为络合常数.使用1stopt1.5软件计算得出K、CL和Fend.
2 结果与讨论 2.1 2个湖泊DOM的三维荧光光谱特征一般最大发射波长小于380 nm的荧光峰被认为是含有羟基和氨基等供电子基团的苯环结构,而大于380 nm的峰则与多环芳香结构有关[20].参考前人研究[11],太湖DOM的EEM图中A峰(Ex/Em 275 nm /325 nm)和B峰(Ex/Em 230 nm /330 nm)可归为类蛋白物质,而位于Ex/Em 330 nm/425 nm的C峰主要是类腐殖物质(图 1a).玄武湖DOM同样具有3个峰,其中A峰和B峰的位置与太湖DOM相似,而D峰位于Ex/Em 375 nm/500 nm,可表征为结构更紧密的类腐殖物质(图 1b). 2个湖泊DOM中3个荧光峰的强度大小为A峰>B峰>C(D)峰,表明类蛋白物质是2个湖泊DOM的主要组成成分,而类腐殖物质较少.太湖和玄武湖DOM与有机质结构和成熟度有关的荧光峰比值r(A, C)值分别为1.25和1.35[21].据文献报道[22],在洁净水体中类蛋白荧光峰强度很低,而随着受污染程度增加,类蛋白荧光峰强度逐渐升高.因此,2个湖泊存在一定程度的水质污染,与前人调查结果一致[21].本研究采样时间为夏季,2个湖泊中浮游藻类和水生植物因富营养化而过量生长,其自身代谢和残体降解会释放大量类蛋白DOM进入水体中,致使类蛋白荧光组分浓度升高[2, 4].
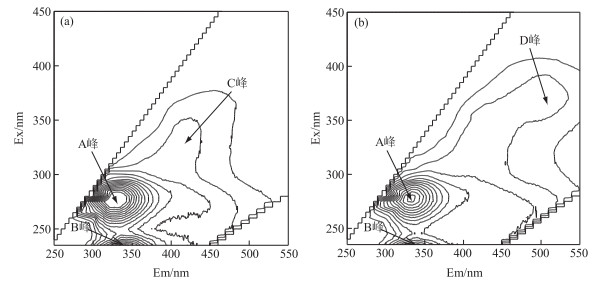
|
图 1 太湖DOM(a)和玄武湖DOM(b)的三维荧光图谱 Fig.1 Excitation-emission matrix spectra of DOM in Lake Taihu(a) and Lake Xuanwu(b) |
随着TC浓度增加,太湖和玄武湖DOM同步荧光光谱中235、275和350 nm处的峰荧光强度显著降低,说明TC可以与DOM中的类色氨酸、类络氨酸和类腐殖质组分发生相互作用(图 2a, b).其中275 nm处的荧光猝灭较强,表明类色氨酸荧光团对DOM的内在荧光猝灭贡献更大,而350 nm处的荧光强度变化最小,说明类腐殖物质与TC的荧光猝灭作用有限.此外,同步荧光光谱也可一定程度上揭示DOM荧光基团微环境的变化[23]. 275 nm处的荧光峰在2个DOM中随TC浓度添加都发生蓝移现象(275~270 nm).这可能是由于类蛋白质中色氨酸残基附近的微环境极性降低引起[23]. TC存在时类色氨酸残基位于疏水性更强的微环境中,更少地暴露于溶液中.文献表明,TC分子主要黏附在色氨酸残基的疏水位点中[24].可以看出,DOM不同组分对TC的亲和力和黏附位点具有明显差异.
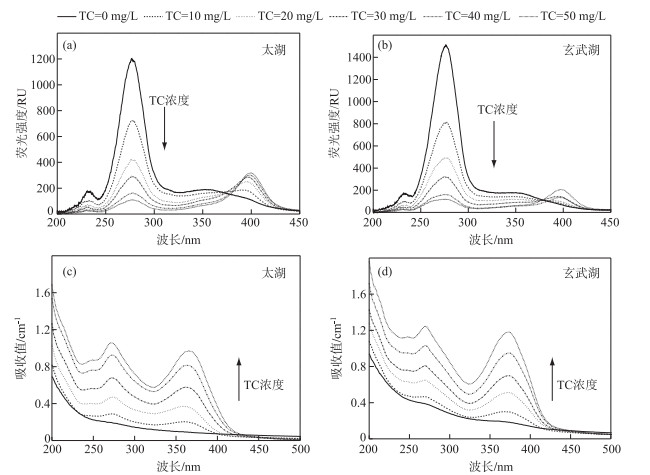
|
图 2 TC对太湖和玄武湖DOM的同步荧光光谱(a,b)和紫外光谱(c,d) Fig.2 Synchronous fluorescence spectra(a, b) and UV-Vis spectra(c, d) of TC-DOM interaction in Lake Taihu and Lake Xuanwu |
进一步研究DOM和TC的猝灭类型,太湖和玄武湖DOM与TC相互作用后的UV-Vis光谱变化分别如图 2c和d所示. 200 nm附近的吸收峰表征多肽骨架结构,210~310 nm之间的吸收峰来源于色氨酸和酪氨酸中氨基酸侧链的光吸收,而356 nm附近的吸收峰则是TC的分子特征[25]. TC添加前后DOM吸收光谱的剧烈变化表明, TC对2个DOM的荧光猝灭均属于静态猝灭[10].静态猝灭是指荧光分子和猝灭剂作用形成非荧光络合物的过程,而猝灭剂通过碰撞和能量转移等使激发态猝灭分子返回基态的过程称为动态猝灭,动态猝灭不会改变吸收光谱.以上结果表明2个湖泊DOM可以与TC发生络合作用,形成了非荧光性的DOM-TC络合物,导致自由游离态TC浓度降低.文献指出,水体中抗生素的自由态浓度与其抗性基因表达呈正相关[5].此外,DOM也可能作为架桥促进TC在沉积物矿物界面的吸附,促进TC从水相到固相界面的传输迁移[4].
2.3 2个湖泊DOM与TC荧光猝灭效应的二维相关光谱分析对DOM同步荧光图谱进行2D-COS分析,得到TC与不同DOM荧光组分的络合顺序.太湖DOM同步图的对角线上分别在275和400 nm附近出现2个自交正峰(图 3a),表明相应组分的光谱强度变化剧烈.而位于235 nm /275 nm和275 nm /400 nm附近的2个正交叉峰,说明位于235 nm的类络氨酸荧光峰、位于275 nm的类色氨酸荧光峰和位于400 nm的类富里酸荧光峰光谱变化方向一致(随TC浓度升高而降低).根据Noda等规则[18],异步图可揭示外部干扰下不同波长连续变化的程度:位于波长λ1/λ2的正交叉峰表明λ1处的光谱变化比λ2处更快速;位于波长λ1/λ2的负交叉峰表明λ1处的光谱变化落后于λ2处.在TDOM异步图的对角线下方(图 3b),275 nm /235 nm和275 nm /260 nm处分别存在2个正交叉峰,而400 nm/235 nm、400 nm/275 nm和400 nm/350 nm处分别存在3个负交叉峰,这些图谱特征表明荧光猝灭顺序为:275 nm > 260 nm > 235 nm > 350 nm > 400 nm,即荧光猝灭优先发生在低波长处.因此,与类腐殖物质相比,类色氨酸和类酪氨酸物质对TC的敏感性更高.在玄武湖DOM中观察到了类似的现象(图 3c和d),证明TC与类蛋白物质的相互作用优先于类腐殖物质,与DOM来源无关.

|
图 3 DOM与TC相互作用的2D-COS图:太湖DOM同步图(a)和异步图(b),玄武湖DOM同步图(c)和异步图(d) Fig.3 2D-COS plots of DOM-TC interaction: synchronous map(a) and asynchronous map(b) of DOM in Lake Taihu, synchronous map(c) and asynchronous map(d) of DOM in Lake Xuanwu |
虽然同步荧光光谱可以定性表征DOM与TC的相互作用,但不同荧光团的荧光峰可能重叠,无法准确定量独立荧光组分与TC的相互作用特点.通过PARAFAC分析模型计算和“S4T6C3”检验验证,共得到3种荧光组分.如图 4所示,组分C1的发射最大值在425 nm,激发最大值在250 nm,与类腐殖质中的富里酸荧光组分相似[26].组分C2存在2个荧光峰,分别位于Ex/Em 230 nm/336 nm和275 nm/336 nm,与文献中经典的T峰一致[27],代表类蛋白质中的色氨酸荧光组分. C3的荧光峰形状与C2类似,有2个激发最大值分别位于230和260 nm,1个发射最大值位于303 nm,与文献中的B峰位置相似[27],为类蛋白质中的酪氨酸荧光组分.根据3个组分的荧光得分(Fmax),太湖DOM中C1、C2和C3分别占总荧光组分的18 %、66 %和16 %,玄武湖DOM中相应组分分别占11 %、65 %和24 %,太湖DOM比玄武湖DOM中类腐殖组分含量更高.
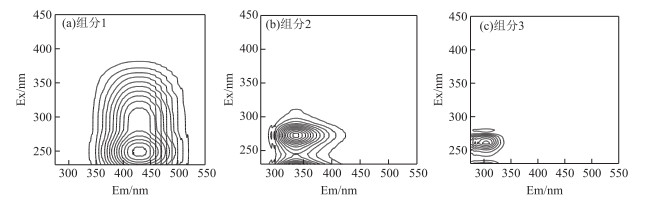
|
图 4 PARAFAC荧光组分的荧光光谱图 Fig.4 Excitation-emission matrix spectra of PARAFAC fluorescent components |
3个PARAFAC组分对TC表现出不同的响应特征(图 5).在太湖DOM中,添加少量的TC(6.5 μmol/L)显著降低C2和C3的荧光强度,而C1的荧光猝灭程度相对较弱.随着TC浓度增加,3种组分的Fmax逐渐降低,当TC浓度为45.5 μmol/L时,C1、C2和C3组分的可猝灭部分分别为79 %、100 %和99 %.玄武湖DOM的结果相似,C1、C2和C3组分的可猝灭部分分别为82 %、98 %和96 %,表明C1与TC的相互作用弱于C2和C3.因此,TC络合特征与DOM独立组分密切相关.文献指出在同样温度范围标准色氨酸的猝灭程度高于标准腐殖质的猝灭效应[28],但另一项研究也发现L-络氨酸(52 %)比L-色氨酸(35 %)的荧光猝灭更强[29].
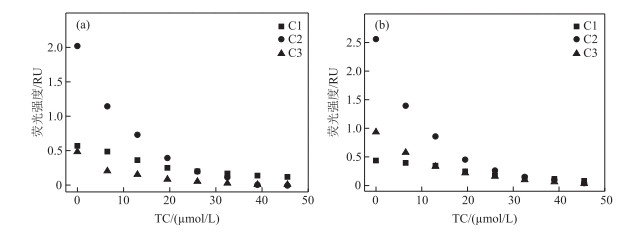
|
图 5 太湖(a)和玄武湖(b)DOM中TC与3个PARAFAC荧光组分的荧光猝灭图 Fig.5 Fluorescence quenching diagram of TC with three PARAFAC fluorescence components in Lake Taihu(a) and Lake Xuanwu(b) |
通过Ryan-Weber非线性模型拟合3个荧光组分的猝灭过程获得络合常数,如表 1所示,R2表明该模型拟合度很高.在太湖和玄武湖DOM中3种荧光组分的lgK值范围分别为5.29~5.73和5.05~5.85,表明TC与DOM发生了强烈的络合作用. 2个湖泊DOM中C2、C3的Fend值均为0,表明类蛋白质组分几乎完全被络合,而太湖和玄武湖DOM中分别有9.78 %和16.78 %的C1组分未与TC发生络合作用.相应的,3个荧光组分的lgK值在2个DOM中大小顺序相同,均表现为C2>C3>C1,表明类蛋白质更易与TC形成络合物.在DOM与磺胺二甲基嘧啶的相互作用中发现了类似的结果[4],进一步采用标准色氨酸、标准络氨酸和标准腐殖质作为典型DOM,发现抗生素对色氨酸和络氨酸的荧光猝灭相似,均强于腐殖质[30].这可能是因为腐殖质主要以酚基、芳基和羧基为主,蛋白质主要以氨基和脂肪族为主,而氨基Ⅰ、氨基Ⅱ、芳香族和脂肪族是DOM与TC反应过程中的作用官能团[13].然而,也有研究发现DOM与卡马西平的相互作用中类富里酸物质的络合作用更强[3],说明不同的DOM种类和猝灭剂的络合作用存在差异.此外,虽然太湖DOM中C1比例高于C3,但C1的lgK值小于C3,说明组分络合作用与其在DOM中的比例无关. C2的lgK值大于C3,说明类色氨酸比类络氨酸物与TC作用更强,这与2D-COS结果一致,即275 nm处的荧光猝灭优先于235 nm处.总体来说,富含类色氨酸和类络氨酸组分的DOM能有效地与TCs发生络合作用,形成复合物,降低TCs的生物有效性.然而,DOM具有生物活性和光活性,在自然矿化过程中容易被生物降解和光解,可能导致络合态TCs重新进入水体中,影响TCs在水环境中的迁移以及对植物和生物的有效性和毒性.
| 表 1 Ryan-Weber模型计算的太湖和玄武湖DOM中3个PARAFAC组分与TC相互作用的lgK和Fend Tab.1 The lgK and Fend for the three PARAFAC components in DOM of Lake Taihu and Lake Xuanwu calculated by Ryan-Weber model |
1) EEM-PARAFAC分析显示太湖和玄武湖DOM中均含有3个荧光组分,其中类色氨酸组分C2是2个DOM的主要荧光组成,其次为类络氨酸C3和类富里酸C1组分.
2) 同步荧光光谱联合2D-COS分析表明类色氨酸优先于类络氨酸物质与TC发生猝灭作用,而类富里酸组分对TC敏感性最低.
3) DOM与TC的猝灭机制属于静态猝灭,TC可改变DOM分子的微环境极性. 3个荧光组分与TC的荧光猝灭符合Ryan-Weber非线性方程,并且各组分与TC的络合常数大小顺序为:C2 > C3 > C1.
| [1] |
Chen XF, Chuai XM, Liu T et al. Characteristics and source identification of the dissolved organic matter in the lakes of west Jiangsu by spectroscopy. J Lake Sci, 2012, 24(2): 259-266. [陈小锋, 揣小明, 刘涛等. 江苏省西部湖泊溶解性有机物光谱学特征和来源解析. 湖泊科学, 2012, 24(2): 259-266. DOI:10.18307/2012.0214] |
| [2] |
Yao X, Zhang YL, Zhu GW et al. Different degradation mechanism of dissolved organic matter derived from phytoplankton and macrophytes in Lake Taihu, China. Acta Scientiae Circumstantiae, 2014, 34(3): 688-694. [姚昕, 张运林, 朱广伟等. 湖泊草、藻来源溶解性有机质及其微生物降解的差异. 环境科学学报, 2014, 34(3): 688-694.] |
| [3] |
Hernandez-Ruiz S, Abrell L, Wickramasekara S et al. Quantifying PPCP interaction with dissolved organic matter in aqueous solution:combined use of fluorescence quenching and tandem mass spectrometry. Water Research, 2012, 46(4): 943-954. DOI:10.1016/j.watres.2011.11.061 |
| [4] |
Bai LL, Cao CC, Wang CH et al. Roles of phytoplankton-and macrophyte-derived dissolved organic matter in sulfamethazine adsorption on goethite. Environmental Pollution, 2017, 230: 87-95. DOI:10.1016/j.envpol.2017.06.032 |
| [5] |
Chen ZY, Zhang YJ, Gao YZ et al. Influence of dissolved organic matter on tetracycline bioavailability to an antibiotic-resistant bacterium. Environmental Science & Technology, 2015, 49(18): 10903-10910. |
| [6] |
Sarmah AK, Meyer MT, Boxall ABA. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment. Chemosphere, 2006, 65(5): 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [7] |
Bai LL, Xu HC, Wang CH et al. Extracellular polymeric substances facilitate the biosorption of phenanthrene on cyanobacteria Microcystis aeruginosa. Chemosphere, 2016, 162: 172-180. DOI:10.1016/j.chemosphere.2016.07.063 |
| [8] |
Zhu JP, Mei T, Peng Y et al. Characterizing the interaction between roxarsone and humic acid by fluorescence quenching experiment. Environmental Science, 2014, 35(7): 2620-2626. [朱江鹏, 梅婷, 彭云等. 荧光猝灭法研究洛克沙胂与腐殖酸的相互作用. 环境科学, 2014, 35(7): 2620-2626.] |
| [9] |
Huang CC, Li YM, Wang Q et al. Components optical property of CDOM in Lake Taihu based on three-dimensional excitation emission matrix fluorescence. J Lake Sci, 2010, 22(3): 375-382. [黄昌春, 李云梅, 王桥等. 基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征. 湖泊科学, 2010, 22(3): 375-382. DOI:10.18307/2010.0309] |
| [10] |
Xu J, Sheng GP, Ma Y et al. Roles of extracellular polymeric substances (EPS) in the migration and removal of sulfamethazine in activated sludge system. Water Research, 2013, 47(14): 5298-5306. DOI:10.1016/j.watres.2013.06.009 |
| [11] |
Xu HC, Yu GH, Yang LY et al. Combination of two-dimensional correlation spectroscopy and parallel factor analysis to characterize the binding of heavy metals with DOM in lake sediments. Journal of Hazardous Materials, 2013, 263: 412-421. DOI:10.1016/j.jhazmat.2013.09.042 |
| [12] |
Chen W, Habibul N, Liu XY et al. FTIR and synchronous fluorescence heterospectral two-dimensional correlation analyses on the binding characteristics of copper onto dissolved organic matter. Environmental Science & Technology, 2015, 49(4): 2052-2058. |
| [13] |
Bai LL, Zhao Z, Wang CL et al. Multi-spectroscopic investigation on the complexation of tetracycline with dissolved organic matter derived from algae and macrophyte. Chemosphere, 2017, 187: 421-429. DOI:10.1016/j.chemosphere.2017.08.112 |
| [14] |
Yan PF, Hu ZH, Yu HQ et al. Fluorescence quenching effects of antibiotics on the main components of dissolved organic matter. Environmental Science and Pollution Research, 2016, 23(6): 5667-5675. DOI:10.1007/s11356-015-5800-0 |
| [15] |
Xu J, Zhang Y, Zhou CB et al. Distribution, sources and composition of antibiotics in sediment, overlying water and pore water from Taihu Lake, China. Science of the Total Environment, 2014, 497/498: 267-273. DOI:10.1016/j.scitotenv.2014.07.114 |
| [16] |
Zhang SH, Pang S, Wang PF et al. Antibiotic concentration and antibiotic-resistant bacteria in two shallow urban lakes after stormwater event. Environmental Science and Pollution Research, 2016, 23(10): 9984-9992. DOI:10.1007/s11356-016-6237-9 |
| [17] |
Murphy KR, Stedmon CA, Graeber D et al. Fluorescence spectroscopy and multi-way techniques. Analytical Methods, 2013, 5(23): 6557-6566. DOI:10.1039/c3ay41160e |
| [18] |
Noda I, Ozaki Y. Two-dimensional correlation spectroscopy:applications in vibrational and optical spectroscopy. London: John Wiley and Sons Inc, 2005.
|
| [19] |
Ryan DK, Weber JH. Fluorescence quenching titration for determination of complexing capacities and stability constants of fulvic acid. Analytical Chemistry, 1982, 54(6): 986-990. DOI:10.1021/ac00243a033 |
| [20] |
Ishii SKL, Boyer TH. Behavior of reoccurringPARAFAC components in fluorescent dissolved organic matter in natural and engineered systems:A critical review. Environmental Science & Technology, 2012, 46(4): 2006-2017. |
| [21] |
Fu PQ, Wu FC, Liu CQ et al. Three-dimensional excitation emission matrix fluorescence spectroscopy of dissolved organic matter from Chinese highland lakes. Oceanologia et Limnologia Sinica, 2007, 38(6): 512-520. [傅平青, 吴丰昌, 刘丛强等. 高原湖泊溶解有机质的三维荧光光谱特性初步研究. 海洋与湖沼, 2007, 38(6): 512-520.] |
| [22] |
Li D, Li XW, Niu ZC et al. A comparative study on macrobenthic community structure and diversity in different trophic status lakes of Jiangsu Province. Asian Journal of Ecotoxicology, 2017, 12(1): 163-172. [李娣, 李旭文, 牛志春等. 江苏省不同营养状况湖泊底栖动物群落结构与多样性比较. 生态毒理学报, 2017, 12(1): 163-172.] |
| [23] |
Bani-Yaseen AD. Spectrofluorimetric study onthe interaction between antimicrobial drug sulfamethazine and bovine serum albumin. Journal of Luminescence, 2011, 131(5): 1042-1047. DOI:10.1016/j.jlumin.2011.01.019 |
| [24] |
Anand U, Jash C, Boddepalli RK et al. Exploring the mechanism of fluorescence quenching in proteins induced by tetracycline. The Journal of Physical Chemistry B, 2011, 115(19): 6312-6320. DOI:10.1021/jp2008978 |
| [25] |
Bi HN, Tang L, Gao X et al. Spectroscopic analysis on the binding interaction between tetracycline hydrochloride and bovine proteins β-casein, α-lactalbumin. Journal of Luminescence, 2016, 178: 72-83. DOI:10.1016/j.jlumin.2016.05.048 |
| [26] |
Lee BM, Seo YS, Hur J. Investigation of adsorptive fractionation of humic acid on graphene oxide using fluorescence EEM-PARAFAC. Water Research, 2015, 73: 242-251. DOI:10.1016/j.watres.2015.01.020 |
| [27] |
Yamashita Y, Jaffé R, Maie N et al. Assessing the dynamics of dissolved organic matter (DOM) in coastal environments by excitation emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC). Limnology and Oceanography, 2008, 53(5): 1900-1908. DOI:10.4319/lo.2008.53.5.1900 |
| [28] |
Baker A. Thermal fluorescence quenchingproperties of dissolved organic matter. Water Research, 2005, 39(18): 4405-4412. DOI:10.1016/j.watres.2005.08.023 |
| [29] |
Wang ZG, Cao J, Meng FG. Interactions between protein-like and humic-like components in dissolved organic matter revealed by fluorescence quenching. Water Research, 2015, 68: 404-413. DOI:10.1016/j.watres.2014.10.024 |
| [30] |
Peng N, Wang KF, Liu GG et al. Quantifying interactions between propranolol and dissolved organic matter (DOM) from different sources using fluorescence spectroscopy. Environmental Science and Pollution Research, 2014, 21(7): 5217-5226. DOI:10.1007/s11356-013-2436-9 |
 2018, Vol. 30
2018, Vol. 30 

