(2: 浙江省环境监测中心, 杭州 310012)
(2: Zhejiang Environmental Monitoring Centre, Hangzhou 310012, P. R. China)
沉水植物是水生态系统的重要组成部分,具有巨大的生态系统服务功能,比如可以稳定沉积物、固定营养物质,并为鱼和水禽提供栖息地[1],在营养物质循环和生物和非生物转化过程中也发挥重要作用[2].李琳琳等[3]的研究表明,种植沉水植物菹草(Potamogeton crispus)和苦草不仅能改善水质,还能改变菌群结构,显著提高水体细菌多样性,也能提高其他水生生物类群,如周丛生物、底栖生物和鱼类的多样性.但随着水体富营养化程度加剧,全球范围内的水生植被,尤其是沉水植物衰退和消失的现象比较普遍[4-5].因此,恢复沉水植物具有十分重要的生态意义.
生物质炭(Biochar)是生物有机材料(木材、草和玉米秆等)在缺氧或低氧环境中经热解炭化形成的一类富碳物质,主要组成为芳香烃和单质碳或具有石墨结构的碳[6-7].已有研究表明生物质炭可以提高土壤固碳能力,降低土壤中重金属的生物可利用性,因此,具有修复土壤重金属污染的潜力[8].生物质炭还可以通过改善土壤肥力、增强土壤保肥能力和降低土壤酸度等来改善植物的生长环境[9],来提高作物产量[10].生物质炭对水体中重金属离子、有机污染物和残留药物等也具有较强去除作用[11],生物质炭能抑制底泥中铵态氮、化学需氧量和磷酸盐向上覆水的释放[12],并能吸附水体中硝态氮[13].已有研究尝试使用人工基质来辅助沉水植被修复水体,结果表明基质辅助能使水体修复效果更长久稳定[14],因此,将生物质炭用于水生态系统中沉水植被的恢复具有重要应用前景.但目前关于生物质炭对沉水植被生长的影响还鲜有报道,对水生态系统的影响尚不明确.
苦草(Vallisneria spiralis)俗称水韭菜、扁担草、面条草等,隶属于水鳖科(Hydrocharitaceae)苦草属(Vallisneria)的多年生沉水草本植物,是世界广布种[15],也是我国水体中分布最为常见的一种沉水植物,常被用于恢复重建富营养化水体中沉水植被[16].苦草能够在富营养化水体中正常生长,对富营养和光照有一定耐受性[17],能有效去除污染水体中氮、磷营养盐,抑制藻类生长,因此,在富营养化水体生态修复中具有重要价值.郝孟曦[18]的研究表明,近几十年来江汉湖群大型水生植物群落受到破坏而改变,苦草也逐渐从优势种变成亚优势种或伴生种.因此,探索生物质炭对水体中沉水植物恢复的作用,对于应用生物质炭修复受损环境具有重要意义.本研究选用典型沉水植物苦草作为受试植物,研究生物质炭对苦草发芽和幼苗生长的影响,了解生物质炭的生态学效应,为恢复大型水生植物提供指导.
1 材料与方法 1.1 苦草种子获取与前处理试验所用苦草种子由南京固城湖养殖场提供.将风干保存的苦草种子浸泡于自来水24 h后取出,通过磁力搅拌和纱布搓揉等方式清洗掉其表面粘液,然后置于4℃冰箱内春化24 h以上.选取颗粒饱满的种子,在超净工作台内用70 %乙醇荡洗30 s,8 %次氯酸钠消毒5 min,最后用无菌水清洗备用.
1.2 生物质炭制备与处理试验所用的生物质炭采购自浙江遂昌县,由高山毛竹制备而成,先将毛竹置于窑中,在控制氧气量的情况下烧制约3 d,再在充足氧的条件下煅烧若干小时,使窑内温度达到800℃,最后进行密封冷却.制备好的生物质炭由粉碎机研磨粉碎后,利用不同孔径的筛网将其筛分为1~2 mm的大粒径(large size biochar, LSB)和0.25~0.5 mm的小粒径(small size biochar, SSB)两部分.按每1 g生物质炭与10 ml 1 mol/L盐酸的比例,用盐酸浸泡1 h,去除灰分等杂质,然后用自来水反复洗涤直到浸出液为中性,最后用去离子水洗涤后在80℃烘箱中烘干至恒重[19]. EDS能谱分析结果表明,两种生物质炭的总碳含量约为95 %,扫描电镜分析结果显示大粒径生物质炭结构均匀,呈蜂窝状(图 1a),小粒径生物质炭经过研磨处理后结构有所变化,质地均匀性不如大粒径生物质炭(图 1b).

|
图 1 大粒径生物质炭(a)与小粒径生物质炭(b)的扫描电镜图 Fig.1 SEM images of large size biochar(a) and small size biochar(b) |
以苦草作为受试生物,探究不同营养水平下生物质炭对苦草种子萌发及幼苗生长的影响.参考相关文献[20-22]设置由NaNO3和KH2PO4配制的中营养添加浓度(MN)、轻富营养添加浓度(LHN)、重富营养添加浓度(HN)和超富营养添加浓度(SHN)4个组,培养液中总氮浓度在1.7~12.5 mg/L之间,总磷浓度在0.05~0.40 mg/L之间(表 1).苦草生长基质分为大粒径生物质炭(LSB)和小粒径生物质炭(SSB),并用石英砂作为对照(CK),共12个处理组,每处理组包含3个重复.
| 表 1 不同处理组水体营养盐添加水平 Tab.1 The nutrient salts concentrations in different treatment groups |
称量LSB、SSB和石英砂(CK)各50 g作为苦草培养基质,置于容积350 ml、底面直径7.5 cm、高8 cm的聚丙烯密封植物组培瓶中(图 2),然后在121℃灭菌120 min以消除其他生物对试验结果的影响.每个组培瓶中播种20粒苦草种子并添加200 ml由超纯水配制的不同浓度营养液,放置于光照培养箱中,在25℃、光照周期比12 h :12 h(L :D)和2000±300 lx光照强度条件下培养,30 d后取出苦草,测定其生长指标,同时分析培养液的理化指标.
|
图 2 试验装置示意图 Fig.2 The diagram of the test |
按照国家环境保护总局制定的标准方法[23],采用紫外分光光度法测定水体中硝态氮浓度,采用N-(1-萘基)-乙二胺光度法测定亚硝态氮浓度,采用纳氏试剂分光光度法测定氨氮浓度,采用钼锑抗分光光度法测定水体中正磷酸盐浓度.
1.4.2 植物生长指标的测定试验进行30 d后,计算苦草种子萌发率,并用刻度尺测量苦草幼苗根系和叶片长度,将幼苗的叶片和根系分开称量鲜重后放入烘箱中60℃烘干至恒重,称量各部分干重,计算出单株苦草幼苗的叶生物量比和根生物量比,并计算地下生物量和地上生物量的比值得出根冠比.
1.5 统计分析使用MS Excel 2013和SPSS 21.0软件对数据进行统计分析,采用LSD多重分析比较不同数据组的差异,采用双因素方差分析法(Two-way ANOVA)分析水体营养状况、基质类型对苦草萌发、生长形态、生物量积累与分配的影响,采用Spearman分析各生长指标与水体营养盐浓度之间的关系.显著性水平设置为α=0.05.
2 结果与分析 2.1 生物质炭对水体营养盐浓度的影响不同粒径生物质炭和苦草萌发生长的联合作用会对水体中营养盐浓度产生不同的影响,与初始浓度相比,培养30 d后所有处理组水体硝态氮浓度均大幅度降低,只有在超富营养添加浓度下(SHN)LSB和SSB组中硝态氮浓度才显著高于其他处理组(P < 0.05).与石英砂对照组相比,在中营养添加浓度(MN)时,添加生物质炭组水体中硝态氮浓度无差异或略高(P>0.05),而在高初始营养盐浓度时,LSB和SSB组硝态氮浓度显著低于CK组(P < 0.05),同时LSB组水体硝态氮浓度均显著低于SSB组(P < 0.05).水体中正磷酸盐磷浓度变化趋势与硝态氮相反,所有处理组30 d后正磷酸盐磷浓度均高于添加的初始磷酸盐磷浓度. LSB和SSB处理组正磷酸盐磷浓度上升至1.28~2.43 mg/L,为最高添加磷浓度的3.2~6.1倍,均显著高于CK组(P < 0.05),但在LSB和SSB处理组内磷浓度无显著性差异(P>0.05)(图 3).

|
图 3 不同初始营养盐浓度下不同基质和苦草萌发生长对水体硝态氮(a)、亚硝态氮(b)、氨氮(c)和正磷酸盐(d)浓度的影响(不同小写字母表示同一基质时不同初始营养浓度间差异显著(P < 0.05),不同大写字母表示同一初始营养浓度下不同基质间差异显著(P < 0.05);下同) Fig.3 Changes of nitrate-N (a), nitrite-N (b), ammonia-N (c) and orthophosphate-P (d) concentrations affected by different sized substrate and V. spiralis(Different small letters indicated significant difference among the same substrate of different nutrient concentrations group at 0.05 level, different capital letters indicated significant difference among the same nutrient concentrations of different substrate group at 0.05 level; the same was below) |
在苦草与生物质炭的联合作用下,培养液中硝态氮发生了运移转化,产生了一定量的亚硝态氮与氨氮(图 3).不同基质组内亚硝态氮与氨氮浓度均无显著性差异,但LSB和SSB组水体中亚硝态氮浓度显著低于石英砂CK组(P < 0.05),两种不同粒径生物质炭组中亚硝态氮浓度均低于检测限(< 0.003 mg/L). LSB组中氨氮浓度高于SSB组和对照组,水体中最终氨氮浓度在0.39~0.85 mg/L之间.在LSB组内,MN和HN初始营养盐浓度下最终氨氮浓度与其他营养盐处理组相比存在显著差异(P < 0.05). SSB组中水体最终氨氮浓度较低,在0.05 mg/L左右.
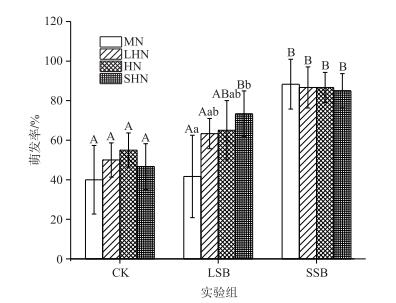
2.2 不同营养水平下生物质炭对苦草种子萌发与生长的影响 2.2.1 生物质炭对苦草种子萌发率的影响在不同的初始营养盐水平下,生物质炭对苦草种子萌发率的影响结果见图 4,在石英砂CK组中不同初始营养盐水平对苦草种子萌发率无显著影响(P>0.05),萌发率只有50 %左右,都处于较低水平,而SSB组苦草种子萌发率达80 %以上,显著高于石英砂CK组(P < 0.05). LSB组苦草种子萌发率随着营养盐水平的提高而提升,超富营养添加浓度(SHN)下种子萌发率显著高于中营养添加浓度(MN)(P < 0.05).双因素方差分析结果表明,生物质炭是提高苦草种子萌发率的主要因素,而氮、磷营养盐和与基质交互作用对苦草种子萌发无显著影响(P>0.05)(表 2).
|
图 4 不同初始营养盐浓度下基质类型对苦草种子萌发率的影响 Fig.4 Effects of substrate on germination rate of V. spiralis under different initial nutrient concentrations |
| 表 2 不同初始营养盐浓度与基质类型对苦草种子萌发率影响的方差分析 Tab.2 Two-way ANOVA results of the effects of different initial nutrient concentrations and substrates on germination rate of V. spiralis |
生物质炭作为基质对苦草幼苗生长过程中叶片和根长的影响见图 5,石英砂CK组苦草幼苗叶片长度随着初始营养盐浓度的升高而降低,最高营养盐条件下幼苗叶片生长受到一定程度的抑制,而LSB和SSB组中高初始营养盐浓度对叶片生长没有明显的抑制作用.双因素方差分析结果表明,初始营养盐浓度和基质类型对苦草幼苗叶片生长均有显著影响(P < 0.05),而根长则只与基质类型相关,初始营养盐水平及与基质类型的交互作用对苦草根长没有显著影响(P>0.05)(表 3). SSB组的苦草根系长度与CK组相比无显著差异(P>0.05),而LSB组的苦草根系长度显著低于SSB组和对照组(P < 0.05)(图 5).

|
图 5 不同初始营养盐浓度下基质类型对苦草幼苗叶片长度(a)和根系长度(b)的影响 Fig.5 Effects of substrate on leaf and root lengths of V. spiralis under different initial nutrient concentrations |
| 表 3 不同初始营养盐浓度与基质类型对苦草幼苗形态的方差分析 Tab.3 Two-way ANOVA results of the effects of different initial nutrient concentrations and substrates on length of leaves and roots of V. spiralis |
生物质炭对苦草幼苗各部分生物量都有极显著的影响(P < 0.01)(图 6),初始营养盐浓度和基质类型对苦草幼苗单株叶片生物量和单株总生物量有显著的交互作用,而初始营养盐浓度对苦草各部分生物量均无显著影响(P>0.05)(表 4). SSB组的苦草幼苗总叶片生物量(每个组培瓶内所有植株叶片生物量的总和)和总生物量(每个组培瓶内所有幼苗的叶片和根生物量总和)均高于LSB组和CK组,CK组的幼苗总根生物量(每个组培瓶内所有幼苗的根生物量总和)最高(图 6),与根长长度变化的结果变化趋势一致(图 5).石英砂CK组中幼苗的单株叶生物量和总生物量积累均受到水体初始营养盐浓度的影响,随着营养盐浓度的升高而显著降低(P < 0.05),尤其是超富营养添加浓度(SHN)对幼苗生物量积累有明显的抑制作用,而LSB和SSB组在超富营养添加浓度(SHN)单株幼苗的叶片和总生物量则高于其他营养盐水平(图 4e).同时,在除超富营养添加浓度(SHN)以外的营养盐浓度条件下,2个不同粒径生物质炭组中单株总生物量显著低于石英砂CK组(P < 0.05),而最高营养盐浓度条件下二者无显著差异(图 6d).

|
图 6 不同初始营养盐浓度下基质类型对苦草幼苗叶片生物量(a)、根系生物量(b)、总生物量(c)、单株总生物量(d)、单株叶片生物量(e)和单株根系生物量(f)积累的影响 Fig.6 Effects of substrate on leaf biomass (a), root biomass (b), total biomass (c), total biomass of single plant (d), leaf biomass of single plant (e) and root biomass of single plant (f) of V. spiralis under different initial nutrient concentrations |
| 表 4 不同初始营养盐浓度与基质对苦草幼苗生物量积累影响的方差分析 Tab.4 ANOVAs results of the effects of different initial nutrient concentrations and substrates for biomass accumulation of V. spiralis |
在不同初始营养盐浓度和不同基质条件下苦草幼苗根生物量比和叶生物量比如表 5所示,在MN、LHN和HN营养盐水平条件下不同基质的苦草叶生物量比、根生物量比均没有显著性差异(P>0.05),石英砂CK组中根冠比有大于LSB和SSB组的趋势,但差异不显著(P>0.05).超富营养添加浓度(SHN)下,LSB和SSB组中苦草叶生物量比显著高于CK组(P < 0.05),根生物量比和根冠比显著低于CK组(P < 0.05),2个不同粒径生物质炭组之间的叶生物量比、根生物量比和根冠比之间则无显著差异(P>0.05). LSB组和CK组在不同初始营养盐水平下叶生物量比、根生物量比和根冠比均无显著差异(P>0.05),SSB组中超富营养添加浓度(SHN)下叶生物量比显著高于其他3个营养盐水平(P < 0.05),根生物量比和根冠比则显著低于其他3个营养盐水平(P < 0.05).
| 表 5 不同初始营养盐浓度下基质类型对苦草幼苗叶根生物量比例的影响* Tab.5 Effects of substrate on biomass allocation of V. spiralis under different initial nutrient concentrations |
不同初始营养盐水平和基质下苦草培养实验结束后,水体最终营养盐浓度与苦草种子萌发和生长指标的Spearman相关性分析结果如表 6所示,种子萌发率与水体最终亚硝态氮浓度呈显著负相关(P < 0.01),与水体最终正磷酸盐浓度呈显著正相关(P < 0.05);幼苗叶长与最终硝态氮和亚硝态氮浓度都呈显著负相关(P < 0.01);苦草幼苗总叶片生物量和总生物量均与最终氨氮浓度呈显著负相关(P < 0.05);根长与最终硝态氮和亚硝态氮浓度均呈显著正相关(P < 0.05),与最终氨氮和正磷酸盐浓度均呈显著负相关(P < 0.01);幼苗总根生物量也与最终氨氮和正磷酸盐均呈显著负相关(P < 0.05).因此,生物质炭和苦草生长联合对水体中氮磷形态和浓度产生影响.
| 表 6 水体最终营养盐浓度与苦草种子萌发和生长指标的Spearman相关性分析 Tab.6 Spearman correlation analysis of final nutrient concentration and growth parameters of V. spiralis |
本研究选取了2种不同粒径的生物质炭作为基质并以石英砂作为对照,在不同氮、磷浓度的水体中培养苦草,结果表明:①在该体系中生物质炭对硝态氮有一定的吸附转化作用,其中LSB对硝态氮有较强的吸附转化作用,SSB也能降低水体硝态氮浓度;②2种粒径生物质炭组中亚硝态氮浓度显著低于石英砂对照组,与生物质炭对亚硝态氮吸附作用有关[24],表明生物质炭可以降低水体中亚硝态氮浓度. ③2种不同粒径生物质炭组中均存在一定浓度的氨氮累积,其中LSB组中水体氨氮浓度比SSB组更高,而石英砂CK组氨氮浓度则低于检测限.有研究表明[25],种植苦草的水体中,各形态氮浓度高低表现为硝态氮>氨氮>亚硝态氮,这与本试验CK组的各形态氮浓度大小基本一致,而在添加生物质炭组中,LSB的氨氮浓度高于硝态氮浓度,SSB组则无此现象.生物质炭对水体中氨氮具有一定的吸附作用[26],但也有研究表明生物质炭本身会释放氨氮[10],由于水体中未添加氨氮,因此,本试验中少量的氨氮(<0.2 mg/L)是由生物质炭释放或苦草产生的.有一些研究表明[27-28],生物质炭颗粒越小,对氨氮的吸附量越大,因此SSB组水体氨氮浓度低于LSB组. ④石英砂CK组中水体最终正磷酸盐浓度与初始添加浓度基本一致,而LSB和SSB组中水体中最终正磷酸盐浓度均显著上升,但不同粒径生物质炭组之间无显著差异.生物质炭往往有较强的磷释放作用[29],实验前生物质炭虽然进行了酸泡洗、纯水冲泡,但是在长期不换水浸泡的试验过程中生物质炭仍然能释放一定数量磷,与文献报道结果一致[29].因此,本试验结束后水体正磷酸盐浓度上升是由生物质炭释放引起的.
3.2 水体营养盐与基质对苦草种子发芽生长的影响在苦草萌发生长试验过程中测定了苦草种子的萌发率、苦草幼苗的形态、生物量指标,并进行了苦草幼苗生长与水体营养盐浓度的相关性分析.结果表明:在CK组中,苦草种子萌发率为40 % ~55 %,在不同初始营养盐浓度之间没有显著性差异.与CK组相比,LSB组苦草种子萌发率显著提高,在设置的4种初始营养盐浓度下萌发率都在80 %以上,因此,水体初始营养盐浓度对苦草种子发芽没有显著影响,基质大小则会显著影响苦草种子的萌发率,这与前人的研究结果一致[30-31].在较高营养盐浓度(LHN、HN和SHN)下,LSB组的苦草种子萌发率为60 % ~73 %,比CK组提高了20 % ~33 %,SSB组苦草萌发率最高,这表明生物质炭颗粒大小影响苦草的萌发率,生物质炭特别是小粒径生物质炭有利于苦草种子萌发.
苦草幼苗叶片长度测定结果显示,在同一起始氮、磷浓度下大、小粒径生物质炭组中苦草叶片长度均没有显著性差异,表明不同粒径生物质炭作为基质对苦草的叶片形态无显著影响,而在石英砂CK组中随着营养盐浓度增加,苦草幼苗的叶片长度显著降低,相关性分析结果可知,叶片长度与水体中最终硝态氮、亚硝态氮浓度均呈显著负相关,表明叶片生长受水体过高营养盐浓度的抑制,而石英砂CK组在轻富营养添加浓度(LHN)下叶片长度显著低于LSB组,CK组超高初始营养盐浓度(SHN)下叶片长度显著低于生物质炭添加组,表明以生物质炭为基质时,能有效缓解高浓度氮对苦草幼苗胁迫,生长情况与中等氮浓度时无显著差异.方差分析结果表明苦草的叶片长度与营养盐浓度和基质均有显著相关性,而生物质炭具有吸附氮的能力[32],降低了水体中总氮浓度,对苦草幼苗的生长有积极作用.在2个高营养盐浓度(HN和SHN)条件下SSB组苦草叶片总生物量显著高于石英砂CK组,而LSB组叶片总生物量则与CK组无显著差异,表明SSB作为基质对苦草幼苗叶生物量积累有促进作用.在超富营养添加浓度(SHN)下SSB组单株苦草的叶生物量显著高于LSB组和CK组,LSB组苦草幼苗单株叶生物量与CK组相似,这表明试验过程中单株苦草的叶生物量变化趋势与总叶片生物量变化趋于一致.
苦草根长分析结果显示,SSB组中苦草根系长度与CK组无显著差异,而LSB组的根系长度显著缩短;根系生物量测定结果表明不同基质粒径组之间无显著差异,但单株根系生物量的计算结果则是CK组显著高于生物质炭组.因此,与石英砂CK组相比,小粒径生物质炭组中苦草根系在长度不变的情况下生物量有所下降;同时,在超富营养添加浓度(SHN)下SSB组和LSB组苦草根生物量比和根冠比都显著低于CK组,这表明生物质炭作为基质对苦草幼苗生长优于石英砂,在水体营养盐较低时苦草根冠比会提高,将生物量更多地分配到根系,从而使苦草从沉积物中吸收更多的营养盐[33].相对于石英砂,生物质炭组中有更多的营养盐赋存于生物质炭中.因此,苦草不需要把生物量分配到根系中,根系生物量比有所下降,进而小粒径生物质炭基质更有利于提供营养盐促进苦草生长.
4 结论采用2种不同粒径的生物质炭作为基质并与石英砂作为对照,进行苦草种子萌发和幼苗生长试验,探索不同初始营养盐浓度下生物质炭对苦草种子萌发与生长的生物学效应.结果表明, 生物质炭对苦草种子萌发有很强的促进作用,这种作用还与生物质炭的粒径大小有关,小粒径生物质炭对苦草种子萌发促进作用更为明显,苦草种子萌发率达80 %以上.生物质炭不仅显著提高苦草种子萌发率,而且有利于苦草幼苗生长,与大粒径生物质炭相比小粒径生物质炭存在时水体中氨氮浓度更低,为苦草幼苗生长提供更好的环境,更有利于其生长.在以后试验中,需加强对幼苗生长指标如相对生长速率的测定分析,探索生物质炭对苦草生长速率的影响.本研究主要分析生物质炭对苦草萌发和幼苗生长的影响,因而在试验过程中对试验系统进行了灭菌处理,排除了其他生物如微生物对氮、磷转化和水生植物生长的影响,下一步需在自然条件下研究生物质炭对苦草萌发和生长的生物学效应[34],为生物质炭用于大型水生植物恢复提供技术支撑.
| [1] |
French GT, Moore KA. Interactive effects of light and salinity stress on the growth, reproduction, and photosynthetic capabilities of Vallisneria americana (Wild Celery). Estuaries, 2003, 26(5): 1255. DOI:10.1007/bf02803628 |
| [2] |
Srivastava J, Gupta A, Chandra H. Managing water quality with aquatic macrophytes. Reviews in Environmental Science & Bio/technology, 2008, 7(3): 255-266. DOI:10.1007/s11157-008-9135-x |
| [3] |
Li LL, Tang XM, Zhang YH et al. Influence of submerged vegetation restoration on bacterial diversity and community composition in West Lake. J Lake Sci, 2013, 25(2): 188-198. [李琳琳, 汤祥明, 张云华等. 沉水植物生态修复对西湖细菌多样性及群落结构的影响. 湖泊科学, 2013, 25(2): 188-198. DOI:10.18307/2013.0203] |
| [4] |
Jin XC, Chu JZ, Wang SR. Effects of nitrogen concentration and form in wateron photosynthetic characteristics of Hydrilla verticillata and Myriophyllum verticillatum. Chin J Appl Environ Biol, 2007, 13(2): 200-204. [金相灿, 楚建周, 王圣瑞. 水体氮浓度、形态对黑藻和狐尾藻光合特征的影响. 应用与环境生物学报, 2007, 13(2): 200-204.] |
| [5] |
Melzer A. Aquatic macrophytes as tools for lake management. Hydrobiologia, 1999, 395-396(1): 181-190. DOI:10.1007/978-94-017-3282-6_17 |
| [6] |
Joseph S, Lehmann J. Biochar for environmental management:An introduction. Biochar for Environmental Management:Science and Technology, 2009, 25(1): 15801-15811. DOI:10.4324/9781849770552 |
| [7] |
Xie ZB, Liu Q, Xu YP et al. Advances and perspectives of biochar research. Soils, 2011, 43(6): 857-861. [谢祖彬, 刘琦, 许燕萍等. 生物炭研究进展及其研究方向. 土壤, 2011, 43(6): 857-861.] |
| [8] |
Liu JJ, Yang X, Lu KP et al. Effect of bamboo and rice straw biochars on the transformation and bioavailability of heavy metals in soil. Acta Scientiae Circumstantiae, 2015, 35(11): 3679-3687. [刘晶晶, 杨兴, 陆扣萍等. 生物质炭对土壤重金属形态转化及其有效性的影响. 环境科学学报, 2015, 35(11): 3679-3687. DOI:10.13671/j.hjkxxb.2014.1044] |
| [9] |
Liu Y, Li ZH, Zou B et al. Research progress in effects of biochar application on crop growth and synergistic mechanism of biochar with fertilizer. Chinese Journal of Applied Ecology, 2017, 28(3): 1030-1038. [刘悦, 黎子涵, 邹博等. 生物炭影响作物生长及其与化肥混施的增效机制研究进展. 应用生态学报, 2017, 28(3): 1030-1038. DOI:10.13287/j.1001-9332.201703.035] |
| [10] |
Huang C, Liu LJ, Zhang MK. Effects of biochar on properties of red soil and ryegrass growth. Journal of Zhejiang University:Agric & Life Sci, 2011, 37(4): 439-445. [黄超, 刘丽君, 章明奎. 生物质炭对红壤性质和黑麦草生长的影响. 浙江大学学报:农业与生命科学版, 2011, 37(4): 439-445.] |
| [11] |
Zhang JH. Wastewater treatment with biomass char prepared by the physical activation process[Dissertation]. Hangzhou: Zhejiang University, 2011. [张璟慧. 生物质炭的制备及对水中污染物的去除研究[学位论文]. 杭州: 浙江大学, 2011. ]
|
| [12] |
Li Y, Li FM, Zhang XW et al. Effects of biochar covering on the release of pollutants from sediment. Environmental Science, 2013, 34(8): 3071-3078. [李扬, 李锋民, 张修稳等. 生物炭覆盖对底泥污染物释放的影响. 环境科学, 2013, 34(8): 3071-3078. DOI:10.13227/j.hjkx.2013.08.046] |
| [13] |
Li L, Chen X, Ww D et al. Adsorption of aqueous nitrate-N by immobilized modified biochar. Journal of Agro-Environment Science, 2015, 34(1): 137-143. [李丽, 陈旭, 吴丹等. 固定化改性生物质炭模拟吸附水体硝态氮潜力研究. 农业环境科学学报, 2015, 34(1): 137-143. DOI:10.11654/jaes.2015.01.020] |
| [14] |
Tang X, Cao T, Xie P et al. In situ study on the maintenance of clear water by restoration of submersed macrophytes with the aid of modified soils. J Lake Sci, 2013, 25(1): 16-22. [汤鑫, 曹特, 谢平等. 改性粘土辅助沉水植物修复技术维持清水稳态的原位研究. 湖泊科学, 2013, 25(1): 16-22. DOI:10.18307/2013.0103] |
| [15] |
Xiong BH, Li W. Ecological studies on Vallisneria L. in China. Journal of Wuhan Botanical Research, 2000, 18(6): 500-508. [熊秉红, 李伟. 我国苦草属(Vallisneria L.)植物的生态学研究. 武汉植物学研究, 2000, 18(6): 500-508.] |
| [16] |
Yin Y, Sun YY, Wang XR et al. Bio-toxic effect of pyrene on Vallisneria spiralis. Chinese Journal of Applied Ecology, 2007, 18(7): 1528-1533. [尹颖, 孙媛媛, 王晓蓉等. 芘对苦草的生物毒性效应. 应用生态学报, 2007, 18(7): 1528-1533. DOI:10.13287/j.1001-9332.2007.0256] |
| [17] |
Sand-Jensen K, Madsen TV. Minimum light requirements of submerged freshwater macrophytes in laboratory growth experiments. Journal of Ecology, 1991, 79(3): 749-764. DOI:10.2307/2260665 |
| [18] |
Hao MX. Diversity and community succession of macrophytes in Jianghan Lake groups[Dissertation]. Wuhan: Hubei University, 2014. [郝孟曦. 江汉湖群主要湖泊水生植物多样性及群落演替规律研究[学位论文]. 武汉: 湖北大学, 2014. ]
|
| [19] |
Li JH, Lv GH, Bai WB et al. Effect of modified biochar on soil nitrate nitrogen and available phosphorus leaching. Chinese Journal of Agrometeorology, 2012, 33(2): 220-225. [李际会, 吕国华, 白文波等. 改性生物炭的吸附作用及其对土壤硝态氮和有效磷淋失的影响. 中国农业气象, 2012, 33(2): 220-225.] |
| [20] |
Zheng BH, Xu QJ, Zhu YZ. Primary study on enacting the lake nutrient control standard. Environmental Science, 2009, 30(9): 2497-2501. [郑丙辉, 许秋瑾, 朱延忠等. 湖泊营养盐控制标准制订方法的初步研究. 环境科学, 2009, 30(9): 2497-2501. DOI:10.13227/j.hjkx.2009.09.014] |
| [21] |
Song YZ, Yang MJ, Qin BQ. Physiological response of Vallisneria natans to nitrogen and phosphorus contents in eutrophic waterbody. Environmental Science, 2011, 32(9): 2569-2575. [宋玉芝, 杨美玖, 秦伯强. 苦草对富营养化水体中氮磷营养盐的生理响应. 环境科学, 2011, 32(9): 2569-2575. DOI:10.13227/j.hjkx.2011.09.044] |
| [22] |
Wen MZ, Li KY, Wang CH. Effects of nutrient level on growth of Vallisneria natans in water. Research of Environmental Sciences, 2008, 21(1): 74-77. [文明章, 李宽意, 王传海. 水体的营养水平对苦草(Vallisneria natans)生长的影响. 环境科学研究, 2008, 21(1): 74-77. DOI:10.13198/j.res.2008.01.80.wenmzh.011] |
| [23] |
State Environmental Protection Administration of China, Editorial Committee for Water and wastewater monitoring and analysis methods. Water and wastewater monitoring and analysis methods. 4th ed. Beijing: China Environmental Science Press, 2002, 246, 266, 271, 279. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第四版. 北京: 中国环境科学出版社, 2002, 246, 266, 271, 279.]
|
| [24] |
Mukherjee A, Lal R, Zimmerman AR. Impacts of biochar and other amendments on soil-carbon and nitrogen stability:a laboratory column study. Soil Science Society of America Journal, 2014, 78(78): 1258-1266. DOI:10.2136/sssaj2014.01.0025 |
| [25] |
Wang PF, Wang C, Wang XR et al. Purification effects on nitrogen under different concentration and nitrogen conformation transform principles by Vallisneria spiralis L. Environmental Science, 2008, 29(4): 890-895. [王沛芳, 王超, 王晓蓉等. 苦草对不同浓度氮净化效果及其形态转化规律. 环境科学, 2008, 29(4): 890-895. DOI:10.13227/j.hjkx.2008.04.003] |
| [26] |
Li FY, Xie Y, Shi L et al. Adsorption of ammonia nitrogen in wastewater using rice husk derived biochar. Chinese Journal of Environmental Engineering, 2015, 9(3): 1221-1226. [李飞跃, 谢越, 石磊等. 稻壳生物质炭对水中氨氮的吸附. 环境工程学报, 2015, 9(3): 1221-1226. DOI:10.12030/j.cjee.20150338] |
| [27] |
Ma FF, Zhao BW, Diao JR et al. Ammonium adsorption characteristics in aqueous solution by dairy manure biochar. Environmental Science, 2015, 36(5): 1678-1685. [马锋锋, 赵保卫, 刁静茹等. 牛粪生物炭对水中氨氮的吸附特性. 环境科学, 2015, 36(5): 1678-1685. DOI:10.13227/j.hjkx.2015.05.023] |
| [28] |
Du YH, Jiang EC, Li ZY et al. Adsorption mechanism of ammonium nitrogen onto rice husk biochar. Transactions of The Chinese Society of Agricultural Machinery, 2016, 47(2): 193-199, 214. [杜衍红, 蒋恩臣, 李治宇等. 稻壳炭对铵态氮的吸附机理研究. 农业机械学报, 2016, 47(2): 193-199, 214. DOI:10.6041/j.issn.1000-1298.2016.02.025] |
| [29] |
Ai XY. Adsorption research of phosphorate and nitrogen from wastewater using Eichhornia crassipes biochars[Dissertation]. Chongqing: Chongqing University, 2013. [艾小雨. 凤眼莲生物质炭对水中磷和氮吸附研究[学位论文]. 重庆: 重庆大学, 2013. ]
|
| [30] |
Han CM, Hu G, Wu T et al. Effects of water quality and substrate type on seed germination of Vallisneria spiralis L. Chinese Journal of Ecology, 2014, 33(6): 1515-1519. [韩翠敏, 胡庚, 武涛等. 不同水体条件和基质类型对苦草(Vallisneria spiralis L.)种子萌发的影响. 生态学杂志, 2014, 33(6): 1515-1519. DOI:10.13292/j.1000-4890.20140327.021] |
| [31] |
Ji GH, Li Y, Wang LQ et al. Effects of light on seed germination and growth of Vallisneria spiralis. Science World, 2006(7): 43-44. [季高华, 李燕, 王丽卿等. 光照对苦草种子发芽和生长的影响. 科学园地, 2006(7): 43-44.] |
| [32] |
Zeng Z. Preparation of biochar from aquatic eco-remediation plants and their sorption on ammonium and phosphate[Dissertation]. Hangzhou: Zhejiang University, 2013. [曾峥. 水生态修复植物的生物质炭制备及对氨氮、磷的吸附效应[学位论文]. 杭州: 浙江大学, 2013. ]
|
| [33] |
Chen DY, Xie YF, Liu ZW. The response to external phosphorus loadings of experimental aquatic systems with submerged plants of different root to shoot ratios. Chin J Appl Environ Biol, 2016, 22(5): 747-751. [陈德元, 谢贻发, 刘正文. 生长不同根冠比沉水植物的实验水体对磷输入的响应比较研究. 应用与环境生物学报, 2016, 22(5): 747-751. DOI:10.3724/SP.J.1145.2016.04005] |
| [34] |
Li ZQ, Dan Y, Tu MH. Seed germination of three species of Vallisneria (Hydrocharitaceae), and the effects of freshwater microalgae. Hydrobiologia, 2005, 544(1): 11-18. DOI:10.1007/s10750-004-7895-z |
 2018, Vol. 30
2018, Vol. 30 

