(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
伴随着我国经济的快速发展,大量污染物的产生和排放致使水体富营养化日趋严重.富营养化使得水体中的藻类大量生长繁殖,并在适宜的条件下上浮聚集,形成蓝藻水华,给周边居民的生产和生活造成了严重影响和损失[1].中国第2次湖泊现状调查显示,138个面积大于10 km2湖泊中有85.4 %的湖泊水质超过了富营养化标准,其中高于重富营养化标准的占40.1 % [2].微囊藻是我国水华蓝藻的主要种类.尽管对微囊藻水华进行了大量研究[3-4],但到目前为止微囊藻水华暴发机理还有许多方面亟待完善.在自然水体中,微囊藻水华暴发时,大量微囊藻以群体状态漂浮在水体表层[3-5].微囊藻的群体形态比单细胞微囊藻耐受更高的光强,使其在野外高光强条件下更具竞争优势[6].在营养波动较大的环境中,微囊藻群体也能形成一套独特的利用营养盐的策略,使其能够获得竞争优势并保持快速生长,增强抵抗逆境胁迫伤害的能力[7].同时,群体微囊藻较大的体积可以有效抵御浮游动物的牧食[8],更容易克服水体扰动产生的裹挟力[9].而微囊藻在野外环境条件下主要以群体形式存在[10],当在实验室分离培养时,群体微囊藻经过数代繁殖后,往往会解聚成单细胞或双细胞[11-12].微囊藻群体特征的消失表明:在室内培养过程中,促进群体形成的因子在培养基中不存在[13].微囊藻如何由单细胞转变为群体这一问题引起了广泛关注.有研究报道,许多因素都可以诱导单双细胞微囊藻形成群体微囊藻,其中包括浮游动物释放的信息化学物质[12]、异养细菌[14]、氮[15]磷[16]限制、钙镁离子[17]、微囊藻毒素[18]、高光强[19]和扰动[20-21]等.尽管有关微囊藻单双细胞状态转变为群体状态的研究已经取得了很大进展,然而到目前为止,其机理还不是很清楚.
风浪扰动在微囊藻水华的形成过程中具有重要作用.风浪扰动通常会将底泥中的大量沉积物带入水体,引起沉积物中氮磷等营养盐的释放和水体透明度下降[22].同时,水体扰动产生的裹挟力会直接作用于水体中的微囊藻,刺激并引起藻细胞生理特征的改变[23].另外,扰动对微囊藻的迁移聚集也有较大影响[24-25].关于扰动对微囊藻的影响,大都以单细胞、双细胞微囊藻作为研究对象[26-27].而关于水体扰动对群体微囊藻大小的影响,国内外的学者对此进行了少量的研究[21, 28-30],但这些只是研究了单一的扰动方式或不同的扰动强度对群体微囊藻的影响.然而在自然环境下,比如连续流动的河流属于持续扰动,在这种水体中很少出现蓝藻水华.而在大型湖泊(比如太湖)、水库这种间歇扰动条件下,往往会频繁暴发蓝藻水华.因此研究人员就想到利用水动力作用(人工曝气、调水引流)来控制微囊藻水华.如Oberholster等[31]研究表明,单纯的人工曝气不足以促使Sheldon湖向混合良好的水生系统过渡,并且蓝藻在整个夏季仍然占主导地位. Tsukada等[32]调查发现从Biwa湖抽水调入Yogo湖,确实影响了蓝藻水华的持续时间,且抽水期间没有发生蓝藻水华,但人工曝气却不足以防止蓝藻水华暴发. Visser等[33]也有类似的研究结果.这就说明不同的水动力作用(持续或间歇性曝气)对蓝藻水华会有不同的影响.而这种不同的扰动方式对纯种微囊藻群体的大小以及生长影响如何?目前,国内外鲜见相关报道.
本研究以太湖群体水华微囊藻(Microcystis flos-aquae)作为研究对象,通过室内模拟扰动实验,探讨了不同扰动方式(包括持续扰动和间歇扰动)对太湖群体水华微囊藻大小以及生长的影响.太湖是我国第三大淡水湖,现有水面面积约2338 km2,是典型的浅水湖泊,同时也是微囊藻水华多发的湖泊[34].近年来,太湖每年5-10月都会出现大量微囊藻水华,给周边的经济发展和人民生活造成重大影响和损失[35].该研究将有助于人们对太湖微囊藻水华暴发机理的认识,为进一步揭示蓝藻水华的暴发机理和治理蓝藻水华提供科学理论依据.
1 材料和方法2017年6月在太湖梅梁湾采集水华微囊藻,经显微镜观察、鉴定,并采用稀释法分离得到单个水华微囊藻群体,然后在BG-11培养液中进行培养,等到水华微囊藻繁殖到一定密度后采用经过改良的BG-11培养液(总氮浓度为10 mg/L,总磷浓度为0.5 mg/L)[36]扩大培养,连续培养了6个月后正式进行实验.首先,往0.5 L锥形瓶中加入0.15 L经过灭菌的改良BG-11培养基,然后接种0.15 L处于对数生长期的水华微囊藻(经镜检,微囊藻形态包括少量单细胞、双细胞和大量小群体).实验分为不扰动组、间歇扰动组和持续扰动组.
实验开始后不扰动组放入光照培养箱中,培养温度为25℃,光照强度为3000 lux,光照周期为光照:非光照=12 h:12 h,直至实验结束.间歇扰动和持续扰动组放入转速为100转/min[4, 21](相当于3~4 m/s风速[37],太湖平均风速3 m/s左右[38])的振荡式光照摇床中,温度设定为25℃,光照强度为3000 lux,光照周期为光照:非光照=12 h:12 h.整个实验期间,持续扰动组为每天扰动,直至实验结束;间歇扰动组连续扰动24 h后停止扰动,将其取出放入光照培养箱中,下次扰动时再放入摇床连续扰动24 h后再停止,如此循环.间歇扰动组为实验第1、5、9和13天扰动,在扰动24 h后立即取样,其他时间不扰动.每个处理设置3个重复,共9个.整个实验进行17天,实验第0、1、5、9、13和17天取一定量的藻细胞溶液进行分析,取样过程均在无菌操作台进行,取样后不补充营养盐.取样后分别测定水样中水华微囊藻细胞数量、胞外多糖含量、叶绿素a(Chl.a)浓度和群体大小.藻细胞数量计数方法[39]:先摇匀样品,然后吸取0.1 ml藻液,在显微镜下计数不同类型细胞(单细胞、双细胞、3~10细胞群体、10~100细胞群体和>100细胞群体)的细胞数量及其所占比例.首先,在显微镜下直接计数单细胞、双细胞、3~10细胞群体以及10~100细胞群体的细胞数量.接下来通过超声波将所有群体都打散成单细胞,再次计数细胞数量得到总细胞数.总细胞数减掉单细胞、双细胞、3~10细胞群体以及10~100细胞群体的细胞数量则得到>100细胞群体的细胞数量.胞外多糖含量的测定参考Yang等[40]的方法,将总胞外多糖(EPS)分为固着性胞外多糖(bEPS)和溶解性胞外多糖(sEPS)分别进行测定.取10 ml藻液,4℃条件下11000转/min离心15 min,分离上清液和藻细胞,收集上清液用于测定sEPS.藻细胞加蒸馏水摇匀至10 ml,调节pH至10,45℃水浴4 h,4℃条件下11000转/min离心15 min,上清液用于测定bEPS. 2次收集的上清液经0.45 μm滤膜过滤,经透析后,采用蒽酮硫酸比色法测定多糖. EPS= bEPS+sEPS.测定微囊藻群体大小时使用带有数码相机的显微镜(Nikon E100)和QCapture pro软件,每个水样随机取100个群体测量微囊藻群体最大直径,取平均值作为微囊藻群体大小. Chl.a浓度参照文献[41]测定.
数据处理过程中,制图使用Origin 8.5软件,对照组和实验组微囊藻群体大小、Chl.a浓度、胞外多糖含量等指标差异采用SPSS 21.0软件单因素方差法(P < 0.05或P < 0.01)进行统计分析.
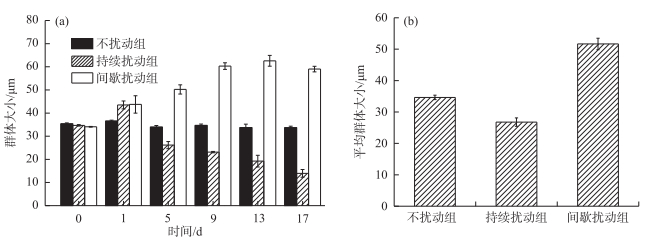
2 结果 2.1 不同扰动方式对水华微囊藻群体大小的影响实验结束时不同扰动方式下水华微囊藻群体大小差异很大(图 1).扰动前第0天不扰动组、持续扰动组和间歇扰动组水华微囊藻群体的大小分别为35.38、34.68和34.09 μm(图 2a),三者无显著性差异(P>0.05).当实验结束时,持续扰动组的水华微囊藻群体大小变小为13.95 μm,而间歇扰动组的水华微囊藻群体大小增长至59.01 μm,不扰动组水华微囊藻群体大小为33.67 μm,三者之间都存在极显著差异(P < 0.01)(图 2).持续扰动组和间歇扰动组的水华微囊藻群体大小在第1天扰动24 h后并无显著性差异(P>0.05),两者与不扰动组相比呈极显著差异(P < 0.01).而在第5天时持续扰动组和间歇扰动组的水华微囊藻群体大小分别为26.16和50.23 μm,呈极显著差异(P < 0.01).随着实验的进行,不扰动组的水华微囊藻群体大小相对稳定,持续扰动组的群体大小逐渐变小至13.95 μm,而间歇扰动组则逐渐增大最终趋于平缓至59.00 μm(图 2a).而就平均群体大小相比较而言,持续扰动组最小,为26.85 μm,间歇扰动组最大,为51.83 μm(图 2b).

|
图 1 实验结束时不同扰动方式下水华微囊藻群体大小比较 Fig.1 Comparison of the colony size of Microcystis flos-aquae in different disturbance modes at the end of experiment |
|
图 2 实验中水华微囊藻群体大小变化(a)及平均群体大小(b) Fig.2 Changes in colony size (a) and mean colony size (b) of Microcystis flos-aquae in this experiment |
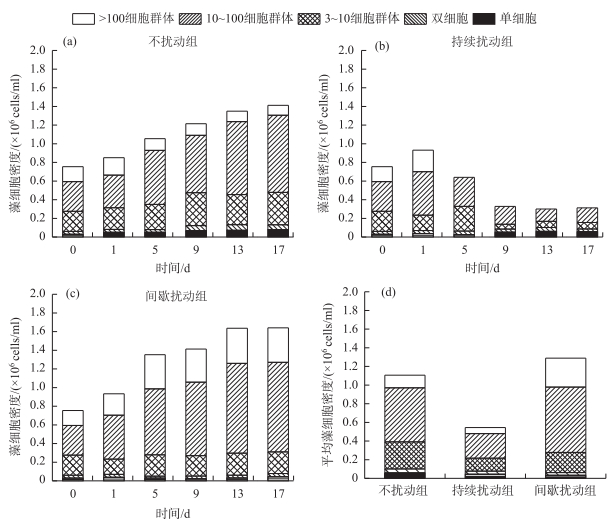
如图 3所示,不同扰动方式对水华微囊藻不同类型藻细胞(单细胞、双细胞、3~10细胞群体、10~100细胞群体和>100细胞群体)的密度影响不同.在扰动前第0天,持续扰动组与间歇扰动组和不扰动组不同类型藻细胞密度无显著性差异(P>0.05),扰动结束后,持续扰动组与间歇扰动组和不扰动组的藻细胞密度均发生了明显变化.第1天扰动结束后,持续扰动组与间歇扰动组不同类型藻细胞密度无显著性差异(P>0.05),两者10~100细胞群体、>100细胞群体藻细胞密度分别为0.466×106、0.230×106 cells/ml和0.469×106、0.230×106 cells/ml,而不扰动组10~100细胞群体、>100细胞群体藻细胞密度分别为0.349×106、0.187×106 cells/ml,显著低于持续扰动组和间歇扰动组(P < 0.05).当实验结束时,持续扰动组>100细胞群体完全消失(图 3b),而间歇扰动组>10细胞群体(包括>100细胞群体)藻细胞密度略微上升最后趋于平缓(图 3c).整个实验过程中,间歇扰动组>10细胞群体平均藻细胞密度最大,为1.009×106 cells/ml,持续扰动组>10细胞群体平均密度最小,为0.327×106 cells/ml.
|
图 3 不同扰动方式下群体水华微囊藻藻细胞密度变化(a、b、c)和平均藻细胞密度(d) Fig.3 Changes of different cell density (a, b, c) and mean different cell density of Microcystis flos-aquae colonies in different disturbance modes (d) |
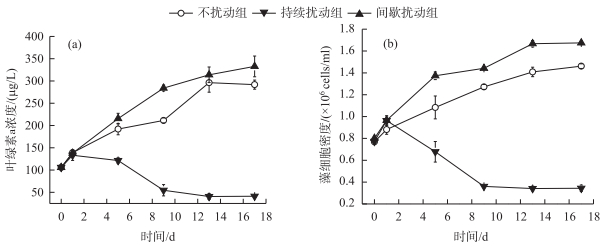
通过微囊藻Chl.a浓度(图 4a)来表征其生物量,微囊藻的藻细胞密度(图 4b)来表征其生长情况.实验第0天不扰动组、间歇扰动组和持续扰动组水华微囊藻的Chl.a浓度无显著性差异(P>0.05),而到实验第5天出现明显区别,不扰动组和间歇扰动组的Chl.a浓度呈上升趋势,且间歇扰动组高于不扰动组,持续扰动组的Chl.a浓度则开始下降.到实验结束时,间歇扰动组的Chl.a浓度最高,上升至332.72 μg/L,是不扰动组的1.14倍,持续扰动组则不断下降至41.30 μg/L,与不扰动组和间歇扰动组呈极显著性差异(P < 0.01).微囊藻藻细胞密度与Chl.a浓度呈现的规律基本相似.实验开始后,不扰动组和间歇扰动组的藻细胞密度都呈现快速增大的趋势,实验第5天开始间歇扰动组的增长幅度明显高于不扰动组,实验结束时间歇扰动组藻细胞密度(1.675×106 cells/ml)显著高于持续扰动组(0.344×106 cells/ml)和不扰动组(1.461×106 cells/ml)(P < 0.01).而持续扰动组的藻细胞密度从第5天开始下降,直到实验结束都显著低于不扰动组和间歇扰动组(P < 0.01),这可能是持续长时间的扰动对藻细胞造成一定的伤害,不利于其生长,在经过一段时间后逐渐适应.
|
图 4 不同扰动方式下群体水华微囊藻叶绿素a浓度(a)和藻细胞密度(b)变化 Fig.4 Changes of Chl.a concentration(a) and algal cell density (b) of Microcystis flos-aquae colonies in different disturbance modes |
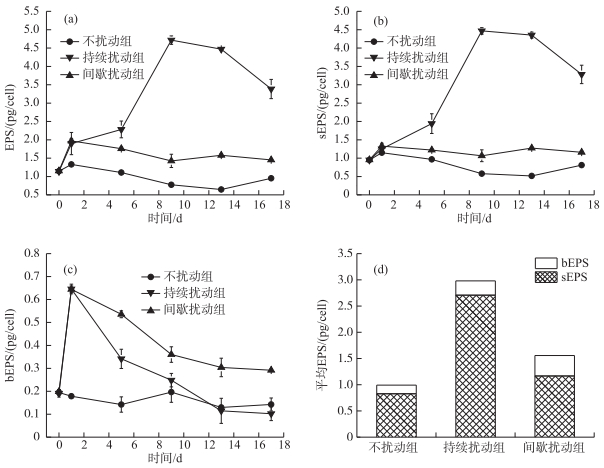
扰动前对照组和实验组水华微囊藻群体的胞外多糖含量(总胞外多糖(EPS)、溶解性胞外多糖(sEPS)和固着性胞外多糖(bEPS))差异不显著(图 5)(P>0.05).当第1天扰动结束后,不扰动组、持续扰动组和间歇扰动组的EPS含量都有所升高,分别是第0天含量的1.16、1.66、1.71倍,持续扰动组和间歇扰动组无显著性差异(P>0.05),两者与不扰动组相比呈极显著差异(P < 0.01).随着实验进行,不扰动组和间歇扰动组EPS含量小幅度下降最终趋于平缓,期间间歇扰动组EPS含量始终高于不扰动组,两者有极显著性差异(P < 0.01).而持续扰动组EPS含量在第9天达到最高值(4.72 pg/cell),然后下降(图 5a). sEPS含量的变化趋势与EPS相似,在第1天扰动24 h后,3组sEPS含量都有所升高,其中持续扰动组和间歇扰动组升高最多,分别由0.948、0.955 pg/cell增大至1.252、1.327 pg/cell,与不扰动组(1.150 pg/cell)有显著性差异(P < 0.05).当实验结束时,不扰动组和间歇扰动组sEPS含量趋于稳定,间歇扰动组始终高于不扰动组(图 5b).在第1天扰动结束后,不扰动组的bEPS含量由0.194 pg/cell降低到0.1783 pg/cell,而持续扰动组和间歇扰动bEPS含量明显升高,分别是扰动前含量的3.38、3.25倍,与不扰动组有极显著性差异(P < 0.01).在整个实验过程中,不扰动组的bEPS含量有小幅度波动,整体呈下降趋势.持续扰动组和间歇扰动组bEPS含量则在第1天扰动后,大幅度下降(图 5c).本实验结果表明,间歇性的扰动方式会促进微囊藻细胞胞外多糖的合成,间歇扰动组EPS的平均含量也明显高于不扰动组(图 5d),这使得微囊藻细胞更容易形成群体.而在第1天之后,持续扰动组EPS和sEPS含量显著高于不扰动组和间歇扰动组,可能是因为长时间扰动使藻细胞受伤并死亡,使得藻细胞数量锐减,呈现出单个藻细胞胞外多糖含量高的假象.
|
图 5 实验过程中水华微囊藻群体胞外多糖含量的变化(a、b、c)和平均胞外多糖含量(d) Fig.5 Changes of extracellular polysaccharide content (a, b, c) and mean extracellular polysaccharide content (d) of Microcystis flos-aquae colony in the experiment |
本研究结果表明,在此实验条件下,不同扰动方式对太湖群体水华微囊藻大小影响显著.间歇扰动有利于水华微囊藻小群体聚集形成大群体并维持群体形态,而持续扰动(17天)前期对水华微囊藻生长有促进作用,但随着持续扰动时间的延长,水华微囊藻生长受到抑制,微囊藻群体变小.目前国内外关于风浪引起的水体扰动对微囊藻群体的影响研究还比较少,刘玉等[21]研究发现室内条件下适当的扰动强度(50和100转/min)短时间(24 h)扰动有利水华微囊藻小群体快速形成更大群体,而在扰动结束一段时间后,大群体逐渐减小.杨桂军等[30]野外模拟扰动实验发现水体扰动促使太湖野外微囊藻群体显著增大.而Li等[42]发现湍流混合是影响微囊藻群体形态变化的重要因素,且不同种微囊藻对湍流混合的响应也不同,铜绿微囊藻(M. aeruginosa)和鱼害微囊藻(M. ichthyoblabe)群体比惠氏微囊藻(M. wesenbergii)群体更容易被湍流混合影响而解聚. O'Brien等[28]通过振动网格形成上下流动的水体,研究结果表明已经形成的巨型群体(群体>420 μm)在一定强度的扰动下,群体出现了解聚现象.这些都与本实验的研究结果相似,而本实验中,间歇扰动组每隔4天扰动1次,这使得大的水华微囊藻群体并没有出现解聚现象,群体直径一直保持在60 μm左右.王玉兵等[43]报道,太湖台风引起的扰动短时间内促使微囊藻群体显著增大.李林等[26]在室内采用野外原水培养基模拟研究连续水流和间歇水流对微囊藻生长的影响.结果表明,两种扰动方式下,水流均促进了微囊藻的生长,间歇性扰动条件下微囊藻密度较连续性水流条件下高.在一定流速范围内,动水环境有利于藻类改善其漂浮聚集状态,促进光能和营养物质的吸收,降低氧化损伤[27].另一方面,扰动还能降低藻细胞周围代谢产物的浓度,有助于解除代谢产物对藻细胞生长的抑制作用.然而,扰动也会打乱藻细胞进行生长的光反应和暗反应等所需要的较为稳定的环境[37].所产生的剪切可能会造成藻细胞的机械损伤,抑制或减少藻细胞的分裂,细胞形态、运动特性和生理活性也会被破坏[44].而在本实验中,17天的持续扰动,水流产生的剪切力对水华微囊藻细胞造成机械破坏,同时没有稳定适宜的环境给藻细胞来进行恢复,使得微囊藻生物量在中后期出现负增长(图 4).缺少了生物量的累积,微囊藻大群体(>100细胞群体)也开始消失.
有研究表明EPS能够影响藻细胞表面的厚度,并能导致藻的团聚[45]. Qin等[4]发现由于胞外多糖(EPS)的存在,中度或小的风浪扰动将通过藻细胞/群体聚集而扩大藻群体.藻细胞/群体的聚集增加藻团的浮力,加速表面可见蓝藻水华的形成.由此可见,EPS的增加对微囊藻团聚体的形成起着非常重要的作用.影响微囊藻多糖分泌的因素有很多,如原生动物捕食[40]、温度[46]、pH以及光强的升高[47]等.外界不利环境的刺激,使微囊藻受到胁迫,在受到胁迫的条件下EPS的积累增加,作为微囊藻在胁迫环境下的一种保护机制.本研究中,当实验结束时,间歇扰动组水华微囊藻群体大小和胞外多糖含量都显著高于不扰动组.这可能是因为外部施加的扰动对微囊藻细胞产生了刺激作用,引起生理特征的改变,促进了胞外多糖的分泌.同时外界的刺激可能会进一步地诱导藻细胞中与多糖合成相关基因的表达活性增加.有研究表明[48],微囊藻毒素(MCS)能显著增加微囊藻群体大小,高浓度的MCS暴露引发了4种与多糖生物合成相关基因的某些部分的上调.扰动作为外部环境刺激的一种,可能也有相同的机制.在第1天扰动后,间歇扰动组的EPS含量显著增加之后开始下降.作为在胁迫环境下的一种保护机制,藻会在新环境中分泌大量的多糖来帮助抵御环境的刺激,而在适应了一段时间后多糖分泌量就会减小[49],这与本实验的结果相一致.而持续扰动组EPS的总平均含量虽然最高,但群体却最小,这可能是因为长时间高强度的扰动使藻细胞受伤并死亡,导致藻细胞数量锐减(图 4b),而水体中仍有部分EPS残留,从而使得单位细胞含有的EPS升高.此外生物量的骤减也不利于微囊藻群体的增大,所以一定强度下长时间的持续扰动不利于群体微囊藻的生长和聚集.
有文献报道[50-51],水体扰动对藻类生长有抑制作用.李飞鹏等[52]采集夏季崇明岛中心湖原水在环形有机玻璃水槽开展了实验发现,与静止水槽相比流速对蓝藻的生长造成明显的抑制作用,同时促进了绿藻的生长.在本实验中长时间的扰动明显抑制了群体微囊藻的生长.以往的研究报道[21, 29-30]扰动对微囊藻生长促进与抑制主要与扰动强度有关,而本实验研究不同扰动方式对微囊藻的影响,结果表明(图 4),间歇扰动促进了微囊藻细胞的生长,长时间的持续扰动对微囊藻细胞的生长有抑制作用.
太湖是一个典型的大型浅水湖泊,受亚热带季风和台风的影响,风速较大且全年盛行,特别是夏季和秋季,风浪扰动使湖水始终处于一个动态环境.据秦伯强等[53]报道太湖蓝藻水华的发生均在大风作用过后的小风或静风、天气晴朗时段.这些观察表明太湖蓝藻水华的发生受到风浪扰动的影响,同时太湖由风浪引起的扰动属于间歇扰动,而不是持续性扰动,本研究中间歇扰动方式与太湖的实际情况类似.可以推测在夏季和秋季,当太湖水体中存在一定生物量的微囊藻小群体时,适当强度和频率的风浪扰动会促使太湖微囊藻小群体碰撞聚集形成大群体,由于微囊藻大群体有较快的上浮速度[54],所以当风速变小或者静风时,微囊藻大群体就会快速漂浮至水面,当微囊藻大群体达到一定的数量就会形成水华[24].本研究也发现,这种间歇扰动有助于保持微囊藻群体大小的稳定.所以,太湖这种间歇性的风浪扰动对维持微囊藻水华是有利的.该研究结果将有助于人们对太湖微囊藻水华暴发机理的认识,同时为蓝藻水华的治理提供一定参考价值.
4 结论1) 适当扰动强度(100转/min)下间歇扰动有利于水华微囊藻群体生长和聚集形成更大的群体.
2) 长时间的持续扰动(17天)则会抑制水华微囊藻群体的生长和增大.
| [1] |
Landsberg JH. The effects of harmful algal blooms on aquatic organisms. Reviews in Fisheries Science, 2002, 10(2): 113-390. DOI:10.1080/20026491051695 |
| [2] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [3] |
Zhu W, Zhou X, Chen H et al. High nutrient concentration and temperature alleviated formation of large colonies of Microcystis: Evidence from field investigations and laboratory experiments. Water Research, 2016, 101: 167-175. DOI:10.1016/j.watres.2016.05.080 |
| [4] |
Qin B, Yang G, Ma J et al. Spatiotemporal changes of Cyanobacterial bloom in large shallow eutrophic Lake Taihu, China. Frontiers in Microbiology, 2018, 9: 451. DOI:10.3389/fmicb.2018.00451 |
| [5] |
Burkert U, Hyenstrand P, Drakare S et al. Effects of the mixotrophic flagellate Ochromonas sp. on colony formation in Microcystis aeruginosa. Aquantic Ecology, 2001, 35(1): 11-17. DOI:10.1023/a:1011454313607 |
| [6] |
Xu S, Yang YJ, Xu JZ et al. The physiological response of colonial and single-celled form of Microcystis to short-term high stress. Acta Hydrobiologica Sinica, 2017, 41(2): 443-447. [徐沙, 杨燕君, 许金铸等. 群体和单细胞微囊藻对短期高光胁迫的生理响应. 水生生物学报, 2017, 41(2): 443-447. DOI:10.7541/2017.55] |
| [7] |
Wang S. Research on environmental influencing factors of the formation and response to the phosphorus utilization of Microcystis colony[Dissertation]. Chongqing: Chongqing University, 2015. [王沙.微囊藻群体形成的环境影响因素及其对磷利用的生理响应[学位论文].重庆: 重庆大学, 2015. ]
|
| [8] |
Yang Z, Kong F, Shi X et al. Morphological response of Microcystis aeruginosa, to grazing by different sorts of zooplankton. Hydrobiologia, 2006, 563(1): 225-230. DOI:10.1007/s10750-005-0008-9 |
| [9] |
Wu X, Kong F. Effectsof light and wind speed on the vertical distribution of Microcystis aeruginosa colonies of different sizes during a summer bloom. International Review of Hydrobiology, 2009, 94(3): 258-266. DOI:10.1002/iroh.200811141 |
| [10] |
Jones RI, Reynolds CS. The ecology of freshwater phytoplankton. Journal of Ecology, 1984, 73(2): 722. DOI:10.2307/2260522 |
| [11] |
Cao HS, Zhou Y. Variation in colony size of Microcystis aeruginosa in a eytrophic lake during recruitment and bloom formation. Journal of Freshwater Ecology, 2010, 25(3): 331-335. DOI:10.1080/02705060.2010.9664375 |
| [12] |
Bolch CJS, Blackburn SI. Isolation and purification of Australian isolates of the toxic cyanobacterium Microcystis aeruginosa, Kütz. Journal of Applied Phycology, 1996, 8(1): 5-13. DOI:10.1007/BF02186215 |
| [13] |
Dong J, Li GB. Influencing factors and mechanisms on colony formation of Microcystis: A review. Acta Hydrobiologica Sinica, 2016, 40(2): 378-387. [董静, 李根保. 微囊藻群体形成影响因子及机理. 水生生物学报, 2016, 40(2): 378-387. DOI:10.7541/2016.50] |
| [14] |
Shen H, Niu Y, Xie P et al. Morphological and physiological changes in Microcystis aeruginosa as a result of interactions with heterotrophic bacteria. Freshwater Biology, 2011, 56(6): 1065-1080. DOI:10.1111/j.1365-2427.2010.02551.x |
| [15] |
Chu Z, Jin X, Yang B et al. Buoyancy regulation of Microcystis flos-aquae during phosphorus-limited and nitrogen-limited growth. Journal of Plankton Research, 2007, 29(9): 739-745. DOI:10.1093/plankt/fbm054 |
| [16] |
Yang Z. Study on the driving factors of colony formation in Mircocystis[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2010. [阳振.微囊藻群体形成的驱动因子研究[学位论文].北京: 中国科学院大学, 2010. ]
|
| [17] |
Guo LL, Zhu W, Li M. Effect of major cations in water on the growth and polysaccharide contents of Microcystis aeruginosa. Ecology and Environmental Sciences, 2013, 22(8): 1358-1364. [郭丽丽, 朱伟, 李明. 水中主要阳离子对铜绿微囊藻生长及多糖的影响. 生态环境学报, 2013, 22(8): 1358-1364. DOI:10.3969/j.issn.1674-5906.2013.08.014] |
| [18] |
Sedmak B, Elersek T. Microcystins induce morphological and physiological changes in selected representative phytoplanktons. Microbial Ecology, 2005, 50(2): 298-305. DOI:10.1007/s00248-004-0189-1 |
| [19] |
Xiao Y, Gan NQ, Zheng LL et al. Studies on morphological responses to light in colonial Microcystis and the underlying physiological mechanisms. Acta Hydrobiologica Sinica, 2014, 38(1): 35-42. [肖艳, 甘南琴, 郑凌凌等. 光强对微囊藻群体形态的影响及其生理机制研究. 水生生物学报, 2014, 38(1): 35-42. DOI:10.7541/2014.05] |
| [20] |
Lin L, Zhu W, Wang TT et al. Effect of fluid motion on colony formation in Microcystis aeruginosa. Water Science and Engineering, 2013, 6 (1): 106-116.
|
| [21] |
Liu Y, Yang GJ, Han LH et al. Effects of different disturbance intensity on the colony size of Microcystis flos-aquae in Lake Taihu. Ecology and Environmental Sciences, 2017, 26(11): 1961-1968. [刘玉, 杨桂军, 韩丽华等. 扰动强度对太湖水华微囊藻群体大小的影响. 生态环境学报, 2017, 26(11): 1961-1968.] |
| [22] |
Qin BQ, Hu WP, Gao G et al. Dynamic mechanism of sediment suspension in Lake Taihu and its conceptual model of endogenous release. Chinese Science Bulletin, 2003, 48(17): 1822-1831. [秦伯强, 胡维平, 高光等. 太湖沉积物悬浮的动力机制及内源释放的概念性模式. 科学通报, 2003, 48(17): 1822-1831. DOI:10.3321/j.issn:0023-074X.2003.17.002] |
| [23] |
Han LH, Yang GJ, Liu Y et al. Effect of disturbance intensity on the growth and chlorophyll fluorescence of Microcystis flos-aquae colony in Lake Taihu. Research of Environmental Sciences, 2018, 31(2): 265-272. [韩丽华, 杨桂军, 刘玉等. 扰动强度对太湖水华微囊藻群体生长和叶绿素荧光的影响. 环境科学研究, 2018, 31(2): 265-272.] |
| [24] |
Qin BQ, Yang GJ, Ma JR et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China. Chinese Science Bulletin, 2016, 61(7): 759-770. [秦伯强, 杨桂军, 马健荣等. 太湖蓝藻水华"暴发"的动态特征及其机制. 科学通报, 2016, 61(7): 759-770. DOI:10.1360/N972015-00400] |
| [25] |
Zhao H, Zhu W, Chen H et al. Numerical simulation of the vertical migration of Microcystis (cyanobacteria) colonies based on turbulence drag. Journal of Limnology, 2016, 76(1). DOI:10.4081/jlimnol.2016.1501 |
| [26] |
Li L, Zhu W. Effect of water flow regimes on growth of Microcystis aeruginosa. Environmental Science & Technology, 2012, 35(10): 34-37. [李林, 朱伟. 连续水流和间歇水流对微囊藻生长的影响. 环境科学与技术, 2012, 35(10): 34-37. DOI:10.3969/j.issn.1003-6504.2012.10.008] |
| [27] |
Song Y, Zhang LL, Chen M et al. Impacts of flow velocity on growth of dominant species Microcystis aeruginosa of algae-bloom in reservoirs. Journal of Sichuan University: Engineering Science Edition, 2016, 48(s1): 25-32. [宋洋, 张陵蕾, 陈旻等. 流速对水库水华优势种铜绿微囊藻生长的影响研究. 四川大学学报:工程科学版, 2016, 48(s1). DOI:10.15961/j.jsuese.2016.s1.005] |
| [28] |
O'Brien KR, Meyer DL, Waite AM et al. Disaggregation of Microcystis aeruginosa, colonies under turbulent mixing: Laboratory experiments in a grid-stirred tank. Hydrobiologia, 2004, 519(1/2/3): 143-152. DOI:10.1023/B:HYDR.0000026501.02125.cf |
| [29] |
Zhou J. Effect of disturbance on colony of Microcystis in Lake Taihu[Dissertation]. Wuxi: Jiangnan University, 2013. [周健.扰动对太湖微囊藻群体的影响研究[学位论文].无锡: 江南大学, 2013. ]
|
| [30] |
Yang GJ, Zhong CN, Qin BQ et al. Effects of in-situ simulative mixing on colony size of Microcystis in Lake Taihu. J Lake Sci, 2017, 29(2): 363-368. [杨桂军, 钟春妮, 秦伯强等. 野外模拟扰动对太湖微囊藻群体大小的影响. 湖泊科学, 2017, 29(2): 363-368. DOI:10.18307/2017.0212] |
| [31] |
Oberholster PJ, Botha AM, Cloete TE. Toxic cyanobacterial blooms in a shallow, artificially mixed urban lake in Colorado, USA. Lakes & Reservoirs Research & Management, 2010, 11(2): 111-123. DOI:10.1111/j.1440-1770.2006.00297.x |
| [32] |
Tsukada H, Tsujimura S, Nakahara H. Seasonal succession of phytoplankton in Lake Yogo over 2 years: effect of artificial manipulation. Limnology, 2006, 7(1): 3-14. DOI:10.1007/s10201-005-0159-4 |
| [33] |
Visser PM, Ketelaarsl HAM, Breemen LWCAV et al. Diurnal buoyancy changes of Microcystis, in an artificially mixed storage reservoir. Hydrobiologia, 1996, 331(1/2/3): 131-141. DOI:10.1007/BF00025414 |
| [34] |
Wang JJ, Yang J, Xian QM et al. Characteristic of microcystin distributions and its relationships with environmental factors in Lake Taihu. J Lake Sci, 2011, 23(4): 513-519. [王经结, 杨佳, 鲜啟鸣等. 太湖微囊藻毒素时空分布特征及与环境因子的关系. 湖泊科学, 2011, 23(4): 513-519. DOI:10.18307/2011.0404] |
| [35] |
Chen Y, Qin B, Teubner K et al. Long-term dynamics of phytoplankton assemblages: Microcystis-domination in Lake Taihu, a large shallow lake in China. Journal of Plankton Research, 2003, 25(4): 445-453. DOI:10.1093/plankt/25.4.445 |
| [36] |
Xu HP, Yang GJ, Zhou J et al. Effect of nitrogen and phosphorus concentration on colony growth of Microcystis flos-aquae in Lake Taihu. J Lake Sci, 2014, 26(2): 213-220. [许慧萍, 杨桂军, 周健等. 氮、磷浓度对太湖水华微囊藻(Microcystis flos-aquae)群体生长的影响. 湖泊科学, 2014, 26(2): 213-220. DOI:10.18307/2014.0207] |
| [37] |
Yan RR, Feng Y, Chen XF et al. Effect of disturbance on growth of Microcystis aeruginosa in different nutrient levels. Environmental Science, 2008, 29(10): 63-67. [颜润润, 逄勇, 陈晓峰等. 不同风等级扰动对贫富营养下铜绿微囊藻生长的影响. 环境科学, 2008, 29(10): 63-67. DOI:10.3969/j.issn.1003-6504.2008.10.016] |
| [38] |
Zhang W, Xu Q, Wang X et al. Spatiotemporal distribution of eutrophication in Lake Tai as affected by wind. Water, 2017, 9(3): 200. DOI:10.3390/w9030200 |
| [39] |
Xu H, Wu YL, Yang GJ et al. Tolerance of Microcystis aeruginosa and Scendesmus obliquus to nitrogen and phosphorus deficiency. Ecological Science, 2014, 33(5): 879-884. [许海, 吴雅丽, 杨桂军等. 铜绿微囊藻、斜生栅藻对氮磷饥饿的耐受能力研究. 生态科学, 2014, 33(5): 879-884.] |
| [40] |
Yang Z, Kong F, Shi X et al. Changes in the morphology and polysaccharide content of Microcystis aeruginosa (cyanobacteria) during flagellate grazing. Journal of Phycology, 2008, 44(3): 716-720. DOI:10.1111/j.1529-8817.2008.00502.x |
| [41] |
Liu HL. Standard for investigation of lake eutrophication. Beijing: China Environment Science Press, 1987.
|
| [42] |
Li M, Xiao M, Zhang P et al. Morphospecies-dependent disaggregation of colonies of the cyanobacterium Microcystis, under high turbulent mixing. Water Research, 2018, 141 : 340-348. DOI: 10.1016/j.watres.2018.05.017.
|
| [43] |
Wang YB, Yang GJ, Qin BQ et al. Effect of typhoon on the size of Microcystis colonies in Lake Taihu. Chinese Journal of Environmental Engineering, 2016, 10(7): 3961-3966. [王玉兵, 杨桂军, 秦伯强等. 台风对太湖微囊藻群体大小的影响. 环境工程学报, 2016, 10(7): 3961-3966. DOI:10.12030/j.cjee.201501193] |
| [44] |
Karp-Boss L, Boss E, Jumars PA. Motion of dinoflagellates in a simple shear flow. Limnology and Oceanography, 2000, 45(7): 1594-1602. DOI:10.4319/lo.2000.45.7.1594 |
| [45] |
Philippis RD, Vincenzini M. Exocellular polysaccharides from cyanobacteria and their possible applications. FEMS Microbiology Reviews, 1998, 22(3): 151-175. DOI:10.1111/j.1574-6976.1998.tb00365.x |
| [46] |
Tan BL, Yang Z, Zhang M. The effect of temperature fluctuation on the growth and polysaccharide composition of phytoplankton. J Lake Sci, 2014, 26(3): 432-440. DOI:10.18307/2014.0314 |
| [47] |
Shi JQ, Ma JM, Wu ZX. Effects of environmental factors on extracellular polysaccharide produced by Microcystis aeruginosa PCC7820. Journal of Henan Normal University, 2008, 36(5): 119-123. [施军琼, 马剑敏, 吴忠兴. 环境因子对铜绿微囊藻7820胞外多糖的影响. 河南师范大学学报:自然版, 2008, 36(5): 119-123.] |
| [48] |
Gan N, Xiao Y, Zhu L et al. The role of microcystins in maintaining colonies of bloom-forming Microcystis spp. Environmental Microbiology, 2012, 14(3): 730-742. DOI:10.1111/j.1462-2920.2011.02624.x |
| [49] |
Chen CP, Gao YH, Lin P. Production of extracellular polymeric substances (EPS) by benthic diatom: effect of salinity and pH. Acta Oceanologica Sinica, 2006, 28(5): 123-129. [陈长平, 高亚辉, 林鹏. 盐度和pH对底栖硅藻胞外多聚物的影响. 海洋学报, 2006, 28(5): 123-129. DOI:10.3321/j.issn:0253-4193.2006.05.016] |
| [50] |
Wang JH. The experimental study on the influences of flow velocity on algae growth[Dissertation]. Beijing: Qinghua University, 2012. [王建慧.流速对藻类生长影响试验及应用研究[学位论文].北京: 清华大学, 2012. ]
|
| [51] |
Huang NQ. Effects of hydrodynamic condition on the growth of algae at secondary tributary in the three gorges reservoir[Dissertation]. Chongqing: Chongqing University, 2015. [黄宁秋.水动力条件对三峡库区次级支流典型藻类生长影响[学位论文].重庆: 重庆大学, 2015. ]
|
| [52] |
Li FP, Gao Y, Zhang HP et al. Simulation experiment on the effect of flow velocity on phytoplankton growth and composition. J Lake Sci, 2015, 27(1): 44-49. [李飞鹏, 高雅, 张海平等. 流速对浮游藻类生长和种群变化影响的模拟试验. 湖泊科学, 2015, 27(1): 44-49. DOI:10.18307/2015.0106] |
| [53] |
Qin BQ, Hu WP, Chen WM et al. Studies on the hydrodynamic processes and related factors in Meiliang Bay, Northern Taihu Lake, China. J Lake Sci, 2000, 12(4): 327-334. [秦伯强, 胡维平, 陈伟民等. 太湖梅梁湾水动力及相关过程的研究. 湖泊科学, 2000, 12(4): 327-334. DOI:10.18307/2000.0406] |
| [54] |
Xiao Y, Gan N, Liu J et al. Heterogeneity of buoyancy in response to light between two buoyant types of cyanobacterium Microcystis. Hydrobiologia, 2012, 679(1): 297-311. DOI:10.1007/s10750-011-0894-y |
 2019, Vol. 31
2019, Vol. 31 


